物理化学下册复习题
南京大学物理化学下册(第五版傅献彩)复习题及解答

第八章电解质溶液第九章1.可逆电极有哪些主要类型?每种类型试举一例,并写出该电极的还原反应。
对于气体电极和氧化还原电极在书写电极表示式时应注意什么问题?答:可逆电极有三种类型:(1)金属气体电极如Zn(s)|Zn2+ (m) Zn2+(m) +2e- = Zn(s)(2)金属难溶盐和金属难溶氧化物电极如Ag(s)|AgCl(s)|Cl-(m), AgCl(s)+ e- = Ag(s)+Cl-(m)(3)氧化还原电极如:Pt|Fe3+(m1),Fe2+(m2) Fe3+(m1) +e- = Fe2+(m2)对于气体电极和氧化还原电极,在书写时要标明电极反应所依附的惰性金属。
2.什么叫电池的电动势?用伏特表侧得的电池的端电压与电池的电动势是否相同?为何在测电动势时要用对消法?答:正、负两端的电势差叫电动势。
不同。
当把伏特计与电池接通后,必须有适量的电流通过才能使伏特计显示,这样电池中发生化学反应,溶液浓度发生改变,同时电池有内阻,也会有电压降,所以只能在没有电流通过的情况下才能测量电池的电动势。
3.为什么Weslon标准电池的负极采用含有Cd的质量分数约为0.04~0.12的Cd一Hg齐时,标准电池都有稳定的电动势值?试用Cd一Hg的二元相图说明。
标准电池的电动势会随温度而变化吗?答:在Cd一Hg的二元相图上,Cd的质量分数约为0.04~0.12的Cd一Hg齐落在与Cd一Hg固溶体的两相平衡区,在一定温度下Cd一Hg齐的活度有定值。
因为标准电池的电动势在定温下只与Cd一Hg齐的活度有关,所以电动势也有定值,但电动势会随温度而改变。
4.用书面表示电池时有哪些通用符号?为什么电极电势有正、有负?用实验能测到负的电动势吗?答:用“|”表示不同界面,用“||”表示盐桥。
电极电势有正有负是相对于标准氢电极而言的。
不能测到负电势。
5.电极电势是否就是电极表面与电解质溶液之间的电势差?单个电极的电势能否测量?如何用Nernst方程计算电极的还原电势?5.电极电势是否就是电极表面与电解质溶液之间的电势差?单个电极的电势能否测量?如何用Nernst 方程计算电极的还原电势?答:电极电势不是电极表面与电解质溶液之间的电势差。
物理化学下册电解质考试复习题
质量摩尔浓度为m的H2SO4水溶液,其离子平 均活度±与平均活度系数±及m之间的关系 是下列何者( )
H2SO4) (m/m ) (
1/3 1/4 3
H2SO4) 4 (m/m ) ( H2SO4) 27 (m/m ) (
H2SO4) 4 (m/m ) (
选择 0.001 mol · ㎏-1 K3[Fe(CN)6]水溶液的离子强度为 A.6.0×10-3 B. 5.0×10-3 C. 4.5×10-3 D. 3.0×10-3
以Cu作电极电解CuSO4溶液,则电解池中Cu 2+的物质的量
A:阴极区n Cu 2 n 始 n电 n 迁,阳极区n Cu 2 n 始 +n电 -n 迁 B:阴极区n Cu 2 n 始 +n电 -n 迁, 阳极区n Cu 2 n 始 n电 n 迁 C:阴极区n Cu2 n 始 -n电 -n 迁, 阳极区n Cu2 n 始 n电 -n 迁 D:阴极区n Cu 2 n 始 +n电 -n 迁, 阳极区n Cu 2 n 始 n电 -n 迁
1:1弱电解质的标准电离平衡常数 c/c . m K m ( m m )
c 2
m ( 难溶盐)
k 难溶盐 k 难溶盐饱和液 k 水 c c
电解质的活度
B
m m 1/ m ( . ) .m
m 0.00668 = =6.9 108 m 2 / s.v Z.F 96500 m 0.01 .U = =1.0 107 m 2 / s.v Z.F 96500 U
3、r =U dV =2.07 10 6m / s dL dV r =U =3.0 10 6m / s dL
南京大学物理化学下册 第五版傅献彩 复习题及解答

第八章 电解质溶液第九章1.可逆电极有哪些主要类型?每种类型试举一例,并写出该电极的还原反应。
对于气体电极和氧化还原电极在书写电极表示式时应注意什么问题?答:可逆电极有三种类型:(1)金属气体电极 如Zn(s)|Zn2+ (m) Zn2+(m) +2e- = Zn(s)(2)金属难溶盐和金属难溶氧化物电极 如 Ag(s)|AgCl(s)|Cl-(m), AgCl(s)+ e- = Ag(s)+Cl-(m)(3)氧化还原电极 如: Pt|Fe3+(m1),Fe2+(m2) Fe3+(m1) +e- = Fe2+(m2)对于气体电极和氧化还原电极,在书写时要标明电极反应所依附的惰性金属。
2.什么叫电池的电动势?用伏特表侧得的电池的端电压与电池的电动势是否相同?为何在测电动势时要用对消法?答:正、负两端的电势差叫电动势。
不同。
当把伏特计与电池接通后,必须有适量的电流通过才能使伏特计显示, 这样电池中发生化学反应, 溶液浓度发生改变, 同时电池有内阻,也会有电压降,所以只能在没有电流通过的情况下才能测量电池的电动势。
3.为什么Weslon标准电池的负极采用含有Cd的质量分数约为0.04~0.12的Cd一Hg齐时,标准电池都有稳定的电动势值?试用Cd一Hg的二元相图说明。
标准电池的电动势会随温度而变化吗?答:在Cd一Hg的二元相图上,Cd的质量分数约为0.04~0.12的Cd一Hg齐落在与Cd一Hg固溶体的两相平衡区,在一定温度下Cd一Hg齐的活度有定值。
因为标准电池的电动势在定温下只与Cd一Hg齐的活度有关,所以电动势也有定值,但电动势会随温度而改变。
4.用书面表示电池时有哪些通用符号?为什么电极电势有正、有负?用实验能测到负的电动势吗?答:用“|”表示不同界面,用“||”表示盐桥。
电极电势有正有负是相对于标准氢电极而言的。
不能测到负电势。
5.电极电势是否就是电极表面与电解质溶液之间的电势差?单个电极的电势能否测量?如何用Nernst方程计算电极的还原电势?5.电极电势是否就是电极表面与电解质溶液之间的电势差?单个电极的电势能否测量?如何用Nernst 方程计算电极的还原电势?答:电极电势不是电极表面与电解质溶液之间的电势差。
南京大学物理化学下册(第五版)复习题解答:最新整理

物理化学下册课后复习题答案第八章电解质溶液第九章可逆电池电动势及其应用第十章电解与极化作用第十一章化学动力学(一)第十二章化学动力学基础(二)第十三章1.比表面有哪能几种表示方法?表面张力与表面Gibbs自由能有哪些异同点?答:A0= As/m或A0= As/V;表面张力又可称为表面Gibbs自由能,二者数值一样。
但一个是从能量角度研究表面现象,另一个是从力的角度研究表面现象;故二者物理意义不同;单位不同。
2.为什么气泡、小液滴、肥皂泡等都呈圆形?玻璃管口加热后会变得光滑并缩小(俗称圆口),这些现象的本是什么?用同一滴管滴出相同体积的苯。
水和NaCl 溶液,所得的液滴数是否相同弯曲液面有附加压力,其最终会将不规则的液面变为圆形或球形;球形表面积最小,表面自由能最低,最稳定;不相同。
3.用学到的关于界面现角的知识解释以下几种做法或现象的基体原理:①人工降雨;②有机蒸馏中加沸石;③多孔固体吸附蒸气时的毛细凝聚;④过饱和溶液,过饱和蒸气,过冷液体等过饱和现象;⑤重量分析中的“陈化”过程;⑥喷洒农药时,为何常常在农药中加入少量表面活性剂这些现象都可以用开尔文公式说明,①、②、④、⑤是新相刚形面时的体积小,曲率半径小,对与之平衡的旧相有更加苛刻的条件要求。
③多孔固体吸附蒸气时,被吸附的气体的液相对毛细管是润湿的,其曲率半径小零,当气体的分压小于其饱和蒸气压时,就可以发生凝聚。
⑥喷洒农药时,在农药中加入少量表面活性剂,可以降低药液的表面张力,使药液在叶面上铺展。
4.在三通活塞的两端涂上肥皂液,关断右端通路,在左端吹一个大泡,然后关闭左端,在右端吹一个小泡,最后让左右两端相通。
试问当将两管接通后,两泡的大小有何变化?到何时达到平衡?讲出变化的原因及平衡时两泡的曲率半径的比值。
小球更小,大球更大;最后小泡变成一个与大泡曲率半径相同的弧;由于小泡的附加压力大,所以大泡变大,小泡变小,最后使两泡的曲率半径相同5.因系统的Gibbs自由能越低,系统越稳定,所以物体总有降低本身表面Giibs自由能的趋势。
南京大学物理化学下册(第五版)复习题及解答.docx

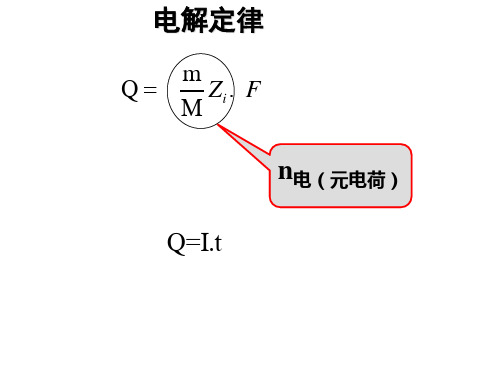
第八章电解质溶液1・Faraday电解定律的基本内容是什么?这定律在电化学中有何用处? 答:法拉第电解定律的基本内容是:通电于电解质溶液之后,(1)在电极上(两相界面),发生化学变化的物质的量与通入电荷成正比・(2〉若将几个电解池串联,通入一定的电荷量后,在各个电解池的电极上发生化学变化的物质的量都相等.Q(E)=Z+eL=z^F根据Faraday定律,通过分析电解过程中反应物在电极上物质的量的变化,就可求岀电荷量的数值,在电化学的定量研究和电解工业上有重要的应用.2.电池中正极、负极、阴极、阳极的定义分别是什么?为什么在原电池中负极是阳极而正极是阴极?答:给出电子到外电路的电极叫做电池的负极,在外电路中电势低.从外电路接受电子的电极叫做电池的正极,在外电路中电势较高.发生氧化作用的电极称为阳极,发生还原作用的一极称为阴极•原电池的阳极发生氧化作用•阴极发生还原作用,内电路的电子由阳极运动到阴极•所以原电池的阴极是正极,阳极是负极.3・电解质溶液的电导率和摩尔电导率与电解质溶液浓度的关系有何不同?为什么?答:强电解质溶液的电导率随着浓度的增大而升高(导电粒子数目增多),但大到一定程度以后,由于正、负离子之间的相互作用增大,因而使离子的运动速率降低,电导率反而下降•弱电解质的电导率随浓度的变化不显著,浓度增加电离度减少,离子数目变化不大•摩尔电导率随浓度的变化与电导率不同,浓度降低,粒子之间相互作用减弱,正、负离子的运动速率因而增加,故摩尔电导率增加.4.怎样分别求强电解质和弱电解质的无限稀释摩尔电导率?为什么要用不同的方法?答:在低浓度下,强电解溶液的摩尔电导率与乞成线性关系.在一定温度下,一定电解质溶液来说,0是定值,通过作图,直线与纵坐标的交点即为无限稀释时溶液的摩尔电导率人箒•即外推法.弱电解质的无限稀释摩尔电导率A益,根据离子独立移动定律,可由强电解质溶液的无限稀释摩尔电导率A 益设计求算,不能由外推法求岀,由于弱电解质的稀溶液在很低浓度下与坨不呈直线关系•并且浓度的变化对4m 的值影响很大,实验的误差很大,由实验值直接求弱电解质的A益很困难.5.离子的摩尔电导率、离子的迁移速率、离子的电迁移率和离子迁移数之间有哪些定量关系式?答:定量关系式:厂+ = “+ dE/ dZ r- = u- dE/ dl厂+ •厂-离产迁移速率山+ 4一离子的电迁移率.饥I4 7一厂++~・"乍=耳=母卯正离子迁移数艺= 1无限稀释强电解质溶液銘=益4 +銘・-盈=(屛+“GF・6.在某电解质溶液中,若有i种离子存在,则溶液的总电导应该用下列哪个公式表示: 答:对电解质溶液来说电导G是其导电的能力,以1一1型电解质溶液为例.⑴G=^+舟+ ・・・;(2)G = 爭?为什么?G=K AJ I K =A H \ • c稀电解质溶液A m =Ai +Am ・•・〃=(△: +Am >C = Am ・ c+Am ・ c «+ =Am • c 则 G+ =/c> A/2・•・G 总=G++G —=盒+古…=工盒・7. 电解质与非电解质的化学势表示形式有何不同?活度因子的表示式有何不同? 答:非电解质的化学势的表示形式:活度因子表示式:非电解质a m ^ = Vm^ —电解质 QB=a 甘• a^r =a±・&为什么要引进离子强度的概念?离子强度对电解质的平均活度因子有什么影响?答:在稀溶液中,影响离子平均活度因子7士的主要因素是离子的浓度和价数,并且离子价数比浓度影 响还要更大一些•且价型愈高,影响愈大,因此而提出离子强度的概念.I = *另加必对平均活度因子的影响lg/+=—常数/!9. 用DebyeHuckel 极限公式计算平均活度因子时有何限制条件?在什么时候要用修正的Debys Hiickel 公式? 答:限制条件为:① 离子在静电引力下的分布遵从Boltzmann 分布公式,并且电荷密度与电势之间的关系遵从静电学中的Poisson (泊松)公式.I② 离子是带电荷的圆球,离子电场是球形对称的,离子不极化•在极稀溶液中可看成点电荷.③ 离子之间的作用力只存在库仑引力,其相互吸引而产生的吸引能小于它的热运动的能量.④ 在稀溶液中,溶液的介电常数与溶剂的介电常数相差不大,可以忽略加入电解质后的介电常数的变 化.若不把离子看作点电荷,考虑到离子的直径,极限公式修正为:—A\z+z- 1/7lgy 士随着离子半径的增大而增大•所以溶液中离子溶度增加,迁移速率亦将增加.12. 影响难溶盐的溶解度主要有哪些因素?试讨论AgCl 在下列电解质溶液中的溶解度大小,按由小 到大的次序排列出来(除水外,所有的电解质的浓度都是0・1 mol ・dm'3).(l) NaNQ (2)NaCl (3)H 2O (4)CuSC)4 (5)NaBr阿=阴(T) +RTlnZn.B 今=炖(丁) +RTlnoni ・B电解质 /zB=/^(T)+RTlnaB=〃g(T) + RTlna# • cf-7M Blgz±= 1+辆I ・10. 不论是离子的电迁移率不是摩尔电导率,氢离子和氢氧根离子都比其他与之带相同电荷的离子要 大得多,试解释这是为什么?答:在水溶液中,屮和OH-离子的电迁移率和摩尔电导率特别大,说明 屮和OH —在电场力作用下 运动速率特别快,这是因为水溶液具有氢键质子可以在水分子间转换,电流很快沿着氢键被传导.11. 在水溶液中带有相同电荷数的离子,如Li 十,Na 十,K + ,Rb +,…,它们的离子半径依次增大,而迁移 速率也相应增大,这是为什么?答:IF ,Na+ ,K+ ,Rb 〒等离子带有相同的电荷,离子半径依次增大,根据修正的Debye-Huckel 公式:答:影响难溶盐的溶解度的主要因素有:①共同离子影响,如AgBr在NaBr中的溶解度远小于水中的溶解度.②其它电解质的影响,其它电解质的存在通过影响离子强度,影响难溶盐的活度系数,从而影响溶解度.溶解度顺序为:(2)<(3)<(1)<(4)«5).13.用Pt电极电解一定浓度的CuSQ溶液,试分析阴极部、中部和阳极部溶液的颜色在电解过程中有何变化?若都改用Cu电极,三部溶液颜色变化又将如何?答:Pt是惰性电极,阴极部溶液中C£+被还原生成Cu,溶液中Ci?+的浓度变小,颜色变淡,阳极部溶液中+向中部迁移,颜色变淡,中部的颜色在短时间内基本保持不变.用Cu做电极时,阴极部的颜色变淡,中部基本不变,阳极部颜色变深.14.什么叫离子氛?Debye-Hiickel-()nsager电导理论说明了什么问题?苔:溶液中每一个离子都被电荷符号相反的离子所包围,由于离子间的相互作用使得离子分布不均匀, 从而形成离子氛.Deby^Huckel-Oisager电导理论说明,电解质溶液的摩尔电导率与离子间相互作用、离子的性质、离子本身结构和溶剂能力以及介质的介电常数都有关系.第九章1.可逆电极有哪些主要类型?每种类型试举一例,并写出该电极的还原反应。
南京大学物理化学下册(第五版)复习题解答:最新整理

物理化学下册课后复习题答案第八章电解质溶液第九章可逆电池电动势及其应用第十章电解与极化作用第十一章化学动力学(一)第十二章化学动力学基础(二)第十三章1.比表面有哪能几种表示方法?表面张力与表面Gibbs自由能有哪些异同点?答:A0= As/m或A0= As/V;表面张力又可称为表面Gibbs自由能,二者数值一样。
但一个是从能量角度研究表面现象,另一个是从力的角度研究表面现象;故二者物理意义不同;单位不同。
2.为什么气泡、小液滴、肥皂泡等都呈圆形?玻璃管口加热后会变得光滑并缩小(俗称圆口),这些现象的本是什么?用同一滴管滴出相同体积的苯。
水和NaCl 溶液,所得的液滴数是否相同弯曲液面有附加压力,其最终会将不规则的液面变为圆形或球形;球形表面积最小,表面自由能最低,最稳定;不相同。
3.用学到的关于界面现角的知识解释以下几种做法或现象的基体原理:①人工降雨;②有机蒸馏中加沸石;③多孔固体吸附蒸气时的毛细凝聚;④过饱和溶液,过饱和蒸气,过冷液体等过饱和现象;⑤重量分析中的“陈化”过程;⑥喷洒农药时,为何常常在农药中加入少量表面活性剂这些现象都可以用开尔文公式说明,①、②、④、⑤是新相刚形面时的体积小,曲率半径小,对与之平衡的旧相有更加苛刻的条件要求。
③多孔固体吸附蒸气时,被吸附的气体的液相对毛细管是润湿的,其曲率半径小零,当气体的分压小于其饱和蒸气压时,就可以发生凝聚。
⑥喷洒农药时,在农药中加入少量表面活性剂,可以降低药液的表面张力,使药液在叶面上铺展。
4.在三通活塞的两端涂上肥皂液,关断右端通路,在左端吹一个大泡,然后关闭左端,在右端吹一个小泡,最后让左右两端相通。
试问当将两管接通后,两泡的大小有何变化?到何时达到平衡?讲出变化的原因及平衡时两泡的曲率半径的比值。
小球更小,大球更大;最后小泡变成一个与大泡曲率半径相同的弧;由于小泡的附加压力大,所以大泡变大,小泡变小,最后使两泡的曲率半径相同5.因系统的Gibbs自由能越低,系统越稳定,所以物体总有降低本身表面Giibs自由能的趋势。
南京大学物理化学下册(第五版傅献彩)复习题及解答.

第八章电解质溶液第九章1.可逆电极有哪些主要类型?每种类型试举一例,并写出该电极的还原反应。
对于气体电极和氧化还原电极在书写电极表示式时应注意什么问题?答:可逆电极有三种类型:(1)金属气体电极如Zn(s)|Zn2+ (m) Zn2+(m) +2e- = Zn(s)(2)金属难溶盐和金属难溶氧化物电极如Ag(s)|AgCl(s)|Cl-(m), AgCl(s)+ e- = Ag(s)+Cl-(m)(3)氧化还原电极如:Pt|Fe3+(m1),Fe2+(m2) Fe3+(m1) +e- = Fe2+(m2)对于气体电极和氧化还原电极,在书写时要标明电极反应所依附的惰性金属。
2.什么叫电池的电动势?用伏特表侧得的电池的端电压与电池的电动势是否相同?为何在测电动势时要用对消法?答:正、负两端的电势差叫电动势。
不同。
当把伏特计与电池接通后,必须有适量的电流通过才能使伏特计显示,这样电池中发生化学反应,溶液浓度发生改变,同时电池有内阻,也会有电压降,所以只能在没有电流通过的情况下才能测量电池的电动势。
3.为什么Weslon标准电池的负极采用含有Cd的质量分数约为0.04~0.12的Cd一Hg齐时,标准电池都有稳定的电动势值?试用Cd一Hg的二元相图说明。
标准电池的电动势会随温度而变化吗?答:在Cd一Hg的二元相图上,Cd的质量分数约为0.04~0.12的Cd一Hg齐落在与Cd一Hg固溶体的两相平衡区,在一定温度下Cd一Hg齐的活度有定值。
因为标准电池的电动势在定温下只与Cd一Hg齐的活度有关,所以电动势也有定值,但电动势会随温度而改变。
4.用书面表示电池时有哪些通用符号?为什么电极电势有正、有负?用实验能测到负的电动势吗?答:用“|”表示不同界面,用“||”表示盐桥。
电极电势有正有负是相对于标准氢电极而言的。
不能测到负电势。
5.电极电势是否就是电极表面与电解质溶液之间的电势差?单个电极的电势能否测量?如何用Nernst方程计算电极的还原电势?5.电极电势是否就是电极表面与电解质溶液之间的电势差?单个电极的电势能否测量?如何用Nernst 方程计算电极的还原电势?答:电极电势不是电极表面与电解质溶液之间的电势差。
南京大学物理化学下册(第五版)复习题及解答

RT ln a zF
7.在公式 ΔrGm =-zE F 中,ΔrGm 是否表示该电池各物都处于标准态时,电池反应的 Gibbs 自由能变 化值?
Θ
Θ
Θ
答:在公式 ΔrGm =-zE F 中,ΔrGm 表示该电池各物都处于标准态时,在 T,p 保持不变的条件 下,按电池反应进行 1mol 的反应时系统的 Gibbs 自由能变化值。 Θ 8.有哪些求算标准电动势 E 的方法?在公式 Θ Θ 中, E 是否是电池反应达平衡时的电动势?K 是否是电池中各物质都处于标准态时的平衡常数? 答:求算标准电动势 E
Θ
ΔrGmΘ =-ZEΘF=ΔrHmΘ-TΔrSmΘ
E r H =-zE F+zFT m T p
(5).稀的 HCI 水溶液中,HCl 的平均活度因子 Y±; Θ 电池:Pt|H2(p )|HCl(m)|AgCl(s)|Ag(s) Θ + 净反应:H2(p ) + AgCl(s) = H (aH+)+Cl (aCl-) +Ag(s)
1 d A n kc A a dt p 若A为理想气体,则有 A A RT
aA P
rc
rp
1 dpA k p pAn a dt
1 d A 1 1 dpA p kc A a dt a RT dt RT
可逆卿一定电流密度下每个电极的实际析出电势等于逆电势加上或减去电极超电势?超电势使得电解池的阴阳两极随电流密度的增大阳极更正阴极更负?外加电压变大消耗电动增多?而原电池的阳极随着电流密度的增加而变小阴极的电势增大总体上原电池的电动势减小所作的电动减小从能量消耗上讲无论原电池或是电解池极化作用都zefzft为负值则表示化学反应的等是不利的但超电势也可以利用?如极谱分析?就是利用浓差极化来分析的一种方法
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
某一溶液中含KBr和KI浓度均为0.1m,今将溶液放于带有Pt电极的多孔磁杯中, 将杯放在一个较大的器皿中,器皿中有一Zn电极与大量0.1m ZnCl2 溶液,设H2 在Zn上析出的过电位是0.70 V,O2 在Pt上过电位是0.45 V,不考虑溶液接界电位,Zn, I2,Br2 的析出过电位可忽略,问:(1) 析出99% 的I2 时所需外加电压是多少(2) 析出99% 的Br2 时所需外加电压是多少(3) 当开始析出O2 时,溶液中Br- 浓度是多少解:阴极上,Zn2+,H+ 可能放电:φ(Zn) = φ+ 0.02958lg[Zn2+] = -0.763 + 0.02958lg0.1 = -0.793 Vφ(H2) = φ+ 0.05915lg[H+] - η = 0.05915lg10-7 - 0.70 = -1.114 V因此,阴极上Zn首先析出.阳极上,Br-,I-,OH- 可能放电:φ(I2) = φ- 0.05915lg[I-] = 0.536 - 0.05915lg0.1 = 0.595 Vφ(Br2)= φ- 0.05915lg[Br-] = 1.066 - 0.5915lg0.1 = 1.125 Vφ(O2/OH-) = φ- 0.05915lg[OH-] + η = 0.401 - 0.5915lg10-7 + 0.45 = 1.261 V因此,阳极上放电的顺序为I-,Br-,OH- .(1) 99% 的I2 析出,[I-] = 0.1 × 1% = 10-3φ(I2) = 0.536 - 0.05915lg10-3 = 0.713 V外加电压E = φ(I2) - φ(Zn) = 0.713 - (-0.793) = 1.506 V(2) 99% 的Br2 析出,[Br-] = 0.1 × 1% = 10-3φ(Br2) = 1.065 - 0.05915lg10-3 = 1.242 V外加电压E = φ(Br2) - φ(Zn) = 1242 + 0.793 = 2.035 V(3) O2 析出时,φ(O2) = 1.261 V 1.261 = 1.065 - 0.05915lg[Br-][Br-] = 4.852 × 10-4 mol·dm-31. 气相反应是一个二级反应,当和的初始压力为时,在25℃时反应的半衰期为1h,在35℃时反应的半衰期为。
(1) 计算25℃和35℃时反应的速率常数 (2) 计算该反应的阿累尼乌斯活化能和指前因子。
2.在673k时,设反应可以进行完全,产物对反应速率无影响,经实验证明该反应是二级反应k与温度T之间的关系为的单位为(1)求此反应的指前因子A及实验活化能。
(2)若在673k时,将通入发应器,使其压力为26.66,然后发生上述反应,试计算反应器中的压力达到时所需的时间。
4.某反应速率方程其中,在298K,时,时,,已知该反应活化能为,求,反应进行到时,该反应速率常数。
5.的热分解反应为从实验测出不同温度时各个起始压力与半衰期值如下:反应温度初始压力半衰期967156.78738096739.197152010307.0661440103047.996212(1)求反应级数和两种温度下的速率常数。
(2)求活化能值。
(3)若1030K时的初始压力为,求压力达到时所需时间。
6.在40℃时,在溶剂中进行分解反应,反应级数为一级,初始反应速率,1h后反应速率,试计算:(1)反应在40℃时的速率常数。
(2)40℃时反应的半衰期、(3)初始浓度为什么?7.反应的速率方程如下:(1)将物质的量比为2:1的A,B混合气体,通入400K的恒温密闭反应容器中,起始总压为3040P a,50s后容器压力为2027P a,问150s后容器中B得分压是多少?(2) 500K时重复上述实验,起始总压为3040P a,50s后B的分压为多少?假设反应的活化能为8.气相反应其速率方程为在300K时,,反应焓变,当温度升高10℃时,升高1倍,求算:(1)300K时反应的平衡常数。
(2)正逆反应的活化能。
(3)若,平衡时A的转化率达到80%,温度应达到多高?9.乙醛光解反应机理如下:试推导的表达式及对C O的量子产率。
10.对于平行反应若总反应的活化能为E,试证明11.求具有下列机理的某气相反应的速率方程:与A,C,D的浓度相比较,B的浓度很小,所以可运用稳态近似法,证明此反应在、高压下为一级,低压下为二级。
12.已知反应已知,求在温度超过多少后,生成主产物的速率大于副产物的速率。
13.反应试证:14.反应(1)350℃时,时,正反应速率的有关数据如下:0.100.100.050.100.050.101.2(2)451℃时,时,逆反应速率的数据如下0.160.160.040.160.040.16若求算值。
1. 液体表面层中的分子受到的不对称力与液体的表面张力有何联系与区别?液体表面层的分子与内部分子均受到分子之间力的作用,但受力的情况有所不同。
在液体内部,分子的周围环境是对称的,分子间作用力彼此相互抵消。
而表面层分子,由于物质在两相中的密度不同或两相的组成不同,使表面层分子受到一个指向液体内部的净作用力。
这就是液体表面分子受到的不对称力。
这个力力图将液体表面层分子拉向液体内部,使表面紧缩,这种收缩倾向在液面上处处在,因此将这种与表面相切并垂直作用于单位长度线段上的表面紧缩力称为表面张力,可见,表面层分子所受到的不对称力是分子间作用力,是短程的,微观的力,是表面层亿万分子受到不对称的分子间力作用后的宏观表现,其方向与液面相切。
2. 有人说,在弯液面上取一小截面ABC,周界以外的表面对周界有表面张力的作用两者大小相等,方向相反,互相抵消了,怎么还会有附加压力呢?表面张力是作用于液体表面上的,处于静止状态的液面上任何一点都必须满足力平衡的条件,所以周界两侧的表面张力大小相等,方向相反,使液面处于力平衡状态,这是对液面上各点而言的,而附加压力是分析液面内外单位载面上所承受的压力问题,由于液面是弯曲的,周界以外的表面对小截面的表面张力的合力不等于零,对凸液面合力的方向,指向液体内部,对凹液面则指向气相,使液面两边的压力不相等,这就是附加压力的来源。
3. 什么叫毛细凝聚现象?由Ke lvin公式可知,当毛细管中的液体能润湿毛细管壁时,管内液面呈凹形,液面曲率半径,则,即凹液面上方的平衡蒸气压力小于平液面上的饱和蒸气压,且r愈小,,即凹液面上方的平衡蒸气压力时,尽管对平面液体未达饱和,但对毛细管中发生凝聚,形成液体。
该过程称为毛细凝聚现象,多孔性固体的内孔中常存在这种现象。
4. 由润湿过程知,铺展系数,式中为接触角,当某液体能在固体表面上铺展时,有,则必须或,这显然是不可能的,对此该作何解释?铺展系数的定义是与杨氏方程结合,可得。
而杨氏方程适用的条件必须为热力学平衡系统。
对的系统,液体能在固体表面自发展开,但即使达到平衡。
对这种系统,杨氏方程不能适用,也不存在接触角,故只能用值判断铺展润湿能否自发进行。
5. 设一弯曲玻璃毛细管A,插入水中后,由于毛细现象,水面上升高度将超过h(见图9-1),因而水滴会从弯口B处不断滴出。
这个设想能否实现?为什么?这个设想如果能实现,即可利用滴下的水滴,推动叶轮作功,系统恢复原状而得到了功,这就是第一类永动机,显然是不可能实现的。
从表面化学的规律来分析,玻璃毛细管中的水面呈凹面上方的气相,才使液面升高,若要在管口处形成液滴落下,首先要在弯口B处形成凸液面,凸液面一旦形成,附加压力的方向则将由原来指相气相转为指向液体内部,则无法保持毛细管内升高的液面了。
所以凸液面不可能形成,也就不可能形成液滴落下了。
实际的情况将是在最初形成的凹形水面到大毛细管口B处时,由于水面无法继续延伸,为了达到液面两边力的平衡只有改变凹液面的曲率半径r,使产生的附加压力与B处的液柱静压力达到平衡(即)。
7. 进行蒸馏实验时,通常在蒸馏瓶中加入少量碎瓷片或沸石类的物质以防止爆沸,试分析其原因。
暴沸现象是由于新相种子(小气泡)难以生成而产生的。
由开尔文公式可知,对小气泡,越小,气泡内的饱和蒸气压液越小,而附加压力却越大。
在液面下的下气泡需承受的外压力等于大气压力,液体静压力及附加压力三者之和。
在正常沸腾温度下,气泡内的饱和蒸气压远远小于,因此小气泡无法产生。
只有再升高温度,使p增大,当达到时,液体便开始沸腾,而一旦气泡形成,它便迅速长大,随之相应增加,相应降低,气泡反抗的外压迅速减小,因而液体沸腾激烈,形成暴沸现象。
为了防止暴沸发生,可以先在液体中加入一些素烧瓷片或沸石因为这些多孔隙物质能提供新相种子(小气泡),使液体过热程度大大降低。
8. 为什么表面活性剂能大大地降低水的表面张力。
因为表面活性剂分子是由亲水的极性基团(如等)和憎水的非极性基团(如碳氢基团)组成的有机化合物,极性基团与水分子的吸引力远小于水分子之间的吸引力,故它的存在有利于其在水中的均匀分布;非极性基团与水分子的吸引力远小于水分子之间的吸引力,故它的存在有利于表面活性剂分子聚集在溶液表面或水-油两相界面,因此当表面活性剂溶于水时将会吸附在水的表面上,采取极性基团向着水,非极性基团指向空气(或油相)的表面定向排列使水和另一相的接触面减小,从而引起水的表面张力显著降低。
9. 两块平板玻璃在干燥时,得放在一起很容易分开。
若在其间放些水,再叠放在一起,使之分开却很费劲,这是什么原因?因为水能润湿玻璃,所以在两块玻璃之间水层的四周皆呈凹液面(图9.2.3)。
凹液面处产生一指向空气的附加压力,附加压力的作用是使两块玻璃的内外两侧受压不等,与水接触的内侧压力较小,与空气接触的外侧所受压力较大故水层周围凹液面处的附加压力使两块玻璃更难分开。
10. 在两只水平放置的毛细管中间皆装有一段液体,(a)管中的液体对管壁完全润湿;(b)管中的液体对管壁完全不润湿,如图9.2.10所示。
当在管右端加热时,管中液体各向哪一端流动?当在右加热时,右端的毛细管膨胀,由可知,上述两因素皆使加热端的附加压力在数值上变小,而破坏原来的平衡。
由于两管中附加压力方向不同(见图9.2.10中箭头)使(a)管中的液体向冷端移动,(b)管中的液体向热端移动。
11. 在半径相同的毛细管下端有两个大小不同的圆球形气泡,如图所示。
试问将活塞C关闭,A及B打开会出现什么现象?两气泡联通后,由于弯液面附加压力的作用,大气泡会变得更大,小气泡变得更小,直到小气泡收缩至毛细管口,其液面的曲率半径与大气泡相等时为止。
12. 解释下列各种现象及原因:(1).四氯化碳和水混合均匀静置放置后会自动分层;(2)汞液滴或空气中气泡通常呈球形;(3)粉尘大的工厂或矿山容易发生爆炸事故(4)矿泉水注入玻璃杯中,水面可略微高出杯口;(1)四氯化碳和水混合均匀后的油水体系,静置后自动分层是液体自动缩小表面界面积的现象,四氯化碳和水混合均匀后,形成了一种以小液滴的形式分散在另一种液体中的多相分散系统,相之间的表面积很大,表面吉布斯函数很高,处于热力学不稳定状态,因此系统会自动缩小表面积而使体系趋于稳定。
