常见晶体模型及晶胞计算
常见晶体模型及晶胞计算
晶胞中微粒个数的计算,求化学式
小结:高考常见题型
1、(2013·江苏,21A(1)) 元素X 位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2。元素Y基态原子的3p 轨道上有4个电子。
X与Y所形成化合物晶体的晶胞如右图所示。 ①在1个晶胞中,X离子的数目为 。 ②该化合物的化学式为 。
Mg、Zn、Ti 每个晶胞含 个原子 六方最密堆积的配位数 =12 2
④面心立方最密堆积(铜型)
Cu、Ag、Au 面心立方堆积的配位数 =12 每个晶胞含 个原子 4
面心立方最密堆积的空间占有率
=74%
金属晶体的四种堆积模型对比
堆积模型
采纳这种堆积的典型代表
(3)若NaCl晶体的密度为ρg/cm3,则 NaCl晶体中Na+与Na+间的最短距离是多少?
a/2
a/2
=
练习
CsCl的晶体结构
(1)每个Cs+( Cl-)周围等距且紧邻的Cl- (Cs+)有 个, Cs+( Cl-)的配位数为 。
8
8×1/8=1
6
——晶胞为体心立方体
8
(2)每个Cs+ ( Cl-)周围 等距且紧邻的Cs+ ( Cl-)有 个。
1
3
6
4
2
A
5
密置层
配位数为4
配位数为6
返
A
B
A
B
A
返
第三层的另一种排列方式,是将球对准第一层的 2,4,6 位,不同于 AB 两层的位置,这是 C 层。
1
2
3
4
5
6
1
2
3
人教版高中化学选修三课件:第三章 专题课 晶体堆积模型及晶胞相关计算ppt

例5 右图为NaCl晶胞结构,已知FexO晶体晶胞结构为 NaCl型,由于晶体缺陷,x值小于1。测知FexO晶体的
密度为ρ=5.71g/cm3,晶胞边长为4.28×10-10m。
探究1:已知铜晶胞是面心立方晶胞,其晶胞特征如右图所示。 若已知该晶体的密度为a g/cm3,NA代表阿伏加德罗常数,相对原子质量为64 , 请回答:
[来源:学科网]
①晶胞中铜原子的配位数为________ ,一个晶胞中原子的数目为________; ②该晶体的边长为_______________,铜原子半径为________(用字母表示)。 列式并计算Cu空间利用率________________
D.YBa2Cu4O7
题型4、 晶体密度、粒子间距离的计算
例4右图为NaCl晶胞结构示意图。 (1)用X射线衍射法测得晶胞的边长为a cm,求该温度下NaCl晶体的密度。
ρ=m/V=
(2)晶体的密度为ρg/cm3,则晶体中Na +与Na+之间的最短距离是多少?
[练习3]. 已知 NaCl 的摩尔质量为 M g·mol-1, 食盐晶体的密度为ρg·cm-3,若下图中Na+与最邻 近的Cl- 的核间距离为 a cm,那么阿伏加德罗常 数的值可表示为 D
【巩固练习】 1.Al2O3在一定条件下可制得AlN,其晶体结构如图2所示,该 晶体中Al的配位数是_________ .
2.六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似, 硬度与金刚石相当,晶胞边长为361.5pm,立方氮化硼晶胞中含有______个 氮原子、_______个硼原子,立方氮化硼的密度是____________g·cm-3(只 要求列算式,不必计算出数值,阿伏加德罗常数为NA)
(完整版)常见晶胞模型

氯化钠晶体离子晶体(1)NaCI晶胞中每个Na+等距离且最近的Cl-(即Na+配位数)为6个(2)(3)NaCI晶胞中每个CI-等距离且最近的Na+(即CI-配位数)一个晶胞内由均摊法计算出一个晶胞内占有的Na+4个; 占有的CI-4个。
在该晶体中每个Na+周围与之最接近且距离相等的Na+ 与每个Na+等距离且最近的CI-所围成的空间几何构型为CsCI晶体(注意:右侧小立方体为CsCI晶胞;左侧为8个晶胞)(1)CsCI晶胞中每个Cs+等距离且最近的C「(即Cs+配位数)为8个CsCI晶胞中每个CI-等距离且最近的Cs+(即CI-配位数)为8个,这几个Cs+在空间构成的几何构型为正方体。
(2)在每个Cs+周围与它最近的且距离相等的Cs+有6个这几个Cs+在空间构成的几何构型为正八面体。
• Cs* OCI- (3)一个晶胞内由均摊法计算出一个晶胞内占有的Cs+ 1个;占有的CI- 1个CaF2晶体(1))Ca2+立方最密堆积,F-填充在全部四面体空隙中。
(2)CaF2晶胞中每个Ca2+等距离且最近的F-(即Ca2+配位数)为8个CaF2晶胞中每个F-等距离且最近的Ca2+(即F-配位数)为4个(3)一个晶胞内由均摊法计算出一个晶胞内占有的Ca2+4个;占有的F-8个。
ZnS晶体:(1)1个ZnS晶胞中,有4 个S2「,有4个Zn2+(2)Zn2+的配位数为4个, S2_的配位数为4个O£n?,•原子晶体(1) 金刚石晶体a 每个金刚石晶胞中含有 8个碳原子,最小的碳环为 6元环,并且不在同一平面(实际为椅 式结构),碳原子为sp 3杂化,每个C 以共价键跟相邻的_4_个 C 结合,形成正四面体。
键角109° 28'b 、 每个碳原子被12个六元环共用,每个共价键被6个六元环共用c 、 12g 金刚石中有2mol 共价键,碳原子与共价键之比为 (2) Si 晶体由于Si 与碳同主族,晶体Si 的结构同金刚石的结构。
高中化学知识点复习 晶体计算类型归纳

面(实际为椅式结构),碳原子为 sp3 杂化
(3)每个碳原子被 12 个六元环共用,每个共价键被 6 个六元环共用,一个六元
1
环实际拥有 个碳原子
2
(4)C 原子数与 C—C 键数之比为 1∶2,12g 金刚石中有 2 mol 共价键
(5)密度=8×12 g·mol-1 NA×a3
(a 为晶胞边长,NA 为阿伏加德罗常数)
NA×a3
离子晶体的配位数
离子晶体中与某离子距离最近的异性离子的数目叫该离子的配位数
(1)正、负离子半径比:AB 型离子晶体中,阴、阳离子的配位数相等,但正、
影响离子晶体配位数的因素
负离子半径比越大,离子的配位数越大。如:ZnS、NaCl、CsCl (2)正、负离子的电荷比。如:CaF2 晶体中,Ca2+和 F-的配位数不同
晶体
晶体结构
结构分析
干冰
(1)面心立方最密堆积:立方体的每个顶点有一个 CO2 分子,每个面上也有一
个 CO2 分子,每个晶胞中有 4 个 CO2 分子
(2)每个 CO2 分子周围等距且紧邻的 CO2 分子有 12 个
(3)密度=4×44 g·mol-1 NA×a3
(a 为晶胞边长,NA 为阿伏加德罗常数)
Cu Ag Au 12 4
2 a=4r
2
Mg Zn Ti 12
6或2
——
(2)金属晶胞中原子空间利用率计算: 空间利用率 V球
球数 4 r3
3
V晶胞
a3
①简单立方堆积:如图所示,原子的半径为 r,立方体的棱长为 2r,则 V 球=43πr3,V 晶胞=(2r)3=8r3,空间利
(4)在 NaCl 晶体中,每个 Na+周围与它最接近且距离相等的 Na+共有 12 个,
3-1-2晶胞及其相关参数计算 (含视频)(教学课件)-高中化学人教版(2019)选择性必修第二册

6 1 +8 1 +4=8 28
晶胞的相关计算: 1. 晶体化学式的确定 学以致用2:请计算出NaCl晶胞Na+和Cl-的个数。
Na+数=12×
1 4
+1 =4
Cl-数=8×
1 8
+6
×
1 2
=4
一个晶胞含4个NaCl
Na+数: Cl-数=1:1
氯化钠的化学式为NaCl
ห้องสมุดไป่ตู้
离子晶体化学式只表示每个晶胞或晶体中各类粒子的最简整数比
知识拓展 1. 三棱柱晶胞中粒子数目的计算
三棱柱
体心 面心 棱边
顶点
1 1/2 水平1/4 竖1/6
1/12
任务一:晶胞中粒子数目的计算——六棱柱
六棱柱
体心 面心 棱边 顶点
1 1/2 水平1/4 竖1/3
1/6
小结
(1)立方体 (3)六棱柱
体心 面心 棱边 顶点
1
1/2 (2)三棱柱
1/4
1/8
复习回顾
晶体的构成微粒呈周期性的有序排列
晶体:内部微粒(原子、离子或分子)在三维空间里呈周期性排列
而构成的具有规则几何外形的固体。
一、晶胞
金刚石结构 思考讨论
铜晶体结构
只需研究基本重复单元
氯化钠晶体结构
要研究晶体的结构,应当如何入手呢?是否需要研究构成晶体的所有部分?
晶胞:描述晶体结构的最小基本重复单元叫做晶胞。
晶胞的相关计算:
大蓝本61页
例1: 以晶胞参数为单位长度建立的坐标系 可以表示晶胞中各原子的位置,称作原子分数 坐标,如图中原子1的坐标为 12,21,12 ,则原 子 2 和 3 的 坐 标 分 别 为 _________ 、 __________ 。
常见晶体模型与晶胞计算 Word版含解析

常见晶体模型与晶胞计算1.典型晶体模型晶体晶体结构晶体详解原子晶体金刚石(1)每个碳与相邻4个碳以共价键结合,形成正四面体结构(2)键角均为109°28′(3)最小碳环由6个C 组成且六原子不在同一平面内(4)每个C 参与4条C —C 键的形成,C 原子数与C —C 键数之比为1∶2SiO 2(1)每个Si 与4个O 以共价键结合,形成正四面体结构(2)每个正四面体占有1个Si,4个“12O”,n (Si)∶n (O)=1∶2(3)最小环上有12个原子,即6个O,6个Si分子晶体干冰(1)8个CO 2分子构成立方体且在6个面心又各占据1个CO 2分子(2)每个CO 2分子周围等距且紧邻的CO 2分子有12个离子晶体NaCl 型(1)每个Na +(Cl -)周围等距且紧邻的Cl -(Na +)有6个,每个Na +周围等距且紧邻的Na +有12个(2)每个晶胞中含4个Na +和4个Cl -CsCl 型(1)每个Cs+周围等距且紧邻的Cl -有8个,每个Cs +(Cl-)周围等距且紧邻的Cs+(Cl-)有6个(2)如图为8个晶胞,每个晶胞中含1个Cs+、1个Cl-金属晶体简单立方堆积典型代表Po ,配位数为6,空间利用率52%面心立方最密堆积又称为A 1型或铜型,典型代表Cu 、Ag 、Au ,配位数为12,空间利用率74%体心立方堆积又称为A 2型或钾型,典型代表Na 、K 、Fe ,配位数为8,空间利用率68%六方最密堆积又称为A3型或镁型,典型代表Mg 、Zn 、Ti ,配位数为12,空间利用率74%2.晶胞中微粒的计算方法——均摊法【重难点指数】★★★【重难点考向一】常见晶胞类型和结构特点【典型例题1】(1)【2015·高考全国卷Ⅰ,37(5)】碳有多种同素异形体,其中石墨烯与金刚石的晶体结构如图所示:石墨烯晶体金刚石晶体①在石墨烯晶体中,每个C原子连接________个六元环,每个六元环占有________个C原子。
常见晶体模型及晶胞计算

常见晶体模型及晶胞计算引言晶体是由周期性排列的原子、离子或分子构成的固体材料。
晶体的周期性排列导致了其具有一些特殊的性质,例如独特的光学、电学和热学性质。
为了研究晶体的这些性质,科学家提出了各种模型来描述晶体的结构。
在本文中,我们将介绍几种常见的晶体模型,并讨论晶胞计算的方法。
晶体模型1.金属晶体模型金属晶体模型是最简单的晶体模型之一、金属晶体由金属原子构成,没有共价键或离子键。
金属晶体的特点是具有密堆结构,例如面居中立方(fcc)或体居中立方(bcc)结构。
这些结构可以用简单的立方晶胞来描述,其中原子位于晶格点上。
2.离子晶体模型离子晶体是由正负离子构成的晶体。
离子晶体的特点是具有离子键,即正离子和负离子之间的静电相互作用力。
离子晶体的结构可以用通常称为离子晶胞的基本单元来描述。
离子晶胞中包含正离子和负离子,并且具有充分保持电中性的结构。
3.共价晶体模型共价晶体由共价键相互连接的原子或离子组成。
共价键是由共用电子对形成的,这些电子对由每个原子的价电子共享。
共价晶体的结构可以用共价晶胞来描述,其中原子或分子通过共价键连接。
晶胞计算晶胞计算是研究晶体结构的一种方法。
具体来说,晶胞计算是为了确定晶体的晶胞参数,即晶体中原子、离子或分子的排列和间距。
晶胞计算通常包括以下步骤:1.数据收集:这是晶胞计算的第一步。
通过使用X射线衍射、中子衍射或电子衍射等实验技术,收集晶体的衍射数据。
2.数据分析:在收集到晶体的衍射数据后,需要对这些数据进行分析。
这包括确定晶胞中原子的位置和间距。
一般采用的方法是使用维护衍射方程来进行数据分析。
3.模型构建:在完成数据分析后,可以构建晶胞模型。
这可以通过使用复结构拓扑方法或使用分子动力学模拟等方法来实现。
4.晶胞参数优化:晶胞参数的优化是为了获得最佳的晶胞参数。
这可以通过使用晶体学软件进行计算和优化来实现。
5.结果解释:最后一步是对晶胞计算结果进行解释和分析。
这可以包括确定晶体中原子、离子或分子的排列和结构,并进一步研究晶体的性质。
常见的晶体结构及其原胞晶胞

§1-2 常见的晶体结构及其原胞、晶胞1) 简单晶体的简单立方(simple cubic, sc) 它所构成的晶格为布喇菲格子。
例如氧、硫固体。
基元为单一原子结构的晶体叫简单晶体。
其特点有: 三个基矢互相垂直(),重复间距相等,为a,亦称晶格常数。
其晶胞=原胞;体积= ;配位数(第一近邻数) =6。
(见图1-7)图1-7简单立方堆积与简单立方结构单元2) 简单晶体的体心立方( body-centered cubic, bcc ) , 例如,Li,K,Na,Rb,Cs,αFe,Cr,Mo,W,Ta,Ba等。
其特点有:晶胞基矢, 并且,其惯用原胞基矢由从一顶点指向另外三个体心点的矢量构成:(见图1-9 b)(1-2)其体积为;配位数=8;(见图1-8)图1-8体心立方堆积与体心立方结构单元图1-9简单立方晶胞(a)与体心立方晶胞、惯用原胞(b)3) 简单晶体的面心立方( face-centered cubic, fcc ) , 例如,Cu,Ag,Au,Ni,Pd,Pt,Ne, Ar, Xe, Rn, Ca, Sr, Al等。
晶胞基矢,并且每面中心有一格点, 其原胞基矢由从一顶点指向另外三个面心点的矢量构成(见图1-10 b):(1-3)其体积=;配位数=12。
,(见图1-10)图1-10面心立方结构(晶胞)(a)与面心立方惯用原胞(b)4) NaCl结构(Sodium Chloride structure),复式面心立方(互为fcc),配位数=6(图1-11 a)。
表1-1 NaCl结构晶体的常数5) CsCl结构(Cesuim Chloride structure),复式简单立方(互为sc),配位数=8(图1-11 b)。
表1-2 CsCl结构晶体的常数图1-11 NaCl结构和CsCl结构6) 金刚石结构(Diamond structure), 两套fcc格子相互沿对角线位移1/4处套合。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
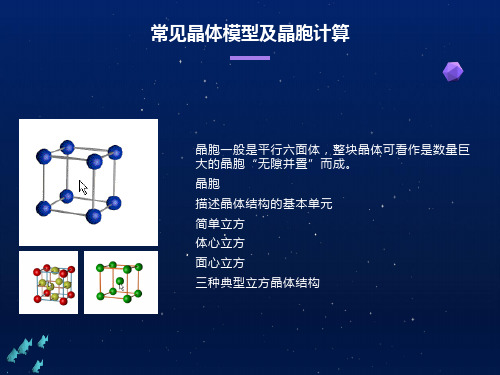
晶胞 描述晶体结构的基本单元
晶胞一般是平行六面体,整块晶体可看作是数量巨大的 晶胞“无隙并置”而成。
三种典型立方晶体结构
简单立方
体心立方
面心立方
晶胞中微粒的计算方法——均摊法
原则:晶胞任意位置上的一个原子如果是被n个图形晶胞 所共有,那么,每个晶胞对这个原子分得的份额是1/n。
每个晶胞含 1 个原子
球半径为r 正方体边长为a r=2/a 空间利用率=
晶胞含有原子的体积 ×100% 晶胞体积
=2r
K、Na、Fe ②体心立方堆积(钾型) 体心立方堆积的配位数 =8 每个晶胞含 2 个原子
Mg、Zn、Ti ③六方最密堆积(镁型) 六方最密堆积的配位数 =12 每个晶胞含 2 个原子
的距离为 a cm,该晶体密度为
练习
CsCl的晶体结构 ——晶胞为体心立方体
(1)每个Cs+( Cl-)周围等距 且紧邻的Cl- (Cs+)有 8 个, Cs+( Cl-)的配位数为 8 。
(2)每个Cs+ ( Cl-)周围 等距且紧邻的Cs+ ( Cl-)有 6 个。 (3)每个晶胞中含 1 个Cs+、含 8×1/8=1个Cl-,故每 个晶胞中含有 1 个“CsCl”结构单元; N(Cs+) ︰ N( Cl-) = 1︰1 ,化学为 CsCl 。 思考:NaCl、CsCl同属AB型离子晶体, NaCl晶体中 Na+的配位数与CsCl晶体中Cs+的配位数是否相等?
在每个小立方体中平均分摊到的CO2
(8×1/8 + 6×1/2) = 4 个 分子数为:
离子晶体
NaCl的晶体结 ——简单立方体 (1) 每个Na+( Cl-)周围等 构 Cl
- 距且紧邻的Cl- (Na+)有 Na+ 6 个,构成 正八面体 , Na+( Cl-)的配位数为 6 。
(2)每个Na+周围等距且 紧邻的Na+有 12 个。 (3)每个晶胞中平均有 4 个Na+, 4 个Cl-,故每个晶 胞中含有 4 个“NaCl”结构单元; N(Na+) ︰ N( Cl-) = 1 ︰1 ,化学为 NaCl 。 (4)能否 把“NaCl”称为分子式?
2、Cu单质的晶体的晶胞结构如下图。若Cu原子的半径 是r cm,则Cu单质的密度的计算公式是 (用 NA表示阿伏伽德罗常数)
立方晶胞中原子个数
3 1
7 3 6 2 1 2
4
2
8
5
4 1
棱上:1/4
1
返
顶点:1/8
体心:1Biblioteka 面上:1/2返返
返
2 2 1 A 4 3 1 6 A 4 5 3
配位数为4 非密置层
配位数为6 密置层
返
1 6 5
2 3 4
A
B
A B A
返
第三层的另一种排列 方式,是将球对准第一层 1 6 5 4
2
3
的
2,4,6
位,不同
于 AB 两层的位置,这是 C 层。
1 6 5
2 3 4
1 6
5
2
3
4
A C B
A C
B
返
A
-
(1)设NaCl晶胞的边长为acm,则 晶胞中Na+和Cl-的最近距离(即小立 示为 ( ) 方体的边长)为 a/2 cm,则晶胞中 同种离子的最近距离为 a/2 cm。 (2)晶胞的边长为acm,求NaCl晶 体的密度。 M / NA×晶胞所含粒子数 58.5 / NA×4 = ρ= a3 晶胞的体积 (3)若NaCl晶体的密度为ρg/cm3,则 NaCl晶体中Na+与 Na+间的最短距离是多少?
Cu, Ag, Au
74%
12
原子晶体
金刚石
该晶胞实际分摊到的碳原子数为 (4 + 6 ×1/2 + 8 ×1/8) = 8个。
小结:高考常见题型 (一) 晶胞中微粒个数的计算, 求化学式 (二) (三) 的计算 确定配位数 晶体的密度及微粒间距离
练习 1、(2013· 江苏,21A(1)) 元素X 位于第四周期,其基态原子的内层轨道全部 排满电子,且最外层电子数为2。元素Y基态原子的 3p 轨道上有4个电子。 X与Y所形成化合物晶体的晶胞 如右图所示。 ①在1个晶胞中,X离子的数目 为 4 。 ②该化合物的化学式为 ZnS 。
④面心立方最密堆积(铜型)Cu、Ag、Au 面心立方堆积的配位数 =12
每个晶胞含 4 个原子
面心立方最密堆积的空间占有率 =74%
金属晶体的四种堆积模型对比
堆积模型 简单立方 体心立方 (钾型) 六方最密 (镁型) 面心立方最密 (铜型) 采纳这种堆积 的典型代表 Po(钋) K、Na、Fe Mg、Zn、Ti 空间利用率 52% 68% 74% 配位数 6 8 12 晶胞
(1)长方体(立方体):
N=N顶角×1/8 + N棱上×1/4 + N面上×1/2 + N体内
(2)非长方体(非立方体):
视具体情况分析。
分子晶体 干冰晶体结构 ——晶胞为面心立方体
8个CO2分子位于立方体顶点 6个CO2分子位于立方体面心 在每个CO2周围等距离且相距最近 的CO2共有 12 个。
CaF2的晶体结构
(1)每个Ca2+周围等距且 紧邻的F-有 8 个, Ca2+配 位数为 8 。 (2)每个F-周围等距且紧 邻的Ca2+有 4 个, F-配位 数为 4 。 FCa2+
(3)每个晶胞中含 4 个Ca2+、含 8 个F-, Ca2+和 F-的个数比是 1︰2 。
3、金属晶体:
①简单立方堆积 唯一金属——钋 简单立方堆积的配位数=6
