药物GLP认证目录(更新至2016年1月)
glp药品经营管理规范

glp药品经营管理规范《药品非临床研究质量管理规范》(Good laboratory practice of drug,GLP) 系指对从事实验研究的规划设计、执行实施、管理监督和记录报告的实验室的组织管理、工作方法和有关条件提出的法规性文件。
GLP认证是指国家食品药品监督管理局对药物非临床安全性评价研究机构的组织管理体系、人员、实验设施、仪器设备、实验项目的运行与管理等进行检查,并对其是否符合GLP作出评定。
GLP认证分为申请与受理、资料审查与现场检查以及审核与公告三大环节。
GMP 是针对药厂生产的,GLP是针对药物实验室的。
第一条为加强药物非临床研究的监督管理,规范药物非临床研究质量管理规范(以下简称GLP)认证管理工作,根据《中华人民共和国药品管理法》和《中华人民共和国药品管理法实施条例》及有关规定,制定本办法。
第二条GLP认证是指国家食品药品监督管理局对药物非临床安全性评价研究机构的组织管理体系、人员、实验设施、仪器设备、试验项目的运行与管理等进行检查,并对其是否符合GLP作出评定。
第三条国家食品药品监督管理局主管全国GLP认证管理工作,省级药品监督管理部门负责本行政区域内药物非临床安全性评价研究机构的日常监督管理工作。
第二章申请与受理第四条拟申请GLP认证的药物非临床安全性评价研究机构可根据本机构的研究条件,申请单项或多项药物安全性评价试验项目的认证。
申请GLP认证的机构,应在申请前按照GLP的要求运行12个月以上,并按照GLP的要求完成申请试验项目的药物安全性评价研究.第五条申请GLP认证的药物非临床安全性评价研究机构,应向国家食品药品监督管理局报送《药物非临床研究质量管理规范认证申请表》、申请资料(附件1、2)和电子版本。
申请资料中有关证明文件的复印件应加盖申请机构公章。
药品非临床研究质量管理规范GLP

药品GLP与药物非临床研究
四、药品GLP对药物非临床安全性研究的质量保证作用 1、规定研究人员及其他有关人员的资格和职责,规范
并标准化安全性评价试验的操作和行为。 2、保证研究机构具备稳定和适当基本设施。 3、保证试验系统和材料的可靠性。 4、通过实施SOP来规范各种试验和操作。 5、建立完善的试验资料记录和保管制度。 6、建立质量保证体系(QAS)(包括人员、机构、软件、
GLP的发展
其后,GLP的概念逐渐扩展到其它有毒有害 物质(如农药、环境和食品污染物、工业毒物、 射线等)的实验室安全性评价,以及各类健康相 关产品(食品和保健食品、化妆品、涉水产品、 消毒产品等)的实验室评价(包括安全性和功效 学评价)、甚至还包括了对临床实验室大部分检 验工作的管理。
GLP的概念
GLP的发展历史和现状
卫生部十分重视健康相关产品检验和 化学物毒性评价的GLP管理工作。
1999年3月发布了《卫生部健康相关产 品检验机构工作制度》和《卫生部健康相 关产品检验机构认定与管理办法》;2000 年1 月发布《卫生部健康相关产品检验机构 认定与管理规范》。
GLP的发展历史和现状
2000 年 11 月 卫 生 部 发 布 《 化 学 品 毒 性 鉴定管理规范》(包括化学品毒性鉴定实 验室条件及工作准则,即GLP);2001年6 月发布《化学品毒性鉴定机构资质认证工 作程序》和《化学品毒性鉴定机构资质认 证标准》。
1、具备医学、药学或其他相关专业本科以上学历。 2、具有相应的业务素质和工作能力。
(二)专题负责人
1、具有全面负责该项研究工作运行的能力。 2、具有对研究程序作技术评估和判断的能力。 3、具有对研究过程中出现的异常情况及试验方案中未
药品认证名词解释(一)

药品认证名词解释(一)药品认证名词解释1. GMP(Good Manufacturing Practice)•合格生产规范•是指药品生产过程中需要遵守的一系列规范和标准。
GMP要求药品生产过程中的每一个环节都必须经过规定的程序和严格控制,确保药品的质量、安全和有效性。
2. ISO 9001(International Organization for Standardization)•国际标准化组织9001标准•是指一种针对质量管理体系的国际标准。
ISO 9001要求企业建立和维护一个能够持续提供符合要求的产品和服务的质量管理体系。
3. GLP(Good Laboratory Practice)•良好实验室规范•是指药品研发和实验室测试过程中需要遵守的一系列规范和标准。
GLP要求实验室在进行药品试验之前,必须有完善的实验设计、记录、报告和质量保证/质量控制程序,以确保结果的可靠性和准确性。
4. GCP(Good Clinical Practice)•临床实践规范•是指药物临床试验中需要遵守的一系列道德与科学准则。
GCP要求临床试验必须经过审查和批准,并且对试验对象的权益、安全性和试验结果进行严格的监督和评估。
5. GDP(Good Distribution Practice)•良好分销规范•是指药品分销过程中需要遵守的一系列规范和标准。
GDP要求药品的运输、储存和分销过程中必须有合适的设施、措施和程序,以确保药品的质量、安全和完整性。
6. CTD(Common Technical Document)•公共技术文件•是指提交药品注册申请时所需的一种标准化文件格式。
CTD提供了一套标准的药品注册申请文件的结构和内容,以便药品监管部门能够更方便地审查和评估申请文件。
7. SOP(Standard Operating Procedure)•标准操作规程•是指一套针对特定操作或过程的规范化文件,其中包含详细的步骤和工作要求。
国内GLP实验室清单(优选借鉴)
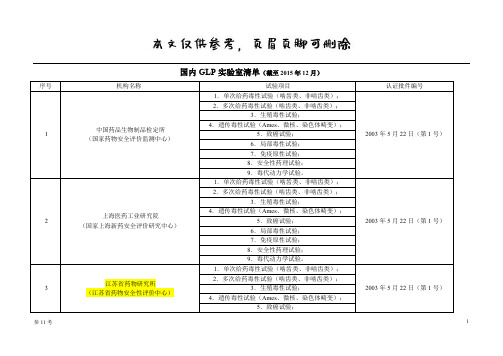
序号
机构名称
试验项目
认证批件编号
1
中国药品生物制品检定所
(国家药物安全评价监测中心)
1.单次给药毒性试验(啮齿类、非啮齿类);
2003年5月22日(第1号)
2.多次给药毒性试验(啮齿类、非啮齿类);
3.生殖毒性试验;
4.遗传毒性试验(Ames、微核、染色体畸变);
7.免疫原性试验;
8.安全性药理试验。
6
中国科学院上海药物研究所
(药物安全评价研究中心)
1.单次给药毒性试验(啮齿类、非啮齿类);
2004年8月3日(第3号)
2.多次给药毒性试验(啮齿类、非啮齿类);
3.生殖毒性试验;
4.遗传毒性试验(Ames、微核、染色体畸变);
5.致癌试验;
6.局部毒性试验;
7.免疫原性试验;
3.生殖毒性试验;
4.遗传毒性试验(Ames、微核、染色体畸变);
5.致癌试验;
6.局部毒性试验;
7.免疫原性试验;
8.安全性药理试验。
11
北京协和建昊医药技术开发有限责任公司
(中国医学科学院中国协和医科大学新药安全评价研究中心)
1.单次给药毒性试验(啮齿类、非啮齿类);
2004年12月23日(第7号)
8.安全性药理试验;
9.毒代动力学试验。
7
广州市医药工业研究所
(新药安全评价研究重点实验室)
1.单次给药毒性试验(啮齿类、非啮齿类);
2004年9月6日(第4号)
2.多次给药毒性试验(啮齿类、非啮齿类);
3.局部毒性试验;
4.免疫原性试验;
5.安全性药理试验。
通过中国GLP认证单位汇总20140224.

是
上海中医药大学(药物安全性评价研究中心) 否
上海市食品药品检验所(药物安全评价中中 心)
否
上海市计划生育科学研究所(中国生育调节药 否 物毒理检测中心)
山东欣博药物研究有限公司(山东欣博药物安 否 全评价研究中心)
山东省医药工业研究院(药物安全性评价中 心)
否
山东省食品药品检验所(药物安全评价中心) 否
上海润诺生物 科技有限公司
否
Shenyang Research Institute of Chemical Industry, Safety Evaluation Center
沈阳化工研究 院安全评价中 是 心
Suzhou Xishan Zhongke Laboratory Animal Co., Ltd.
Chengdu, Sichuan, P.R. China
Beijing, P.R. China Jiulong Town, Luogang District, Guangzhou, P.R. China Guangzhou Science City,Guangdong, P.R. China Nanning, Guangxi, P.R. China Nanning, P.R. China
南京大学模式 动物研究所
否
GenScript Corporation,
南京金斯瑞生 物科技有限公 否
Beijing, P.R. China
Beijing, P.R. China
Beijing, P.R. China
Pudong, Shanghai, P.R. China
Kunming, Yunnan, P.R. China Pudong New Area, Shanghai, P.R. China Dongguan, Guangdong, P.R. China Nanjing, Jiangsu, P.R. China
GLP的历史_现状及发展[1]
![GLP的历史_现状及发展[1]](https://img.taocdn.com/s3/m/028069d85022aaea998f0f31.png)
验收检查指南 (试行) 》。国家科委颁布的 GLP 在一定程度上推动了我国 GLP 的发展 , 但我国 的 GLP 处于推行 、指导和推荐阶段 , 并未正式 执行 ,也没有监督检查 。由于种种原因 ,我国的 GLP 未能得到很好的推广和实施 ,进展缓慢 。 3. 2 现状
1998 年 6 月 , 国家药品监督管理体制进行 了重大改革 ,成立了国家药品监督管理局 ,包括 GLP 在内的所有药品监督管理法规进行了执法 主体的转移 , GLP 由国家药品监督管理局安全 监管司研究监督处主管 。理顺了管理体制 , 为 GLP 的发展创造了条件 。在研究监督处的组织 领导下 , 1998 年 8 月召开了 GLP 专家座谈会 , 1998 年 10 月起重新修订 GLP ,并于 1999 年 10 月 14 日发布 , 1999 年 11 月 1 日起施行《药品 非临床研究质量管理规范 (试行) 》。修改后 GLP 与 1994 年版的 GLP 相比有如下改变 。 3. 2. 1 题目改变由原来的“规定”改为“规范”, 体现了法规特点 。 3. 2. 2 结构修改 对内容重复和分散的论述做 了调整和删除 ,比原《规定》减少了 9 条 ;术语解 释条款提前 。 3. 2. 3 内容修改 更加明确了各层次人员的职 责 、质量保证部门的职责 , 明确了 GLP 的监督 、 检查及认证部门 。取消了原《规定》中对违反规 定工作人员的行政处罚条款 。
36第2期总第52期重庆中草药研究二oo五年十二月glp的历史现状及发展丁季春重庆市中药研究院重庆400065安全有效可控是新药研究开发中需要明确的三个基本问题其中临床前安全性评价是决定新药能否进入临床试验的关键因素之一
36 第 2 期 (总第 52 期)
重庆中草药研究
我国CRO行业市场规模、竞争格局及典型企业分析(2021年)
2000
609 369 454
382 323 443
1637
1086 1312 1543
880
2328
1500 1000 500
2011 2012 2013 2014 2015 2016 2017 2018 2019
0 2020
(亿元)
1800 1600 1400 1200
1000 800 600 400 200
33 29
5.0%
2017
2018
0.0% 2019 2020E 2021E 2022E 2023E
专业化分工的产物,“降本增效”的新药研发助推器。随着药物研发的 支出不断增加,研发难度的不断加大,CRO 企业凭借其低成本、专业性
3
强、高效以及多种路径降低研发风险越来越得到药企的青睐,在药企研 发中的渗透率不断提升。美国的 CRO 行业渗透率一直居于世界第一, 2019 年其外包支出占整个医药行业研发支出的 45.0%,高于全球平均, 而国内的CRO 渗透率在 2019 年约 34.7%,还有待进一步发展。 图表 29:研发外包机构参与能够缩短新药研发时间 图表 30:全球制药外包服务渗透率对比 (月)
图表 23:2011-2020 全球医疗健康产业投融资概况 图表 24:2011-2020 国内医疗健康产业投融资概况
2
(亿元)
6000 5000 4000 3000 2000 1000
0
融资总额(亿元) 1951
投融资事件(件)
3000
1972
5169
2583 2226
2500
2199
3557 3663
0.0% 2011 2012 2013 2014 2015 2016 2017 2018 2019 2020
药物非临床研究质量管理规范认证申请资料要求
附1-2药物非临床研究质量管理规范认证申请资料要求一、申请资料说明1.申请机构主体资格证明文件。
申请机构应当提交统一社会信用代码证书复印件,或者有关登记部门颁发的营业执照复印件,或者事业单位法人证书复印件,或者上级主管部门签发的有效证明文件复印件等。
具体开展药物非临床安全性评价研究的机构为法人设立的分公司或者其直属下级机构的(以下简称分支机构),除提交法人主体资格证明文件外,还需提交分支机构设立有关材料或者确定法人与分支机构之间隶属关系的有关文件,无法提供设立材料或者确定隶属关系的文件的,由法人出具书面说明。
2.机构概要。
2.1机构发展概况(包括历史沿革,开展药物非临床安全性评价试验和按照GLP开展药物非临床安全性评价研究的基本情况等);2.2组织机构框架图(说明各部门名称、相互关系、各部门负责人等);2.3试验设施平面图(包括整体平面图和外观照片,GLP与非GLP区域平面图,实验室、动物饲养室、管理区域等平面图及各区域的面积等)。
—14—3.组织机构的设置与职责(包括机构管理部门的设置情况,供试品保管、动物饲养与管理、病理检查及质量保证等部门职能概要)。
4.机构人员构成情况、人员基本情况以及参加培训情况(见表1、2、3)。
5.机构主要人员情况:包括机构负责人、质量保证部门负责人、专题负责人、动物饲养管理负责人、组织病理学检查部门负责人、资料保管负责人、供试品管理负责人及其他负责人(见表4)。
6.动物饲养区域和动物试验区域情况。
6.1动物设施面积和动物收容能力情况(见表5);6.2各动物饲养区的平面图(包括动物饲养设施、动物用品供给设施、试验操作区、污物处理区域等);6.3动物饲养区人流、动物流、物品流、污物流、空气流等流向图(可以结合平面图绘制),空气净化系统的送风、回风和排气平面布局图;6.4环境条件,包括动物饲养室的温度、湿度、压力差、照度、噪音、洁净度、氨浓度等环境条件的控制方法、监控程序或者方法以及发生异常时的应急预案;实验动物设施温度、湿度、压力梯度、微生物等环境条件的年度检查报告和检测数据等(见表6);6.5饲料、饮水、垫料等动物用品的来源与检测频次(包括饲料生产厂家、营养学分析、有害物质的分析、卫生学等检测结—15—果以及饮水的检测结果等);6.6功能实验室、化学及生物污染特殊区域的环境控制状况;6.7清洁剂、消毒剂、杀虫剂使用情况(见表7);6.8实验动物的来源、质量合格证明和检疫情况。
我国药物非临床研究质量管理规范实施概况
历史沿革
我国的药品GLP制度最早可追溯到 1993年。为使我国新药安全性评价研究 符合国际规范。1993年12月11日,国家科 委发布了《药品非临床研究质量管理规 定(试行)》,1994年1月1日开始试行。 1996年8月6日,国家科委又印发了《药品 非临床研究质量管理规定(试行)》实 施指南(试行)和执行情况验收检查指 南(试行)。这在一定程度上推动了我 国GLP的发展。1998年6月,国家药品监 督管理局成立,GLP的执法主体变为国家 药品监督管理局。1999年lOft 14日,国家 药品监督管理局发布《药品非临床研究质 量管理规范(试行)》。1999年11月1日 起施行。《规范》明确了各相关人员的职 责、质量保障部门的职责,GLP的监督、 检查及认证部门。 2003年8月6日,国家食药监管局正 式颁布了《药物非临床研究质量管理规 范》,又印发了《药物非临床研究质量管 理规范检查办法(试行)》,自2003年lo月1 日起,依照此文件的规定对药物非临床安
药监管局网站共发布药品GLP认证公告22
个,获得GLP证书的机构共37家,其中, 北京6家,上海和山东各5家,四Jq4家, 辽宁、江苏、广东、浙江、湖北各2家, 吉林、云南、山西、新疆、天津、重庆、 河南各1家。
良好实验室规范或标准实验室规范,是用 于规范与人类健康和环境有关的非临床安 全性研究的一整套组织管理体系。它包括 试验计划、试验实施过程、试验的监督、 记录、档案和报告的管理,目的是确保实 验资料的真实性、完整性和可靠性。 国际上GLP的适用范围广泛,包括人 用药品、农药、兽药、化妆品、食品添加 剂、饲料添加剂、医疗器械和工业化学品 等。我国目前拥有4个GLP体系,分别由3 个不同部门负责执行和监控,即农药和兽 药由农业部负责;医药和药械由国家食品 药品监督管理局负责;一般新化学品和工 业化学品由国家环保总局负责。本文仅对 我国药品GLP实施情况作简要介绍。
药物非临床研究质量管理规范认证公告(第1号)(2018年第1号)
矿产资源开发利用方案编写内容要求及审查大纲
矿产资源开发利用方案编写内容要求及《矿产资源开发利用方案》审查大纲一、概述
㈠矿区位置、隶属关系和企业性质。
如为改扩建矿山, 应说明矿山现状、
特点及存在的主要问题。
㈡编制依据
(1简述项目前期工作进展情况及与有关方面对项目的意向性协议情况。
(2 列出开发利用方案编制所依据的主要基础性资料的名称。
如经储量管理部门认定的矿区地质勘探报告、选矿试验报告、加工利用试验报告、工程地质初评资料、矿区水文资料和供水资料等。
对改、扩建矿山应有生产实际资料, 如矿山总平面现状图、矿床开拓系统图、采场现状图和主要采选设备清单等。
二、矿产品需求现状和预测
㈠该矿产在国内需求情况和市场供应情况
1、矿产品现状及加工利用趋向。
2、国内近、远期的需求量及主要销向预测。
㈡产品价格分析
1、国内矿产品价格现状。
2、矿产品价格稳定性及变化趋势。
三、矿产资源概况
㈠矿区总体概况
1、矿区总体规划情况。
2、矿区矿产资源概况。
3、该设计与矿区总体开发的关系。
㈡该设计项目的资源概况
1、矿床地质及构造特征。
2、矿床开采技术条件及水文地质条件。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
药物GLP认证目录(更新至2016年1月) 机构名称 试验项目 认证批件编号
山东省医药工业研究所(药物安全性评价中心) 1.单次和多次给药毒性试验(啮齿类); 2.单次和多次给药毒性试验(非啮齿类,不含灵长类); 3.生殖毒性试验(Ⅰ段); 4.遗传毒性试验(Ames、微核、染色体畸变); 5.局部毒性试验; 6.免疫原性试验; 7.安全性药理试验。
GLP10004018
四川省天然药物研究所(安全性评价中心) 1.单次和多次给药毒性试验(啮齿类); 2.生殖毒性试验(Ⅰ段、Ⅱ段); 3.遗传毒性试验(Ames、微核、染色体畸变); 4.局部毒性试验; 5.免疫原性试验; 6.安全性药理试验。
GLP10002016
安徽合源药物安全研究有限公司
1. 单次和多次给药毒性试验(啮齿类); 2. 单次和多次给药毒性试验(非啮齿类,不含灵长类); 3. 局部毒性试验; 4. 毒代动力学试验。
GLP13003055
北京市药品检验所(药物安全评价中心)
1.单次和多次给药毒性试验(啮齿类)
2.局部毒性试验 3.免疫原性试验(过敏试验) GLP08001006
北京协和建昊医药技术开发有限责任公司(中国医学科学院北京协和医学院新药安全评价研究中心)
1.单次和多次给药毒性试验(啮齿类); 2.单次和多次给药毒性试验(非啮齿类); 3.生殖毒性试验(Ⅰ段、Ⅱ段、Ⅲ段); 4.遗传毒性试验(Ames、微核、染色体畸变); 5.致癌试验; 6.局部毒性试验; 7.免疫原性试验; 8.安全性药理试验; 9.毒代动力学试验。
GLP10012026 1.单次和多次给药毒性试验(啮齿类); 2.单次和多次给药毒性试验(非啮齿类); 3.生殖毒性试验(Ⅰ段、Ⅱ段、Ⅲ段); 4.遗传毒性试验(Ames、微核、染色体畸变); 5.致癌试验; 6.局部毒性试验; 7.免疫原性试验; 8.安全性药理试验; 9.毒代动力学试验。
GLP14004061
北京昭衍新药研究中心有限公司
1. 单次和多次给药毒性试验(啮齿类); 2. 单次和多次给药毒性试验(非啮齿类); 3. 生殖毒性试验(Ⅰ段、Ⅱ段、Ⅲ段); 4. 遗传毒性试验(Ames、微核、染色体畸变); 5. 致癌试验; 6. 局部毒性试验; 7. 免疫原性试验; 8. 安全性药理试验; 9. 毒代动力学试验。
GLP11005033
成都百康医药工业药理毒理研究院
1. 单次和多次给药毒性试验(啮齿类); 2. 单次和多次给药毒性试验(非啮齿类,不含灵长类); 3. 局部毒性试验; 4. 免疫原性试验; 5. 安全性药理试验; 6. 毒代动力学试验。
GLP11006034
1. 生殖毒性试验(I段、Ⅱ段); 2. 遗传毒性试验(Ames、微核、染色体畸变); GLP15001069
成都华西海圻医药科技有限公司(国家成都中药安全性评价中心)
1. 单次和多次给药毒性试验(啮齿类); 2. 单次和多次给药毒性试验(非啮齿类); 3. 生殖毒性试验(Ⅰ段、Ⅱ段、Ⅲ段); 4. 遗传毒性试验(Ames、微核、染色体畸变、小鼠淋巴瘤试验); 5. 致癌试验; 6. 局部毒性试验; 7. 免疫原性试验; 8. 安全性药理试验; 9. 毒代动力学试验。
GLP11010038 福建医科大学(福建省新药安全性评价中心) 1.单次和多次给药毒性试验(啮齿类); 2.单次和多次给药毒性试验(非啮齿类,不含灵长类); 3.局部毒性试验; 4.免疫原性试验; 5.安全性药理试验。
GLP14011068
广州医药工业研究院(药物非临床评价研究中心)
1. 单次和多次给药毒性试验(啮齿类); 2. 单次和多次给药毒性试验(非啮齿类); 3. 局部毒性试验; 4. 免疫原性试验; 5. 安全性药理试验。
GLP10013027
广州中医药大学科技产业园有限公司(新南方药物安全性评价中心)
1.单次和多次给药毒性试验(啮齿类) 2.单次和多次给药毒性试验(非啮齿类,不包括灵长类) 3.局部毒性试验 4.生殖毒性试验 5.遗传毒性试验(Ames、微核、染色体畸变)
GLP07004004
国家上海新药安全评价研究中心(上海益诺思生物技术有限公司)
1. 单次和多次给药毒性试验(啮齿类); 2. 单次和多次给药毒性试验(非啮齿类); 3. 生殖毒性试验(Ⅰ段、Ⅱ段、Ⅲ段); 4. 遗传毒性试验(Ames、微核、染色体畸变、小鼠淋巴瘤试验); 5. 致癌试验; 6. 局部毒性试验; 7. 免疫原性试验; 8. 安全性药理试验; 9. 毒代动力学试验。
GLP11008036
海南海医药物安全性评价研究有限责任公司(海南医学院海南省药物安全性评价研究中心)
1.单次和多次给药毒性试验(啮齿类); 2.单次和多次给药毒性试验(非啮齿类); 3.局部毒性试验; 4.免疫原性试验; 5.安全性药理试验。
GLP10005019
1.生殖毒性试验(Ⅰ段、Ⅱ段); 2. 遗传毒性试验(Ames、微核、染色体畸变); 3. 毒代动力学试验。 GLP14002059
海南省药品检验所(安全性评价研究中心) 1.单次和多次给药毒性试验(啮齿类); 2.遗传毒性试验(Ames、微核试验); 3.局部毒性试验; 4.免疫原性试验。
GLP10006020 河北省中西医结合医药研究院 1.安全性药理试验; 2.毒代动力学试验。 GLP14006063
河北省中西医结合医药研究院(新药评价中心) 1.单次和多次给药毒性试验(啮齿类); 2.局部毒性试验。 GLP10009023
河北医科大学(新药安全评价研究中心)
1.单次和多次给药毒性试验(啮齿类); 2.单次和多次给药毒性试验(非啮齿类,不包括灵长类); 3.局部毒性试验; 4.安全性药理试验。
GLP10007021
黑龙江中医药大学(药物安全性评价中心) 1. 单次和多次给药毒性试验(啮齿类); 2. 单次和多次给药毒性试验(非啮齿类,不含灵长类); 3. 安全性药理试验。
GLP13003053
湖北省预防医学科学院(食品药品安全性评价研究所)
1.单次和多次给药毒性试验(啮齿类) 2.单次和多次给药毒性试验(非啮齿类,不包括灵长类) 3.生殖毒性试验 4.遗传毒性试验(Ames、微核、染色体畸变) 5.局部毒性试验
GLP07001001
湖南省实验动物中心(湖南省药物安全评价研究中心)
1. 单次和多次给药毒性试验(啮齿类); 2. 单次和多次给药毒性试验(非啮齿类); 3. 遗传毒性试验(Ames、微核、染色体畸变); 4. 局部毒性试验; 5. 安全性药理试验; 6. 毒代动力学试验。
GLP12003041
1. 单次和多次给药毒性试验(灵长类) 2. 免疫原性试验 3. 生殖毒性试验(Ⅰ段、Ⅱ段) GLP15007075
江苏鼎泰药物研究有限公司(鼎泰国际毒理研究中心) 1. 单次和多次给药毒性试验(啮齿类); 2. 单次和多次给药毒性试验(非啮齿类); 3. 生殖毒性试验(Ⅰ段、Ⅱ段、Ⅲ段); 4. 遗传毒性试验(Ames、微核、染色体畸变); 5. 致癌试验; 6. 局部毒性试验; 7. 免疫原性试验; 8. 安全性药理试验; 9. 毒代动力学试验。
GLP11003031
江西省药物研究所(安全评价中心)
1. 单次和多次给药毒性试验(啮齿类);
2. 局部毒性试验; 3. 免疫原性试验。 GLP12007045 康龙化成(北京)生物技术有限公司
1.单次和多次给药毒性试验(啮齿类); 2.单次和多次给药毒性试验(非啮齿类); 3.局部毒性试验; 4.免疫原性试验; 5.安全性药理试验; 6.毒代动力学试验。
GLP14001058
1. 生殖毒性试验(Ⅰ段、Ⅱ段) 2. 遗传毒性试验(Ames、微核、染色体畸变) GLP15010078
1. 生殖毒性试验(Ⅰ段、Ⅱ段) 2. 遗传毒性试验(Ames、微核、染色体畸变) GLP15010078
科文斯医药研发(上海)有限公司
1. 单次和多次给药毒性试验(啮齿类); 2. 单次和多次给药毒性试验(非啮齿类); 3. 局部毒性试验; 4. 免疫原性试验; 5. 毒代动力学试验。
GLP12011049
辽宁省食品药品检验所(药物安全评价中心) 1.单次和多次给药毒性试验(啮齿类) 2.局部毒性试验 3.免疫原性试验 4.安全性药理试验
GLP07005005
鲁南制药集团股份有限公司(新药安评中心)
1. 单次和多次给药毒性试验(啮齿类); 2. 局部毒性试验; 3. 安全性药理试验。 GLP11002030
1.单次和多次给药毒性试验(非啮齿类,不含灵长类); 2.生殖毒性试验(Ⅰ段、Ⅱ段); 3.遗传毒性试验(微核); 4.免疫原性试验; 5.毒代动力学试验。
GLP14010067
美迪西普亚医药科技(上海)有限公司
1.单次和多次给药毒性试验(啮齿类); 2.单次和多次给药毒性试验(非啮齿类); 3.局部毒性试验。 GLP11009037
1. 遗传毒性试验(Ames、微核、染色体畸变); 2. 安全性药理试验; 3. 毒代动力学试验。 GLP12005043
1. 生殖毒性试验(Ⅰ段、Ⅱ段) 2. 免疫原性试验 GLP15004072
青岛市药品检验所(新药安全评价中心) 1.单次和多次给药毒性试验(啮齿类) 2.局部毒性试验 GLP08002007
