2010~2015年我国药品评价抽验情况分析
2010~2015年上半年我国I类新药申报生产在评审分析

2010~2015年上半年我国I类新药申报生产在评审分析王佳庆;赵志刚【摘要】Objective: To provide scientific basis for drug discovery and development, we summarized the conditions of declaration, production and evaluation of 1st category new drug from 2010 to the first half of 2015 in our country.Methods:Statistically analyzed the declaration, production and evaluation of 1st category new drug from 2010 to the first half of 2015 in our country.Results: The chemicals had more advantage than biologics and traditional Chinese medicine in drug discovery and development. Among the chemicals, the research area was focused on anti-infectious, cardiovascular drug, biological agents and anti-tumor. And the tablet was the main research dosage forms.Conclusion: We should make more efforts on drug discovery and development, and focus on discovery of orphan drugs.%目的:总结2010~2015年上半年我国I类新药的申报生产在评审情况,为我国新药研发提供依据。
2010年全国药品评价抽验品种及抽样量

460粒(0.35g/粒)
14
归脾丸
丸剂
大蜜丸60丸(9g/丸);小蜜丸:≥9盒且≥480g;
水蜜丸:≥9盒且≥300g;浓缩丸:9盒
合剂
10ml:9盒;100ml:15瓶
15
华佗再造丸
浓缩丸
360g(至少9个最小包装)
16
藿胆丸
丸剂
多剂量25瓶,单剂量120袋
片剂
600片
滴丸
1700丸
17
金匮肾气丸
片剂
480片
36
通心络胶囊
胶囊剂
30粒/盒×30盒
37
通宣理肺丸
片剂
450片
胶囊剂
450粒
丸剂
大蜜丸:120丸;水蜜丸:600克
38
胃苏颗粒
颗粒剂
60袋(5g/袋);45袋(15g/袋)
39
乌鸡白凤丸
丸剂
(1)小蜜丸、水蜜丸、浓缩丸:570g(至少需要15个
包装);(2)大蜜丸:66丸(至少需要9个包装)
混悬剂
300支
多潘立酮口腔崩解片
口腔崩解片
216片
多潘立酮混悬液
分散片
240片
89
盐酸多塞平片
片剂
260片
90
法莫替丁胶囊
胶囊剂
120粒
法莫替丁注射液
注射剂
120支
注射用法莫替丁
注射剂
120支
91
泛影葡胺注射液
注射剂
1ml:360支;20ml及以上:120支
92
酚酞片
片剂
90片(至少9个最小包装)
93
大蜜丸:100丸(至少9个最小包装)
我药店2010-2015年211例药品不良反应报告分析

湖南广播电视大学开放教育、成人教育专科毕业作业题目:我药店2010-2015年211例药品不良反应报告分析学号1343001451224姓名黄彩华分校:株洲电大教学点:校本部指导教师:湖南广播电视大学教务处制湖南广播电视大学毕业作业写作过程记录表(此页由学生填写)湖南广播电视大学毕业作业评审表我药店2010-2015年211例药品不良反应报告分析摘要目的:了解药店药品不良反应(ADR)发生规律及监测、报告现状。
为改进零售药店药品不良反应( ADR) 监测工作提供参考方法:以药店2010-2015年211例ADR 为研究对象,从年龄、性别分布、时间分布、给药途径、药物类型、累及器官或系统及主要临床表现、ADR 类型、转归等方面进行统计分析。
了解药店ADR 发生的特点。
结果:涉及的药品有10大类共53种。
抗生素、中成药品种数及其所致 ADR 例数居前;ADR 的发生与患者性别无显著相关性;60岁以上老年人、抗感染和心血管类药易引发ADR;结论:社会药店应高度重视ADR监测和报告工作,应加强宣传和培训,提高零售药店药学人员的ADR报告意识与能力。
促进合理用药。
关键词:零售药店; 药品不良反应; 药品不良反应监测增长目录摘要关键词 (1)目录 (2)前言 (3)第1章资料与方法 (4)1.1资料来源 (4)1.2 处理方法 (4)第2章ADR 病例分析结果 (5)2.1年龄与性别分布 (5)2.2引发ADR的给药方式 (5)2.3.ADR涉及的药品种类 (5)2.4 ADR的报告类型 (6)2.5 ADR的结果 (6)2.6ADR的填报现状 (6)第3章讨论 (8)3. 1 ADR 与性别、年龄的关系 (8)3.2 ADR与给药途径关系 (8)3.3引起ADR的药物中,心血管系统药品最多…………………………………8.3.4 ADR 涉及的人体器官组织分布 (8)3.5 ADR药品品种分布 (8)3.6 ADR联合用药分布 (9)3.7 ADR报告数量分析……………………………………………………………9.3.8 ADR报表填写质量一般 (9)第4章致谢 (10)参考文献 (11)前言本人在药店工作多年,一直负责我店药品不良反应(ADR)报送工作。
2015年5月CDE药品审评情况分析报告(最终)
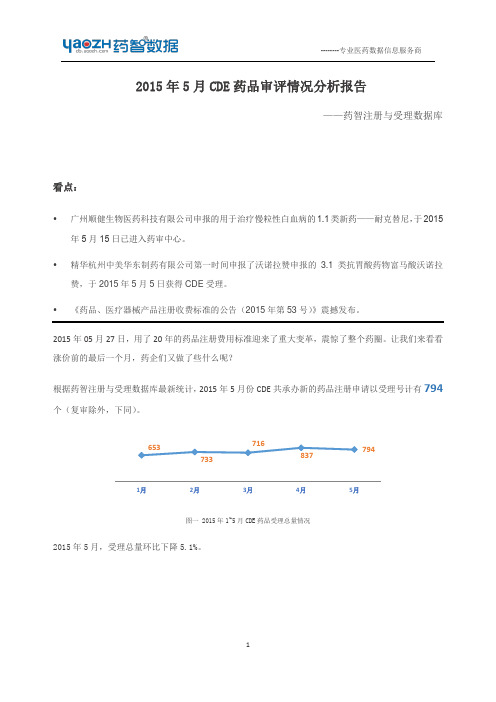
2015 年 5 月 CDE 药品审评情况分析报告
——药智注册与受理数据库
看点:
广州顺健生物医药科技有限公司申报的用于治疗慢粒性白血病的 1.1 类新药——耐克替尼, 于 2015 年 5 月 15 日已进入药审中心。 精华杭州中美华东制药有限公司第一时间申报了沃诺拉赞申报的 3.1 类抗胃酸药物富马酸沃诺拉 赞,于 2015 年 5 月 5 日获得 CDE 受理。 《药品、医疗器械产品注册收费标准的公告(2015 年第 53 号) 》震撼发布。
物,已进入申报临床阶段。耐克替尼可以克服格列卫(常用抗白血病药物)临床产生的耐药性。中国科学 院广州生物与健康研究院丁克课题组成功设计合成了有效的 Bcr-Abl T315I 激酶抑制剂耐克替尼。相关 专利权已转让给广州顺健医药公司进行后期开发。 据统计,截至 2015 年 5 月底,CDE 共承办 121 个替尼类相关受理号。 2015 年 5 月共审批完毕 1.1 类化药新药 2 个品种
表二 2015 年 5 月 1.1 类化药新药审批完毕的品种
受理号 CXHL1300784 CXHL1300785 CXHL1300786 CXHL1300783 CXHL1400095 CXHL1400094 CXHL1400093
药品名称 AD-35 片 AD-35 片 AD-35 片 AD-35 伯瑞替尼肠溶胶囊 伯瑞替尼肠溶胶囊 伯瑞替尼
表一 2015 年 5 月新承办的 1.1 类新药
受理号 CXHL1500439 CXHL1500440 CXHL1402236 CXHL1402235 CXHL1500858 CXHL1500860 CXHL1500859 CXHL1500202 CXHL1500204 CXHL1500203
2015年度药品审评报告

2015 年度药品审评报告国家食品药品监督管理总局药品审评中心2015 年,在国家食品药品监督管理总局的领导下,药品审评中心(以下简称药审中心)紧紧围绕“改革审评制度,解决审评积压,提高审评质量,完善审评体系”,不断推进各项工作,切实维护和促进公众健康。
根据国家食品药品监督管理总局有关工作要求,现将《2015 年度药品审评报告》予以发布。
一、2015 年主要工作措施及进展2015 年,药审中心深化制度改革,加强审评管理,消除审评积压,提升审评效率,确保审评质量,各项工作举措取得积极进展,为更好保障公众用药安全有效,促进公众健康奠定了基础。
(一)推进审评制度改革按照国务院、总局党组关于药品审评制度改革的要求和工作部署,2015 年,药审中心在改革审评管理制度、改进用人机制、强化审评质量管理等方面推出了多项改革举措,以全力推进审评制度改革。
改革审评管理制度。
在对创新药实行一次性批准临床试验、加强后续沟通交流与监管,以及有条件批准临床试验方面取得实质性进展;组织研究肿瘤适应症创新药临床试验备案管理的可行性;完善“立卷审查”快速审评方法,加快淘汰存在重大缺陷的注册申请,并为承接药品注册申请受理工作奠定了基础;强化以临床价值为导向的审评管理,完善适应症团队审评制度,探索建立项目管理人制度;逐步完善有关药品注册申请的优先审评制度,起草了《临床急需儿童用药申请优先审评审批品种评定的基本原则》,并上网征求意见。
改进用人机制。
制定首席审评员招聘方案,探索建立首席专业岗位制度,构建科学化、与国际接轨的审评体系;制定《审评员薪酬管理暂行办法》,探索研究多劳多得、优劳优得的动态评估绩效分配体系,以调动工作人员的创造性和积极性;平稳完成三至七级专业技术岗位设置工作,保证了审评人才梯队建设;起草完成《药审中心解决审评积压尽职免责与违规追责暂行规定》,为稳定与激励审评队伍,不断提高审评质量和效率进行探索;探索引入外部咨询机构和专业人员参与中心的管理制度建设等。
药品质量分析报告范文

药品质量分析报告范文按照省局下达的任务,对全市范围内药品生产、经营企业和医疗机构进行了监督抽样,保证了人民群众用药的安全有效。
为了进一步提高工作效率,提高药品监督抽验的不合格率,为今后的药品抽验工作提供科学可靠的依据,现将我市xx~xx年度药品质量情况分析如下:一、药品抽验完成情况xx~xx年总计抽验化学药、生化药、抗生素、中成药、中药材、中药饮片2620批。
其中不合格药品277批,抽验不合格率10.6%。
其中计划性抽验2210批,不合格药品84批,不合格率3.8%。
日常监督抽验410批,不合格药品193批,不合格率47.1%。
XX市抽验药品496批,不合格药品66批,不合格率13.3%。
XX县抽验药品183批,不合格药品24批,不合格率13.1%。
一分局抽验药品172批,不合格药品31批,不合格率18.0%。
二分局抽验药品380批,不合格药品26批,不合格率6.8%。
三分局抽验药品182批,不合格药品41批,不合格率22.5%。
稽查队抽验药品388批,不合格药品56批,不合格率14.4%。
药检所抽验药品818批,不合格药品33批,不合格率4.0%。
药品抽验不合格率由高到低依次是:三分局>一分局>稽查队>XX市>XX县>二分局>药检所(一)计划抽验三年共完成计划抽验2210批,不合格药品84批,不合格率3.8%。
按抽验单位分类:1、从生产单位抽验2批,不合格率为0。
2、从经营单位抽验1330批,不合格药品48批,不合格率为3.6%。
3、从使用单位抽验880批,不合格药品36批,不合格率为4.1%。
按药品分类:1、抽验化学药品648批,不合格率为0。
2、抽验抗生素药品274批,不合格率为0。
3、抽验生化药品9批,不合格率为0。
4、抽验中成药708批,不合格药品35批,不合格率为4.9%。
5、抽验中药材、中药饮片571批,不合格药品49批,不合格率8.6%。
(二)日常监督抽验三年共完成日常监督抽验410批,不合格药品193批,不合格率47.1%。
《2015年度药品检查报告》-权威统计

行业研究/2016年06月05日总局发布《2015年度药品检查报告》监管加强利好品牌药企[Table_Summary]投资要点:事件:●2016年6月3日,总局发布《2015年度药品检查报告》,对全年药品检查情况及检查发现主要问题进行了阐述。
点评:●总局药品检查力度超预期,制药产业监管趋严,升级整合迹象显现。
2015年,国家食品药品监督管理总局食品药品审核查验中心秉持客观、公正、廉洁、高效的原则,依法依规、科学严格开展药品检查。
共检查企业/品种数698家,派出检查组数682次,派出人次达到2082次。
对检查发现的违法违规行为进行严厉查处,药品GMP认证整改率、飞行检查不通过率均明显提高,显示总局监管趋严。
我们认为,药品生产质量监管力度仍将继续加强,“小散乱差”的药企将逐渐退出,产业升级整合迹象显现。
(图1)●药品GMP认证检查数量同比降低,但监管力度明显加强,整改率提高近一倍。
2015年总局共接收药品GMP认证申报资料221份,涉及201家药企,认证检查任务较2013、2014年数量明显降低,但整改复核17家,占7.7%,同比提高近一倍,总局监管力度明显加强。
(图2)2015年对114个品种进行药品注册生产现场检查,较2014年小幅降低,包括化学原料药31个、化学制剂56个、中药8个、生物制品15个、血液制品4个。
最终完成审核件108个,其中通过103个,不通过5个。
2015年药品GMP跟踪检查计划271家次,全年实际检查181家次,以注射剂和预防类生物制品为主。
●飞行检查力度空前,通过率仅32%,中药饮片成重灾区。
全年共派出49个检查组对59个企业进行了飞检,其中中药饮片14组19家企业,银杏叶提取物及制剂5组8家企业。
(图3)现场检查通过的19家,不通过39家,1家待处理,通过率仅32%。
共有22家被收回药品GMP证书,6家被吊销GMP证书,3家立案查处。
(图4)●中药材生产规范化、规模化和现代化仍需提升。
2015年国家评价性抽验复方丹参片的质量分析

2015年国家评价性抽验复方丹参片的质量分析杨建龙;韩晶;王辉;徐丹;蔡广知;贡济宇【摘要】目的根据国家评价性抽验任务,对2015年吉林省全省范围内市场中流通的复方丹参片进行质量分析研究.方法根据《中国药典》2010年版第一增补本及《药品补充检验方法和检验项目批件号2008010》对全省范围内抽检的46批复方丹参片进行了全项检验,并对检验结果进行了统计分析与比较.结果按照现行标准检验,样品合格率为97.8%,但是通过对片剂中樟脑成分的检测发现,各厂家中樟脑的含量差异参差不齐.结论吉林省内抽检的46批样品根据现行检验标准检验,只有1批样品不合格,根据检验依据和结果可以认为,当前吉林省内生产、经营、流通使用的复复方丹参片质量较好.但是发现了不少问题,建议有关部门加强对复方丹参片中冰片授料的监管,以保证产品质量.【期刊名称】《中国中医药现代远程教育》【年(卷),期】2017(015)001【总页数】3页(P139-141)【关键词】复方丹参片;国家评价性抽验;质量控制;药品管理【作者】杨建龙;韩晶;王辉;徐丹;蔡广知;贡济宇【作者单位】长春市食品药品检验中心中药科室,长春130012;吉林省食品检验所检验二部,长春130103;长春市食品药品检验中心中药科室,长春130012;长春市食品药品检验中心中药科室,长春130012;长春中医药大学药物分析实验室,长春130117;长春中医药大学药物分析实验室,长春130117【正文语种】中文复方丹参片处方由丹参、三七、冰片三味药组成[1],主要用于冠心病、心绞痛以及气滞血瘀所致的胸痹、胸闷、心前区刺痛等,其中丹参为君药,三七为臣药,冰片为佐使药。
此处方由上海中药二厂于1975年研制成功[2],1977年版至2015年版《中国药典》均有收载,并收载于《国家基本药物目录》,由于其价格低廉、疗效确切、服用方便,是临床常用的现代中药复方制剂。
在国家食品药品监督管理局网站上查询得知,关于复方丹参片的相关记录有685条信息。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
检 查 和 含量 测 定 为 此 .应 进 一 步 加 强 生 产 企 业 药 品质 量 监 管 力度 ,规 范药 品经 营 流 通环 节 的 管理 , 并 加大 药 品检测 机构 投 人 力度 ,提 高药 品全 检率 。
1 评价 抽 验 的 概 念 及 方 法
2 研 究 方 法
本 文 通 过 收 集 整 理 CFDA 发 布 的 同家 药 品 质 量 公告 中关 于 2010~2015年 国家药 品评 价抽 验 的 数 据 ,采 片】STATA 10.0统计 软 件 ,分 析抽 验 药 品 总
年药 品抽 样 品种 数 和抽 样批 次 数 总体 呈 上 升趋 势 , 采 用 新 的 检 验 方 法 ,或 其 他 技 术 手 段 开 展 检 验 T
药 品抽 验 质量 基 本 良好 ;经 营 流通 环 节药 品抽 验 不 作 药 品监 管 部 门 会组 织 专 家对 评 价性 抽 验结 果 进 合格 率 高 于生 产 环节 ;药 品抽 验 不合 格项 日主要 为 行 分析 .并将 检验 结果 反 馈给 药 品生产 、流通 企业
安全 有 效具 有重 大意 义。
分 别寄送 到 指 定 的省 级 药检 所 进 行检 验 。对 所 抽 药
本 文 采 用 STATA 10.0统 计 软 件 ,分 析 2010~ 品除按 法 定标准 检验 外 ,还 会 根据药 品类 别的特 点 、
2015年 冈家 药 品 评 价抽 验 数 据 ,结 果 表 明 ,我 同 每 风 险 隐患 等 有针 对性 地 增 加部 分检验 项 目,或 尝 试
3 分 析 结 果
3 1 20 1 0 2@i 5牟 家药 品评价 骏总体情沉: 斩 国家 药品 质 量公 告 数据 显示 。从 20l0年 以 来 ,
我 同 每 年 药 品 抽 样 品 种
药 学 与 临 床 研 究
升 趋 势 由 于 20l2年 4月 爆 发 了 “毒 胶 囊 ”事 件—— 皮 革 明 胶 导 致 胶 囊 中 重 金 属 铬 含量 严 重 超 标 ,同 家加 大 了 药 品抽 样 的 力 度 ,发 布 的 药 品 质 量 公 告期 数 从 往 年 的 4期 增 加 到 6期 ,抽 样批 次 数 达 到 历 年 之 最 。
动 态 .发 现 药 品 质 量 问 题 和 进 展 趋 势 ,指 导 并 加 强 验 .以 发现现 行标 准 的不 足之 处 并进 行 改进 、、
闺家 对 药 品 质量 的 宏观 控制 ,进 而掌 握 药 品 生 产 、
闫家 药 品抽 验 以评 价抽验 为 主。国家 和 省 (区 、
经 营 、使 用 的状 况 ,督 促 医 药 单 位 严 格 按 照 药 品 标 市 )药 品 监 督管 理部 门根 据药 品质 量 监督 检 杏 1 作
摘 要 药品 抽 查检验 是 国家对 药 品 质量 实施监 管 的 重要 手段 。在 收 集并 整 理 2010 ̄2(】15 年 国家 药品 评 价抽 验 相 关数 据 的 基 础 上 ,采 用 STATA 10.0统 计软 件 ,对抽 验 药品 总批 次 、合 格 率 、被 抽 样单 位性 质 、主要 不合格 项 目等 方 面进 行 分析 。 总结抽 验 不 合格 药品 出现 的规 律 及 分布 特 点 ,为药监 部 门把 握 药品 监 管重 点及 难点提 供 参考 。
量 直 接 关 系着 人 民群 众 的身 体 健 康 和生 命安 全 。国 质量 差 异 和 变化 :二 是在 现有 的药 品法 定 标 准 、特
家 采用 药 品 监 督 检 查 等 重 要 手段 来 了 解 药 品 质 量 定 的检 查 参 数 的基 础 上 ,作进 一 步 的探 索性 研究 检
药 品抽 验 是指 各 级 药 品监 管 机构 按 照《国家 药 批 次 、合 格 率 、被 抽 样 单 位 性 质 、主 要 不 合 格 项 日
品抽 验 管理 规 定》,依法 应 用抽 查 检验 的方 式 掌 握 等 .以 了 解我 国药 品抽 验 的整 体 情 况 。针 对 存 在 的
了 解药 品 质量 的行 政 行 为, 又 分 为 评 价抽 验I1l和 监 问 题 .提 出建 议 及 改 进 措 施 ,以期 进 一 步加 强 药 品
准 生产 、经 营 、使用 合格 药 品 ,实 施 有 效 监 督 。这 对 制 汀年度 药 品 质量 抽 验计 划 ,采 J}j“分 散抽 样 、集 中
札绝 假 劣 药 品生 产 和在 市 场 的流 通 ,确 保 人 民用 药 检 验 ”的方式 。由各 省 负 责抽 样 .把 全 同抽 取 的 样 品
关键 词 药品质 量 ;抽 查检 验 :统计 分析 中图分类 号 R95 文献 标 志码 A 文章编 号 1673—7806(2018)01—074一O3
药 品是用 于 预 防 与治疗 疾 病 的 特殊 物 质 。其 质 国药 品 的 总体 状况 ,比较 同种药 品在 不 同地 区间 的
督抽 验 评 价抽 验 是药 品监 督管 理 部 门 为掌 握 、了 监 管 ,确保 人 民用 药安 全有效
解辖 fx=内 药 品 质 量 总 体 水 平 与 状 态 而 进 行 的 抽 查 检 验 一1 作 主要 有 两 个 目的 :一 是 通 过 抽 验 了 解 全
作 者 简 介 周 晶 .男 ,在 职 研 究 生 E—mail:zj41918@ 163.COIll 通 讯 作 者 于 浩 ,女 ,教授 ,博 士 生 导 师 E—mail:haoyu@t mu.edu cn 收 稿 日期 2 clI7—1l】一12 修 回 日期 21117—11-2()
2018
;b;26(1)
2010~2015年我 国药 品评价抽验情况 分析
周 晶 ,于 浩
南京 医科 大 学 公共 卫 生学 院 ,南京 2l1166; 江 苏省食 品药 品监 督 检验研 究院 综 合 业务 科 ,南京 210019;
南 京 医科 大 学 公共卫 生 学院 生物 统计 学 系,南京 21 1 1 66
