甘氨酰脯氨酸二肽氨基肽酶测定试剂盒(GPDA底物法)产品技术要求zhongshengbeikong
γ-谷氨酰基转移酶(GGT)测定试剂盒(GCANA底物法)产品技术要求lideman

γ-谷氨酰基转移酶(GGT)测定试剂盒(GCANA底物法)适用范围:本产品用于体外定量测定人血清中γ-谷氨酰基转移酶的含量。
1.1包装规格:试剂1(R1):5×60mL、试剂2(R2):5×12mL;试剂1(R1):4×80mL、试剂2(R2):4×16mL;试剂1(R1):3×40mL、试剂2(R2):3×8mL;试剂1(R1):2×80mL、试剂2(R2):2×16mL;试剂1(R1):2×400mL、试剂2(R2):2×80mL;试剂1(R1):1×20mL、试剂2(R2):1×6mL;试剂1(R1):2×60mL、试剂2(R2):2×12mL;试剂1(R1):4×60mL、试剂2(R2):4×12mL;试剂1(R1):2×61mL、试剂2(R2):2×13mL;640测试/盒:【试剂1(R1):2×60mL、试剂2(R2):2×12mL】;960测试/盒:【试剂1(R1):3×60mL、试剂2(R2):3×12mL】;试剂1(R1):5×61mL、试剂2(R2):5×13mL。
1.2 主要组成成分试剂1(R1)(以下简称R1):无色液体,试剂2(R2)(以下简称R2):浅黄色液体。
表1 试剂组成2.1 外观液体双试剂: R1:(缓冲液):无色澄清液体;R2(启动液):浅黄色澄清液体。
2.2 净含量液体试剂的净含量不得低于标示体积。
2.3 试剂空白2.3.1空白吸光度在37℃、(405 nm±10%范围内的)波长、1cm光径条件下,用去离子水或(生理盐水)作为样品加入试剂测试时,试剂空白吸光度应<1.2 ABS。
2.3.2空白吸光度变化率在37℃、(405 nm±10%范围内的)波长、1cm光径条件下,用去离子水或(生理盐水)作为样品加入试剂测试时,试剂空白吸光度变化率(ΔA/min)应≤0.005。
总蛋白测定试剂盒(双缩脲法)产品技术要求zhongshengbeikong

总蛋白测定试剂盒(双缩脲法)适用范围:本产品与ABBOTT ARCHITECT c4000/c8000/c16000全自动生化分析仪配套使用,用于体外定量测定人血清中总蛋白的浓度。
1.1包装规格液体单剂型(液体Ⅰ型)试剂(R):60mL×4;试剂(R):80mL×4。
1.2主要组成成分试剂(R)(液体)氢氧化钠0.6mol/L酒石酸钾钠32mmol/L碘化钾20mmol/L硫酸铜12mmol/L2.1 外观试剂(R)应为蓝色溶液,无杂质、无絮状物,外包装完整无破损。
2.2 净含量液体试剂净含量应不少于标示值。
2.3 试剂空白吸光度在波长546nm(540nm~560nm)(光径1cm)处,试剂空白吸光度(A)应≤0.200。
2.4准确度测定尿素、尿酸和总蛋白复合冰冻人血清国家标准品(编号:360012),相对偏差应不超过±5%。
2.5分析灵敏度对应于浓度为60g/L的TP所引起的吸光度差值(△A)的绝对值应在0.100~0.500的范围内。
2.6重复性重复测试高、中、低浓度样本,变异系数(CV)应≤5%。
2.7批间差测定同一样本,批间差(R)应≤6%。
2.8线性范围在[2,100]g/L范围内,线性相关系数(r)应≥0.990;在(30,100]g/L范围内,线性相对偏差应不超过±10%;在[2,30]g/L范围内,线性绝对偏差应不超过±3g/L。
2.9试剂稳定性2.9.1试剂效期稳定性:原包装的试剂盒在2℃~8℃避光贮存,有效期为36个月。
试剂有效期满后3个月以内,试剂性能应符合2.1、2.3、2.4、2.5、2.6、2.8的要求。
2.9.2开盖稳定性:开盖后,在2℃~8℃避光保存,稳定期为30天;稳定期满后1天内,试剂性能应符合2.1、2.3、2.4、2.5、2.6、2.8的要求。
α-淀粉酶测定试剂盒(CNPG3底物法)产品技术要求beiken
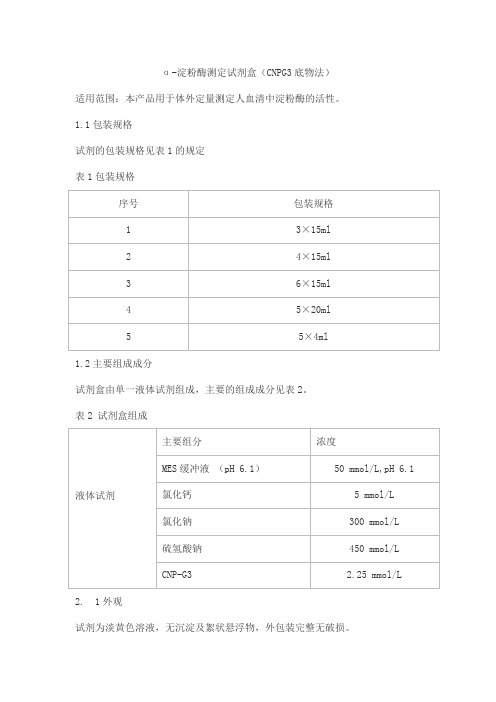
α-淀粉酶测定试剂盒(CNPG3底物法)适用范围:本产品用于体外定量测定人血清中淀粉酶的活性。
1.1包装规格试剂的包装规格见表1的规定表1包装规格1.2主要组成成分试剂盒由单一液体试剂组成,主要的组成成分见表2。
表2 试剂盒组成2. 1外观试剂为淡黄色溶液,无沉淀及絮状悬浮物,外包装完整无破损。
2. 2 净含量试剂的净含量应不少于标示值。
2. 3 试剂空白2.3.1试剂空白吸光度:用生理盐水测试试剂盒,在405nm的波长下记录试剂空白吸光度,应不大于0.35。
2.3.2 试剂空白吸光度变化率用生理盐水测试试剂盒,试剂空白吸光度变化率(ΔA/min)应不超过0.002。
2.4分析灵敏度测试校准品,1U/L的α-淀粉酶引起的吸光度变化值应≥0.0002。
2.5线性范围测试血清样本,试剂线性在[5,1000] U/L(37℃)范围内;a) 线性相关系数(r)应不小于0.990;b) 在[5,50]U/L范围内的绝对偏差不超过±5U/L,在(50,1000] U/L范围内的相对偏差应不超过±10%。
2.6精密度2.6.1重复性用质控品重复测试所得结果的重复性(变异系数,CV)应不大于5%。
2.6.2批间差试剂盒批间差应不大于10%。
2.7准确度:测试专用的标准物质(GBW(E)090286、GBW(E)090595、GBW(E)090593、GBW09177),所得准确度偏差不超过±10%.2.8 稳定性:试剂盒贮存在2℃~8℃条件下,有效期为24个月。
产品在有效期末测试2.1、2.3、2.4、2.5、2.6.1、2.7,结果符合各项要求。
丙氨酸氨基转移酶测定试剂盒(丙氨酸底物法)产品技术要求lepu

丙氨酸氨基转移酶测定试剂盒(丙氨酸底物法)适用范围:用于体外定量测定人血清中丙氨酸氨基转移酶的活性。
1.1 规格试剂1:3×60 mL,试剂2:1×45 mL;试剂1:1×60 mL,试剂2:1×20 mL;试剂1:1×60 mL,试剂2:1×12 mL;试剂1:4×60 mL,试剂2:4×15 mL;试剂1:2×40 mL,试剂2:2×10 mL;试剂1:3×28 mL,试剂2:3×7 mL;试剂1: 1×4L,试剂2: 1×1L;试剂1: 2×4L,试剂2: 1×2L。
1.2 主要组成成分试剂1主要组分:试剂2主要组分:2.1 净含量应不低于试剂瓶标示装量。
2.2 外观试剂1:无色或淡黄色透明溶液;试剂2:无色或淡黄色透明溶液。
外包装完好、无破损,标签完好、字迹清晰。
2.3 试剂空白2.3.1 试剂空白吸光度应不小于1.0(波长340nm,光径1cm)。
2.3.2 试剂空白吸光度变化率试剂空白吸光度变化率(△A/min)应不大于0.004。
2.4 分析灵敏度测试100U/L的被测物时,吸光度变化率(ΔA/min)应不低于0.0025。
2.5 准确度用参考物质(GBW09177)定值的血清测定,实测值与标示值的偏差不超过±12.0%。
2.6 重复性批内变异系数(CV)应不大于5%。
2.7 线性2.7.1在[0.5,800]U/L区间内,线性相关系数r应不低于0.9900;2.7.2[0.5,96)U/L区间内,线性绝对偏差应不超过±11.52U/L;[96,800]U/L 区间内,线性相对偏差应不超过±12%。
2.8 批间差批间差应不大于10%。
2.9 稳定性取在2℃~8℃条件下贮存达到12个月后的试剂进行检测,检测结果应符合2.2、2.3、2.4、2.5、2.6、2.7的要求。
丙氨酸氨基转移酶测定试剂盒(丙氨酸底物法)产品技术要求haomai

丙氨酸氨基转移酶测定试剂盒(丙氨酸底物法)适用范围:本试剂盒用于体外定量测定人血清中丙氨酸氨基转移酶(ALT)的活性。
1.1包装规格1.2主要组成成分本试剂由试剂1(R1)和试剂2(R2)组成试剂1(R1):Tris 100mmol/L L-丙氨酸500mmol/L乳酸脱氢酶1150U/L试剂2(R2):α-酮戊二酸15mmol/LNADH 0.2mmol/L2.1 外观试剂盒外观应整洁,文字符号标识清晰;R1为无色透明液体,R2为无色透明液体。
液体试剂不得有沉淀和絮状物。
2.2 装量试剂瓶内液体装量应不少于标示值。
2.3 试剂空白2.3.1 试剂空白吸光度以生理盐水为样品,在37℃、340nm波长、1cm光径条件下,吸光度≥1.0。
2.3.2 试剂空白吸光度变化率以生理盐水为样品,在37℃、340nm波长、1cm光径条件下,吸光度变化率(△A/min)≤0.004。
2.4 分析灵敏度浓度为40U/L的样本,吸光度变化△A/min>0.005。
2.5 准确性相对偏差应不大于15%。
2.6 重复性用不同浓度的两个样本进行检测,各重复检测10次,其批内变异系数(CV)应不超过5%。
2.7 线性2.7.1在(5,500)U/L范围内,线性相关系数r应不低于0.990;2.7.2 在(5,50]U/L范围内绝对偏差不超过±5U/L;(50,500)U/L范围内相对偏差不超过±10%。
2.8 批间差用三个批号的试剂盒测定同一份样本,试剂盒批间相对极差应不超过10%。
2.9 稳定性试剂盒在2~8℃避光保存,可稳定18个月。
取到效期后的样品检测试剂空白吸光度、空白吸光度变化率、分析灵敏度、准确度、重复性、线性范围应分别符合2.3.1、2.3.2、2.4、2.5、2.6、2.7的要求。
抗环瓜氨酸肽抗体测定试剂盒(胶乳免疫比浊法)产品技术要求zhongshengbeikong

抗环瓜氨酸肽抗体测定试剂盒(胶乳免疫比浊法)适用范围:本试剂用于体外定量测定人血清中抗环瓜氨酸肽抗体的含量。
1.1规格液体双剂型试剂1(R1):60mL×2, 试剂2(R2):20mL×2;试剂1(R1):60mL×1, 试剂2(R2):20mL×1;试剂1(R1):45mL×1, 试剂2(R2):15mL×1;选配校准品(2个浓度):0.5mL×2;选配质控品(2个水平):0.75mL×2。
1.2规格划分说明根据净含量划分规格。
1.3主要组成成分试剂盒由试剂1(R1)液体、试剂2(R2)液体、校准品液体(选配)和质控品液体(选配)组成。
1.3.1 试剂1(R1)液体:甘氨酸缓冲液100mmol/L 1.3.2 试剂2(R2)液体:包被环瓜氨酸肽的胶乳颗粒0.12w/v%1.3.3 校准品:人血清基质抗环瓜氨酸肽抗体定值范围:浓度1:1U/mL~10U/mL;浓度2:70U/mL~120U/mL(每批定值)1.3.4 质控品:人血清基质抗环瓜氨酸肽抗体定值范围:水平1:10U/mL~30U/mL;水平2:30U/mL~70U/mL(每批定值)2.1 外观试剂盒中各组件的外观应满足:a)试剂1(R1)应为无色透明溶液,无杂质、无絮状物,外包装完整无破损;b)试剂2(R2)应为白色乳浊液,无杂质、无絮状物,外包装完整无破损;c) 校准品应为淡黄色、黄色或淡红色透明溶液,无混浊、无未溶解物,外包装完整无破损;d) 质控品应为淡黄色、黄色或褐色透明溶液,无混浊、无未溶解物,外包装完整无破损。
2.2 净含量液体试剂净含量应不少于标示值。
2.3 试剂空白吸光度在波长546nm (530nm-570nm)(光径1cm)处,试剂空白吸光度(A)应≤1.800。
2.4 准确度测定抗环瓜氨酸肽抗体纯品, 回收率应在80%~120%范围内。
γ-谷氨酰基转移酶测定试剂盒(GCANA底物法)产品技术要求zenmeixikema

γ-谷氨酰基转移酶测定试剂盒(GCANA底物法)适用范围:用于体外定量检测人血清中γ-谷氨酰基转移酶的活性。
1.1规格a) 试剂1:2×40ml,试剂2:2×10ml;b) 试剂1:2×80ml,试剂2:2×20ml;c) 试剂1:4×60ml,试剂2:4×15ml;d) 试剂1:2×60ml,试剂2:2×15ml;e) 试剂1:2×72ml,试剂2:2×18ml;f) 试剂1:12×16ml,试剂2:12×4ml;g) 试剂1:2×400ml,试剂2:2×100ml;h) 试剂1:8×60ml,试剂2:2×60ml;i) 试剂1:3×80ml,试剂2:3×20ml;j) 试剂1:1×40ml,试剂2:1×10ml;k) 试剂1:4×40ml,试剂2:4×10ml。
1.2 组成试剂主要组分见表1:表1 试剂主要组分2.1 外观外包装完整无破损,标签清晰;试剂1应为无色或淡黄色透明溶液;试剂2应为淡黄色溶液。
2.2 净含量应不低于试剂瓶标示装量。
2.3 试剂空白2.3.1 试剂空白吸光度在405nm处测定试剂空白吸光度,应<0.8。
2.3.2 试剂空白吸光度变化率试剂空白吸光度变化率(△A/min)应≤0.005。
2.4 分析灵敏度测定浓度为50U/L的样品,吸光度变化率(△A/min)应不低于0.012。
2.5 线性2.5.1在[5,450]U/L范围内,线性回归的相关系数应不低于0.990;2.5.2测试浓度(50,450]U/L的样品,相对偏差应不超过±10%;测试浓度[5,50]U/L的样品,绝对偏差应不超过±5U/L。
2.6 重复性2.6.1 批内重复性变异系数(CV)应不超过5%。
腺苷脱氨酶测定试剂盒(过氧化物酶法)0产品技术要求zhongshengbeikong

腺苷脱氨酶测定试剂盒(过氧化物酶法)适用范围:本试剂用于体外定量测定人血清中腺苷脱氨酶的活性。
1.1包装规格液体双剂型试剂1(R1):60mL×2,试剂2(R2):60mL×1,质控品:1mL×1;试剂1(R1):50mL×1,试剂2(R2):25mL×1,质控品:1mL×1。
1.2主要组成成分1.2.1 试剂1(R1)(液体)三(羟甲基)氨基甲烷(Tris)50mmol/L4-氨基安替吡啉 2 mmol/L嘌呤核苷磷酸化酶(PNP)0.1U/mL黄嘌呤氧化酶(XOD)0.2 U/mL过氧化物酶(POD)0.6 U/mL1.2.2 试剂2(R2)(液体)三(羟甲基)氨基甲烷(Tris)(pH 8.0)50 mmol/L腺嘌呤核苷10 mmol/LN-乙基-N-(2-羟基-3-硫丙基)-3-甲基苯胺(EHSPT)2 mmol/L1.2.3 质控品(冻干粉)腺苷脱氨酶20U/L~40U/L。
(每批定值,值有差异,详见值单)2.1 外观试剂盒中各组件的外观应满足:2.1.1 试剂1(R1)应为无色透明溶液,无杂质、无絮状物,外包装完整无破损;2.1.2 试剂2(R2)应为无色透明溶液,无杂质、无絮状物,外包装完整无破损;2.1.3 质控品应为浅黄色冻干粉,复溶后应为浅黄色透明溶液,无混浊、无未溶解物,外包装完整无破损。
2.2 净含量液体试剂净含量应不少于标示值。
2.3试剂空白吸光度在波长546nm(540nm~550nm)处(光径1cm),试剂空白吸光度(A)应≤0.050,试剂空白吸光度变化率(△A/min)≤0.002。
2.4 准确度测定BCR647,相对偏差应不超过±10%。
2.5分析灵敏度对应于活性为10U/L的腺苷脱氨酶所引起的吸光度变化率应在0.003~0.006的范围内。
2.6重复性重复测定高、中、低浓度样本,变异系数(CV)应≤6 %。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
甘氨酰脯氨酸二肽氨基肽酶测定试剂盒(GPDA底物法)
适用范围:本试剂用于体外定量测定人血清中甘氨酰脯氨酸二肽氨基肽酶的含
量。
1.1规格
液体双剂型
试剂1(R1):60mL×2, 试剂2(R2):15mL×2;
试剂1(R1):60mL×1, 试剂2(R2):15mL×1;
试剂1(R1):40mL×1, 试剂2(R2):10mL×1;
选配校准品:冻干粉型:0.5mL×1;
选配质控品:冻干粉型:(2个水平):0.5mL×2。
1.2规格划分说明
根据净含量、复溶体积划分规格。
1.3主要组成成分
试剂盒由试剂1(R1)液体、试剂2(R2)液体、校准品冻干粉(选配)和质控
品冻干粉(选配)组成。
1.3.1 试剂1(R1)液体:
双甘
肽 100mmol/
L
1.3.2 试剂2(R2)液体:
甘氨酰脯氨酰对硝基苯胺对甲苯磺酸 150mmol/L
1.3.3 校准品:人血清基质
甘氨酰脯氨酸二肽氨基肽酶
定值范围:20U/L~100U/L(每批定值)
1.3.4 质控品:人血清基质
甘氨酰脯氨酸二肽氨基肽酶
定值范围:水平1:10U/L~40U/L,水平2:40U/L~100U/L(每批定值)
2.1 外观
试剂盒中各组件的外观应满足:
a)试剂1(R1)应为无色透明溶液,无杂质、无絮状物,外包装完整无破损;
b)试剂2(R2)应为浅黄色透明溶液,无杂质、无絮状物,外包装完整无破损;
c) 校准品应为白色或淡黄色冻干粉,复溶后应为白色或淡黄色溶液,无混浊,
无未溶解物,外包装完整无破损;
d) 质控品应为白色或淡黄色冻干粉,复溶后应为白色或淡黄色溶液,无混浊,
无未溶解物,外包装完整无破损。
2.2 净含量
液体试剂净含量应不少于标示值。
2.3 试剂空白吸光度和空白吸光度变化率
2.3.1试剂空白吸光度:在波长405nm(光径1cm)处,试剂空白吸光度(A)应
≤1.000。
2.3.2试剂空白吸光度变化率:在波长405nm(光径1cm)处,试剂空白吸光度
变化率绝对值(|△A/min|)应≤0.100。
2.4 准确度
测定甘氨酰脯氨酸二肽氨基肽酶纯品,回收率应在80%~120%范围内。
2.5分析灵敏度
对应于浓度为50U/L的GPDA所引起的吸光度变化率(△A/min)的绝对
值应在0.003~0.030的范围内。
2.6重复性
重复测定高、中、低浓度样本,变异系数(CV)应≤10%。
2.7批间差
测定同一样本,批间差(R)应≤15%。
2.8线性范围
在[10,600]U/L范围内,线性相关系数(r)应≥0.990;
在[10,60]U/L范围内,线性绝对偏差应不超过±9U/L;
在(60,600]U/L范围内,线性相对偏差应不超过±15%。
2.9 质控品定值有效性
测定结果应在质控范围内。
2.10 批内瓶间差
2.10.1校准品批内瓶间差
变异系数CV≤10%。
2.10.2质控品批内瓶间差
变异系数CV≤10%。
2.11 稳定性
2.11.1效期稳定性
原包装的试剂盒在2℃~8℃避光贮存,有效期为12个月。有效期满后3个月以
内,试剂盒性能应符合2.1、2.3、2.4、2.5、2.6、2.8、2.9、2.10的要求。
2.11.2 校准品复溶稳定性
复溶后的校准品在2℃~8℃密闭避光保存,稳定期为1天,稳定期满后,
用已复溶校准品校准合格的试剂盒,测定结果应符合2.1、2.4、2.10.1的要求。
2.11.3质控品复溶稳定性
复溶后的质控品在2℃~8℃密闭避光保存,稳定期为1天。稳定期满后
测定,结果应符合2.1、2.9、2.10.2的要求。
2.12校准品溯源性
校准品溯源性应符合GB/T 21415-2008的要求,并提供相关溯源过程、测定值不
确定度等内容。校准品溯源至Sigma公司甘氨酰脯氨酸二肽氨基肽酶纯品。
