本科有机化学 第四章 卤代烷
大学有机化学练习测试题—卤代烃

第六章卤代烃学习指导:1.卤代烷分类和命名:IUPAC命名法;2.化学性质:取代反应(水解,氰解,氨解,醇解,与硝酸银作用,S N1,S N2历程和影响因素);除反应(脱卤化氢,E1,E2历程);与金属镁反应;3.S N1和S N2两种反应影响亲核取代反应的因素:烷基和卤素的影响;4.E1和E2两种历程,Saytzeff规则;烃基对卤素活泼性的影响;5.双键位置对卤素原子活性的影响。
习题一、命名下列各物种或写出结构式。
1、写出溴仿的构造式。
2、写出的系统名称。
3、写出(Z)-3-甲基-2-乙基-1-氯-1-溴-1-丁烯的构型式。
4、写出的系统名称。
5、写出的系统名称。
二、完成下列各反应式(把正确答案填在题中括号内)。
1、2、()()+()3、4、5、6、三、理化性质比较题(根据题目要求解答下列各题)。
1、排列下列溴代烷在NaOH水溶液中的反应速率快慢次序:(A)Br—CH2CH2CH(CH3)22、将下列化合物按与AgNO3(SN1)醇溶液反应快慢排序:(B)(CH3)3CCl(C)CH3CH2CH2CH2Cl(D)(CH3)2C==CHCl3、将下列化合物按E消除HBr的反应速率快慢排序:(A)(CH 3)2CHCH 2CH 2Br4、指出下列化合物中,按S N 1反应哪一个进行得较快。
(A)(CH 3)2CBrCH 2CH 35、将下列化合物按S N 1反应活性大小排列: (A)CH 3CH =CHCl(B)CH 2=CHCH 2Cl(C)CH 3CH 2CH 2Cl四、基本概念题(根据题目要求回答下列各题)。
1、卤代烷与NaOH 在水与乙醇混合物中进行反应,指出下列情况哪些属于S N 2机理,哪些属于S N 1机理。
1.产物的构型完全转化。
2.有重排产物。
3.碱的浓度增加反应速率加快。
4.叔卤代烷反应速率大于仲卤代烷。
5.增加溶剂的含水量反应速率明显加快。
五、用简便的化学方法鉴别下列各组化合物。
有机化学(第9版)第四章 烷烃与环烷烃

反-1,3-二甲基环戊烷 trans-1,3-dimethylcyclopentane
配套题库请下载 医学猫 APP,执业、三基、规培、主治、卫生资格、正副高等题库都已入库。
有机化学 (第9版)
二、结构与稳定性
成键角度与杂化轨道产生偏差会产生角张力,偏差越大,角张力越大,环越不 稳定。
环己烷 > 环戊烷 > 环丁烷 > 环丙烷 环烷烃稳定性
链终止
有机化学 (第9版)
五、化学性质
(二)卤代反应
3. 烷烃卤代反应的取向
烷烃卤代反应的取向取决于烷烃的结构及卤素的活性
有机化学 (第9版)
五、化学性质
(二)卤代反应
4. 烷基自由基稳定性及构型
sp2杂化 甲基自由基
叔丁基自由基
自由基稳学猫 APP,执业、三基、规培、主治、卫生资格、正副高等题库都已入库。
(1)概念:连在伯、仲、叔碳上的氢。 (2)表示方法:1° H、2° H和3 °H。
有机化学 (第9版)
二、构造异构和命名
(一) 碳链异构
由于碳链结构不同而产生的同分异构现象。
C5H12
(二)命名
(正)戊烷 n-pentane
(异)戊烷 iso-pentane
(新)戊烷 neo-pentane
烷烃的命名通常分为普通命名法(common nomenclature)和系统命名法
(systematic nomenclature)。
配套题库请下载 医学猫 APP,执业、三基、规培、主治、卫生资格、正副高等题库都已入库。
有机化学 (第9版)
二、构造异构和命名
常见的烷烃
常见烷烃的结构及名称
中文 甲烷 乙烷 丙烷 丁烷 戊烷
有机化学 卤代烷

R O C R'
醇 醚 硫醇 硫醚 酯
®山东农业大学化学学院
(接下页)
RX +
Nu
R Nu
CN
C C R' 炔基负离子
CH(CO2Et)2 丙二酸酯负离子
I
R CN R C C R'
腈 高级炔
R CH(CO2Et)2 烷基丙二酸酯
RI
碘代烷
®山东农业大学化学学院
与分子型亲核试剂的反应
Saytzeff Rule: 消除反应的 主要产物是
双键上烃基取代最多的烯烃。
RCH CH2 KOH, EtOH HX
RCH CH2 + HX
KOH, EtOH CH3CH CHCH3
HX
CH3CH CHCH3 81%
+ CH3CH2CH CH2 19%
®山东农业大学化学学院
优先形成共轭烯烃
KO H, EtO H H2C CHCH2CHCH(CH3)2
RC C X
HH
B 和位氢均有弱酸性
C C + X + HB R H 消除H成烯烃
消除反应(Elimination Reaction)
®山东农业大学化学学院
§5.3 一卤代烷的化学反应
1. 卤代烷的亲核取代反应
(SN反应,Nucleophilic Substitution Reaction)
1. 卤代烷通式:
R Cl , R Br , R I
性质接近 通常总称卤代烷
RF
性质特殊 氟代烷
®山东农业大学化学学院
2. 卤代烷的类型 一卤代 二卤代 多卤代
大学有机化学反应方程式总结卤代烃的亲核取代与消除反应

大学有机化学反应方程式总结卤代烃的亲核取代与消除反应大学有机化学反应方程式总结:卤代烃的亲核取代与消除反应有机化学是研究有机化合物结构、性质和反应的科学,而有机反应方程式则是描述这些有机化合物之间转化的表达式。
在大学有机化学中,卤代烃是一个重要的研究对象,它们可以通过亲核取代和消除反应与其他化合物发生反应。
本文将总结卤代烃的亲核取代与消除反应的反应方程式,以帮助读者更好地理解和应用这些反应。
1. 亲核取代反应亲核取代反应是卤代烃与亲核试剂发生反应的常见方式。
亲核试剂可以是负离子或有机分子。
以下是亲核取代反应的常见类型及其对应的反应方程式:1.1 醇的亲核取代反应醇是一类常见的亲核试剂,在亲核取代反应中起着重要作用。
一个常见的例子是卤代烷和带负电荷的醇负离子进行SN2反应,生成醇取代产物。
其反应方程式如下:RX + OH- → ROH + X-其中,R代表一个有机基团,X代表卤素。
1.2 氨的亲核取代反应氨是另一个常见的亲核试剂,它可以与卤代烃发生亲核取代反应,生成胺取代产物。
以下是氨的亲核取代反应的反应方程式:RX + NH3 → RNH2 + HX其中,R代表一个有机基团,X代表卤素。
1.3 胺的亲核取代反应除了氨,胺也可以与卤代烃发生亲核取代反应。
以下是胺的亲核取代反应的反应方程式:RX + R'NH2 → RR'NH + HX其中,R和R'代表有机基团,X代表卤素。
2. 消除反应消除反应是卤代烃的另一种重要反应类型。
在消除反应中,卤代烃通过引入碱试剂或通过热力条件,失去卤素原子并形成双键或三键。
以下是消除反应的常见类型及其对应的反应方程式:2.1 β-消除反应β-消除反应是一种常见的消除反应类型,其中卤代烃临近卤素的碳上的β位上发生消除反应。
典型的β-消除反应是氢化物消除反应,其反应方程式如下:RX + NaNH2 → R-H + NaNHX其中,R代表一个有机基团,X代表卤素。
卤代烃鉴别

卤代烃鉴别引言卤代烃是一类有机化合物,其中的氢原子被卤素(氯、溴或碘)取代。
由于卤素的特殊性质,卤代烃在化学反应中表现出与其他有机化合物不同的行为。
准确鉴别卤代烃对于有机化学实验和工业生产具有重要意义。
本文将介绍几种常用的方法和试剂,用于鉴别不同类型的卤代烃。
1. 银离子试剂法银离子试剂法是最常用的鉴别卤代烃的方法之一。
该方法基于溴离子(Br-)和碘离子(I-)与银离子(Ag+)形成沉淀的不同溶解度。
实验步骤:1.取少量待鉴别的卤代烷溶液,加入少量银离子试剂(如硝酸银AgNO3溶液)。
2.观察是否生成沉淀,并记录其颜色和形态。
结果分析:•若生成白色沉淀,则表示存在氯离子(Cl-),即为氯代烷。
•若生成黄色沉淀,则表示存在溴离子(Br-),即为溴代烷。
•若生成黄色沉淀,并在阳光下变黑,则表示存在碘离子(I-),即为碘代烷。
2. 碱溶液法碱溶液法是用于鉴别卤代烃的另一种常见方法。
该方法基于卤代烃与氢氧化钠(NaOH)或氢氧化银(AgOH)反应生成相应的卤化物盐的溶解度差异。
实验步骤:1.取少量待鉴别的卤代烷溶液,加入少量稀碱溶液(如氢氧化钠NaOH或氢氧化银AgOH溶液)。
2.观察是否生成沉淀,并记录其颜色和形态。
结果分析:•若生成白色沉淀,则表示存在氯离子(Cl-),即为氯代烷。
•若生成黄色沉淀,则表示存在溴离子(Br-),即为溴代烷。
•若生成黄色沉淀,并在阳光下变黑,则表示存在碘离子(I-),即为碘代烷。
3. 明胶试剂法明胶试剂法是一种用于鉴别卤代烃的快速方法。
该方法基于卤代烷与明胶溶液反应生成不同颜色的络合物。
实验步骤:1.取少量待鉴别的卤代烷溶液,加入少量明胶溶液。
2.加热溶液至沸腾,观察溶液颜色的变化。
结果分析:•若溶液变为淡黄色,则表示存在氯离子(Cl-),即为氯代烷。
•若溶液变为橙黄色,则表示存在溴离子(Br-),即为溴代烷。
•若溶液变为红棕色,则表示存在碘离子(I-),即为碘代烷。
4. 红磷试剂法红磷试剂法是一种用于鉴别卤代烃的特殊方法,适用于区分氯代烷和其他卤代烷。
卤化反应知识点总结高中

卤化反应知识点总结高中一、概念1.1 卤化反应卤化反应是指有机化合物中含有卤素原子发生的一类化学反应。
卤素包括氯、溴、碘和氟等,它们在有机化合物中往往展现出特殊的化学性质,因此引起了有机化学家的广泛关注。
1.2 卤代烷卤代烷是一类含有卤素原子(如氯、溴、碘)的有机化合物。
它们的分子结构中卤素原子直接连接在碳原子上,形成了C-X 键,其中 X 代表卤素原子。
常见的卤代烷有氯代烷、溴代烷和碘代烷等。
二、机理2.1 亲核取代反应在卤化反应中,最常见的是亲核取代反应。
亲核取代反应是一种在卤代烷的分子中,有一个亲核试剂进攻了卤代烷分子,取代了一个卤素原子的反应。
亲核试剂可以是氢氧根离子、氢氧根离子还原后的OH、CN 等。
在 SN1 机理中,亲核试剂和卤代烷发生竞争评价,通常以过量的亲核试剂为主。
在 SN2机理中,亲核试剂和卤代烷一起进行反应,这样生成的取代产物中两种异构体并存。
2.2 卤代烷的活性卤代烷的活性是指卤代烷分子中 C-X 键的极化程度。
一般来说,氟代烷 > 溴代烷 > 氯代烷 > 碘代烷。
这是因为卤素原子的电负性随原子序数的增加而递增,因此 C-X 键的极化程度也会随着增大。
活性的卤代烷易于发生亲核取代反应,而不活性的卤代烷则相对惰性。
因此,不同活性的卤代烷在进行卤化反应时会表现出不同的反应速率和产物构成。
三、特点3.1 亲核试剂的选择在进行卤化反应时,需要选择合适的亲核试剂来实现反应。
一般来说,对于不同的卤代烷活性,选择的亲核试剂也会有所不同。
同时,一些亲核试剂还需要配合溶剂、温度等条件,才能够有效地进行反应。
3.2 立体化学卤化反应中还涉及到立体化学的问题。
在 SN1 机理中,由于离子是在分子内部形成的,因此不会发生立体异构体的生成。
而在 SN2 机理中,取代产物往往会形成两种可能的异构体。
另外,还有一种叫做消旋化学的问题。
由于反应中涉及到手性碳原子的取代,因此当卤代烷存在手性时,反应产物也会涉及到手性物质的生成。
有机化学综合练习五(有机合成)
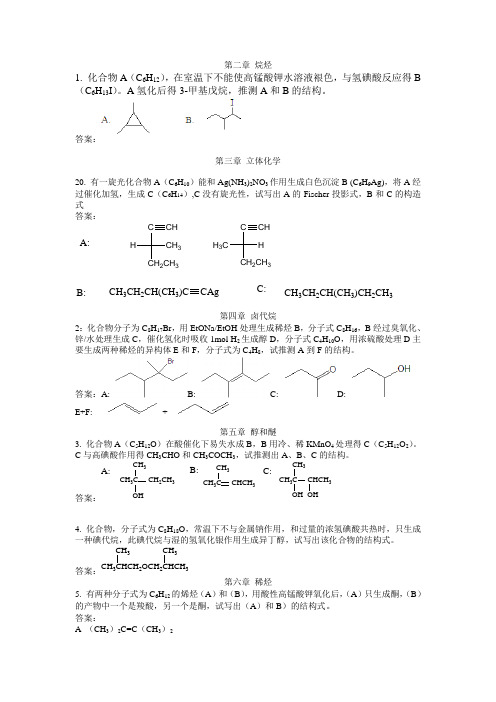
第二章 烷烃1. 化合物A (C 6H 12),在室温下不能使高锰酸钾水溶液裉色,与氢碘酸反应得B (C 6H 13I )。
A 氢化后得3-甲基戊烷,推测A 和B 的结构。
答案:第三章 立体化学20. 有一旋光化合物A (C 6H 10)能和Ag(NH 3)2NO 3作用生成白色沉淀B (C 6H 9Ag),将A 经过催化加氢,生成C (C 6H 14),C 没有旋光性,试写出A 的Fischer 投影式,B 和C 的构造式 答案:CCH 2CH 3CH 3HCH CCH 2CH 3H H 3CCH A:B:CH 3CH 2CH(CH 3)CCAgCH 3CH 2CH(CH 3)CH 2CH 3C:第四章 卤代烷2:化合物分子为C 8H 17Br ,用EtONa/EtOH 处理生成稀烃B ,分子式C 8H 16,B 经过臭氧化、锌/水处理生成C ,催化氢化时吸收1mol H 2生成醇D ,分子式C 4H 10O ,用浓硫酸处理D 主要生成两种稀烃的异构体E 和F ,分子式为C 4H 8,试推测A 到F 的结构。
答案:A: B:C: D:E+F: +第五章 醇和醚3. 化合物A (C 5H 12O )在酸催化下易失水成B ,B 用冷、稀KMnO 4处理得C (C 5H 12O 2)。
C 与高碘酸作用得CH 3CHO 和CH 3COCH 3,试推测出A 、B 、C 的结构。
答案:A:CH 3CCH 3CH 2CH 3CH 3CCH 3CHCH 3CH 3CCH 3CHCH 3B:C:4. 化合物,分子式为C 8H 18O ,常温下不与金属钠作用,和过量的浓氢碘酸共热时,只生成一种碘代烷,此碘代烷与湿的氢氧化银作用生成异丁醇,试写出该化合物的结构式。
答案:CH 32OCH 23CH 3CH 3第六章 稀烃5. 有两种分子式为C 6H 12的烯烃(A )和(B ),用酸性高锰酸钾氧化后,(A )只生成酮,(B )的产物中一个是羧酸,另一个是酮,试写出(A )和B )的结构式。
有机化学 第四章 答案

第四章(一)教材练习题答案4-1 (1)反-1,4-二氯环己烷(2)(2S,3R)-1,2,3-三氯丁烷(3)R-2-氯-2-溴丁烷(4)1-甲基-2-氯环戊烷4-2 (1)因氯代环己烷分子极性高于环己烷,故沸点高。
(2)含有三氯原子。
4-3 (1)(2)(3)(4)CH3CH2CH2OH CH3CH2OCH3CNCH3CHCH3SH4-4 1.(1)CH3CHCH2CH3CH3CH2CH2CH2 CH3CCH3CH3+++>>(2)CH3+>>+CH2+2.CH3CH2Br CH3CH2CH2Br CH3CHCH2BrCH3CH3CCH2BrCH3CH3G为:CH3CH3CH2H3CHCCH3H3CCCH3CH33.这些基团对反应速度的影响与他们的体积有关,由溴甲烷到新戊基基溴,随着基团G的体积增大,反应速度减小。
4-5 1.碳正离子(1)和(3)发生重排的动力在于,经重排可以从较不稳定的仲或伯碳正离子得到较稳定的叔碳正离子。
碳正离子(1)氢迁移后可得到叔碳正离子,而如果甲基迁移将得到仲碳正离子。
因为碳正离子的稳定性是叔>仲,所以是氢迁移得到较稳定的叔碳正离子。
2.+CH3CCH2CH3CH3+CH3CH2CHCH3 +CH3CHCCH3CH34-6 溴代新戊烷是伯卤代烷,若发生S N 2反应,由于体积大的叔丁基的影响,阻挡了亲核试剂的背后进攻,难以发生构型翻转,故按S N 1机理反应。
4-7 1.+(CH 3)4N CH 33 2.CH 3CH 2CH 2CHCNCl3.对于S N 1反应,卤代新戊烷是伯卤代烷,不易形成碳正离子;而由于中心碳原子连接体积大的叔丁基阻挡了亲核试剂的背后进攻,使构型翻转形成S N 2的过渡态也同样不容易,所以卤代新戊烷的亲核取代反应速度很慢。
4-8 (1) HO - > RO - > HS - (2)Cl - > Br - > I - 4-9 (1)CN - > Cl - > Br - > I - (2)RO - > HO - > HS -3-10 CCCH 3CH 2CH 3H 3CH(二)教材习题答案1.(1)CF 2Cl 2 (2)ClCH 2CH 2Ph (3)HICH 3CH 2CH 2CH 2CH 3(4) (CH 3)3CCH 2Cl (5) CH 3CH 2MgBr2.(1)5-甲基-3-氯甲基-2-溴辛烷 (2)5-丁基-5-氯壬烷 (3)(2S ,3S )-2,3-二氯丁烷 (4)(2R ,3S )-2-氯-3-溴戊烷 3.HOCH 3CH 3CH 2CH 3+(CH 3)3CCH 2OCCH 3(1)O(2)CH 3CH 2CH CCH 2CH 2CH 3CH 2CH 2CH 3NCH 33(3)(4)CH 3(H 3C)3C (5)(6)H 2CCHCH 2CN4.(1)第二个快,S N 2机理,RI > RCl ;(2)第一个快,S N 2机理,碳上有支链空阻大; (3)第一个快,S N 2机理,烯丙基卤 》烷基卤; (4)第一个快,S N 2机理,亲核能力SH ->OH -;(5)第二个快,S N 2机理,非质子性溶剂有利于反应; (6)第一个快,S N 1机理,叔卤烷>仲卤烷。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
34
• 溶剂的影响(溶剂化作用) (a)质子溶剂(protic solvent):具有酸性质子的溶剂,常含 O—H、N—H键,可与带负电荷的亲核试剂形成氢键; (b)非质子溶剂(aprotic solvent):不含O—H、N—H极性键; (c)极性非质子溶剂(polar aprotic solvent):不含能形成氢键 的O—H、N—H基团,但具有强烈的偶极。 • 对亲核试剂的影响:强烈溶剂化小体 积负离子,使亲核性降低; • 优点:价格便宜,溶解能力较强。 原子半径小,电荷集中,则在质 子溶剂(protic solvent)中溶剂 化程度高(通过氢键),亲核性 弱(如:F-弱于I-, RO-弱于RS-)
思考:(1) 判断下列基团的离去能力? F- , OH- , NH2- , CH3(2) 下面反应能否发生?
30
I-是良好的 离去基团
其它良好的离去基团(离去能力 > I-):
比碘负离子 更容易离去
31
•亲核试剂(nucleophile)的影响 对SN1反应:影响不大 对SN2反应:提高亲核试剂浓度及亲核性则有利于反应
乙醇/水
CH3Br + NaOH
sp2
-
CH3OH + NaBr
sp3
sp3
-
亲核试剂从离去基团背面进攻 Back-side attack
构型反转!
Inversion of configuration
协同反应(concerted reaction):新键的生成与旧键的断裂 同时发生,一步反应,无中间体生成. 13
21
从反应机理入手分析:
推动力:叔碳正离子比仲碳正离子稳定
22
迁移基团:可以是H、甲基或更大体积的烷基 推动力:生成更稳定的中间体或热力学稳定的产物
23
24
影响亲核取代反应速率的诸因素
Factors affecting SN reactions
•底物(卤代烷)结构 •离去基团 •亲核试剂 •溶剂
9
亲核取代反应 (Nucleophilic Substitution,SN)
+
-
+
-
共价键异裂
亲核试剂 (nucleophile)
底物 (substrate)
产物 (product)
离去基团 (leaving group)
亲核试剂(nucleophile,Nu):富有电子和具有进攻碳原子核能力的试剂 •Nu(负离子): HO-, RO-, HS-, RS-, CN-, X-, C-等 •Nu:(中性分子): NH3, H2O, ROH等 10 亲核取代反应(nucleophilic substitution):由亲核试剂引起的取代反应
R3C- > R2N- > RO- > F 同族元素,(在质子溶剂中)亲核性与碱性强弱顺序相反:周期高 的原子亲核性大,碱性弱
33
导致碱性与亲核性不一致的原因: 可极化性(polarizability)和溶剂化作用(solvent effect) •可极化性: 同族元素从上向下,原子半径递增.原子核对外层电子的约束力降低, 外层电子所占轨道容易变形,可极化性增大.在SN2反应中,亲核试剂 的未成键电子分布可按需变形,这样亲核试剂即使与底物碳原子距 离还比较远时便开始成键了,有利于过渡态的稳定.
C F < C Cl < C Br < C I
C F > C Cl > C Br > C I
6
+
-
电负性(electronegativity): C I Br 2.5 2.7 3.0 Cl F 3.2 4.0
C
X
诱导效应(inductive effect):由于成键电子电负性的差异使成键电 子向一方偏移而发生的极化现象,用“+I”或“-I”表示. •衡量标准:以H为基准,比H电负性大的原子或基团具有吸电子诱导 效应(“-I”)(electron withdrawing);比H电负性小的原子或基团具 有推电子诱导效应(“+I”)(electron donating). •表示方法:用“”表示电子云移动的方向
异裂
sp2
C p
H H
平面结构,带正电荷 的碳为sp2杂化,未参 与杂化的p轨道上不带 电子(碳正离子为缺 电子物种)
与烷基自由基比较!
碳正离子的相对稳定性:
CH3 CH3 > C+ C+ H3C CH3 H3C H 叔 仲
>
CH3 C+ H H 伯
> H
H C+
H
原因:烷基的+I效应和超共轭效应
19
不稳定
稳定
碳正离子越稳定,则可认为越容易生成
就SN1反应而言:反应活性顺序为CH3X < 1o < 2o < 3o 原因: 碳正离子的稳定性(the stability of carbocations)。
27
卤代烷的结构与亲核取代反应类型的一般关系
几种特殊情况: • 与桥头碳原子相连的卤原子很不活泼,难以发生SN2或SN1反应
离去能力的评判:容纳负电荷的能力
•离去基团碱性越弱,形成的负离子越稳定,越容易离去 •共轭酸酸性越强,负离子(离去基团)碱性越弱 酸性: HI > HBr > HCl > HF 碱性: I- < Br- < Cl- < F离去能力: I- > Br- > Cl- > F反应活性: RI > RBr > RCl > RF
亲核性(nucleophilicity)和碱性(bisicity): • 亲核性(nucleophilicity):亲核试剂置换离去基团能力,指和碳原子 的亲合能力 • 测量方法:用SN2反应速率的大小度量 • 碱性(basicity):是热力学属性,通过平衡常数衡量,指和质子的结 合能力; • 亲核性与碱性的关系:很多情况下一致,但有时也不一致
17
+
-
(CH3)3C E
Br
+ -
(CH3)3C Ea1 CH3 H3C C+ sp2 CH3 碳正离子中间体 (carbocation) Ea2
OH
Hale Waihona Puke (CH3)3CBr(CH3)3C OH + Br反应进程
18
碳正离子中间体的结构和相对稳定性
carbocation
X
-XH C H H H
(S)-3-bromo-3-methylhexane
溶剂解(solvolysis): 溶剂作为反应试剂
立体化学: 外消旋化
(S)
16
单分子亲核取代反应(SN1)机理:
CH3 HO- + H3C C Br CH3 CH3 H3C C OH + BrCH3
+
-
sp2
+
-
有碳正离子中间体的生成!
28
SN2:亲核试剂从离去 基团的背面进攻受阻
SN1:因桥环体系的限制, 桥头碳正离子不能伸展为平 面结构,很不稳定,难形成
• 烯丙基卤和苄卤即容易发生SN2反应,也容易发生SN1反应
原因:主要是共轭效应
29
•离去基团(leaving group)的影响
离去基团越容易离去,则SN1或SN2反应越容易进行
32
亲核性大小一般规律:
反应中心为同种元素的亲核试剂,亲核性与碱性的强弱一致.负离 子比相应共轭酸中性分子亲核性强.
RO- > HO- > ArO- > RCOO- > ROH > H2O
中心原子处于同一周期并具有相同电荷的亲核试剂,其亲核性与 碱性大小一致:电负性大的原子, 碱性小,亲核性也小.
CH3 CH3CHCHCH3 OH
CH3 CH3CCH2 Br CH3
H2O
CH3 CH3CHCHCH3 Cl
H2O
CH3 CH3CCH2CH3 OH 93%
CH3 CH3
CH3CCH2 OC2H5
C2H5OH
CH3 CH3CCH2CH3 + 其它产物 OC2H5
重排的结果: • 分子骨架未改变,官能团位置与预料的不同 分子骨架发生改变 如何重排?为何要重排?
对SN1立体化学的解释:
H3CH2CH2C H3C H3CH2C C Br H2O 丙酮 CH2CH2CH3 HO C CH3 CH2CH3 (R) 立体化学: 外消旋化 H3CH2CH2C H3C H3CH2C (S) C OH
(S)-3-bromo-3-methylhexane
20
碳正离子的重排 (rearrangement)
(1) 底物结构的影响 • 对SN2反应:空间效应(steric hindrance)
叔丁基卤不发 生SN2反应!
25
就SN2反应而言:底物反应活性顺序为CH3X > 1o > 2o > 3o,烷基体 积增大将阻碍反应的进行,且分枝比分枝空间效应更明显。
26
• 对SN1反应:电子效应(electronic effect)
fluoro: 氟 chloro:氯 bromo:溴 iodo:碘
4
注意标明构型!
5
卤代烷的结构
Structure of alkyl halides
sp3 C
p
X
卤原子半径增大, 电子云密度降低, 与碳原子轨道的重 叠程度降低.
• atomic radius: • bond length: • bond energy:
CH3 H3C C Br + HO-(稀) CH3 CH3 H3C C OH + BrCH3
