慢病毒载体的构建讲解
慢病毒构建原理

慢病毒构建原理
◆慢病毒载体(Lentivirus)是一类改造自人免疫缺陷病毒(HIV)的病毒载体,是逆转录病毒的一种,基因组是RNA,其毒性基因已经被剔除并被外源性目的基因所取代,属于假型病毒。
可利用逆转录酶将外源基因整合到基因组中实现稳定表达,具有感染分裂期与非分裂期细胞的特性。
◆慢病毒基因组进入细胞后,在细胞浆中反转录为DNA,形成DNA整合前复合体,进入细胞核后,DNA整合到细胞基因组中。
整合后的DNA转录成mRNA,回到细胞浆中,表达目的蛋白;或产生小RNA。
慢病毒介导的基因表达或小RNA干扰作用持续且稳定,并随细胞基因组的分裂而分裂。
图片
◆慢病毒载体具有宿主范围广,基因容量大等特点。
体外应用时,慢病毒载体能够有效地感染培养的神经元、肝细胞、心肌细胞、肿瘤细胞、内皮细胞、干细胞等多种类型原代细胞和大部分细胞系。
由于慢病毒的感染具有整合特性,其能够将外源基因有效地整合到宿主染色体上,因而可以达到持久性表达,从而构建稳转细胞株,用于基因的细胞功能研究。
◆体内应用时,慢病毒载体的应用不如rAAV载体应用广泛,因为其具有一定的免疫原性,且随机整合特性可能导致细胞功能基因的异常。
相比较腺相关病毒,慢病毒的扩散范围较小,但其表达更快、基因容量更大(可容纳4kb),可作为大容量基因的载体。
慢病毒载体构建原理

慢病毒载体构建原理
慢病毒(lentivirus)是一类病毒,属于反转录病毒的一种。
慢病毒可以作为基因转移的工具,被广泛应用于基因治疗、基因编辑、干细胞研究等领域。
慢病毒载体构建是利用慢病毒作为基因传递的载体,将外源基因导入慢病毒基因组中,并通过慢病毒的复制和转录机制,将外源基因稳定地表达在宿主细胞中的过程。
慢病毒载体构建的原理主要包括以下几个步骤:
1. 选择适当的慢病毒载体,慢病毒载体通常由慢病毒的基因组和外源基因组成。
在构建慢病毒载体时,需要选择适当的慢病毒载体,通常选择已经经过改造的慢病毒载体作为基础,然后将需要表达的外源基因插入到载体中。
2. 插入外源基因,将需要表达的外源基因插入到慢病毒载体的适当位置。
通常采用限制性内切酶切割和连接酶连接的方法,将外源基因与慢病毒载体连接起来,形成重组的慢病毒载体。
3. 构建重组慢病毒载体,将插入了外源基因的慢病毒载体导入到适当的宿主细胞中,利用宿主细胞的复制和转录机制,使重组慢
病毒载体在宿主细胞中稳定复制和表达外源基因。
4. 验证慢病毒载体的稳定性和表达效果,对构建的重组慢病毒
载体进行验证,包括验证慢病毒载体在宿主细胞中的稳定性和外源
基因的表达效果。
通常采用PCR、Western blot等方法对慢病毒载
体进行验证。
总之,慢病毒载体构建是利用慢病毒作为基因传递的载体,将
外源基因导入慢病毒基因组中,并通过慢病毒的复制和转录机制,
使外源基因稳定地表达在宿主细胞中的过程。
这一技术在基因治疗、基因编辑、干细胞研究等领域具有重要的应用前景,对于疾病治疗
和生命科学研究具有重要意义。
慢病毒载体构建原理

慢病毒载体构建原理
慢病毒载体是一种常用于基因转染和基因治疗研究的工具,其构建原理主要包括载体选择、基因插入、包装和转染等几个关键步骤。
下面将分别对这些步骤进行详细介绍。
首先,载体选择是慢病毒构建的第一步。
常用的慢病毒载体包括pLenti、pSico、pRetro等,这些载体通常具有较高的转染效率和稳定性。
在选择载体时,需要考虑载体的大小、复制能力、转染效率以及转染细胞类型等因素,以确保最终构建的慢病毒载体能够满足实验需求。
其次,基因插入是慢病毒构建的关键步骤之一。
一般来说,可以利用限制性内切酶切割载体,然后将待插入的基因片段与载体连接,形成重组载体。
在进行基因插入时,需要注意选择合适的限制性内切酶,控制酶切的时间和温度,以确保基因能够正确插入到载体中。
接下来是包装步骤。
包装是指将重组载体导入到包装细胞中,通过包装细胞的辅助,使其产生慢病毒颗粒。
常用的包装细胞包括293T细胞、HEK293细胞等。
在包装过程中,需要利用辅助载体,如
pMD2.G和psPAX2等,通过三质体共转染的方式,使包装细胞产生
慢病毒颗粒。
最后是转染步骤。
转染是将包装好的慢病毒颗粒导入到目标细
胞中,实现基因的转染。
在进行转染时,需要根据目标细胞的特性
选择合适的转染方法,如离体转染、体内转染等,以确保慢病毒能
够有效地转染目标细胞,并表达目标基因。
总的来说,慢病毒载体构建的原理涉及到载体选择、基因插入、包装和转染等关键步骤。
通过合理的实验设计和操作,可以构建出
稳定、高效的慢病毒载体,为基因转染和基因治疗研究提供有力的
工具支持。
慢病毒载体的构建

慢
慢病毒载体是一种常用的基因转移工具,其安全性评估主要 包括对病毒的毒力、致病性和传播性的评估。在构建慢病毒 载体时,应确保所选用的慢病毒毒株无致病性,且不具有传 播性。
慢病毒载体的生物安全性
在构建慢病毒载体时,应确保载体无外源污染,如细菌、真 菌、支原体等污染。同时,应进行逆转录酶活性检测,以确 保载体无逆转录酶活性,从而避免潜在的基因重组和插入突 变风险。
慢病毒载体的构建流程
01
02
03
04
目的基因的克隆
将目的基因克隆到慢病毒载体 中,常用的克隆方法包括限制
性酶切、连接和转化等。
慢病毒载体的包装
将目的基因与包装信号共同转 染包装细胞,包装细胞能够产 生具有感染力的慢病毒颗粒。
慢病毒的纯化
通过离心、过滤等方法将慢病 毒颗粒从包装细胞中分离出来
,并进行纯化。
生物学功能分析
对目的基因进行生物学功能分析, 如报告基因实验、细胞活性实验、 动物模型实验等,以评估慢病毒 载体对目的基因功能的改善效果。
安全性评估
对慢病毒载体进行安全性评估, 包括对宿主细胞的毒性、免疫反 应、致瘤性等方面进行检测,以 确保慢病毒载体的应用安全可靠。
05
慢病毒载体的安全性与伦理问题
慢病毒的滴度测定
测定纯化后慢病毒的滴度,即 每毫升或每毫克病毒颗粒的数
量。
02
慢病毒载体的设计
包装元件的选择
01
02
03
包装元件
选择合适的包装元件是构 建慢病毒载体的关键步骤, 包括病毒的复制酶、转录 酶和整合酶等。
安全性
确保所选的包装元件无致 病性,不会对宿主细胞造 成不良影响。
兼容性
确保所选的包装元件与载 体的其他元件兼容,能够 实现有效转导和表达。
慢病毒载体包装构建过程
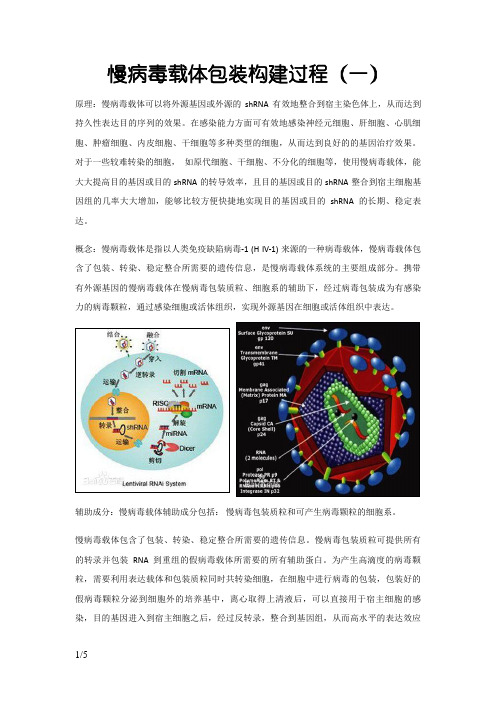
慢病毒载体包装构建过程(一)原理:慢病毒载体可以将外源基因或外源的shRNA有效地整合到宿主染色体上,从而达到持久性表达目的序列的效果。
在感染能力方面可有效地感染神经元细胞、肝细胞、心肌细胞、肿瘤细胞、内皮细胞、干细胞等多种类型的细胞,从而达到良好的的基因治疗效果。
对于一些较难转染的细胞,如原代细胞、干细胞、不分化的细胞等,使用慢病毒载体,能大大提高目的基因或目的shRNA的转导效率,且目的基因或目的shRNA整合到宿主细胞基因组的几率大大增加,能够比较方便快捷地实现目的基因或目的shRNA的长期、稳定表达。
概念:慢病毒载体是指以人类免疫缺陷病毒-1 (H IV-1) 来源的一种病毒载体,慢病毒载体包含了包装、转染、稳定整合所需要的遗传信息,是慢病毒载体系统的主要组成部分。
携带有外源基因的慢病毒载体在慢病毒包装质粒、细胞系的辅助下,经过病毒包装成为有感染力的病毒颗粒,通过感染细胞或活体组织,实现外源基因在细胞或活体组织中表达。
辅助成分:慢病毒载体辅助成分包括:慢病毒包装质粒和可产生病毒颗粒的细胞系。
慢病毒载体包含了包装、转染、稳定整合所需要的遗传信息。
慢病毒包装质粒可提供所有的转录并包装RNA 到重组的假病毒载体所需要的所有辅助蛋白。
为产生高滴度的病毒颗粒,需要利用表达载体和包装质粒同时共转染细胞,在细胞中进行病毒的包装,包装好的假病毒颗粒分泌到细胞外的培养基中,离心取得上清液后,可以直接用于宿主细胞的感染,目的基因进入到宿主细胞之后,经过反转录,整合到基因组,从而高水平的表达效应分子。
基本原理:慢病毒载体系统由两部分组成,即包装成分和载体成分。
包装成分:由HIV-1基因组去除了包装、逆转录和整合所需的顺式作用序列而构建,能够反式提供产生病毒颗粒所必需的蛋白。
包装成分通常被分开构建到两个质粒上,一个质粒表达Gag和Pol蛋白,另一个质粒表达Env蛋白,其目的也是降低恢复成野生型病毒的可能。
将包装成分与载体成分的3个质粒共转染细胞(如人肾293T细胞),即可在细胞上清中收获只有一次性感染能力而无复制能力的、携带目的基因的HIV-1载体颗粒。
USP22 ShRNA慢病毒载体的构建及鉴定

USP22 ShRNA慢病毒载体的构建及鉴定目的构建并鉴定USP22基因ShRNA慢病毒载体,为进一步研究USP22基因在鼻咽癌中的作用机制奠定基础。
方法针对USP22基因的编码序列设计并合成2条特异性干扰序列,序列两端含有限制性内切酶位点HpaⅠ和XhoⅠ。
寡核苷酸链退火生成寡核苷酸双链,5′端磷酸化后将含有酶切位点的寡核苷酸双链克隆到pLL3.7慢病毒表达载体。
连接产物经转化、培养,提取其质粒,提取出来的质粒经HpaⅠ和XhoⅠ酶切电泳鉴定,鉴定正确的质粒进行测序。
构建成功的慢病毒表达载体pLL-USP22-shRNA與包装载体质粒混匀共转染于293T细胞。
通过荧光显微镜下观察绿色荧光蛋白(GFP)情况,对病毒滴度和感染效率进行检测。
结果成功构建慢病毒表达载体pLL-USP22-shRNA。
与包装载体质粒共转染293T细胞后测定慢病毒滴度为4×107 TU/ml。
结论本实验应用相关技术成功构建USP22 ShRNA慢病毒载体,为进一步研究USP22基因的生物学功能奠定了基础。
标签:USP22;慢病毒载体;构建;鉴定肿瘤细胞中基因表达具有组织特异性,USP22泛素水解酶属去泛素化酶DUB基因家族成员,其普遍表达表明其功能的保守性,因此,USP22被归类为肿瘤干细胞的标记基因而引起高度关注[1]。
国内外学者研究发现,USP22基因过表达与结直肠癌[2]、肺癌[3]、胃癌[4]、食管癌[5]、乳腺癌[6]等恶性肿瘤的浸润、转移和预后差高度相关。
沉默USP22基因表达,能显著抑制膀胱癌[7]、结直肠癌[8]细胞增殖,由此推测USP22基因可能成为肿瘤治疗的一个新靶点。
本研究通过基因工程技术构建USP22 ShRNA慢病毒载体,为进一步研究USP22基因在人鼻咽癌细胞中的作用机制提供实验基础。
1 材料与方法1.1 实验材料、试剂及仪器pLL3.7慢病毒表达载体及包装载体质粒购自广州永诺生物科技有限公司。
慢病毒载体构建 Protocol

慢病毒载体构建是一种用于基因治疗和基因转导的重要工具,其用于将外源基因或shRNA等插入到慢病毒载体中,从而实现对特定基因的表达调控。
下面是慢病毒载体构建所需试剂和耗材、实验仪器、准备工作、实验方法、注意事项、常见问题及解决方法。
一、所需试剂和耗材1.慢病毒载体:用于包装目的基因的包装细胞系,如HepG2.2.15等。
2.目的基因或shRNA:需要插入慢病毒载体的DNA或RNA片段。
3.质粒DNA:用于构建慢病毒载体,包括表达盒质粒和包装质粒等。
4.DNA聚合酶:用于DNA扩增和连接。
5.限制性内切酶:用于DNA切割。
6.DNA连接酶:用于DNA连接。
7.缓冲液:维持反应液的pH值和其他辅助因子的浓度。
8.dNTPs(脱氧核糖核苷三磷酸):DNA合成的原材料,包括dATP、dTTP、dCTP、dGTP。
9.细胞培养基:用于细胞培养。
10.胎牛血清:提供细胞生长所需的营养物质。
11.抗生素:用于防止细胞污染。
12.其他细胞生物学试剂:如胰蛋白酶、无血清培养基等。
二、实验仪器1.实验室搅拌器:用于混合和振荡反应液。
2.离心机:用于离心管和细胞培养瓶等。
3.水浴锅:用于保温反应液。
4.移液器:用于精确添加试剂和溶液。
5.细胞培养箱:用于细胞培养。
6.倒置显微镜:观察细胞生长状态和感染情况。
7.紫外线分光光度计:用于测量DNA浓度。
8.电泳仪和电泳槽:用于分析DNA样品。
9.定量PCR仪:用于定量分析目的基因的转导效率。
三、准备工作1.了解慢病毒载体构建的基本原理和步骤。
2.设计并合成目的基因或shRNA序列,并确认其正确性。
3.准备所有所需的试剂和耗材,并确保它们处于保质期内。
4.检查实验室内是否具备上述实验仪器,并确保其正常运行。
5.准备好实验服、口罩、手套等个人防护用品。
6.用70%乙醇擦拭实验台面,以确保无菌环境。
7.用高压蒸汽灭菌法灭菌所有的实验器具,包括离心管、移液器等。
8.设置细胞培养箱的温度和湿度等参数。
慢病毒载体构建原理

慢病毒载体构建原理慢病毒是一类能够长期潜伏在宿主细胞内,并且在细胞分裂时能够传递给子细胞的病毒。
慢病毒的研究和应用在基因治疗、基因工程和细胞治疗等领域具有重要意义。
慢病毒载体构建是慢病毒研究的关键环节,下面将介绍慢病毒载体构建的原理。
首先,慢病毒载体构建的关键是选择合适的病毒骨架。
常用的慢病毒载体包括HIV-1、HIV-2和SIV等。
这些病毒骨架具有较高的转导效率和稳定性,能够有效地将外源基因导入宿主细胞中。
在选择病毒骨架时,需要考虑到载体的稳定性、毒性和转导效率等因素,以确保慢病毒载体能够在宿主细胞中稳定表达外源基因。
其次,慢病毒载体构建需要将外源基因整合到病毒基因组中。
一般来说,外源基因会被整合到病毒的长末端重复序列(LTR)之间,这样可以确保外源基因能够稳定地表达。
在整合外源基因时,需要使用逆转录酶将外源基因的RNA转录成DNA,并将其整合到病毒基因组中。
整合外源基因的位置和数量会影响慢病毒载体的稳定性和表达水平,因此需要对整合位点和整合数量进行精确控制。
另外,慢病毒载体构建还需要考虑到病毒的包装限制。
在病毒的生命周期中,病毒颗粒的组装和包装需要依赖于病毒的包装信号。
因此,在构建慢病毒载体时,需要确保外源基因的整合不会影响到病毒的包装信号,否则会影响病毒的组装和包装,从而降低病毒的转导效率和稳定性。
最后,慢病毒载体构建还需要考虑到病毒的安全性和稳定性。
在构建慢病毒载体时,需要对病毒的毒性进行改造,以降低其对宿主细胞的损害。
同时,还需要对病毒的复制和传播进行限制,以确保慢病毒载体在宿主细胞中稳定表达外源基因,同时不会对宿主细胞造成不良影响。
综上所述,慢病毒载体构建是慢病毒研究和应用的重要环节。
通过选择合适的病毒骨架、整合外源基因、考虑病毒的包装限制和确保病毒的安全性和稳定性,可以构建出稳定、高效的慢病毒载体,为基因治疗、基因工程和细胞治疗等领域的研究和应用提供重要支持。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
pWXLd : psPAX2 : pMD2G =20:15:6
三 .滴度测定:稀释计数法 滴度单位:TU/ml,指每毫升中含有的具有生物活性的病毒颗粒 数。”TU”为”transducing units”的缩写,中文为“转导单位”,表
示可以感染并进入到靶细胞中的病毒基因组数。
第一天 细胞准备
将生长状态良好的293T细胞消化计数后稀释至1×105/ml,加入96孔 板,100µl/孔,为每个病毒准备10个孔。放入37℃,5%CO2培养箱
重组酶(Gateway® LR Clonase™ II) 293FT细胞(<16代) 293FT细胞的培养基及其添加成分(Non-Essential Amino Acids,L-Glutamine,pyeuvate solution and G418) 制备感受态用的试剂
我们用的慢病毒载体的2个包装载体
第三天 追加培养液
在每个孔再加入100µl完全培养液,利于细胞的生长。 第五天 观察结果并计算滴度
在荧光显微镜下观察结果,并数出最后两个有荧光的荧光细胞克隆数。 假设为X和Y,则滴度(TU/ml)=(X+Y×10)×1000/2/X孔的病毒
Cytoskeletal anchoring of GLAST determines susceptibility to brain
damage: an identified role for GFAP.
(J Biol Chem,
2007, Oct.)
慢病毒载体介导人IL-12基因修饰树突状细胞体外抗肺癌作用的研究 (邸军,吉林大学博士学位论文,2009年5月)
shRNA : psPAX2 : pMD2G = 20:15:5
Duox1 is the main source of hydrogen peroxide in the rat thyroid cell line
PCCl3
(Exp Cell Res.,2007, Nov. 1 )
人白细胞介素10基因慢病毒载体的构建及重组 (中国普通外科杂志,2008年8月)
必需区,包装成重组病毒颗粒。为了增加病毒载体插入外源DNA的容 量,除了可以删除病毒的非必需基因外,还可以进一步删去部分或全 部必需基因,这些必需基因的功能由辅助病毒或包装细胞系反式提供。
病毒载体的包装系统,即将外源基因包装到病毒颗粒中,需要: 宿主细胞 病毒复制和包装所必须的顺式作用元件和外源基因的表达盒 辅助元件,即病毒复制和包装所必需的所有反式作用元件(辅助质粒、 辅助病毒、包装细胞系等)
慢病毒载体的构建
背景知识
病毒载体
是一种常使用于分子生物学的工具,可将遗传物质带入细胞,原理 是利用病毒具有传送其基因组进入其他细胞,进行感染的分子机制。可 发生于完整活体(in vivo)或是细胞培养(in vitro)中。可应用于基础研 究、基因疗法或疫苗。
基因载体系统
病毒载体系统
非病毒载体系统
我们用的慢病毒载体表达系统的转移载体
一、空载质粒的验证
包装载体及表达载体质粒的验证
M
MM
A
B
图1 用500ng的pMD2.G、psPAX2、pWPXLd质粒转化Stb13的感受态 菌种,培养后进行小提(图A)并酶切验证(图B)
二、慢病毒载体的包装
病毒包装的实验流程(以6孔板为例)
第一天:293FT铺板(无抗生素;第二天细胞密度达到80%~90%) 第二天:脂质体转染(转移载体+psPAX2+ pMD2.G)
背景知识
病毒载体的纯化: 病毒可以看作是一个具有特定结构的生物大分子。病毒的结构复杂,
纯化时不能采用蛋白质变性和复性的方法,因为一旦病毒蛋白发生变性, 或病毒结构发生破坏,在体外就很难再重建成有感染性的病毒颗粒。因 此,在病毒的纯化过程中必须保持病毒的结构不受破坏,并且监测其感 染活性。
初始物的收集或制备:培养上清和细胞裂解液都可作为纯化的初始物 初始物的浓缩:可选用盐析、超滤、透析等方法进行浓缩。 目标病毒的分离纯化 :氯化铯密度梯度离心法,柱层析法(亲和层析法)
DNA/RNA DNADNADNA-
DN A
反腺腺单慢
转病伴纯病
录 病 毒 载
毒 载 体
随 病 毒 载
疱 疹 病 毒
毒 载 体
体
体载
体
细胞内包装
裸
阳
蛋白
阳
离
质
离
子
复
脂
合
质
物
复
子 多 聚 物
嵌 合 物
合 物
细胞外包装
背景知识
病毒载体产生的原理: 最简单的做法是,将适当长度的外源DNA插入病毒基因组的非
中培养。
第二天 加病毒
在EP管中做10倍梯度稀释,连续10个稀释度。稀释方法如下:每种 病毒准备10个1.5ml EP管,每管加入90µl培养液,往第一个管中加入 10µl病毒原液,混匀后,吸取10µl加入第二个管混匀。依此类推,做
十个稀释度(10~10-8)。 吸取96孔板中原有的培养基,加入含稀释好的病毒液。并做好标记。
6-10h换液后开始计时 第三天:转染24h后,转染效率应达到70%以上 第四天:48h收获含病毒的上清,0.45um滤膜过滤,同时向6孔板中加
入2ml完全培养基;1份病毒液+2份完全培养基感染目的细胞 第五天:72h再次收获病毒上清,再次感染目的细胞 第六天:一般感染48h后可见荧光
包装质粒的其他参考比例
背景知识
病毒载体的要求: 1、携带外源基因并能包装成感染性病毒颗粒 2、介导外源基因转移和表达 3、对机体不致病
类型: 1、重组型病毒载体(可复制型;复制缺陷型) 2、无病毒基因的病毒载体(复制缺陷型)
组成: 1、病毒复制和包装元件 2、病毒基因 3、插入的外源基因或元件 4、病毒外壳/外膜
容量: 自身基因组大小的105%~110%
我们现在正在做的病毒载体是复制缺陷型的慢病毒载体(Lentiviral vector),分表达系统和干涉系统 实验基本流程:
构建含有目的基因的转移载体
与2个病毒包装载体共转染293FT细胞
进行病毒的纯化、滴度测定
侵染目的细胞,表达或干涉目的基因
材料:
包装载体:pMD2.G、psPAX2的质粒 表达系统:pWPXLd的质粒 干涉系统:pEN-hH1c、pDSL-hpUGIP的菌种 制备感受态用的Top10、Stb13的菌种
