高二化学期中考试复习提纲
普通高中学业水平测试(化学复习提纲)

普通高中学业水平测试(化学复习提纲)普通高中学业水平测试(化学复习提纲)本文档旨在为普通高中学业水平测试(化学)的复习提供一份详细的提纲。
我们建议学生在复习时按照以下提纲进行,以保证复习的全面性和系统性。
一、化学基本概念1.1 物质的组成与分类- 元素的定义及表示方法- 原子、离子、分子、原子团的定义及性质- 纯净物与混合物的区别- 分散系的分类及特点1.2 化学反应- 化学反应的基本类型(化合、分解、置换、复分解)- 化学反应的条件及影响因素- 化学平衡的定义及原理- 可逆反应的特点1.3 物质的量- 物质的量的定义及单位(摩尔)- 物质的量的计算(物质的量浓度、质量分数等)- 物质的量在化学反应中的应用二、化学实验2.1 实验基本操作- 仪器的识别及使用方法- 常见玻璃仪器的洗涤与干燥- 实验基本操作(称量、溶解、过滤、蒸发、蒸馏、萃取等)- 实验安全及事故处理2.2 气体的制备与检验- 气体的制备方法及实验操作- 气体的收集与净化- 气体的检验方法及现象判断2.3 物质的鉴定与分析- 常见离子的鉴定方法及现象- 常见物质的成分分析及鉴别- 光谱分析、色谱分析等现代分析方法简介三、无机化学3.1 常见元素与化合物- 氧、氢、碳、氮、硫、磷等常见元素的单质及化合物- 金属元素(碱金属、碱土金属、过渡金属等)的性质及应用- 非金属元素(卤素、氧族、氮族等)的性质及应用3.2 化学键与晶体结构- 离子键、共价键、金属键的定义及特点- 晶体结构的类型及特点- 金属晶体的电子排布与性质关系四、有机化学4.1 有机化合物的结构与性质- 烷烃、烯烃、炔烃、芳香烃的结构与性质- 醇、酚、醚、酸、酯、胺等有机化合物的结构与性质- 生物大分子(蛋白质、核酸、多糖等)的结构与功能4.2 有机反应- 加成反应、消除反应、取代反应、氧化反应等有机反应类型- 有机反应的条件及影响因素- 有机合成路线的设计与评价五、化学与生活5.1 生活中的化学现象- 饮食中的化学成分及作用- 洗涤剂、化肥、农药的化学原理及作用- 能源转换过程中的化学反应5.2 化学与环境- 环境污染的类型及危害- 环境保护的化学途径及实例- 可持续发展与化学的关系六、选修内容6.1 现代化学技术- 电化学、光谱学、色谱学等现代化学分析方法- 纳米技术、材料科学等化学在前沿领域的应用6.2 化学史- 化学发展史概述- 著名化学家及其主要贡献- 化学与社会发展的关系以上为普通高中学业水平测试(化学)的复习提纲。
高二化学第五章烃复习提纲
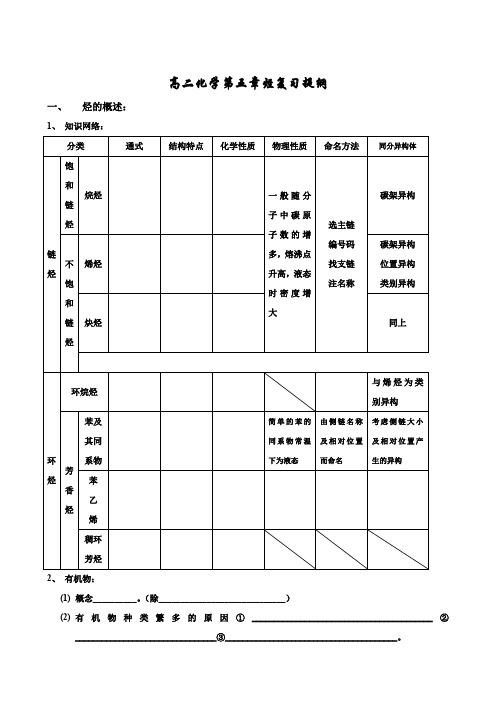
高二化学第五章烃复习提纲一、烃的概述:1、知识网络:2、有机物:(1)概念__________。
(除_____________________________)(2)有机物种类繁多的原因①_________________________________________②________________________________③_______________________________________。
(3) 特点:①________________ ②___________________________③____________________④______________________⑤______________________________3、 同系物、同分异构体、同素异形体和同位素 (1)比较(2) 同系物的判别:例1、下列各组物质中,肯定是同系物的是C C 2H 2和C 4H 6D 2-甲基丁烷与2,2-二甲基丙烷 练习、有下列各组物质:A O 2和O 3(臭氧)B 12C 和13C CD 甲烷和戊烷E FG 环丙烷和丁烷H 对二甲苯和苯(1)________组两物质互为同位素 (2)________组两物质互为同素异形体 (3)________组两物质属于同系物 (4)______组两物质互为同分异构体 (5)________ 组中的物质是同一物质。
(3)同分异构体的写法:① 写碳链:原则(主链由长到短,支链由整到散,位置由心到边,连接不能到端,大于不操作。
) ② 变位置(变换不饱和键或取代基的位置---不能超过碳的四键)若是环状结构,先考虑对称,然后由邻、间再到对。
③ 判断类别(类别异构)例2、写出C 6H 14、C 6H 13Cl 、C 6H 12、C 6H 10、C 8H 10、C 8H 9Cl 的同分异构体的结构简式并命名。
例3、若某烃与氢气完全加成反应生成2,2,3- 三甲基戊烷,则该烃可能是___________________ ____________________________________________________________________。
普通高中学业水平测试(化学复习提纲)

普通高中学业水平测试(化学复习提纲)
第一章:物质的组成与结构
- 原子的基本结构、质子、中子和电子的基本概念
- 原子序数、质量数、同位素的概念
- 原子的电子层次结构、元素周期律和元素周期表
- 分子的组成、化学键的基本概念、离子化合物与共价化合物的区别
- 化学方程式及其表示法
第二章:化学反应与能量
- 五大反应类型的概念及其化学方程式的写法
- 化学反应的化学计量关系初步、化学计量计算与限制性因素原理、摩尔概念
- 酸碱中和反应和氧化还原反应的基本概念
- 化学反应的能量变化(焓变)及热效应的计算
第三章:化学元素及其化合物
- 氢、氧、碳、氮、硫、铁、铜等元素的性质、化学结构、用途及其在生活、工业、农业、医学等领域应用
- 化学元素和化合物的检验方法及其原理
- 盐类、氧化物、酸、碱的基本性质及应用
第四章:化学实验、化学计算与化学常识
- 实验室通用器皿、仪器及其用途和操作规范
- 实验室安全注意事项
- 化学计算的应用和实际意义
- 化学现象在工农业、生活中的应用及与人体健康和生态环境之间的关系
以上是本文化学复习提纲的主要内容,希望能为大家的学习提供一定的指导和帮助。
《高二化学期中考试复习》PPT课件

分析电解反应的一般思路:
明确溶液中存在哪些离子、电极 阴阳两极附近有哪些离子
根据放电顺序分析,书写电极式得出产物 根据电极方程式相加得总反应式
电解规律(惰性电极)小结
Ⅰ
Ⅱ
阳极:S2- > I- > Br- > Cl- > OH- > 含氧酸根 > F-
阴极:Ag+>Fe3+>Cu2+>H+>Fe2+>Zn2+>Al3+>Mg2+>Na+
沉降
Na+、 Cl-、 .Mg2+、
Mg2+、 Ca2+、 Fe3+ 、 SO42-
除泥沙
Ca2+、 Fe3+ 、 SO42-
略过量 BaCl2 溶液
除SO42-
、 Na+、 Cl-、 Ca2+
略过量NaOH 溶液
、 , Ba2+ 引入OH- 除Fe3+ Mg2+
Na+、 Cl-、 Mg2+、 Ca2+、 Fe3+ 、引入Ba2+
随堂练习
1、如图所示: 通电后A极上析出Ag (1) 判断电源以及甲、乙、 丙三池中的电极名称, 并分别书写电极反应式
湿润酚酞试纸
(2)对该装置的有关叙述正确的是 A. P是电源的正极
B
B. F极上发生的反应为:4OH- - 4e-=2H2O+O2↑ C.电解时,甲、乙、丙三池中,除E、F两极外,其余电
C.阴极产物为NaOH和H2 D.电解槽的阳极用铁网制成
二、铜的电解精炼
普通高中学业水平测试(化学复习提纲)

普通高中学业水平测试(化学复习提纲)
一、化学基础知识回顾
- 元素、化合物和混合物的概念及特点
- 原子结构和元素周期表
- 化学键的种类和特点
二、化学反应与能量变化
- 化学反应的基本概念和特征
- 反应物、生成物和化学方程式
- 反应速率和化学平衡
- 能量变化与化学反应的关系
三、化学式与化学计算
- 化学式的表示和命名规则
- 化学计算中的基本概念和方法
- 摩尔质量和摩尔计算
- 溶液浓度的计算
四、化学元素及其化合物
- 常见元素的特性和应用
- 酸、碱和盐的性质及应用
- 金属与非金属元素的特点和反应
- 有机化合物的基本概念和分类
五、化学实验与实验技能
- 常见实验室仪器的使用和操作技巧
- 常见化学实验的步骤和安全注意事项
- 数据处理和实验结果的分析
六、环境保护与可持续发展
- 环境污染的种类和影响
- 节约能源和资源的重要性
- 可持续发展的概念和措施
- 化学在环境保护中的应用
以上是普通高中学业水平测试化学复习的提纲,希望能够帮助你复习化学知识。
记住要理解概念,掌握基本原理,并多做相关练习和实验,加深对化学的理解和应用能力。
祝你成功!。
高二化学选修2复习提纲三篇

高二化学选修2复习提纲三篇每天进步一点,就是要持之以恒。
与从事其他所有的事一样,学习绝不能三天打鱼两天晒网,更不能半途而废。
下面是本文库为您推荐高二化学选修2复习提纲三篇。
高二化学选修2复习提纲11.了解有机合成对人类生活的重要意义,了解阿司匹林、洗涤剂等的合成过程及其相应的反应类型;了解纤维素和橡胶的加工工艺及结构特点。
(1)以氯苯为原料合成阿司匹林有机物制备的一般过程:①通过结构分析确定有机物的分子结构;②依据分子结构研究化学合成路线;③探索每一个中间物的生成条件,以求用最经济的手段制备出产物。
(2)十二烷基苯磺酸钠的合成洗衣粉的主要成份之一是烷基苯磺酸钠,常用的有十二烷基苯磺酸钠,其合成路线如下:+Cl2+C6H6C12H26C12H25ClC12H25C12H25SO3Na+浓硫酸C12H252SO3H+NaOH2 表面活性剂的结构特点:由亲水基团和疏水基团两部分构成。
(3)纤维素:①植物纤维由纤维素和木质素(一种含苯环的芳香族化合物,非纤维素)构成。
植物纤维在一定的压强与亚硫酸钠作用下,木质素溶解。
纤维素制成纸浆;木质素加入适量固化剂后喷洒在沙丘表面有固沙保水的功能,且易降解。
②纤维素酯的制造:纤维素高分子长链由许多葡萄糖单元构成,每个葡萄糖单元中含有3个羟基,能与硝酸或醋酸酐发生酯化反应,生成纤维素硝酸酯或纤维醋酸酯。
了解硝酸纤维(火棉、胶棉)、醋酸纤维、粘胶纤维(人造丝、人造棉)、铜氨纤维的制造和简单用途。
(4)天然橡胶与合成橡胶:天然橡胶是由许多蜷曲的线型高分子(聚异戊二烯分子)组成的,二烯烃的性质与乙烯相似,异戊二烯分子加聚时能发生1、4加聚。
高二化学选修2复习提纲2(一)化学与资源开发利用1.了解化学在水处理中的应用。
(1)天然水中所含的杂质及其处理方法。
含有的杂质主要有悬浮物质、胶体物质和可溶物质等。
饮用水(自来水)的处理工序:原水→ 过滤→ 吸附→ 杀菌。
常见的混凝剂:铝盐和铁盐等,其净水原理:铝离子或铁离子水解生成胶体的净水功能。
高二上化学期中知识点总结
高二上化学期中知识点总结在高二上学期的化学学习中,我们接触了许多重要的知识点。
下面我将对这些知识点进行总结,以帮助大家更好地复习和掌握。
一、化学元素与元素周期表1. 元素的概念:物质中由相同原子核电荷数目的原子组成的种类2. 元素符号:化学元素用拉丁字母缩写表示3. 元素周期表:按照元素的原子序数排列,反映元素性质的周期性变化规律4. 族:周期表中纵列的元素具有相似的性质,称为同一族元素5. 周期:周期表中横行的元素称为一周期,周期内原子数逐渐增加,性质逐渐变化二、化学反应与化学方程式1. 化学反应的定义:物质的转化过程,在反应过程中,原子重新组合2. 反应物与生成物:反应开始时存在的物质称为反应物,反应结束后产生的物质称为生成物3. 化学方程式的表示:用符号和化学式表示化学反应的过程和化学物质的变化4. 化学方程式的平衡:保持反应物和生成物的摩尔比例不变(示例:2H2 + O2 → 2H2O)三、化学键与化合物1. 化学键的概念:化学元素之间相互结合的力,将原子聚集成分子或离子2. 离子键:金属与非金属之间的化学键3. 共价键:非金属元素之间的化学键4. 化合物:由两个或两个以上不同元素组成的物质四、化学平衡与化学反应速率1. 化学平衡的条件:反应物和生成物浓度达到一定比例2. 平衡常数:用于描述化学平衡的特性,在特定温度下不变(示例:aA + bB ⇌ cC + dD,平衡常数为K=[C]^c[D]^d/[A]^a[B]^b)3. 化学反应速率:描述单位时间内反应的进程4. 影响反应速率的因素:温度、浓度、触媒等五、离子与溶液1. 电离与离子:物质在水中溶解时,将分子分解成带电的离子2. 强电解质与弱电解质:能够完全电离的称为强电解质,不能完全电离的称为弱电解质3. 酸碱指示剂:根据溶液的酸碱性质发生颜色变化的物质六、氧化还原反应1. 氧化与还原:一个物质失去电子称为氧化,一个物质获得电子称为还原2. 氧化剂与还原剂:氧化剂能使其他物质氧化,而还原剂能使其他物质还原3. 氧化还原反应的特征:变化物质的氧化态和还原态,同时伴随电子的转移综上所述,以上是高二上学期化学知识点的总结。
高二化学《有机化学实验期中复习》文库.docx
《有机化学实验期中复习》内容:1.有机物分离提纯的方法;2.常见有机物的制备;3.重要的有机化学实验;4.有机物的鉴定。
一.有机物的分离提纯常用方法:____________ 、____________ 、 _____________ 、____________ oI .洗气法:用于除去气体中的某些杂质气体,洗涤剂必须只能吸收杂质气体。
练习1.实验室制取的乙烘屮常混有H2S,乙烯中常混有SO?等,为了提纯乙烘和乙烯,通常可将其通入盛有 _________________ 的洗气瓶以除去H2S, S02o练习2.要除去甲烷中的乙烯或乙烘,可将其通入盛有_____________ 的洗气瓶。
II・(洗涤)分液法:用于除去某些液体小的杂质(分液前要加入某种试剂使Z分层)。
练习3.除去乙酸乙酯中的乙酸可用 ___________________________ 洗涤后再分液。
练习4・苯中少量的甲苯或二甲苯等均可用__________________________ 洗涤后再分液来除公。
练习5.苯中少量的苯酚、溟苯中溶冇的少量漠均可用___________________ 洗涤后再分液來除去。
皿・蒸傳法:用于互溶的两种液体的提纯或分离,蒸馆前,有时需加入某种试剂使混合物中的一成分转化成难挥发的物质。
(沸点相差30°C以上)练习6.乙醇中的水,乙醇中的乙酸都可以在其中加入足量的______________ ,再将其蒸馆来除公。
练习7.乙醇屮少量的乙酸加入足量的 ___________ 溶液屮和后再蒸係出乙醇。
IV.重结晶:利用杂质和被提纯物在某溶剂中溶解度_____________ 的分离方法。
操作步骤: _____ 、________ 、________ O原则:溶剂的选择①杂质在此溶剂中的溶解度________________ ,容易除去②被捉纯物在此溶剂中的溶解度受温度的影响很__________ (“大”或“小”)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1
高二化学期中考试复习提纲
一、请写出下列化学反应方程式:
1. 氰酸铵转化为尿素: 2. 乙烯与溴水反应: 3. 乙烯与溴化氢反应: 4. 丙烯与溴水反应: 5. 丙烯与溴化氢反应: 6. 乙烯使酸性高锰酸钾褪色 7. 1,3-丁二烯与溴水1:1反应(两种情况): 8. 丙烯生成聚丙烯: 9. 异戊二烯(2-甲基-1,3-丁二烯)聚合生成橡胶: 10. 以乙炔为原料制备聚氯乙烯: 11. 由乙炔生成苯 12. 丁烷裂解 13. 苯与足量的氢气反应 14. 甲苯与足量的氢气反应
15. 以戊烷为原料经裂解生成乙烯:
16. 苯与液溴在催化剂(Fe)作用下反应:
17. 苯与混酸(浓硝酸、浓硫酸) 反应:
18. 甲苯使酸性高锰酸钾退色可以表示
19. 乙苯使酸性KMnO4溶液退色可以表示
为:
20. 甲苯与混酸(浓硝酸、浓硫酸)反应:
21. 以苯为原料制备乙苯:
22. 溴乙烷的消去反应:
23. 溴乙烷的水解反应:
24. 乙醇的催化氧化:
25. 2-丙醇的催化氧化
26. 乙醇与钠的反应:
27. 乙醇与铝的反应
2
28. 乙醇的消去反应: 29. 由乙醇生成乙酸乙酯的反应: 30. 乙醇与溴化氢反应: 31. 丙三醇与硝酸反应生成三硝酸甘油酯: 32. 甲醇燃料电池的电极反应方程式以及总反应方程式: 33. 乙二醇催化氧化反应: 34. 苯酚和钠反应: 35. 往苯酚钠溶液中通入少量二氧化碳气体: 36. 往苯酚钠溶液中通入过量二氧化碳气体: 37. 苯酚钠和盐酸反应: 38. 苯酚和溴水反应: 39. 银氨溶液的制备: 40. 乙醛和H2的加成反应: 41. 丙酮和H2的加成反应 42. 乙醛和银氨溶液反应: 43. 乙醛与新制Cu(OH)2反应:
44. 甲醛发生银镜反应:
45. 以甲醛为原料合成人造象牙
46. 以甲醛为原料合成三聚甲醛
47. 以乙醛为原料合成三聚乙醛
48. 以氰胺(H2N-CN)为原料合成三聚
氰胺
49. 以甲醛为原料制备酚醛树脂:
50. 乙二醛与足量银氨溶液反应
51. 乙二醛与足量新制氢氧化铜溶液反应
52. 对苯二甲酸与乙二醇发生缩聚反应:
53. 以乳酸为原料合成聚乳酸
54. 实验室制取乙炔的反应:
55. 氮化镁与水反应
56. 电石(碳化钙)与反应生成乙炔
57. 苯酚与强氧化钠溶液反应
1、下列通式可以代表那几类同分异构体
(1)CnH2n:(n≥3) 和 ;
(2)CnH2n-2:(n≥3) 和 ;
(3)CnH2n+2O:(n≥2) 和 ;
(4)CnH2nO:(n≥2) 、 和 ;(n≥3) ;
(5)CnH2nO2:(n≥2) 、
(6)CnH2n-6O:(n≥7) 、 和 。
2、写出符合下列分子式的同分异构体的结构简式
a、C5H10 b、C4H10O
c、C7H8O(芳香族化合物的同分异构体) d、苯丙烯(包括顺反异构)
e、C9H12(苯环的侧链上连有三个碳) f、C6H14(一氯代物有三种的结构简式)
3、分子里原子共线、共面问题:其实是分子的构型问题,掌握以下分子的构型:
CH4 形,CH≡CH 形,CH2=CH2 形, 形,饱和碳原子均为四面体形。
4、常见有机物的密度大小:密度大于水的与水分层,有机层在 层;密度小于水的与水分层,有机层在 层(填“上”、
“下”)。请选择填空:
A.硝基苯 B.溴苯 C.甲苯 D.乙苯 E.二甲苯 F.己烷 G.戊烯 H.苯 J.CCl4 I.酒精
与水分层且在上层的有 ;与水分层且在上层的有 ;与水混溶的是 。
常见液态烃的密度都比水 小。
5、关于萃取:溴水与苯混合,萃取后的结果:溴的苯溶液在 层,为 色;碘水与CCl4混合,萃取后的结果:碘
的CCl4溶液在 层,为 色。酒精通常 作萃取剂,因为 。
6、各类烃含碳(或含氢)质量分数的变化规律:烷、烯、炔三类烃中,含碳量为一定值的是 ,含碳量最高的
是 ,含碳量由高到低的顺序是 。烷烃中,随C原子数的增多,C% ;炔烃中,随C原
子数的增多,C% 。
7、烃的燃烧规律:燃烧通式
①等物质的量的烃CxHy完全燃烧时,耗氧量决定于 的值,此值越大,耗氧量越大;
②等质量的烃CxHy完全燃烧时,耗氧量决定于 的值,此值越大,耗氧量越大;
③具有相同最简式的烃,无论以何种比例混合,只要总质量一定,完全燃烧时生成CO2、H2O及耗氧量也一定。
④气态烃在温度>1000C时完全燃烧前后的气体总体积变化:据燃烧通式,
当y=4 △V=0 反应前后气体体积
当y>4 △V=y/4-1 反应前后气体体积
当y<4 △V=1-y/4 反应前后气体体积
8、根据燃烧反应求烃的化学式
单一烃:可由CxHy~O2~CO2~H2O及总量关系,求出x、y。
混合烃组成确定
① 设分子平均组成为CxHy,根据(1)的方法求出x、y
② 列出可能组合(平均值法)
③求出烃的物质的量之比(十字交叉法)
例、某混合气体由两种气态烃组成。取22.4L该混合气体完全燃烧后,得到44.8LCO2(均在标况)和36g H2O,则这两种气
态烃是
A.C2H2、C3H8 B.C2H2、C2H6 C.C2H4、C2H6 D.CH4、C3H4
9、消去反应: 、 能发生消去反应。醇发生消去反应的条件是: ,具有什
么结构特点的醇才能发生硝去反应: 。
10、催化氧化:醇发生催化氧化的反应条件是: ,反应产物与醇的结构有何内在
联系:
11、苯酚:纯净的苯酚是 的晶体,实验室里的苯酚常呈 色,其原因是: 苯酚
为何具有弱酸性:
苯酚与溴反应的条件是: ,产物是: 其反应类型是
苯中混有的少量苯酚为何不能用溴水除去: ,
如何检验苯酚:
12、苯、甲苯、四氯化碳、已烷、苯酚、乙醛等,能否使溴水褪色,其原理是:
13、乙醛:如何制取银氨溶液: ,写出有关反应的离子方程式:
写出乙醛与银氨溶液反应的化学方程式和离子方程式:
14、乙酸:实验室如何制取乙酸乙酯:
在实验中浓硫酸的作用是: ,饱和碳酸氢钠溶液的作用是:
