最新版药典中的对照品汇总
《中国药典》2020版—辛酸钠国家药用辅料标准

附件:辛酸钠XinsuannaSodium CaprylateC8H15NaO2166.20 本品按无水物计算,含C8H 15NaO2应不得少于99.0%。
【性状】本品为白色或类白色结晶性粉末。
本品在水或冰醋酸中易溶,在乙醇中略溶,在丙酮中几乎不溶。
【鉴别】(1)取本品约20mg,加水0.5ml 溶解后,加甲氧基苯乙酸试液(取甲氧基苯乙酸2.7g,加10%氢氧化四甲铵的甲醇溶液6ml 溶解后,加乙醇20ml,摇匀,贮存于聚乙烯容器中)1.5ml,于冰浴中冷却30 分钟,生成大量白色结晶性沉淀;置20℃的水浴中,搅拌5 分钟,沉淀不消失;加氨试液1ml, 沉淀完全溶解;再加16%碳酸铵溶液1ml ,没有沉淀生成。
(2)在有关物质项下记录的色谱图中,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致。
【检査】碱度取本品2.5g,加水25ml 溶解后,依法测定(通则0631),pH 值应为8.0~10. 5。
溶液的澄清度与颜色取本品2.5g,加水25ml 溶解后,依法检查(通则0901 与通则0902),溶液应澄清无色。
如显色,与橙黄色1 号标准比色液(通则0901 第一法)比较,不得更深。
水分取本品,照水分测定法(通则0832 第一法)测定,含水分不得过3.0% 。
重金属取本品2.0g,加冰醋酸-水-乙醇(5:10:85)25ml 溶解后,作为供试品溶液。
依法检查(通则0821 第一法),含重金属不得过百万分之五。
有关物质取本品约0.12g,加水5ml 溶解后,加稀硫酸1ml,摇匀,加乙酸乙酯10ml,振摇提取后,静置使分层,取乙酸乙酯层,加无水硫酸钠干燥后,取上清液作为供试品溶液;精密量取1ml,置100ml 量瓶中,用乙酸乙酯稀释至刻度,摇匀,精密量取5ml,置50ml 量瓶中,用乙酸乙酯稀释至刻度,摇匀,作为对照溶液。
另取辛酸对照品约10mg,加乙酸乙酯10ml 使溶解,作为对照品溶液。
2020版药典四部凡例

一、《中华人民共和国药典》简称《中国药典》,依据《中华人民共和国药品管理法》组织制沱和颁布实施。
《中国药典》一经颁布实施,英所载同品种或相关内容的上版药典标准或原国家药品标准即停止使用。
《中国药典》由一部、二部、三部.四部及其增补本组成。
一部收载中药,二部收载化学药品,三部收载生物制品及相关通用技术要求,四部收载通用技术要求和药用辅料。
除特別注明版次外,《中国药典》均指现行版。
本部为《中国药典》四部。
二、《中国药典》主要由凡例、通用技术要求和品种正文构成。
凡例是为正确使用《中国药典》.对品种正文、通用技术要求以及药品质量检验和检泄中有关共性问题的统一规定和基本要求。
通用技术要求包括《中国药典》收载的通则、指导原则以及生物制品通则和相关总论等。
《中国药典》各品种项下收载的内容为品种正文。
三、药品标准由品种正文及其引用的凡例、通用技术要求共同构成。
本版药典收载的凡例、通则/生物制品通则.总论的要求对未载入本版药典的其他药品标准具同等效力。
四、凡例和通用技术要求中釆用“除另有规立外”这一用语,表示存在与凡例或通用技术要求有关规泄不一致的情况时,则在品种正文中另作规窪,并据此执行。
五、品种正文所设各项规左是针对符合《药品生产质量管理规范》(Good Manufacturing Practices, GMP)的产品而言。
任何违反GMP或有未经批准添加物质所生产的药品,即使符合《中国药典》或按照《中国药典》未检出其添加物质或相关杂质,亦不能认为其符合规泄。
六、《中国药典》的英文需称为Pharmacopoeia of the People's Republic of China;英文简称为Chinese Pharmacopoeia:英文缩写为ChPo通用技术要求七、通则主要包括制剂通则、其他通则、通用检测方法。
制剂通则系为按照药物剂型分类, 针对剂型特点所规左的基本技术要求。
通用检测方法系为各品种进行相同项目检验时所应采用的统一规定的设备.程序、方法及限度等。
《中国药典》2020版—卡波姆均聚物国家药用辅料标准

附件:卡波姆均聚物(曾用名:卡波姆)Kabomu JunjuwuCarbomer Homopolymer本品系以非苯溶剂为聚合溶剂的丙烯酸键合多元醇烯丙基醚的高分子聚合物。
按干燥品计,含羧酸基(-COOH)应为56.0%~68.0%。
乙酸乙酯与环己烷(生产工艺中使用时测定)置顶空瓶中,精密加人二甲基亚砜5ml,密封,作为供试品溶液;分别取乙酸乙酯和环己烷适量,精密称定,用二甲基亚砜定量稀释成每1ml 中含乙酸乙酯0.2mg 和环己烷0.12mg 的混合溶液,精密量取5ml ,置顶空瓶中,密封,作为对照品溶液。
照残留溶剂测定法(通则0861 第二法)测定,用100%二甲基聚硅氧烷为固定液(或极性相近的固定液)的毛细管柱,程序升温,起始温度为40℃,维持3 分钟,以每分钟5℃的速率升温至120℃,维持20 分钟,再以每分钟20 ℃的速率升温至220℃,维持3 分钟,再以每分钟20℃的速率升温至240℃,维持8 分钟;进样口温度260℃,检测器温度260℃;顶空瓶平衡温度为85°C ,平衡时间为90 分钟。
取对照品溶液与供试品溶液分别顶空进样。
按外标法以峰面积计算,含乙酸乙酯不得过0.5% ,环己烷不得过0.3%。
苯取苯适量,精密称定,用二甲基亚砜定量稀释制成每1ml 中含苯1.0mg 的溶液。
精密量取该溶液适量,加水定量稀释制成每1ml 中含苯0.5μg 的溶液,作为苯储备液。
取本品约炽灼残渣取本品1.0g,依法检查(通则0841),遗留残渣不得过2.0%。
重金属取炽灼残渣项下遗留的残渣,依法检查(通则0821 第二法),含重金属不得过百万分之二十。
【含量测定】取本品约0.4g,精密称定,加水400ml,充分溶胀后加氯化钾2g,照电位滴定法(通则0701),用氢氧化钠滴定液(0.25mol/L)滴定。
每1ml 氢氧化钠滴定液(0.25mol/L)相当于11.25mg 的-COOH。
【类别】药用辅料,软膏基质和释放阻滞剂。
2020版药典中药材人工牛黄

(4)取本品50mg,加水5ml,超声处理5分钟,加甲醇至10ml,静置,取上清液作为供试品溶液。另取牛磺酸对照品,加甲醇制成每1ml含0. 5mg的溶液,作为对照品溶液。照薄层色谱法(通则0502)试验,吸取上述两种溶液各2μl,分别点于同一硅胶G薄层板上,以正丁醇-乙醇-冰醋酸-水(4∶1∶2∶1)为展开剂,展开,取出,晾干,在105℃加热10分钟,喷以1 %茚三酮乙醇溶液,在105℃加热至斑点显色清晰。供试品色谱中,在与对照品色谱相应的位置上,显相同颜色的斑点。
【检查】干燥失重 取本品约0.5g,在五氧化二磷60℃减压干燥4小时,减失重量不得过2.0%(通则0831)。
【含量测定】取本品约10mg,精密称定,用少量三氯甲烷研磨后转移至100ml棕色量瓶中,超声处理使溶解,取出,迅速放冷,再加三氯甲烷稀释至刻度,摇匀。精密量取5ml,置100ml棕色量瓶中,加三氯甲烷稀释至刻度,摇匀。照紫外-可见分光光度法(通则0401),在453nm的波长处测定吸光度,按胆红素的吸收系数()1038计算,即得。
12.本品按干燥品计算,含胆酸(C24H40O5)不得少于13.0%。
胆红素 对照品溶液的制备 取胆红素对照品10mg,精密称定,置100ml棕色量瓶中,加三氯甲烷80ml,超声处理使充分溶解,加三氯甲烷稀释至刻度,摇匀。精密量取10ml,置50ml棕色量瓶中,用三氯甲烷稀释至刻度,摇匀,即得(每1ml中含胆红素20μg)。
《中国药典》2020版—间甲酚国家药用辅料标准

附件:间甲酚JianjiafenMetacresolOHCH3本品为由合成法制得的3-甲基苯酚。
含C7H8O 应为98.0%~102.0%。
【性状】本品为无色或微黄色液体;有刺激性臭味。
本品在乙醇或二氯甲烷中易溶,在水中略溶。
C7H8O 108.14 [108-39-4]【鉴别】(1)在含量测定项下记录的色谱图中,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致。
(2)本品的红外光吸收图谱应与对照品的图谱一致(通则0402)。
【检查】酸度取本品1.5ml,置100ml 量瓶中,用水溶解并稀释至刻度,摇匀,作为供试品溶液;精密量取25ml,加甲基红指示液0.15ml,用氢氧化钠滴定液(0.01mol/L)滴定至溶液显黄色,消耗氢氧化钠滴定液(0.01mol/L)不得过0.50ml。
溶液的澄清度与颜色取酸度检查项下的供试品溶液,依法检查(通则0901),溶液应无色;如显浑浊,与3 号浊度标准液(通则0902 第一法)比较,不得更浓。
有关物质取本品适量,精密称定,用甲醇定量稀释制成每1ml 中约含10mg 的溶液,作为供试品溶液;精密量取适量,用甲醇定量稀释制成每1ml 中约含间甲酚5μg与50μg的溶液,摇匀,作为灵敏度测试溶液与自身对照溶液;另取甲苯适量,精密称定,用甲醇定量稀释制成每1ml 中约含甲苯8.9μg的对照品溶液。
照含量测定项下的色谱条件,取灵敏度测试溶液1µl ,注入气相色谱仪,记录色谱图,间甲酚峰信噪比应不小于10;精密量取对照品溶液、自身对照溶液与供试品溶液各1µl,注入气相色谱仪,记录色谱图,按外标法以峰面积计算,甲苯不得过0.089%;按自身对照法以间甲酚面积计算,邻甲酚与对甲酚均不得过0.5%,单个杂质不得过0.10%,总杂质不得过1.0%。
不挥发物取本品2.0g,置已恒重的蒸发皿中,于水浴上蒸干后,在105℃干燥1 小时,遗留残渣不得过2mg(0.1%)。
2015版药典中药材和对应对照品
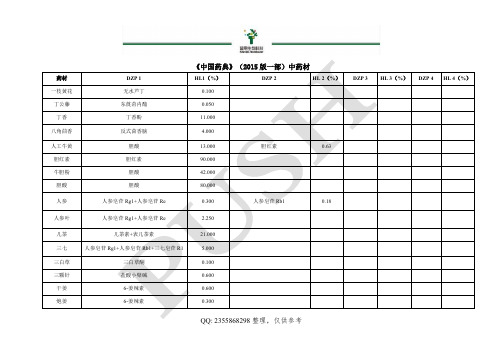
琥珀酸 甘草次酸 丁香酚 赖氨酸、亮氨酸、缬氨酸 地肤子皂苷 Ic
梓醇
0.080
异欧前胡素
0.020 0.050 0.600 0.080 0.250 0.150 0.450 1.500 0.250
绿原酸
16.000
6.000
0.100 0.080 0.150 1.000 3.000 0.200
桂皮酸 咖啡酸
QQ: 2355868298 整理,仅供参考
3,6'-二芥子酰
0.15
0.5
基蔗糖
0.25
两面针 连翘 吴茱萸 牡丹皮 体外培育牛黄
氯化两面针碱 连翘苷
吴茱萸碱+吴茱萸次碱 丹皮酚 胆酸
QQ: 2355868298 整理,仅供参考
土木香
土木香内酯+异土木香内酯
2.200
土贝母 土荆皮 土茯苓 大叶紫珠 大青叶 大枣
大黄
大蒜 大蓟
土贝母苷甲
1.000
土荆皮乙酸
0.250
落新妇苷
0.450
毛蕊花糖苷
0.150
靛玉红
0.020
齐墩果酸
白桦脂酸
芦荟大黄素+大黄酸+大黄素+大黄酚+大黄素
芦荟大黄素+大黄酸+大黄素+大黄 0.20(游离蒽
银杏内酯 C
黄柏酮
0.15
精氨酸、丙氨酸、缬氨酸、亮氨酸
0.650
1.800 0.200
毛蕊花糖苷
0.02
QQ: 2355868298 整理,仅供参考
二甲基亚砜CP2020版中国药典质量标准

二甲基亚砜ErjiajiyafengDimethyl SulfoxideC2H6OS 78.13 [67-68-5]本品可由二甲硫醚在氧化氮存在下通过空气氧化制得;也可以从制造纸浆的副产物中制得。
本品按无水物计算,应不得少于99.5%。
【性状】本品为无色液体。
本品与水、乙醇或乙醚能任意混溶,在烷烃中不溶。
折光率本品的折光率(通则0622)为1.478~1.480。
相对密度本品的相对密度(通则0601)为1.095-1.105。
【鉴别】(1)取本品5ml,置试管中,加氯化镍50mg,振摇使溶解,溶液呈黄绿色,置50℃水浴中加热,溶液呈绿色或蓝绿色,放冷,溶液呈黄绿色。
(2)本品的红外光吸收图谱应与对照品的图谱一致(通则0402)。
【检查】酸度取本品50.0g,加水100ml溶解后,加酚酞指示液0.1ml,用氢氧化钠滴定液(0.01mol/L)滴定至溶液显粉红色,消耗氢氧化钠滴定液(0.01mol/L)的体积不得过5.0ml。
吸光度取本品适量,通入干燥氮气15分钟,以水为空白,照紫外-可见分光光度法(通则0401),立即测定,在275nm波长处的吸光度不得大于0.30;在285nm与295nm波长处的吸光度不得大于0.20;在285nm与295nm波长处的吸光度与275nm波长处的吸光度的比值,分别不得过0.65与0.45;在270~350nm的波长范围内,不得有最大吸收峰。
氢氧化钾变深物精密量取本品25ml,置50ml量瓶中,加水0.5ml与氢氧化钾1.0g,密塞,在水浴上加热20分钟,放冷,将溶液置1cm吸收池中,以水为空白溶液,照紫外-可见分光光度法(通则0401),在350nm的波长处测定吸光度,不得大于0.023。
水分取本品,照水分测定法(通则0832第一法1)测定,含水分不得过0.2%。
有关物质取本品5.0g,精密称定,置10ml量瓶中,精密加内标溶液(取二苯甲烷适量,加丙酮稀释制成每1ml中含1.25mg的溶液)1ml,用丙酮稀释至刻度,摇匀,作为供试品溶液;另取本品50.0mg,精密称定,置100ml量瓶中,精密加内标溶液10ml,用丙酮稀释至刻度,摇匀,作为对照溶液;取二甲基亚砜对照品50.0mg[1],精密称定,置100ml量瓶中,精密加内标溶液10ml,用丙酮稀释至刻度,摇匀,作为对照品溶液;照气相色谱法(通则0521)试验,以聚乙二醇20M(或极性相似)为固定液的毛细管柱为色谱柱,柱温为150℃,进样口温度为230℃,检测器温度为250℃,分流比为20∶1。
《中国药典》2020版—卡波姆共聚物国家药用辅料标准

附件:卡波姆共聚物Kabomu GongjuwuCarbomer Copolymer本品系以非苯溶液为聚合溶剂的丙烯酸键合多元醇烷基醚的长链烷基甲基丙烯酸酯高分子共聚物。
按干燥品计,含羧酸(-COOH)应为52. 0%~62. 0%。
【性状】本品为白色疏松粉末;有特征性微臭,有引湿性。
乙酸乙酯与环己烷(生产工艺中使用时测定)置顶空瓶中,精密加人二甲基亚砜5ml,密封,作为供试品溶液;分别取乙酸乙酯和环己烷适量,精密称定,用二甲基亚砜定量稀释成每lml 中含乙酸乙酯0.2mg 和环己烷0.12mg 的混合溶液,精密量取5ml ,置顶空瓶中,密封,作为对照品溶液。
照残留溶剂测定法(通则0861 第二法)测定,用100%二甲基聚硅氧烷为固定液(或极性相近的固定液)的毛细管柱,程序升温,起始温度为40℃,保持3 分钟,以每分钟5℃的速率升温至120℃,维持20 分钟,再以每分钟20 ℃的速率升温至220℃,维持3 分钟,再以每分钟20℃的速率升温至240℃,维持8 分钟;进样口温度260℃,测器温度260℃;顶空瓶平衡温度为85°C ,平衡时间为90 分钟。
取对照品溶液与供试品溶液分别顶空进样。
按外标法以峰面积计算,含乙酸乙酯不得过0.5% ,环己烷不得过0.3%。
苯取苯适量,精密称定,用二甲基亚砜定量稀释制成每1ml 中含苯1.0mg 的溶液。
精密量取该溶液适量,加水定量稀释制成每1ml 中含苯0.5μg 的溶液,作为苯储备液。
取本品约250mg,精密称定,置顶空瓶中,精密加入氯化钠水溶液(20mg/ml)10.0 ml,机械混合均匀(约30 分钟),密封,作为供试品溶液,此溶液应在配制后3 小时内进样;取本品约250mg,精密称定,置顶空瓶中,精密加入氯化钠水溶液(20mg/ml)9.0ml,机械混合均匀(约30 分钟),精密加入苯储备液1ml,机械混合均匀(约1 分钟),密封,作为对照品溶液。
