BRD4和PI3K-AKT双重抑制剂SF2523抗肾细胞癌作用及分子机制研究
酪氨酸激酶抑制剂对肾癌免疫微环境的调节及其机制

酪氨酸激酶抑制剂对肾癌免疫微环境的调节及其机制赵奇【摘要】酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI)是转移性肾癌的标准治疗方案.最新的研究发现,TKI不仅可以抑制肿瘤血管形成,还对肾癌免疫微环境起到调节作用.肾癌及其周围组织所形成的抑制性的免疫微环境是疾病进展、治疗耐受的重要原因.TKI通过阻断磷酸化信号转导子及转录激活因子3(signaltransducer and activator of transcription 3,STAT3)、粒细胞巨噬细胞集落刺激因子(granulocyte macrophagecolony stimulating factor,GM-CSF)等信号通路,减少具有免疫抑制功能的骨髓源性抑制细胞(myeloid-derivedsuppressor cell,MDSC),加强自然杀伤性T细胞功能.TKI还可以抑制调节性T细胞(regulatory T cells,Treg),起到增强细胞免疫的作用.TKI联合免疫治疗可能成为治疗转移性肾癌的新趋势.【期刊名称】《复旦学报(医学版)》【年(卷),期】2015(042)004【总页数】5页(P555-559)【关键词】酪氨酸激酶抑制剂;肾细胞癌;免疫微环境;骨髓源性抑制细胞【作者】赵奇【作者单位】复旦大学附属中山医院泌尿外科上海200032【正文语种】中文【中图分类】R737.11肾细胞癌是泌尿系统的常见恶性肿瘤,占所有成人恶性肿瘤的2%~3%。
在初诊肾癌的患者中,20%~30%已存在转移,另有将近30%的局限性肾癌患者在后续的治疗中发生转移[1]。
而转移性肾癌(metastatic renal cell carcinoma,mRCC)的5年生存率仅10%[2]。
近年来,以血管内皮生长因子受体酪氨酸激酶抑制剂(vascular endothelial growth factor receptor tyrosine kinase inhibitor,VEGFRTKI)为代表的分子靶向药物治疗,正逐步替代传统的干扰素、白介素治疗,成为目前mRCC的标准治疗方案。
仑伐替尼作用原理机制

仑伐替尼作用原理机制
仑伐替尼,常用于治疗晚期肝癌、转移性肾癌等恶性肿瘤。
那么,仑伐替尼的作用机理是什么呢?
首先,我们需要了解仑伐替尼的结构以及生物学特性。
仑伐替尼
是一种多靶点的小分子酪氨酸激酶(TK)抑制剂,可以抑制肿瘤相关
信号通路的多个靶点,包括受体酪氨酸激酶(RTK),血管内皮生长因
子受体(VEGFR)和血小板衍生生长因子受体(PDGFR)等。
接着,我们需要了解仑伐替尼的作用机制。
仑伐替尼主要通过以
下几个方面发挥抗肿瘤作用:
1. 抑制肿瘤细胞增殖
仑伐替尼可以通过阻断肿瘤细胞分裂过程中的多个信号通路,从
而抑制肿瘤细胞的增殖。
例如,它可以抑制表皮生长因子受体(EGFR)的激活,阻止其向下游信号传导。
2. 促进肿瘤细胞凋亡
仑伐替尼可以通过激活bax/bcl-2通路,刺激细胞凋亡过程,从
而诱导肿瘤细胞死亡。
而在慢性髓细胞白血病中,仑伐替尼还可以直
接影响克隆的生存能力,抑制白血病细胞的增殖。
3. 增强免疫系统功能
仑伐替尼还可以增强机体免疫系统的功能,使得机体更容易识别
和排除肿瘤细胞。
例如,它可以促进T细胞的发育和成熟,提高免疫
细胞的活性。
总之,仑伐替尼可以通过多个信号通路的抑制,从而抑制肿瘤细
胞的生长和扩散,促进肿瘤细胞的凋亡和免疫系统的功能。
它的多靶
点抑制也使得它在肝癌和肾癌的治疗中表现出很好的临床疗效。
丁苯酞通过下调NF-κB_信号通路抑制细胞焦亡减轻大鼠肾缺血-_再灌注损伤
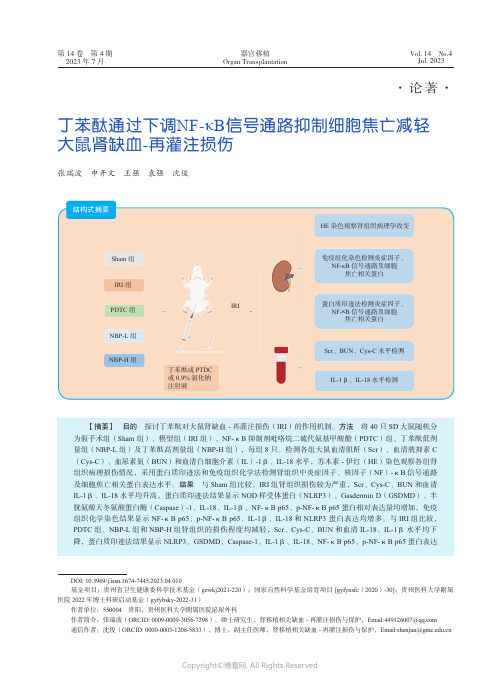
第14卷 第4期2023年7月Vol. 14 No.4Jul. 2023器官移植Organ Transplantation ·论著·丁苯酞通过下调NF-κB 信号通路抑制细胞焦亡减轻大鼠肾缺血-再灌注损伤张瑞波 申开文 王强 袁强 沈俊【摘要】 目的 探讨丁苯酞对大鼠肾缺血-再灌注损伤(IRI )的作用机制。
方法 将40只SD 大鼠随机分为假手术组(Sham 组)、模型组(IRI 组)、NF-κB 抑制剂吡咯烷二硫代氨基甲酸酯(PDTC )组、丁苯酞低剂量组(NBP-L 组)及丁苯酞高剂量组(NBP-H 组),每组8只。
检测各组大鼠血清肌酐(Scr )、血清胱抑素C (Cys-C )、血尿素氮(BUN )和血清白细胞介素(IL )-1β、IL-18水平,苏木素-伊红(HE )染色观察各组肾组织病理损伤情况,采用蛋白质印迹法和免疫组织化学法检测肾组织中炎症因子、核因子(NF )-κB 信号通路及细胞焦亡相关蛋白表达水平。
结果 与Sham 组比较,IRI 组肾组织损伤较为严重,Scr 、Cys-C 、BUN 和血清IL-1β、IL-18水平均升高,蛋白质印迹法结果显示NOD 样受体蛋白(NLRP3)、Gasdermin D (GSDMD )、半胱氨酸天冬氨酸蛋白酶(Caspase )-1、IL-18、IL-1β、NF-κB p65、p-NF-κB p65蛋白相对表达量均增加,免疫组织化学染色结果显示NF-κB p65、p-NF-κB p65、IL-1β、IL-18和NLRP3 蛋白表达均增多。
与IRI 组比较,PDTC 组、NBP-L 组和NBP-H 组肾组织的损伤程度均减轻,Scr 、Cys-C 、BUN 和血清IL-18、IL-1β水平均下降,蛋白质印迹法结果显示NLRP3、GSDMD 、Caspase-1、IL-1β、IL-18、NF-κB p65、p-NF-κB p65蛋白表达DOI: 10.3969/j.issn.1674-7445.2023.04.010基金项目:贵州省卫生健康委科学技术基金(gzwkj2021-220);国家自然科学基金培育项目 [gyfynsfc (2020)-30];贵州医科大学附属医院2022年博士科研启动基金(gyfybsky-2022-31)作者单位:550004 贵阳,贵州医科大学附属医院泌尿外科作者简介:张瑞波(ORCID: 0009-0009-3056-7298),硕士研究生,肾移植相关缺血-再灌注损伤与保护,Email:****************通信作者:沈俊(ORCID: 0000-0003-1208-5833),博士,副主任医师,肾移植相关缺血-再灌注损伤与保护,Email:***************.cn结构式摘要HE 染色观察肾组织病理学改变免疫组化染色检测炎症因子、 NF-κB 信号通路及细胞焦亡相关蛋白IRISham 组IRI 组PDTC 组NBP-H 组丁苯酞或PTDC 或0.9%氯化钠注射液NBP-L 组蛋白质印迹法检测炎症因子、 NF-κB 信号通路及细胞焦亡相关蛋白Scr 、BUN 、Cys-C 水平检测IL-1β、IL-18水平检测·540·第14卷器官移植肾脏缺血-再灌注损伤(ischemia-reperfusion injury ,IRI )通常由器官移植、肾部分切除手术、败血症等引起,如不及时采取有效措施加以预防,很容易发展为急性肾损伤,导致病死率上升[1-6]。
分子靶向抗肿瘤药物

靶向Hedgehog通路抑制剂GDC-0449
n 阻断Hedgehog-ligand细胞表面受体 PTCH 和/或 SMO n Cruis和Roche联合研发 n 自2009年2月起开始临床II期研究,单药给药用于晚期 基底细胞癌患者
GDC-0449治疗晚期基底细胞癌
n Phase I study
食管不典型增生中存在众多的基因组改变
Shi et al. Clinical Cancer Research. 2013
11q13是早期病变与食管鳞癌共有的基因组改变
Shi et al. Clinical & Translational Oncology. 2013
ANO1可能是早期病变与食管鳞癌中11q13.3扩增的靶基因
广谱型抑制剂
q
特异型酪氨酸激酶抑制剂 靶点专一、毒副作用小、 但疗效不理想。
q
广谱型的酪氨酸激酶抑制剂靶向 多个靶点/通路,比特异性的酪 氨酸激酶抑制剂具有更好临床表 现,但毒副作用大 广谱型酪氨酸激酶抑制剂如 Sunitinib、 ZD6474、 Sorafenib 已经证实比特异性抑制剂具有更 好的治疗效果,毒副作用可耐受
分子靶向抗肿瘤药物十年启示
n癌基因依赖型肿瘤 n联合用药策略 n罕见肿瘤治疗 n细胞毒类药物 n毒副作用
n广谱型与特异型
n耐药性
n个性化治疗
分子靶向药物十年启示——
癌基因依赖型肿瘤
(Oncogene Addiction)
n一种肿瘤、一个基因、一个药物
p乳腺癌——HER2
p慢性粒细胞性白血病——BCR-ABL p恶性黑色素瘤——B-RAF
Hedgehog通路
n 正常情况 q 静息和激活两种状态 q 细胞分泌的Hedgehog抑制靶细胞 表面受体Patched (Ptch),从而削 弱后者对效应分子Smoothened (Smo)的抑制作用 q 在早期发育过程中调节细胞的生 长和分化,但在健康的成年人中 呈静息状态
PARP抑制剂抗肿瘤作用及机制研究进展

DOI: 10.3969/j.issn.1673-713X.2021.03.012·综述·PARP抑制剂抗肿瘤作用及机制研究进展陈晨,邹畅,何志巍近年来,随着癌症治疗手段的不断进步,虽然到2017 年癌症死亡率总体下降29%,但仍然是威胁全球人类生命健康的第二大疾病[1],癌症的治疗现状依然严峻。
因晚期癌症患者放化疗及手术的局限性,分子靶向治疗逐渐成为国内外抗肿瘤研究的焦点,聚腺苷酸二磷酸核糖转移酶(poly(ADP-ribose) polymerase,PARP)抑制剂在这些年已取得突飞猛进的进展,此文重点围绕PARP 抑制剂最新临床前及临床研究进展,从药物对肿瘤的疗效及作用机制方面展开综述。
1 PARP 抑制剂概述PARP 抑制剂最早被开发用于提高放疗和化疗的敏感性,因PARP 依赖的修复机制可以修复化疗药物或电离辐射诱发的癌细胞DNA 单链断裂,从而使肿瘤细胞存活,所以PARP 抑制剂联合放、化疗有望阻止DNA 修复,进而导致细胞死亡。
虽然与放化疗联用增敏的文章都有报道[2-5],但迄今为止,还没有PARP 抑制剂被批准与化疗或放疗联用。
2005 年,Bryant 等[6]和Farmer 等[7]两项研究首次确认PARP 抑制剂对乳腺癌基因(breast cancer gene,BRCA)突变的肿瘤会产生联合致死作用,这为肿瘤治疗提供新的思路,即利用肿瘤自身缺陷单纯通过DNA 修复酶抑制剂杀死肿瘤。
2009 年,一项I 期临床试验在人体中再次验证该实验结果[8]。
2014 年全世界第一个PARP 抑制剂奥拉帕尼(olaparib)获得美国食品药品监督管理局(FDA)批准用于治疗卵巢癌[9],随后在2016 年和2017 年,PARP 抑制剂鲁卡帕尼(rucaparib)、尼拉帕尼(niraparib)先后出现。
截至现在,连同塔拉唑帕尼(talazoparib)已经有 4 个PARP 抑制剂靶向药物被FDA 批准上市。
癌症治疗中的靶向药物是如何发挥作用的?

癌症治疗中的靶向药物是如何发挥作用的?癌症是全球范围内的重大健康问题,治疗癌症的方法多种多样。
靶向药物作为现代癌症治疗的重要组成部分,通过针对特定癌细胞内的异常信号通路或分子靶点,实现对肿瘤细胞的精确打击。
本文将介绍靶向药物的作用机制、分类和应用。
一、靶向药物的作用机制靶向药物通过干扰癌细胞内的特定信号通路或结构分子,阻断肿瘤细胞的生长和扩散。
与传统化疗药物相比,靶向药物更加精确地选择性地作用于癌细胞,减少了对正常细胞的伤害。
常见的靶向药物作用机制包括:1.1抑制细胞生长信号传导癌细胞的生长和分裂受到多个信号通路的调控,靶向药物可以抑制这些信号通路的活性,如表皮生长因子受体(EGFR)抑制剂可以阻断癌细胞受到EGFR信号的刺激,从而减少癌细胞的增殖。
1.2阻断血管生成肿瘤生长需要大量的血液供应,靶向药物可以通过阻断血管生成的过程,抑制肿瘤的血液供应。
血管内皮生长因子(VEGF)抑制剂是一类常用的抗血管生成靶向药物。
1.3促进细胞凋亡细胞凋亡是一种正常细胞死亡的机制,癌细胞常常逃避凋亡的过程。
靶向药物可以通过激活凋亡通路,诱导癌细胞自行死亡,如BCL-2抑制剂可以抑制凋亡抑制蛋白BCL-2的活性,从而促进癌细胞凋亡。
二、靶向药物的分类根据作用机制和分子靶点的不同,靶向药物可以分为多个类别:2.1抑制剂这类靶向药物通过与癌细胞内特定的蛋白质结合,阻断其活性。
例如,酪氨酸激酶抑制剂(TKI)是一类常见的抑制剂,它们可以阻断癌细胞内的酪氨酸激酶活性,从而抑制肿瘤细胞的增殖和生存。
2.2抗体药物这类靶向药物是通过与癌细胞表面的特定分子结合,触发免疫系统的反应来杀灭肿瘤细胞。
单克隆抗体药物如帕妥珠单抗(Trastuzumab)可以选择性地结合过表达HER2的乳腺癌细胞,抑制其生长。
2.3核酸药物这类靶向药物通过针对癌细胞内的DNA或RNA靶点,干扰其正常功能。
例如,潘剂沙星(Pazopanib)是一种靶向多种酪氨酸激酶和血管内皮生长因子受体的核酸药物,用于治疗多种癌症。
最热门抗肿瘤靶点及小分子靶向药物全景报告
最热门抗肿瘤靶点及小分子靶向药物全景报告抗肿瘤靶点是指对肿瘤生长、转移等过程具有重要调控作用的蛋白分子或通路。
小分子靶向药物是一类能够专一靶向抗肿瘤靶点并抑制其活性的化学物质。
随着抗肿瘤研究的不断深入,越来越多的抗肿瘤靶点及小分子靶向药物被发现并应用于临床。
以下将介绍一些当前最热门的抗肿瘤靶点及小分子靶向药物:1.EGFR(表皮生长因子受体):EGFR是一种跨膜酪氨酸激酶受体,参与肿瘤细胞的生长和分化等过程。
一些小分子靶向药物如吉非替尼和厄洛替尼等通过抑制EGFR的酪氨酸激酶活性,抑制肿瘤细胞生长。
2.HER2(人表皮生长因子受体2):HER2是一种细胞表面受体,参与调节细胞增殖和存活等过程。
一些小分子靶向药物如曲妥珠单抗和拉普替尼等能够靶向结合HER2,抑制其信号传导,减少肿瘤细胞的增殖。
3.ALK(酪氨酸激酶受体):ALK是一种重排基因,其突变被发现与多种肿瘤的发生和发展相关。
小分子靶向药物如克唑替尼和艾尔莎替尼能够抑制ALK的活性,阻断肿瘤细胞的生长和转移。
4.BRAF(B型RAF激酶):BRAF是一种信号转导分子,突变导致了多种恶性黑色素瘤的发生。
例如,维米非尼和达替尼等小分子靶向药物能够抑制BRAF的活性,减少肿瘤细胞的增殖和转移。
5.PD-1(程序性死亡受体1)和PD-L1(程序性死亡配体1):PD-1和PD-L1参与抑制免疫系统对肿瘤的攻击,突变导致肿瘤逃避免疫监视。
一些免疫检查点抑制剂如伊普替尼和纳武利尼等能够靶向PD-1或PD-L1,恢复免疫系统的抗肿瘤活性。
除了上述靶点外,还有许多其他热门的抗肿瘤靶点及小分子靶向药物,如PI3K、FLT3、VEGFR等。
这些靶点及药物的发现和应用为肿瘤治疗提供了新的进展和希望。
需要注意的是,虽然靶向药物在抗肿瘤治疗中具有重要作用,但并非适用于所有患者。
个体化治疗是当前的研究热点,通过检测患者的肿瘤基因和蛋白表达水平来选择最合适的靶向药物,以提高治疗效果和减少不良反应。
地舒 原理
地舒原理如下:
地舒单抗的原理主要是通过阻断RANKL(核因子κB配体)激活其受体RANK,从而抑制破骨细胞的形成、功能和生存,减少骨吸收过程,以此来打破癌症骨转移的恶性循环。
具体来说:
1. 靶向作用:地舒单抗是一种靶向RANKL的全人源化IgG2单克隆抗体。
它可以特异性地结合RANKL,阻止其与破骨细胞前体及破骨细胞上的RANK受体结合。
2. 抑制骨吸收:通过上述的阻断作用,地舒单抗能够显著降低破骨细胞的活动,减少骨质破坏,从而延缓疾病进程如骨质疏松、骨转移等症状的发展。
3. 抗肿瘤效果:由于RANK受体不仅存在于破骨细胞上,某些肿瘤细胞表面也有RANK的表达。
因此,地舒单抗除了对骨组织有保护作用外,还具有直接针对肿瘤细胞的杀伤作用,有助于抑制肿瘤的发生和转移。
4. 临床疗效:在多项大型随机双盲的III期临床试验中,地舒单抗显示出在乳腺癌、前列腺癌、肺癌等实体瘤以及多发性骨髓瘤中的疗效,包括延长患者首次发生骨骼相关事件(SRE)的时间、降低多次SRE的风险、缓解疼痛等方面。
5. 肾脏代谢:地舒单抗不需要经过肾脏代谢,适用于肾功能不全的患者,无需根据肾功能状态调整剂量,这是其在临床应用中的一大优势。
综上所述,地舒单抗作为一种创新的生物制剂药物,其独特的作用机制为骨转移癌症等相关疾病的治疗提供了新的治疗手段。
同时,由于其较少依赖肾脏代谢的特点,也为肾功能受损的患者带来了便利。
“黄芪-莪术”药对通过PTEN与p-AKT对人乳腺癌细胞增殖的影响
WORLDCHINESEMEDICINE June.2021,Vol.16,No.11
“黄芪莪术”药对通过 PTEN与 pAKT 对人乳腺癌细胞增殖的影响
邓 樱 唐润伟 卫 菊 乐 枫 刘云龙 钱耀明
(上海市第一人民医院中医外科,上海,200080)
摘要 目的:探讨“黄芪莪术”药对通过 PTEN与 pAKT对人乳腺癌细胞 (MDAMB231)增殖的作用机制。方法:将 MDAMB231细胞进行“黄芪莪术”药对(药对组)、顺铂(顺铂组)、“黄芪莪术”药对联合顺铂(药对 +顺铂组)治疗,并 设置空白对照组。MTT法检测细胞增殖,RTqPCR检测 PTEN与 pAKT的 mRNA表达水平,WesternBlotting检测 pAKT 蛋白表达水平。结果:与空白对照组比较,药对组 PTENmRNA表达水平上升,OD值与 pAKT蛋白表达水平下降(P< 005),pAKTmRNA蛋白表达水平变化差异无统计学意义(P>005);顺铂组 OD值与 PTENmRNA表达水平下降(P< 005),pAKTmRNA与蛋白表达水平变化差异无统计学意义(P>005);而药对 +顺铂组在药对治疗的基础上能进一步 抑制 MDAMB231细胞增殖,促进 PTENmRNA的表达,抑制 pAKTmRNA与蛋白表达水平。结论:“黄芪莪术”药对抑 制 MDAMB231细胞增殖的机制可能通过上调 PTEN基因而直接抑制 AKT蛋白水平。 关键词 黄芪;莪术;药对;MDAMB231;增殖;PTEN;pAKT;乳腺癌
基金项目:上海交通大学医学院医工交叉项目(0507N17055) 作者简介:邓樱(198103—),女,博士,主治医师,研究方向:中医药防治乳腺良恶性肿瘤,Email:zywfwz@163com
世界中医药 2021年 6月第 16卷第 11期
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
BRD4和PI3K-AKT双重抑制剂SF2523抗肾细胞癌作用及分子机
制研究
目的:观察BRD4和PI3K-AKT双重抑制剂SF2523在体外和体内抗肾细胞癌
(Renal cell carcinoma,RCC)细胞的作用,并解析其作用的分子机制,为RCC的分
子靶向治疗提供有益的探索。方法和内容:1.对人RCC细胞系(786-O和A489)、
两系原代人RCC细胞(RCC-1、RCC-2),分别应用CCK-8比色法、Trypan blue染
色检测、细胞集落试验、BrdU酶联免疫吸附测定(ELISA)等方法,分别检测不同
剂量SF2523处理后48h、72h,各系人RCC细胞存活及细胞增殖的情况,与对照组
比较,分析SF2523对细胞存活及细胞增殖的影响。
同时应用CCK-8方法、BrdU酶联免疫吸附测定(ELISA)检测观察SF2523对
HK-2肾小管上皮细胞株和原代培养的肾上皮细胞(Renal Epi)的存活和增殖的影
响。2.对人RCC细胞系(786-O和A489)、两系原代人RCC细胞(RCC-1、RCC-2),
分别应用TUNEL细胞核染色方法、分光光度法检测Caspase-3/9活性、Annexin V-
碘化丙啶(PI)流式细胞仪(FACS)法及单链-DNA(ssDNA)ELISA法检测SF2523处理
后以上人RCC细胞系凋亡情况,分析SF2523对RCC细胞凋亡的作用。
3.对人RCC细胞系786-O和原代人RCC-1的细胞用SF2523处理后进一步培
养细胞24h,用碘化吡啶(PI)-FACS方法检测细胞周期进程,对结果进行定量分析,
观察SF2523对人RCC细胞周期的影响。4.对人RCC细胞系786-O细胞株用1.0
μM的SF2523处理24小时,应用Transwell法及细胞轨道示踪实验法,分别观察
细胞迁移、侵袭能力,与对照组比较,分析SF2523对RCC细胞迁移能力的影响;5.
运用免疫印迹(Western Blotting)方法,观察786-O细胞用SF2523处理
后,PI3K-AKT-mTOR信号通路相关分子P-P85、P85、P-AKT S473、P-AKT T308、
AKT1/2、P-S6K1、P-S6等的变化,观察细胞内BRD4调控蛋白Bcl-2和Myc的表
达,分析SF2523对人RCC细胞PI3K-AKT-mTOR及BRD4信号通路的影响。
观察原代培养的肾上皮细胞(Renal Epi)在SF2523处理后p-p85、p85、p-AKT
S473、p-AKT T308、AKT1/2、p-S6K1、p-S6和Bcl-2、Myc的表达,观察SF2523
对肾上皮细胞的影响。比较SF2523与JQ1(BRD4抑制剂)和Wortmannin(PI3K抑
制剂)对人RCC 786-O细胞的作用。
6.建立SCID鼠荷瘤模型,雌性SCID小鼠将786-O RCC细胞注射到左肋腹部
皮下,建立肿瘤移植瘤模型。将荷瘤的SCID小鼠,随机分为3组,分别给予溶剂对
照或SF2523(15/50 mg/kg体重),腹腔注射,隔日处理一次,连续15天,每日观察
肿瘤生长情况,每6日记录肿瘤体积和小鼠体重。
在实验结束时(“Day-36”),分离和称量每组的肿瘤。再选取荷瘤的SCID
小鼠随机分成2组(每组n=3),分别给予溶剂对照和SF2523(50 mg/kg),腹腔注射,
隔日处理一次。
在首次给药后的第6天分离出两组各3个786-O移植瘤(“#1/2/3”)。将肿
瘤组织裂解,并用Western Blotting测定方法观察p-AKT Ser-473、Myc、Bcl-2
表达情况,分析SF2523在体内抗RCC细胞的作用机制。
结果:1.SF2523显著抑制人RCC细胞(786-O和A489)及原代人RCC细胞
(RCC-1、RCC-2)的存活和增殖。SF2523对HK-2肾小管上皮细胞株和原代培养的
肾上皮细胞(Renal Epi)的无显著毒性作用。
2.SF2523诱导人RCC细胞凋亡。SF2523处理的人RCC细胞明显增加了ssDNA
的含量,增加Caspase-3和Caspase-9的活性,还显著增加了Annexin V标记及
TUNEL染色阳性的细胞数目。
3.SF2523能导致RCC细胞周期阻滞,G2-M周期阻滞。SF2523处理的RCC细
胞中G1期百分比显著降低,相应的G2和S期细胞百分比增加。
4.SF2523抑制RCC细胞迁移。SF2523处理显著抑制了“迁移”的786-O细
胞(在Transwell底部)的数量,细胞轨道示踪实验结果显示显著抑制786-O细胞
的侵袭、浸润,定量分析10次细胞轨道示踪实验的结果发现,SF2523的作用是非
常显著的。
5.SF2523同时阻断RCC细胞内PI3K-AKT-mTOR并下调BRD4调控蛋白Bcl-2
和Myc的表达。SF2523显著抑制786-O细胞中p-p85、P-AKT S473、P-AKT T308、
p-S6K1、p-S6的表达,而p85,AKT,S6K1,S6的表达没有变化,BRD4调节蛋白(Bcl-2
和Myc)的表达也显著下调。
SF2523比JQ1(BRD4抑制剂)和Wortmannin(PI3K抑制剂)更有效的抑制RCC
细胞存活,诱导其凋亡。肾上皮细胞内磷酸化的p-p85,p-AKT1,p-S6和p-S6K1
水平和Bcl-2/Myc的表达非常低,SF2523对其的抑制作用也不明显。
Bcl-2/Myc表达下调作用也没有RCC细胞显著。6.SF2523能明显抑制SCID
小鼠中786-O肿瘤生长,使PI3K-AKT抑制及Bcl-2/Myc表达下调。
SF2523治疗组的肿瘤比载体对照肿瘤明显轻得多,SF2523在体内抑制786-O
肿瘤生长表现出剂量依赖性反应,50 mg/kg的SF2523在抑制786-O肿瘤生长方
面明显优于15mg/kg的剂量。SF2523处理的肿瘤中AKT活化(p-AKT Ser-473)和
Myc及Bcl-2表达显著降低。
结论:1.SF2523能显著抑制人RCC细胞的存活和增殖,能诱导细胞凋亡,并导
致细胞周期阻滞,抑制RCC细胞迁移。SF2523对人正常肾上皮细胞无显著毒性作
用。
2.SF2523具有同时阻断RCC细胞内PI3K-AKT-mTOR并下调BRD4调控蛋白
Bcl-2和Myc表达的双重作用,对RCC效果明显优于单通道抑制剂,更有效的抑制
RCC细胞的存活和增殖,诱导细胞凋亡。3.SF2523具有显著的体外和体内抗RCC
细胞作用,其作用机制可能和其抑制PI3K-AKT-mTOR及BRD4信号有关,是一种有
效的双重抑制剂,可能成为治疗RCC的更佳的选择。
