最新中考化学-我们身边的物质综合4气体流程图试题(无答案)
中考化学 流程图综合试题含详细答案

一、中考初中化学流程图1.黑白复印机用的墨粉中常添加Fe3O4粉末,Fe3O4是由Fe2+、Fe3+和O2-按1:2:4的个数比构成的。
如图是氧化沉淀法生产复印用Fe3O4粉末的流程简图。
已知第④步反应中各元素化合价保持不变。
(1)Fe3O4粉末在复印机的电磁场作用下能使墨粉形成字迹或图案,这不仅利用了Fe3O4有磁性,还利用了Fe3O4是______色。
(2)第②步加入试剂X,生成Fe(OH)2的反应方程式为______。
(3)在第③步反应中要控制通入O2的量,以使生成的Fe(OH)2和Fe(OH)3的质量比等于______,才能确保最终生成Fe3O4,操作Y的名称为______。
【答案】黑 FeSO4+2NaOH=Fe(OH)2↓+Na2SO4 45:107 过滤【解析】【分析】【详解】(1)四氧化三铁是黑色的固体,而Fe3O4粉末在复印机的电磁场作用下能使墨粉形成黑色的字迹或图案,所以还利用了Fe3O4是黑色;(2)通过题中的反应原理可以看出,硫酸亚铁和试剂X反应生成了氢氧化亚铁和硫酸钠溶液,结合复分解反应的原理可知,X是氢氧化钠溶液,氢氧化钠溶液和硫酸亚铁反应生成了硫酸钠和氢氧化亚铁沉淀,化学方程式为:FeSO4+2NaOH=Fe(OH)2↓+Na2SO4;(3)Fe3O4是由Fe2+、Fe3+和O2-按1:2:4的个数比构成的,依据质量守恒定律可知,通入氧气后生成的氢氧化亚铁和氢氧化铁的个数比是:1:2,所以生成的Fe(OH)2和Fe (OH)3的质量比等于:(56+17×2):2×(56+17×3)=45:107;经过操作Y后,得到了氢氧化铁沉淀、氢氧化亚铁沉淀和硫酸钠溶液,所以操作Y的名称为:过滤。
故答案为:(1)黑;(2)FeSO4+2NaOH=Fe(OH)2↓+Na2SO4;(3)45:107,过滤。
2.下图为工业利用石灰石和食盐水制作漂白粉的流程图。
中考化学真题分类汇编 2 我们身边的物质 考点8 空气 5 综合 工业流程图(无答案)

亲爱的同学:这份试卷将再次记录你的自信、沉着、智慧和收获,我们一直投给你信任的目光……
学习资料专题
空气
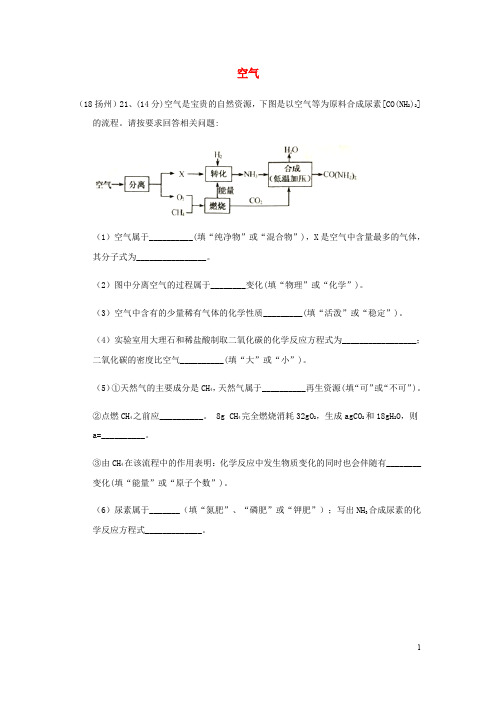
(18扬州)21、(14分)空气是宝贵的自然资源,下图是以空气等为原料合成尿素[CO(NH2)2]的流程。
请按要求回答相关问题:
(1)空气属于__________(填“纯净物”或“混合物”),X是空气中含量最多的气体,其分子式为________________。
(2)图中分离空气的过程属于________变化(填“物理”或“化学”)。
(3)空气中含有的少量稀有气体的化学性质_________(填“活泼”或“稳定”)。
(4)实验室用大理石和稀盐酸制取二氧化碳的化学反应方程式为_________________;
二氧化碳的密度比空气__________(填“大”或“小”)。
(5)①天然气的主要成分是CH4,天然气属于__________再生资源(填“可”或“不可”)。
②点燃CH4之前应__________。
8g CH4完全燃烧消耗32gO2,生成agCO2和18gH2O,则
a=__________。
③由CH4在该流程中的作用表明:化学反应中发生物质变化的同时也会伴随有________
变化(填“能量”或“原子个数”)。
(6)尿素属于_______(填“氮肥”、“磷肥”或“钾肥”);写出NH3合成尿素的化学反应方程式_____________。
中考化学 流程图 综合题

一、中考初中化学流程图1.已知在某化肥K2SO4样品中可能混入了NH4Cl、NH4NO3、K2CO3三种物质中的一种或多种,为推测混入的物质种类,现按图所示进行实验,出现的现象如图中所述(设过程中所有发生的反应都恰好完全进行)。
试根据实验过程和发生的现象填写以下空白:(1)常温下,气体B水溶液的pH __________7(填“大于”“小于”“等于”之一)。
(2)实验步骤②的现象证明可能混入的三物质中,一定存在的物质是 ______________。
(3)根据上述实验,已经证明了溶液E中存在的溶质有(写化学式) ______________。
(4)仅根据上述实验现象, NH4Cl、NH4NO3、K2CO3三种物质中,还不能确定是否混入化肥K2SO4样品中物质是____________________(写化学式)。
(5)要进一步推理化肥样品中的物质,可用溶液E再实验,请简要说明实验操作步骤、发生的现象及结论________________________________________【答案】大于 K2CO3 KNO3 NH4Cl、NH4NO3向溶液E中加入硝酸银,如果有白色沉淀生成,说明样品中含有NH4Cl,可能含有NH4NO3;如果没有白色沉淀,则样品中含有NH4NO3,不含有NH4Cl【解析】(1)由于碱性溶液能使紫色石蕊试液变蓝,所以气体B水溶液的pH>7;(2)由于碳酸根离子与酸能反应生成二氧化碳,所以加入硫酸产生气体,说明含有碳酸根离子,所以一定含有碳酸钾;(3)由于碳酸钾与硫酸反应生成硫酸钾和水、二氧化碳;原来也含有硫酸钾,所以硫酸钾再与硝酸钡反应生成硫酸钡沉淀和硝酸钾,所以E中一定含有KNO3;(4)加入氢氧化钾能产生气体,由于碱性溶液能使紫色石蕊试液变蓝,所以气体B水溶液的pH>7,我们学习过去的碱性气体是氨气,与碱溶液产生氨气,说明样品中含有带铵根离子的盐,只能证明样品中含有带铵根离子的盐,但不能确定是氯化铵还是硝酸铵,化学式为:NH4Cl、NH4NO3;(5)向溶液E中加入硝酸银,如果有白色沉淀生成,说明样品中含有NH4Cl,因为氯化银属于白色沉淀,所以说明一定含有氯化铵,可能含有 NH4NO3;如果没有白色沉淀,则不含有氯离子,则样品中含有NH4NO3,不含有NH4Cl。
中考化学真题分类汇编 2 我们身边的物质 考点8 空气 5 综合 工业流程图(无答案)
空气
(18扬州)21、(14分)空气是宝贵的自然资源,下图是以空气等为原料合成尿素[CO(NH2)2]
:
的流程。
请按要求回答相关问题
(1)空气属于__________(填“纯净物”或“混合物”),X是空气中含量最多的气体,其分子式为________________。
(2)图中分离空气的过程属于________变化(填“物理”或“化学”)。
(3)空气中含有的少量稀有气体的化学性质_________(填“活泼”或“稳定”)。
(4)实验室用大理石和稀盐酸制取二氧化碳的化学反应方程式为_________________;
二氧化碳的密度比空气__________(填“大”或“小”)。
(5)①天然气的主要成分是CH4,天然气属于__________再生资源(填“可”或“不可”)。
②点燃CH4之前应__________。
8g CH4完全燃烧消耗32gO2,生成agCO2和18gH2O,则
a=__________。
③由CH4在该流程中的作用表明:化学反应中发生物质变化的同时也会伴随有________
变化(填“能量”或“原子个数”)。
(6)尿素属于_______(填“氮肥”、“磷肥”或“钾肥”);写出NH3合成尿素的化学反应方程式_____________。
1。
中考化学专题《流程图》综合检测试卷附详细答案

一、中考初中化学流程图1.有一包白色固体样品,可能由硫酸钠、氢氧化钠、碳酸钙、氯化钡、氯化镁中的一种或几种物质组成,为探究该样品的组成,某小组取适量样品按下列流程进行试验。
请回答下列问题:(查阅资料)CO2不能直接与BaCl2和MgCl2发生反应。
(1)过滤操作中用到的玻璃仪器有烧杯、漏斗、________。
(2)滤渣a的成分是________;白色沉淀b的成分是________。
(3)滤渣a中加入足量稀盐酸的目的:________。
(4)若现象①“滤渣全部溶解”变为“滤渣部分溶解”,其他现象不变,则原样品一定存在的物质是________。
【答案】玻璃棒 CaCO3、Mg(OH)2(填名称也可) BaCO3(填名称也可)排除硫酸钡沉淀的干扰,证明样品中无硫酸钠 CaCO3、BaCl2、Na2SO4、NaOH(填名称也可)【解析】【分析】硫酸钠和氯化钡反应生成硫酸钡和氯化钠,氢氧化钠和氯化镁反应生成氢氧化镁和氯化钠,碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳,氢氧化镁和稀盐酸反应生成氯化镁和水,氢氧化钠和二氧化碳反应生成碳酸钠和水,碳酸钠和氯化钡反应生成碳酸钡和氯化钠。
【详解】(1)过滤需要玻璃棒引流,故过滤操作中用到的玻璃仪器有烧杯、漏斗、玻璃棒。
(2)样品加水溶解,硫酸钠和氯化钡反应生成硫酸钡和氯化钠,氢氧化钠和氯化镁反应生成氢氧化镁和氯化钠,碳酸钙不溶于水,过滤得到滤渣a,则滤渣a中可能含有硫酸钡、氢氧化镁和碳酸钙,加入足量的稀盐酸充分反应,滤渣全部溶解,碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳,氢氧化镁和稀盐酸反应生成氯化镁和水,硫酸钡和稀盐酸不反应,假设1.4g滤渣a均为碳酸钙,碳酸钙和稀盐酸反应的关系式为3222 CaCO+2HCl=CaCl+H O+CO 10044,则1g碳酸钙完全反应生成0.44g二氧化碳,滤渣a的质量大于1g,说明滤渣a中含有氢氧化镁,故滤渣a的成分是CaCO3、Mg(OH)2;滤液中可能含有氢氧化钠,氯化钡,氢氧化钠和二氧化碳反应生成碳酸钠和水,碳酸钠和氯化钡反应生成碳酸钡和氯化钠,故白色沉淀b的成分是BaCO3。
【精品】九年级化学上册第四单元我们周围的空气单元综合检测题(无答案)(新版)鲁教版

(1)他先将竹子浸在水里,钻了孔,看到一串串气泡冒出。
然后采用
法(填实验室常用的一种收集方法)
收集了甲、乙两瓶气体。
甲
乙
(2)将放有足量红磷的燃烧匙伸入甲瓶中,用放大镜聚焦,使红磷燃烧,瓶内充满了白烟。
然后将甲瓶倒放入水中,松开夹子,结果流入的水约占瓶子容积的
1/10 ,这说明竹子里的
气体肯定含有
。
鲁教版化学 9 年级 教案
我们周围的空气
一、选择题(本题包括 20 小题,每小题 3 分,共 60 分,每小题只有一个选项符合题意)
1.空气中含量较多且化学性质不活泼的气体是
(
)
A. 氧气
B.
氮气
C.
氩气 D. 二氧化碳
2.下列仪器可以用来直接加热的是(
)
A. 烧瓶 B. 酒精灯
C.
蒸发皿 D. 量筒
(3)再往乙瓶中倒入一些澄清石灰水,发现石灰水马上变浑浊。这说明竹子里的气体肯定
含有
。
(4)那么竹子里的气体含量与空气有什么区别呢 ?于是他又用空气重复了上述实验。 相比较
后得出的结论是
。
24. ( 7 分)将氯酸钾与二氧化锰的混合物粉末
57g 加热到不质量不再减少为止,得到固体
残留物 37.8g 。试回答:
(1) (1 分) 生成氧气的质量为
克;
(2)( 6 分)混合物中氯酸钾的质量分数。
第 4页共 4页
4
鲁教版化学 9 年级 教案
C.生石灰在空气中变质
D.
烧碱在空气中潮解、变质
10. 下列操作中,能鉴别空气、氧气和氢气 3 瓶气体的是 (
)
A. 观察气体颜色
B.
中考化学 流程图 综合题
一、中考初中化学流程图1.高炉炼铁所需的原料有铁矿石、焦炭、石灰石等,其过程可用下图简要表示:已知气体①、气体②和固体③均属于氧化物。
(1)气体②的化学式为_____。
根据氧化物的性质推测炉渣的主要成分为_____(填化学式)。
(2)炼铁高炉底部通过不同高度的出口分离铁水与炉渣(如图2所示)。
能实现渣铁分离的原因是是因为炉渣具有_____、_____的性质。
(3)反应Ⅰ~Ⅴ中属于化合反应的有_____个,属于分解反应的有_____个,属于置换反应的有_____个。
(4)高炉气体中含有多种成分,其中含量最高(占55%~60%)的是_____(填化学式),此外还含有25~30%的可燃性气体_____(填化学式),以及9~12%左右的_____(填化学式)。
【答案】CO CaSiO3熔点高密度比铁水小 3 1 0 N2 CO CO2【解析】【分析】【详解】(1)碳和氧气在点燃的条件下生成二氧化碳,二氧化碳和碳在高温的条件下生成一氧化碳,所以气体②的化学式为CO,化学反应前后,元素种类不变,所以依据氧化物的性质推测炉渣的主要成分为:CaSiO3;(2)炉渣的出口在上方,铁水的出口在下方,所以炉渣具有熔点高、密度比铁水小的性质;(3)Ⅰ是碳和氧气反应生成二氧化碳,属于化合反应,Ⅱ是二氧化碳和碳高温生成一氧化碳,属于化合反应,Ⅲ是一氧化碳和氧化铁在高温的条件下生成铁和二氧化碳,不属于基本反应类型,Ⅳ是氧化钙、二氧化硅反应生成硅酸钙,属于化合反应,Ⅴ是碳酸钙高温生成氧化钙和二氧化碳,属于分解反应,所以反应Ⅰ~Ⅴ中属于化合反应的有3个,属于分解反应的有1个,属于置换反应的有0个;(4)空气中含量最高的是氮气,所以高炉气中含有多种成分,其中含量最高(占55~60%)的是N2,此外还含有25~30%的可燃性气体CO,以及9~12%左右的CO2。
2.人类的生存和发展离不开能源和资源.(1)家用燃料的更新过程如下:煤→液化石油气或管道煤气→天然气,下列有关家用燃料更新的理由,正确的是________(选填字母).A天然气属于可再生能源B气体燃料比固体燃料利用率更高C天然气作为燃料可避免温室效应的发生D煤仅仅用作燃料烧掉浪费资源(2)水是生命之源,合理利用和保护水资源是我们义不容辞的责任.①设法除去硬水中的________,可以使硬水软化成软水.②公共场所可利用“活性炭+超滤膜+紫外线”组合工艺获得直饮水,其中活性炭主要起________作用.(3)海水中有大量可以利用的化学资源,其中所含的氯化镁是金属镁的重要来源之一.从海水中提取金属镁,可按如图流程进行:①下列有关说法正确的是________(选填字母).A步骤I通过一步反应即可实现.B步骤II、III、IV的目的是从海水中提纯氯化镁C步骤V中化学能转化为电能D在此流程中涉及的基本反应类型有4种②在此流程中可以循环利用的物质是________.(4)家中蒸馒头常用的纯碱中含有少量氯化钠,某实验小组要测定该纯碱中碳酸钠的质量分数,取12g纯碱样品放入烧杯中,逐滴加入稀盐酸至不再产生气泡,此时烧杯中没有不溶物,共消耗稀盐酸72.4g,测得反应后溶液的质量为80g.请帮助实验小组完成以下计算(写出计算过程):①根据质量守恒定律计算生成二氧化碳的质量________②样品中碳酸钠的质量分数是多少________?【答案】BD 可溶性的钙、镁化合物吸附 B 氯化氢 4.4g 88.3%【解析】【分析】【详解】(1)A、天然气是三大化石燃料之一,属于不可再生能源,A错误;B、由于气体燃料与空气接触面更大,燃烧更充分,故气体燃料比固体燃料利用率更高,B 正确;C 、天然气作为燃料也生成二氧化碳,所以不可避免温室效应的发生,C 错误;D 、煤仅仅用作燃料烧掉浪费资源,还可以深加工成各种产品,减少环境污染,D 正确。
中考化学专题《流程图》综合检测试卷及答案
一、中考初中化学流程图1.硝酸钙可用于无土栽培等。
一种利用石灰石制备硝酸钙晶体的流程如下:已知:硝酸会挥发、受热会分解。
(1)气体X 为_______(填化学式)。
(2)“制浆”所得的混合物属于_______(填字母)。
a 溶液b 悬浊液c 乳浊液(3)写出“中和”步骤主要反应的化学方程式:________。
(4)工业生产根据以下两项指标判断“中和”反应完全发生:容器内混合物基本变澄清和_____。
(5)“制浆”时须控制好加入水的量。
加入水量太少会导致制浆困难;加入水量太多会导致_。
(6)若省去“制浆”步骤也可制得硝酸钙。
但硝酸利用率会降低、同时会产生污染气体NO x 。
产生NO x 的原因是______。
【答案】CO 2 b ()23322Ca(OH)2HNO Ca NO 2H O +=+ 溶液的pH 等于7 结晶步骤能耗过多 CaO 与HNO 3反应放出大量热,HNO 3受热分解产生NO x【解析】【分析】【详解】(1)煅烧石灰石会使碳酸钙在高温下分解成二氧化碳和氧化钙,所以X 是二氧化碳,其化学式是:CO 2。
(2)氧化钙中加水后得到的是氢氧化钙,氢氧化钙微溶于水,因为反应生成的氢氧化钙部分溶于水,部分悬浮于液体中,所以“制浆”所得的混合物属于悬浊液,故填:b 。
(3)“中和”步骤主要反应是硝酸与氢氧化钙生成硝酸钙和水,化学方程式为:()23322Ca(OH)2HNO Ca NO 2H O +=+。
(4)因为氢氧化钙微溶于水,如果氢氧化钙没有完全反应,液体中就有悬浮的颗粒物,另外氢氧化钙溶液呈碱性,如果氢氧化钙完全反应,溶液应该呈中性,pH =7,所以工业生产常根据以下两项指标判断“中和”反应完全发生:容器内混合物基本变澄清和溶液的pH 等于7。
(5)“制浆”时须控制好加入水的量。
因为氢氧化钙微溶于水,加入水量太少会导致制浆困难;而如果加入水量太多会导致溶液中水分太多,蒸发浓缩时消耗的能量过多,故填:结晶步骤能耗过多;(6)根据题中提供的信息:硝酸受热会分解,而氧化钙和硝酸反应放热,故此法过程中产生NO x的原因是:CaO与HNO3反应放出大量热,HNO3受热分解产生NO x。
中考化学 流程图综合试题及答案
一、中考初中化学流程图1.已知在某化肥K2SO4样品中可能混入了NH4Cl、NH4NO3、K2CO3三种物质中的一种或多种,为推测混入的物质种类,现按图所示进行实验,出现的现象如图中所述(设过程中所有发生的反应都恰好完全进行)。
试根据实验过程和发生的现象填写以下空白:(1)常温下,气体B水溶液的pH __________7(填“大于”“小于”“等于”之一)。
(2)实验步骤②的现象证明可能混入的三物质中,一定存在的物质是 ______________。
(3)根据上述实验,已经证明了溶液E中存在的溶质有(写化学式) ______________。
(4)仅根据上述实验现象, NH4Cl、NH4NO3、K2CO3三种物质中,还不能确定是否混入化肥K2SO4样品中物质是____________________(写化学式)。
(5)要进一步推理化肥样品中的物质,可用溶液E再实验,请简要说明实验操作步骤、发生的现象及结论________________________________________【答案】大于 K2CO3 KNO3 NH4Cl、NH4NO3向溶液E中加入硝酸银,如果有白色沉淀生成,说明样品中含有NH4Cl,可能含有NH4NO3;如果没有白色沉淀,则样品中含有NH4NO3,不含有NH4Cl【解析】(1)由于碱性溶液能使紫色石蕊试液变蓝,所以气体B水溶液的pH>7;(2)由于碳酸根离子与酸能反应生成二氧化碳,所以加入硫酸产生气体,说明含有碳酸根离子,所以一定含有碳酸钾;(3)由于碳酸钾与硫酸反应生成硫酸钾和水、二氧化碳;原来也含有硫酸钾,所以硫酸钾再与硝酸钡反应生成硫酸钡沉淀和硝酸钾,所以E中一定含有KNO3;(4)加入氢氧化钾能产生气体,由于碱性溶液能使紫色石蕊试液变蓝,所以气体B水溶液的pH>7,我们学习过去的碱性气体是氨气,与碱溶液产生氨气,说明样品中含有带铵根离子的盐,只能证明样品中含有带铵根离子的盐,但不能确定是氯化铵还是硝酸铵,化学式为:NH4Cl、NH4NO3;(5)向溶液E中加入硝酸银,如果有白色沉淀生成,说明样品中含有NH4Cl,因为氯化银属于白色沉淀,所以说明一定含有氯化铵,可能含有 NH4NO3;如果没有白色沉淀,则不含有氯离子,则样品中含有NH4NO3,不含有NH4Cl。
中考化学汇编我们身边的物质综合气体流程图试题选择题(1)
矿产资源开发利用方案编写内容要求及审查大纲
矿产资源开发利用方案编写内容要求及《矿产资源开发利用方案》审查大纲一、概述
㈠矿区位置、隶属关系和企业性质。
如为改扩建矿山, 应说明矿山现状、
特点及存在的主要问题。
㈡编制依据
(1简述项目前期工作进展情况及与有关方面对项目的意向性协议情况。
(2 列出开发利用方案编制所依据的主要基础性资料的名称。
如经储量管理部门认定的矿区地质勘探报告、选矿试验报告、加工利用试验报告、工程地质初评资料、矿区水文资料和供水资料等。
对改、扩建矿山应有生产实际资料, 如矿山总平面现状图、矿床开拓系统图、采场现状图和主要采选设备清单等。
二、矿产品需求现状和预测
㈠该矿产在国内需求情况和市场供应情况
1、矿产品现状及加工利用趋向。
2、国内近、远期的需求量及主要销向预测。
㈡产品价格分析
1、国内矿产品价格现状。
2、矿产品价格稳定性及变化趋势。
三、矿产资源概况
㈠矿区总体概况
1、矿区总体规划情况。
2、矿区矿产资源概况。
3、该设计与矿区总体开发的关系。
㈡该设计项目的资源概况
1、矿床地质及构造特征。
2、矿床开采技术条件及水文地质条件。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
学习-----好资料 更多精品文档 我们身边的物质 (2018•赤峰) 小刚同学在学习化学知识后,知道进入久未开启的菜窖可能造成死亡。于是他和小强一起对自家久未开启的菜窖内的气体成分进行了探究。 【提出问题】菜窖内气体的成分是什么? 【查阅资料】蔬菜在一定条件下发酵生成气体,其成分可能含有CO2、CH4等。 【猜想与假设】小刚认为菜窖内的气体含有CO2和CH4。 【实验探究】他们对菜窖内的气体进行取样按图所示装置进行实验
(1)若装量A中澄清石灰水变浑浊,证明气体样品中含有 (2)装置B内发生反应的化学方程式为 (3)装置D内浓硫酸的作用是 (4)E处观察到干燥冷烧杯内壁有 出现,待火焰熄灭后,把烧杯迅速倒转过来,立刻向烧杯内倒入少量澄清石灰水并振荡,石灰水变浑浊,证明气体样品中含有
。E处气体燃烧的化学方程式为
【实验结论】气体样品中含有CO2和CH4,小刚的猜想正确。 【反思与评价】 学习-----好资料 更多精品文档 (5)小强观察上述实验装置发现:装置A和装置C完全相同,他认为可以取消装置C.你是否认同
(填“认同”或“不认同”)理由是 。 (6)根据上述实验探究结果,气体样品中含有CO2,由于二氧化碳
,所以进入久未开启的菜窖前,应向菜窖内通入大量的空气。 (2018•曲靖) 某探究小组的同学通过查阅资料得知:在加热条件下,镁不仅能与水反应还能与氯化铵溶液反应。小组同学对此产生兴趣,他们将砂纸打磨过的镁条加入氯化铵溶液中并加热,迅速产生大量气体。为确定生成气体的成分,他们进行如下探究: 【查阅资料】 (1)镁与氯化铵溶液反应生成两种气体,每种气体只含有氮、氢两种元素中的一种或两种。 (2)镁与水在加热条件下反应生成氢氧化镁和氢气。 (3)氨气是一种极易溶于水的气体,能与酸反应。 【提出问题】该气体成分是什么? 【做出猜想】猜想一:H2和N2 猜想二:N2和NH3 猜想三:
【进行实验】
步骤一:小组同学闻气体气味,发现该气体有刺激性气味。则猜想 不成立。 步骤二:同学们把产生的气体通入盛有水的A装置中除去 学习-----好资料 更多精品文档 ,再将剩余气体依次通入B、C、D装置中,一会儿后,加热试管中的氧化铜,观察到B中溶液不变色,C中无明显现象,D中黑色粉末变成红色固体,试管口有小水珠。装置C的作用是
(合理即可),装置D中发生反应的化学方程式为 。 【得出结论】猜想
成立。 【拓展延伸】经过讨论,小华同学认为用点燃木条检验气体的方法代替装置D也能达到相同的探究目的。你认为是否可行?
(填“可行”或“不可行”)。
(2018•绥化) 实验室中有一种含有纯碱、小苏打和少量水的固体粉末样品。为了测定其中小苏打的含量,某化学兴趣小组的同学在老师的指导下,利用如图所示装置(部分固定装置已略去)进行实验。
已知:①该装置气密性良好,A、C、D中所装药品足量且能完全吸收相关物质 ②碱石灰是CaO与NaOH的固体混合物 ③加热条件下,纯碱稳定不分解,小苏打易分解,反应的化学方程式为: 2NaHCO3 学习-----好资料 更多精品文档 NaCO3+H2O+CO2↑ 探究过程如下: Ⅰ.称量样品和已装入相关药品的装置C、D的质量,分别为:m、m1、m2; Ⅱ.将质量为m的样品装入B玻璃管中,按图连接好装置,关闭弹簧夹,给玻璃管加热 Ⅲ.待玻璃管中样品完全反应,打开弹簧夹通空气,再熄灭酒精灯,直到玻璃管冷却 Ⅳ.再次称量装置C、D的质量,分别为m3、m4 请回答下列问题 (1)装置A中碱石灰的作用是
(2)装置C中所装药品为 (3)装置D中发生反应的化学方程式为 (4)装置E的作用 (5)依据实验所得数据计算,该样品中小苏打的质量分数为 (用相关字母表示)。 (6)误差分析。按上述实验步骤测得该样品中小苏打的质量分数
(填“偏大”“偏小”或“准确”),理由是 。 (18昆明)27.(7分)我国西北地区有很多咸水湖,其中最大的是柴达木盆地的察尔汗盐
池。某盐湖附近的农民通过“冬天捞碱,夏天晒盐”获得大量湖盐。小伟同学取该湖盐样品进行探究。
【提出问题】该湖盐样品的成分是什么? 【查阅资料】冬天捞碱的“碱”指Na2CO3,夏天晒盐的“盐”指NaCl。 学习-----好资料 更多精品文档 【猜想与假设】猜想一:Na2CO3 猜想二:NaCl 猜想三:Na2CO3和NaCl 【实验探究】 实验 实验操作 实验现象 实验结论 实验一 取少量样品于试管中,加适量水溶解后,加入过量稀HNO3 产生能使澄清石灰水变浑浊的气体 ①猜想 不成立
实验二 ②向实验一所得的溶液中加入适量的 ③ 猜想三成立 【拓展延伸】为进一步确定该湖盐样品中Na2CO3的质量分数,小伟同学再取该湖盐样品10.00g做了如图所示的补充实验。
(1)反应结束之后通入空气的目的是 。 (2)装置A中浓NaOH溶液的作用是 (用方程式表示)。 (3)实验结束后测得装置D增重0.44g,则湖盐样品中Na2CO3的质量分数为 %(保留一位小数)。
(18张家界)16.某化学学习小组的同学在学习了《常见的酸》以后,对蚊虫分泌的让人痛痒不止的蚁酸产生了兴趣。他们在老师指导下对蚁酸进行探究。
【查阅资料】蚁酸的主要成分是甲酸,甲酸的化学式为HCOOH;甲酸溶于水,在一定条件下发生分解反应生成两种氧化物。
【提出问题】甲酸溶液是否具有酸性? 学习-----好资料 更多精品文档 【实验与结论】向盛有甲酸溶液的试管中滴加紫色石蕊溶液,观察到溶液颜色变成 红色,说明甲酸溶液显 性。 【提出问题】甲酸分解生成的两种氧化物是什么? 【推断与猜想】 ⑴小组同学根据甲酸中含有氢元素,推测出生成物中含有水。 ⑵他们对另一种氧化物提出两种猜想: 猜想①:二氧化碳;猜想②:一氧化碳。 【实验与结论】 为了证明自己的猜想,他们将甲酸分解产生的气体通过如下图所示的装置(铁架台已略去)。
观察到的实验现象如下: Ⅰ.装置A中澄清石灰水无明显变化。 Ⅱ.装置C中的黑色粉末变红色。 Ⅲ. 装置D中澄清石灰水变浑浊。 【实验结论】甲酸具有酸性,在一定条件下分解生成水和 。 【拓展延伸】人被蚊虫叮咬后,在其叮咬处涂抹 可减轻痛痒。 (18武汉)30.(6分)实验室现有一瓶含少量水的碳酸氢铵样品,为测定其中碳酸氢铵的质量分数,某化学兴趣小组利用下图所示装置进行实验(该装置气密性良好,装置B、C 学习-----好资料 更多精品文档 中所装药品均足量,碱石灰是氧化钙和氢氧化钠的混合物)。已知:碳酸氢铵受热易分解,反应的化学方程式为: NHHCO3 △ NH3↑+H2O↑+CO2↑,NH3能被酸溶液吸收。
部分实验步骤如下: I.打开弹簧夹,通入段时间的氮气; II.关闭弹簧夹,给碳酸氢铵样品加热; III.当样品反应完全,……再停止加热,直到玻璃管冷却; V.实验完毕,测得装置B、C中药品的质量分别增加了m1、m2。 请回答下列问题: (1)NH4HCO3属于____(选填 “氮肥”“磷肥”“钾肥”或“复合肥”);装置B中盛放的液体是_____。
(2)装置C中发生反应的化学方程式为__________。 (3)步骤III中,停止加热前应进行的操作是___________。 (4)该样品中碳酸氢铵的质量分数的表达式为_______(用m1、m2的代数式表示)。 (18江西)23、(10分)甜叶菊苷具有高甜度低热能的特点,是一种新型甜味剂,我国是全国最主要的生产国,实验小组欲探究甜叶菊苷的元素组成,进行如下实验:
[提出猜想] 甜叶菊苷由什么元素组成? [进行实验]小晴取适量的甜叶菊苷按图进行操作,并分别将干冷的烧杯和蘸有澄清石灰水的烧杯倒置与火焰上方。 学习-----好资料 更多精品文档 [讨论交流]其他同学认为小晴的实验设计不严谨,原因是____________________________。经改进试验后,检验到甜叶菊苷在氧气中充分燃烧的产物只有二氧化碳和水,由此确定甜叶菊苷中一定含有碳,氢元素。
[继续探究]为了进步确定其元素组成。利用下图进行实验。(已知:装置中C中的氧化铜能确保甜叶菊苷中的碳元素完全转化为二氧化碳)
(1)是眼前要通一会儿氮气,目的是_________________。 (2) A装置中发生反应的化学方程式为__________________________。 [数据记录]4.02g甜叶菊苷在C装置中充分燃烧后,D装置增重27g, E装置增重8.36g。(产物被完全吸收)
[分析与结论]数据分析: 4.02g 甜叶菊苷中氧元素的质量为___g,由此可以确定甜叶菊苷是由碳,氢,氧元素组成。
[反思评价]若没有F装置,对氧元素质量测定结果的影响是_____________。 (填“偏大”。“偏小”或“无影响”)。
(18杭州)29.(8分)碱式碳酸锌[Znx(OH)y(CO3)z]是制备功能材料ZnO的原料,其化学反应表达式为: Znx(OH)y(CO3)z ZnO+CO2↑+H2O(x、y、z为正整数)。小金设计了图甲所示装置对碱式碳酸锌的组成进行探究(装置气密性良好,药品足量,实验操作正确):
