布洛芬片剂的剂型设计与处方筛选

布洛芬片剂的剂型设计与处方筛选
一、目的和要求
1、了解布洛芬片剂的制备,熟悉其基本工艺过程。
2、熟悉处方筛选过程。
3、掌握其质量检查方法
二、基本概念和原理
片剂系指将药物与适宜的辅料通过制剂技术制成的片状制剂,
制法分为直接压片、干法制粒压片和湿法制粒压片,
除对湿热不稳定的药物之外,多数采用湿法制粒压片。
三、仪器和材料
单冲压片机烘箱
布洛芬淀粉滑石粉HPMC 硬脂酸镁微粉硅胶
四、剂型设计与处方筛选分析
1)
布洛芬为解热镇痛抗炎药,不溶于水,口服易吸收;
该药可缓解急慢性类风湿性关节炎、骨关节炎、强直性脊柱炎、软组织风湿的发作,并可长期服用,能缓解轻度或中度疼痛,适用于退热、痛经、痛风等;
因此可制为片剂。
2)
湿热稳定,因此可用湿法制粒压片;淀粉可用为填充剂,HPMC可用为崩解剂
滑石粉为优良的助流剂,抗粘剂和润湿剂,不能超过5%;微粉硅胶可作压片的助流剂,一般用量为0.1%~0.5%;而硬脂酸镁为优良的润滑剂,不溶于水,易与颗粒混匀,减少摩擦,压片后光洁美观,一般用量为0.1%~1%;因淀粉浆廉价易得,且黏合性好,所以黏合剂可用淀粉浆
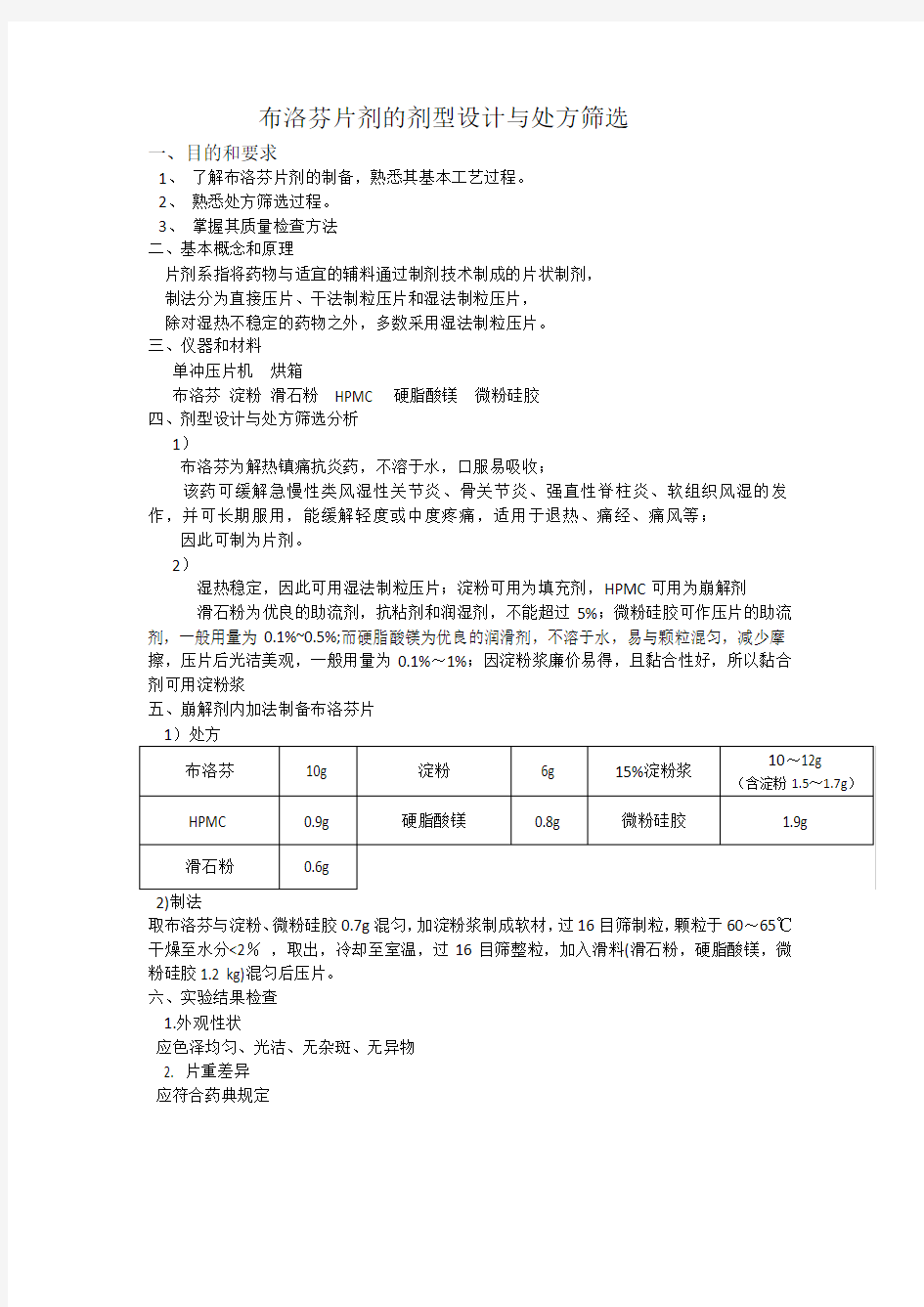
五、崩解剂内加法制备布洛芬片
2)制法
取布洛芬与淀粉、微粉硅胶0.7g混匀,加淀粉浆制成软材,过16目筛制粒,颗粒于60~65℃干燥至水分<2%,取出,冷却至室温,过16目筛整粒,加入滑料(滑石粉,硬脂酸镁,微粉硅胶1.2 kg)混匀后压片。
六、实验结果检查
1.外观性状
应色泽均匀、光洁、无杂斑、无异物
2. 片重差异
应符合药典规定
《中国药典》2005版规定的片重差异限度
的药片不得多于2片,并不得有一片超过限度的1倍。
3.硬度和脆碎度
一般硬度40~60N压力为合格,脆碎度<1%为合格
4.崩解度
崩解时限一般为15分钟
5.溶出度
应符合药典规定,45分溶出标示量70%以上
6.药物含量
根据药典
取本品20片,精密称定,研细,精密称取适量(约相当于布洛芬0.5g),加中性乙醇(对酚酞指示液显中性)20ml,振摇使布洛芬溶解,用垂溶漏斗滤过,容器与滤器用中性乙醇洗涤4次,每次10ml,洗液与滤液合并,加酚酞指示液5滴,用氢氧化钠滴定液(0.1mol/L)滴定”
(完整word版)处方分析题
(一)、 1.VB2注射液 [处方] 维生素B2 2.575g ()烟酰胺77.25g ()乌拉坦38.0625g ()苯甲醇7.5ml ()注射用水加至1000ml () 2.醋酸可的松滴眼液 [处方] 醋酸可的松(微晶) 5.0g ( ) 吐温80 0.8g ( ) 硝酸苯汞0.02g ( ) 硼酸20g ( ) 甲基纤维素钠 2.0g ( ) 纯化水加至1000ml () 3.大蒜油气雾剂 [处方] 大蒜油10ml ( ) 聚山梨酯80 30g ( ) 油酸山梨酯35g ( ) 十二烷基硫酸钠20g ( ) 甘油250ml ( ) 纯化水加至1400ml () 4.盐酸异丙肾上腺素气雾剂 [处方] 盐酸异丙肾上腺素 2.5g ( ) 乙醇296.5g ( ) 维生素 C 1.0g ( )
柠檬油适量( ) 二氯二氟甲烷适量( ) 制成1000g 5.地塞米松软膏 [处方] 地塞米松0.25 g ( ) 硬脂酸120 g ( ) 白凡士林50 g ( ) 液状石蜡150 g ( ) 月桂醇硫酸钠 1 g ( ) 甘油100 g ( ) 三乙醇胺 3 g ( ) 羟苯乙酯0.25 g ( ) 纯化水适量( ) 共制1000 g 6.硝酸甘油片 [处方] 硝酸甘油0.6g () 17%淀粉浆适量() 乳糖88.8g () 硬脂酸镁 1.0g () 糖粉38.0g () 共制1000片 7.红霉素肠溶衣片 [处方] 红霉素1亿U () 淀粉57.5g () 10%淀粉浆l0g ()
硬脂酸镁 3.6g ()共制1000片 8.颅痛定片 [处方] 颅痛定30g ( ) 微晶纤维素25g ( ) 淀粉23g ( ) 微粉硅胶1g ( ) 硬脂酸镁2g ( ) 共制1000片 (二) 1.[处方] 硬脂酸13g 单硬脂酸甘油酯17g 蜂蜡5g 石蜡75g 液状石蜡450g 白凡士林70g、 双硬脂酸铝10.0g 氢氧化钙1.0g 羟苯乙酯1.5g 蒸馏水加至1000g 2. [处方]
食品配方设计知识
食品配方设计知识 一、食品配方设计概述 所谓配方设计,就是根据产品的性能要求和工艺条件,通过试验、优化、评价,合理地选用原辅材料,并确定各种原辅材料的用量配比关系。 如何开发一个新产品,如何设计一个新配方,对企业来说至关重要。要设计一个好的食品配方,成为一个真正的优秀技术人员,必须要有扎实的基本功。 二、配方设计需要哪些基本功 1、熟悉原料的性能、用途及相关背景 每种原料都有其各自的特点,你只有熟悉它,了解它,才能用好它。在不同的配方里,根据不同的性能指标的要求,选择不同的原料十分重要。 2、熟悉食品添加剂的特点及使用方法 食品添加剂是食品生产中应用最广泛、最具有创造力的一个领域,它对食品工业的发展起着举足轻重的作用,被誉为食品工业的灵魂。 了解食品添加剂的各种特性,包括复配性、安全性、稳定性(耐热性、耐光性、耐微生物性、抗降解性)、溶解性等,对配方设计来说,是重要的事情。 3、熟悉设备和工艺特点 熟悉设备和工艺特点,对配方设计有百利而无一害;只有如此,才能发挥配方的最佳效果,才是一项真正的成熟技术。 比方说喷雾干燥和冷冻干燥、夹层锅熬煮和微电脑控制真空熬煮、三维混合和捏合混合等,不同设备导致不同的工艺和配方。 4、积累工艺经验 不多叙述,重视工艺,重视加工工艺经验的积累。就好比一道好菜,配料固然重要,可厨师的炒菜火候同样重要。一样的配方,不一样的工艺,出来的产品质量相差天壤之别,这需要进行总结、提炼。 5、熟悉实验方法和测试方法 配方研究中常用的实验方法有单因素优选法、多因素变换优选法、平均试验法以及正交试验法。一个合格的配方设计人员必须熟悉实验方法及测试方法,这样才能使他不至于在做完实验后,面对一堆实验数据而无所适从。 6、熟练查阅各种文献资料
布洛芬片质量标准
布洛芬片质量标准 含布洛芬(C13H18O2)为标示量的98.0%-105.0% 【性状】白色或粉红色圆形双面微凸包衣片 【鉴别】 (1)取细粉适量(约相当于布洛芬0.5g),加丙酮20ml提取,滤过,滤液蒸发使自然干燥(不加热用普通空气挥干),残渣红外吸收图谱(附录)与布洛芬参考图谱一致(RS186)。 (2)取1项下的残渣适量,用石油醚(40-60℃)重结晶后测定其熔点约为75℃。【检查】 溶出度:取本品1片,照溶出度测定法(第二法),以磷酸盐缓冲液pH7.2溶液900ml为溶出介质,转速每分钟50转,经45分钟时取溶液10ml,滤过,弃去初滤液,精密量取续滤液适量(400mg量取2ml;600mg、800mg量取1ml)置100ml 量瓶中,用溶出介质稀释至刻度,摇匀,作为供试品溶液;另精密称取布洛芬对照品10mg置50ml量瓶中,用溶出介质溶解并稀释至刻度,摇匀,精密量取2ml 置另一50ml量瓶中,用溶出介质稀释至刻度,摇匀,作为对照品品溶液,照紫外-可见分光光度法在221nm的波长处测定吸光度,计算每片的溶出量,限度为标示量的70%,应符合规定。 有关物质:高效液相色谱法测定。 色谱条件: 色谱柱:填料为常规色谱分析柱ODS2不锈钢色谱柱(15cm×4.6mm),用十八烷基硅胶(Spherisorb ODS2)为填充剂封端(5微米)。 流速:2ml/分钟;检测波长:214nm;进样量:20μl。 流动相:磷酸:乙腈:水(0.5:340:600)混匀后,用水稀释至1000ml,过滤脱气即得。 溶液制备: 溶液(1):取本品的细粉适量(约相当于布洛芬0.2g),加30ml甲醇,振摇30分钟,再加入30ml甲醇,用水定容至100ml,混匀,用超细玻璃纤维过滤纸过滤(GF/C是合适的)。 溶液(2):取溶液(1)1ml用流动相定容至100ml,即得。 溶液(3):取布洛芬对照品50mg置25ml量瓶中,加0.006%的2-(4-丁基苯基)丙酸对照品溶液〔2-(4-丁基苯基)丙酸对照品溶液制备:吸取1体积2-(4-丁基苯基)丙酸对照品,用甲醇定容至10体积〕甲醇溶液2.5ml,加甲醇稀释至刻度,摇匀即得。 检测: 在开始试验前,用流动相平衡柱子45分钟,调节灵敏度使溶液(2)峰高为满量程的70-90%,记录色谱图至主峰(布洛芬峰)保留时间的1.5倍。 按上述试验条件进样,布洛芬(主峰)保留时间约为20分钟,在溶液(3)色谱图中,测量2-(4-丁苯基)丙酸的峰高为(a),布洛芬峰低点的峰高为(b), 若a大于1.5b,则符合分析要求,如果不符合,可用乙腈调流动相使之符合要求。结果判定: 溶液(1)色谱图中,若有2-(4-丁苯基)丙酸峰,其峰面积不得大于溶液(3)中2-(4-丁苯基)丙酸峰的峰面积(0.3%);其他单个杂质峰面积不得大于溶液(2)中主峰面积的0.3倍(0.3%);其他杂质峰峰面积的总和不得大于溶液(2)中主峰面积的0.7倍(0.7%);杂质峰面积小于溶液(2)中主峰面积的0.1倍(0.1%)
泡腾片处方及制备工艺小结(优选参考)
2 泡腾片处方及制备工艺小结 一、概要 泡腾片是以适宜的酸和碱为崩解剂制成的一种片剂。泡腾片入水后会产生大量二氧化碳气体从而迅 速溶解,药物起效迅速,生物利用度高,携带方便 且成本低,故近年发展较快。目前临床上常用的泡 腾片主要有口服泡腾片和阴道泡腾片。口服泡腾片 适用于儿童、老年人和不能吞服固体制剂的患者, 质量较好的口服泡腾片泡腾完毕后即为一杯酸甜可口 的饮品;阴道泡腾片用于局部治疗,使用方便,可 增加药物与人体的接触面,提高药效,同时可避免 污染衣物。 二、常用辅料 1、泡腾片常用的酸源主要有柠檬酸、酒石酸、富马酸、 己二酸、 苹果酸。 2、泡腾片的CO 2一般采用碳酸氢钠或碳酸钠,其安全易得,且较纯净;碳酸氢 钾不但价格高,而且服用过多的钾离子对机体不利。 3、 常用的填充剂(稀释剂)有淀粉、糖粉、甘露醇、糊精、蔗糖 酸源 优点 缺点 柠檬酸 易溶于水,口感好,酸度好 具有很强的吸湿性,容易产生粘 冲、胀片等问题 酒石酸 吸湿性较小,酸度较柠檬酸强,泡腾力度大 口感较差,在饮用水中易与矿物质 产生沉淀,价格较贵 富马酸 没有吸湿性,有极好的润滑性,无粘冲、吸潮等问题 水溶性不好,酸度小,崩解慢 己二酸 是较好的水溶性润滑剂,不吸潮 崩解慢,有残留 苹果酸 泡腾效果好,口感佳 吸湿性严重,压片效果差
4、粘合剂可保证制成的颗粒硬度适中、大小均匀、崩解迅速,常用粘合剂有水、乙醇、PVP 、L-HPC 。 5、润滑剂,在制成颗粒后、压片前须加入润滑剂,使颗粒润滑,减少与冲模的摩擦和粘连润。口服泡腾片的润滑剂除了应有良好的润滑性外,一般还要求在水中有良好的溶解性,滑剂大致可分为两类:水溶性润滑剂和水不溶性润滑剂,常用的如下: 填充剂 性质特点 淀粉 无臭无味,不溶于水和乙醇与大多数药物不起作用, 遇水溶胀 糊精 白色、微黄细粉,微有异臭,冷水中溶解缓慢,热水较易溶,片剂、胶囊 剂的填充剂 乳糖 白色、无臭结晶颗粒或粉末,能溶于水,不易吸水,为泡腾片优良的填充 剂 甘露醇 白色、无臭、味甜的结晶粉末,不活泼、无吸湿性,可是泡腾片外观光洁, 味佳、有清凉感 蔗糖 白色、味甜粉末,易受潮结块,为可溶性泡腾片的优良填充剂,有矫味和 黏合作用 粘合剂 特点应用 水 其本身无粘性,但若物料中含有遇水产生粘性的成分,仅加水润 湿即可,仅适用于在水中不易溶解的主药。 乙醇 药物本身有粘性,当原药遇水容易变质或润湿时粘性过强、颗粒 干后变硬等情况时,则宜选用乙醇作润湿剂。 PVP 聚乙烯毗咯烷酮能溶于水和乙醇,为优良的粘合剂,化学性质稳 定,具有很好的溶解性、成膜性和分散稳定性 L —HPC 具有优良性能的非离子型纤维素类衍生物,主要用作药物的赋形 剂、粘合剂和崩解剂,与药物本身不起任何反应,大幅度降低崩 解时限
2006-11-295051---配方优化设计方法简介
配方优化设计方法简介 刘莉,辛振祥 (青岛科技大学,山东 青岛 266042) 摘要:本文综述了配方实验优化设计方法及数据处理方法,并综合分析了各种方法的优缺点和应用范围。 关键词:配方优化设计;单因素变量;正交实验法;回归设计;均匀设计;方差分析;回归分析;遗传算法;神经网络中图分类号:TQ330.61 文献标识码:B 文章编号:1009-797X(2004)10-0008-05 作者简介:刘莉(1970-),女,青岛科技大学高分子科学与工程学院在读研究生,主要从事橡胶配方优化设计及高分子材料加工方面的研究。 收稿日期:2003-06-02 配方优化问题是材料领域中的一个重要研究内容。为了获得性能优异、能满足使用要求的配方,需根据产品的性能要求和工艺条件,通过试验、优化、鉴定,合理地选用原材料,确定各种原材料的用量配比关系。对于这样一个复杂的多目标配方体系,试验方法的设计就显得尤为重要。近年来对配方优化设计的应用研究十分活跃,新的试验方法不断出现,旧的方法不断改进,文献报道较多,但这方面的综述报道却很少。面对如此多的设计方法,如何合理选用已成为配方设计者的一大难题。本文针对这一问题对近年来各种实验方法的优缺点及应用范围进行综合分析,希望有助于配方设计者合理选用试验设计方法及优化方法。 1 试验设计方法 试验设计是配方设计的基础。理想的试验设计方案应当是以尽可能少的试验次数反映尽可能多的信息,试验点在试验空间中的分布要合理,既有一定的均匀性,又便于试验结果的分析与模型的建立。橡胶配方优化研究中最早使用的实验方法是单因子实验,后来是正交设 计、正交回归设计。它们在优化设计中的地位与作用是毋庸置疑的[2]。近年来,又出现了许多新型的实验设计方法,如均匀设计法、信噪比实验设计、物理实验设计、数学实验设计等新型的实验设计方法[3]。 试验设计可分为单因素变量的试验设计和多因素变量的试验设计,根据目标优化选择分为单目标最优化问题和多目标最优化问题。 1.1 单因素变量试验方法 单因素变量法比较简单,特别是用来鉴定新材料,或生产中原材料变动时,只做较少的试验,就可做出判断,见效快,试验数据易于处理,通过图表直观比较即可得出结论。正因为如此,这种方法在配方试验中仍然有一定的价值。实验方法如:黄金分割法、平分法(对分法)、分批试验法(均匀分批试验法、比例分割分批试验法)、分数法(裴波那契法)、爬山法、抛物线法等。 1.2 多因素试验设计方法 在大多数的配方研究中,需要同时考虑两个或两个以上的变量因子对性能的影响规律,这即是多因素配方试验设计的问题。与单因素配方设计不同的是,在基本配方拟定中选择了两个或两个以上的不同组份因素,然后考察这些因素对配方性能的影响规律,这无疑使研究问题变得复杂化,试验次数也将增多。
食品配方设计七步
食品配方设计七步 优质的产品首先要有科学合理的配方,所以在食品生产加工过程中,食品配方设计占有重要的地位。食品的配方设计是根据产品的工艺条件和性能要求,通过试验、优化和评价,合理的选用原辅材料,并确定各种原辅材料用量的配比关系。 食品配方设计一般分为七个步骤:一是主体骨架设计;二是调色设计;三是调香设计;四是调味设计;五是品质改良设计;六是防腐保鲜设计;七是功能营养设计。 主体骨架设计 主体骨架设计主要是主体原料的选择和配置,形成食品最初的形态,它是食品配方设计的基础,对整个配方设计起导向作用。食品主体骨架设计是后续设计的载体,全部加工完成之后才能确定食品的最终形态。 食品主体骨架设计中的主体原料是根据各种食品的类别和要求,赋予产品基础骨架的主要成分,体现食品性质的功用。主体原料的选择必须符合的要求:卫生性和安全性、营养和易消化性、贮藏耐运性、整齐的外观、良好的风味、食品的方便性和快捷性。 在实际设计过程中,对主体原料的量化通常采用倒推法,先设定主体原料的添加量,在此基础上确定其他辅料的添加量,对于主体原料在食品所占的具体比例,要在最终配方设计完成才能确定,其中对主体原料量化的关键是处理好主体原料与辅料的比例问题。 调色设计 食品讲究色、香、味、形,首先就是色。食品的色泽作为食品质量指标越来越受到食品研究开发者、生产厂商和消费者的重视,调色设计在食品加工制造中有着举足轻重的地位。在调色设计中,食品的着色、发色、护色、褪色是食品加工重点研究内容。 食品的调色设计与食品的加工制造工艺和贮运条件密切相关,并受到消费者的嗜好、情绪、传统习惯等主观因素,以及光线、环境等客观环境因素的影响。所以,对食品调色设计要注意以下几点:使用符合相关规定的着色剂;根据食品的物性和加工工艺选择适当的食品着色剂;根据食品的形态,选择适当的添加形式;根据食品的销售地区和民族习惯,选择适当的拼色形式和颜色;食品的调色方法要严格按照国家对着色剂的规定进行;控制食品加工工艺。 调香设计 所谓调香设计就是将芳香物质相互搭配在一起,由于各呈香成分的挥发性不同而呈阶段性挥发,香气类型不断变换,有次序的刺激嗅觉神经,使其处于兴奋状态,避免产生嗅觉疲劳,让人们长久的感受到香气美妙之所在。食品的调香设计就是根据各种香精、香料的特点结合味觉嗅觉现象,取得香气和风味之间的平衡,以寻求各种香气、香料之间的和谐美。 食品的调香不仅要有效、适当的运用食用香精的添加技术,更要掌握食品加工制造和烹调生香的技术。食用香料的使用要点如下:要明确使用香料的目的;香料的用量要适当;食品的香气和味感要协调一致;要注意香料对食品色泽产生的影响;使用香料的香气不能过于新异。
药剂学处方分析题
1.处方分析:复方乙酰水杨酸片(1000片)的制备 处方乙酰水杨酸 268g 对乙酰氨基酚 136g 咖啡因 淀粉 266g 淀粉浆(17%) 滑石粉 15g 轻质液状石蜡 制法:①将对乙酰氨基酚、咖啡因与约1/3淀粉混匀,制软材,制粒,干燥,整粒;②将晶型乙酰水杨酸与上述颗粒混合,加入剩余的淀粉(预干燥),混匀;③将吸附有液状石蜡的滑石粉与上述混合物混匀,过12目筛,压片即得。 (1)分析处方,说明处方中各成份的作用。 (2)参照本处方,写出湿法制粒压片的生产工艺流程。 (3)说明本处方的三主药为什么要分别制粒? (4)说明本处方中崩解剂的加入方法。 (5)为什么滑石粉中要喷入液状石蜡? 解题过程与步骤: (1)乙酰水杨酸268g 主药 对乙酰氨基酚136g 主药 咖啡因主药 淀粉266g 填充剂和崩解剂 淀粉浆(17%) 适量黏合剂 滑石粉15g 润滑剂 轻质液状石蜡润滑剂 (2)药物、辅料→粉碎、过筛 ? ?→ ?加辅料混合→制软材→制湿颗粒→湿粒干燥→整粒 ? ? ? ? ?→ ?加润滑剂和崩解剂混合→压片→(包衣)→质量检查→包装 (3)三主药混合制粒易产生低共熔现象,且可避免乙酰水杨酸与水直接接触防止水解。 (4)内外加法 (5)滑石粉在压片时易因振动而脱落,加入液状石蜡可使滑石粉更易于黏附在颗粒的表面,防止脱落。 2.分析鱼肝油乳的制备处方中各成分的作用。 处方鱼肝油368ml 吐温80 西黄蓍胶9g 甘油19g 苯甲酸 糖精 杏仁油香精 香蕉油香精 纯化水共制1000ml 解题过程与步骤: 处方中鱼肝油为主药,吐温80为乳化剂,西黄蓍胶为辅助乳化剂,甘油为稳定剂,苯甲酸为防腐剂,糖精为甜味剂,杏仁油香精、香蕉油香精为芳香矫味剂。
片剂
Tablets 1 掌握片剂中辅料的类型及各自的功能2 掌握片剂的制备工艺方法及流程3 掌握三种主要的压片工艺的特点及区别4 掌握常用的薄膜衣和肠溶衣材料5 掌握片剂的质量检查6 了解片剂的处方设计及研制Requirements Industrial pharmaceutics §Formulation §Preparation §Quality control Section 1概述 Contents 1 定义含有一种或多种药物的压缩或模制成型固体剂型 第一节概述
2 片剂的特性 ü剂量准确 ü利用刻痕可分剂量—二等分或四等分ü固体剂型,稳定性好 ü 易于临床用药及病人自行用药第一节概述 Characteristics of tablets-Continued Types of tablets-Continued
Conventional tablets Types of tablets-Continued v 泡腾片(Effervescent Tablets ) 产生气体: CO 2 酸碱对组和 碱: NaHCO 3Na 2CO 3 K 2CO 3KHCO 3 酸: citric acid, tartaric acid 遇水产生化学反应第一节概述 Types of tablets-Continued 第一节概述Types of tablets-Continued
v 咀嚼片(Chewable tablets )Examples :Vc 咀嚼片Aluminium Hydroxide 咀嚼片 Albendazole 咀嚼片 第一节概述Types of tablets-Continued 口含片(Troches )Types of tablets-Continued Examples: Nitroglycerin sublingual tablets Types of tablets-Continued
上光油配方设计和优化
上光油(OPV) 又称OPV(over print varnish),上光油是指涂覆在印刷品表面,起到增加光泽度、耐磨性、防水性及耐化学品性等的一种液体。上光油包括水性上光油、油性上光油、UV上光油、醇溶性上光油等品种。现在国内应用最多的是水性上光油,因其具备非常好的环保性能。 今天我们主要讨论水性上光油,水性上光油是指以水为载体的,水性乳液或水性树脂为连接料。 分类: 按涂布印刷方式可分为:胶印联线上光,凹印联线上光,脱机上光。 按性能要求可分为:高光耐磨,耐水,耐热,耐油脂。 按光泽可分为:高光光油,哑光光油。 材料的选择和优化: 1. 在配方中水性树脂的搭配需要具有非常好的成膜性,因为只有成膜良好才能提供好的附着力,优异的耐磨性等其他性能,当然在配方中可以添加少量的成膜助剂,如PM,DPM帮助成膜和提高流平性,但成膜助剂不能多添加,否则会影响抗粘连性。 2. 水溶性丙烯酸树脂液在配方中可以帮助流平,提高光泽和复溶性,但需注意水溶性丙烯酸树脂液添加过多,会造成附着力下降,影响干燥速度以及耐水性。所以不能为了提高光泽而无限制的添加水性溶性树脂液。 3. 蜡乳液品种非常多,在上光油中常用的有聚乙烯蜡,聚丙烯蜡,石蜡等产品。国内产品已经非常成熟。聚乙烯蜡乳液由于高的软化点,耐磨性能优异。如果上光油要求高光泽高透明性可以选择Carymul 7605,高耐磨性可以选择麦可门的ME 91240,Keim MD2000,D-816, 4. 润湿剂的选择非常关键,特别是针对冬天气温低,墨层厚的印刷品上光时,如果润湿剂添加不当,会出现水波纹,麻点,流平不佳等表面缺陷,这时可以选择Greesol A04PA,F04多功能润湿剂,可以帮助配方工程师解决多数表面缺陷和缩环产泡问题。 5. 爽滑耐磨剂在配方中与蜡乳液一起提供耐磨性,并具有非常爽滑的手感和改善抗粘性。Greesol LE6、L94具有非常好的耐磨性和爽滑手感,但需要注意添加量过多可能会对印后处理带来不良影响,如烫印不良。
处方筛选
第二部分、处方筛选 实验目的:考察药物在各种油相,表面活性剂,助表面活性剂中的溶解度,进行处方初步筛选,通过绘制三元相图确定处方及各相比例范围。 实验原理:水和氯仿的相互溶解度很小, 而醋酸却与水、氯仿互溶。在水和氯仿组成的两相混合物中加入醋酸, 能增大水和氯仿间的互溶度, 醋酸增多, 互溶度越大, 当加入醋酸到某一数量时, 水和氯仿能完全互溶, 原来由两相组成的混合体系由混变清。在温度恒定的情况下, 使两相体系变成均匀的混合物所需要的醋酸量, 取决于原来混合物中水和氯仿的比例。同样, 把水加到醋酸和氯仿的均相混合物中时, 当水达到一定数量时, 原来的均相体系变成水相和氯仿相的两相混合体系, 体系由清变混。使体系变成两相所需要的水量, 取决于醋酸和氯仿的起始成分。因此利用体系在相变化时的浑浊和清亮现象的出现。可以判断体系中各组分间互溶度的大小。一般由清到浊, 肉眼比较容易分辨。所以实验采用在均相样品中加入第三物质使之变成二相的方法, 测定两相间的相互溶解度。当二相共存并达到平衡时, 将二相分离, 测得二相的成分, 然后用直线连接这2点, 即得连接线。 实验材料: 仪器:恒温振荡器;离心机;高效液相色谱仪Waters2695(美国Waters公司)、Empower工作站、电子天平(JD500-3G,东莞永旭电子有限公司),西林瓶, 0.45μm微孔有机滤膜,10ml容量瓶 试剂:甲醇(色谱纯),油酸乙酯,肉豆蔻酸异丙酯,蓖麻油 聚氧乙烯蓖麻油,吐温80 ,Labrasol辛酸癸酸聚乙二醇甘油酯 正丁醇,Transcutol HP,无水乙醇,聚乙二醇400,丙二醇 二、苦参总黄酮在油,乳化剂,助乳化剂中的平衡溶解度研究 方案一:UV 标准曲线的建立 槲皮素4mg,溶于10ml 60%乙醇,即浓度为0.25mg/ml,分别稀释为如下浓度,530nm 下测定吸光度
(完整word版)处方分析题与答案
处方分析题答案 1.分析下列软膏基质的处方并写出制备方法。 处方:硬脂醇250g 油相,同时起辅助乳化及稳定作用 白凡士林250g 油相,同时防止水分蒸发并留下油膜,利于角质层水合而产生润滑作用 十二烷基硫酸钠10g 乳化剂 丙二醇120g 保湿剂 尼泊金甲酯0.25g 防腐剂 尼泊金丙酯0.15g 防腐剂 蒸馏水加至1000g 制备:取硬脂醇和白凡士林在水浴上融化,加热至75℃,加入预先溶在水中并加热至75℃的其他成分,搅拌至冷凝即得。 2.写出10%Vc注射液(抗坏血酸)的处方组成并分析? 维生素C 104g 主药 碳酸氢钠49g pH调节剂 亚硫酸氢钠0.05g 抗氧剂 依地酸二钠2g 金属络合剂 注射用水加至1000ml 溶剂 3. 分析下列处方并写出下列软膏基质的制备方法。 处方:硬脂酸甘油酯35g 油相 硬脂酸120g 油相 液体石蜡60g 油相,调节稠度
白凡士林10g 油相 羊毛脂50g 油相,调节吸湿性 三乙醇胺4g 水相,部分与硬脂酸形成有机皂其乳化作用 尼泊金乙酯1g 防腐剂 蒸馏水加之1000g 将油相成分(硬脂酸甘油酯,硬脂酸,液体石蜡,白凡士林,羊毛脂)与水相成分(三乙醇胺,尼泊金乙酯溶于蒸馏水中)分别加热至80℃,将熔融的油相加入水中,搅拌,制成O/W型乳剂基质。 4.处方分析,并写出制备小体积注射剂的工艺流程 肾上腺素1g 主药 依地酸二钠0.3g 金属络合剂 盐酸pH调节剂 氯化钠8g 渗透压调节剂 焦亚硫酸钠1g 抗氧剂 注射用水加至1000ml 溶剂 工艺流程:主药+附加剂+注射用溶剂配液滤过 灌封灭菌 安瓿洗涤干燥(灭菌) 成品包装印字质量检查检漏 5.分析处方,并指出采用何种方法制片?并简要写出其制备方法。 处方:呋喃妥因50g 糊精3g 淀粉30g 淀粉(冲浆10%) 4g
处方审核规范
最新| 医疗机构处方审核规范 为规范医疗机构处方审核工作,促进临床合理用药,保障患者用药安全,国家卫生健康委员会、国家中医药管理局、中央军委后勤保障部3部门联合制定了《医疗机构处方审核规范》(以下简称《规范》)。 《规范》共包括7章23条,对处方审核的基本要求、审核依据和流程、审核内容、审核质量管理、培训等作出规定。通过规范处方审核行为,一方面提高处方审核的质量和效率,促进临床合理用药;另一方面体现药师专业技术价值,转变药学服务模式,为患者提供更加优质、人性化的药学技术服务。 第一章总则 第一条为规范医疗机构处方审核工作,促进合理用药,保障患者用药安全,根据《中华人民共和国药品管理法》《医疗机构药事管理规定》《处方管理办法》《医院处方点评管理规范(试行)》等有关法律法规、规章制度,制定本规范。 第二条处方审核是指药学专业技术人员运用专业知识与实践技能,根据相关法律法规、规章制度与技术规范等,对医师在诊疗活动中为患者开具的处方,进行合法性、规范性和适宜性审核,并作出是否同意调配发药决定的药学技术服务。 审核的处方包括纸质处方、电子处方和医疗机构病区用药医嘱单。
第三条二级以上医院、妇幼保健院和专科疾病防治机构应当按照本规范执行,其他医疗机构参照执行。 第二章基本要求 第四条所有处方均应当经审核通过后方可进入划价收费和调配环节,未经审核通过的处方不得收费和调配。 第五条从事处方审核的药学专业技术人员(以下简称药师)应当满足以下条件: (一)取得药师及以上药学专业技术职务任职资格。 (二)具有3年及以上门急诊或病区处方调剂工作经验,接受过处方审核相应岗位的专业知识培训并考核合格。 第六条药师是处方审核工作的第一责任人。药师应当对处方各项内容进行逐一审核。医疗机构可以通过相关信息系统辅助药师开展处方审核。对信息系统筛选出的不合理处方及信息系统不能审核的部分,应当由药师进行人工审核。 第七条经药师审核后,认为存在用药不适宜时,应当告知处方医师,建议其修改或者重新开具处方;药师发现不合理用药,处方医师不同意修改时,药师应当作好记录并纳入处方点评;药师发现严重不合理用药或者用药错误时,应当拒绝调配,及时告知处方医师并记录,按照有关规定报告。 第八条医疗机构应当积极推进处方审核信息化,通过信息系统为处方审核提供必要的信息,如电子处方,以及医学相关检查、检验学资料、
处方筛选设计
FH2008处方筛选方案 用四因素四水平正交实验设计,氯解磷定的量:200-1000mg,硫酸阿托品:3-15mg, 盐酸苯那辛:3-15mg,地西泮:10-25mg. 地西泮(安定) 【适应症】(1)焦虑症及各种神经官能症。(2)失眠:尤对焦虑性失眠疗效极佳。(3)癫痫:可与其它抗癫痫药合用,治疗癫痫大发作或小发作,控制癫痫持续状态时应静脉注射。(4)各种原因引起的惊厥:如子痫、破伤风、小儿高烧惊厥等。(5)脑血管意外或脊髓损伤性肌强直或腰肌劳损、内镜检查等所致的肌肉痉挛。 【用量用法】口服:⑴抗焦虑:每次2.5~10mg,每日2~4次。严重状态时可增至每日15~30mg,分次服。⑵催眠:每次5~10mg,睡前服。⑶抗癫痫、抗惊厥:成人每次2.5~10mg,每日2~4次。6个月以上儿童,每次0.1mg/kg,每日3次。肌肉或缓慢静脉注射:每次10~20mg,必要时,4小时再重复1次。 【不良反应】(1)本品可致嗜睡、轻微头痛、乏力、运动失调,与剂量有关。老年患者更易出现以上反应。偶见低血压、呼吸抑制、视力模糊、皮疹、尿潴留、忧郁、精神紊乱、白细胞减少。高剂量时少数病人出现兴奋不安。(2)长期应用可致耐受性与依赖性,突然停药有戒断症状出现。易从小剂量用起。 复方氯解磷定注射液 成分: 2ml:氯解磷定0.4g,硫酸阿托品3mg,盐酸苯那辛3mg 适应症: 用于有机磷毒剂和有机磷农药中毒的解毒救治。 用法用量: 肌肉注射。必要时静脉注射。 根据中毒程度选好首次用量: 轻度中毒:0.5~1支。 中度中毒:1~2支,同时用氯解磷定600mg。 重度中毒:2~3支,同时用氯解磷定600~1200mg。 必要时,半小时后可酌情减量重复给药。
布洛芬片剂USP38
USP 38Official Monographs / Ibuprofen3829 Chromatographic system (see Chromatography ?621?)—The 1.5; the tailing factor is not more than 2.0; and the relative liquid chromatograph is equipped with a 254-nm detector standard deviation for replicate injections is not more than and a 4.6-mm × 15-cm column that contains 5-μm packing 2.0%. L7. The flow rate is about 2mL per minute. Chromatograph Procedure—Separately inject equal volumes (about 5μL) the System suitability solution, and record the peak responses of the Standard preparation and the Assay preparation into as directed for Procedure: the relative retention times are the chromatograph, record the chromatograms, and meas- about 1.3 for ibuprofen related compound C and 1.0 for ure the areas for the major peaks. Calculate the quantity, in ibuprofen; the resolution, R, between ibuprofen and mg, of C 13H18O2 in each mL of the Oral Suspension taken by ibuprofen related compound C is not less than 1.5; and the the formula: tailing factor is not more than 2.0. Chromatograph the Standard solution, and record the peak responses as directed125C(D/W U)(R U/R S) for Procedure: the relative standard deviation for replicate injections is not more than 2.0%.in which C is the concentration, in mg per mL, of USP Ibuprofen RS in the Standard preparation; D is the density, in Procedure—Separately inject equal volumes (about 35μL) g per mL, of Oral Suspension; W U is the weight, in g, of the of the Standard solution and the Test solution into the chro- portion of Oral Suspension taken to prepare the Assay prep-matograph, record the chromatograms, and measure the ar- aration; and R U and R S are the ratios of the ibuprofen peak eas for the major peaks. Calculate the percentage of areas to the benzophenone peak areas obtained from the ibuprofen related compound C in the Oral Suspension, Assay preparation and the Standard preparation, respectively. based on the labeled content of ibuprofen, taken by the formula: (12,500C/DL)(r U/r S) in which C is the concentration, in mg per mL, of USP Ibuprofen Tablets Ibuprofen Related Compound C RS in the Standard solution; D is the quantity, in mL, of Oral Suspension taken to pre-? Ibuprofen Tablets contain not less than pare the stock solution for the Assay preparation; L is the 90.0percent and not more than 110.0percent of labeled quantity, in mg, of ibuprofen in each mL of Oral Suspension; and r U and r S are the ibuprofen related com-the labeled amount of C13H18O2. pound C peak areas obtained from the Test solution and the Packaging and storage—Preserve in well-closed contain-Standard solution, respectively. Not more than 0.25% is ers. found. Labeling—Where the Tablets are gelatin-coated, the label Assay— so states. Mobile phase—Dilute 0.7mL of phosphoric acid with water to obtain 1000mL of 0.01 M phosphoric acid. Pre-USP Reference standards ?11?— pare a mixture of this solution and acetonitrile (63:37).USP Ibuprofen RS Make adjustments if necessary (see System Suitability under USP Ibuprofen Related Compound C RS USP Monographs Chromatography ?621?).Identification— Diluent—Prepare a mixture of acetonitrile and water A: Grind 1 Tablet to a fine powder in a mortar, add (1:1).about 5mL of chloroform, and swirl. Filter the mixture, and Internal standard solution—Prepare a solution of benzo-evaporate the filtrate with the aid of a stream of nitrogen to phenone in acetonitrile containing about 3.2mg per mL.dryness: the IR absorption spectrum of a mineral oil disper- sion of the residue so obtained exhibits maxima only at the Standard preparation—Quantitatively dissolve an accu- same wavelengths as that of a similar preparation of USP rately weighed quantity of USP Ibuprofen RS in Diluent to Ibuprofen RS. obtain a stock solution having a known concentration of about 1.2mg per mL. Transfer 20.0mL of this stock solution B: Its retention time, relative to that of the internal stan- and 5.0mL of Internal standard solution to a 50-mL volumet-dard, determined as directed in the Assay, corresponds to ric flask, dilute with acetonitrile to volume, mix, and filter.that of USP Ibuprofen RS. This solution contains about 0.48mg of ibuprofen per mL.Dissolution ?711?— Density—Using a tared 50-mL volumetric flask, weigh Medium: pH 7.2phosphate buffer (see under Buffers in 50mL of Oral Suspension that has been previously well the section Reagents, Indicators, and Solutions); 900mL. shaken to ensure homogeneity, allow to stand until the en-Apparatus 2: 50 rpm. trapped air has risen, and finally invert carefully just prior to Time: 60minutes. transferring it to the volumetric flask. From the observed Procedure—Determine the amount of C13H18O2 dissolved weight of 50mL of the Oral Suspension, calculate the den- from UV absorbances at the wavelength of maximum ab- sity, in g per mL, of the Oral Suspension. sorbance at about 221 nm of filtered portions of the solu-Assay preparation—Transfer an accurately weighed por- tion under test, suitably diluted with Dissolution Medium, if tion of Oral Suspension, equivalent to about 60mg of necessary, in comparison with a Standard solution having a ibuprofen, to a 50-mL volumetric flask, dilute with Diluent to known concentration of USP Ibuprofen RS in the same me-volume, and mix (stock solution). Transfer 20.0mL of this dium. [NOTE—Where the Tablets are labeled as gelatin- stock solution and 5.0mL of Internal standard solution to a coated, determine the amount of C13H18O2 dissolved from second 50-mL volumetric flask, dilute with acetonitrile to the UV absorbance at the wavelength of maximum absorb-volume, mix, and filter. [NOTE—Retain a portion of the stock ance at about 266 nm from which is subtracted the absorb-solution for use in the test for Limit of ibuprofen related com- ance at 280 nm, in comparison with the Standard solution pound C.] similarly measured.] Chromatographic system (see Chromatography ?621?)—The Tolerances—Not less than 80% (Q) of the labeled amount liquid chromatograph is equipped with a 220-nm detector of C13H18O2 is dissolved in 60minutes. and a 4.6-mm × 15-cm column that contains 5-μm packing Uniformity of dosage units ?905?: meet the require- L7. The flow rate is about 2mL per minute. Chromatograph ments. the Standard preparation, and record the peak responses as directed for Procedure: the relative retention times are about Water, Method I ?921?: not more than 5.0%, except that 0.9 for benzophenone and 1.0 for ibuprofen; the resolution,Tablets labeled as gelatin-coated are exempt from this re- R, between benzophenone and ibuprofen is not less than quirement.
