还原
成本还原的方法

245科技资讯 S CI EN CE & T EC HNO LO GY I NF OR MA TI ON 学 术 论 坛在《成本会计》教学中,如果进行成本计算的方法采用逐步结转法中的综合结转,就需要进行成本还原。
1 成本还原的原因逐步结转分步法就是为了计算半成品成本而采用的。
是按照生产步骤逐步计算并结转半成品成本,直到最后步骤计算出产成品成本的一种分步法。
按照结转的半成品成本在下一生产步骤产品成本明细账中的反映不同,逐步结转分步法可分为综合结转和分项结转两种方法,而综合结转法的特点是将上一步骤转入下一生产步骤的半成品,不分成本项目,以总的金额全部计入下一生产步骤产品生产成本明细账中的“直接材料”成本项目或“自制半成品”成本项目。
综合反映各步骤所耗上一步骤所产半成品成本,在综合结转法下,由于各个步骤的自制半成品都没有分成本项目,而是以合计金额直接全部转入到下一生产步骤中的“直接材料”或“自制半成品”项目中,而自制半成品的“制造费用”、“直接人工”等其他费用都计入了产成品的“直接材料”成本项目中,而产成品的“直接人工”、“制造费用”等其他费用相对也在产成品成本中所占比重很小,而产成品的“直接材料”的项目所占的比重很大,这显然不符合产成品成本的实际构成,不便于企业分析与考核产品成本的成本构成和水平。
2 成本还原的含义及种类2.1成本还原的含义就是从最后一个生产步骤起,把所耗上一步骤半成品的综合成本还原为按直接材料、直接人工、制造费用等原始成本项目反映的产成品成本资料。
即将各步骤所耗上一步骤的“”自制半成品成本,按上一生成本还原的方法张琳(黔西南民族职业技术学院 贵州兴义 562400)摘 要:成本会计中,成本计算的方法在采用逐步结转法中的综合结转方法时,不能体现完工产品在生产中所耗用的直接材料,就需要进行成本还原。
关键词:成本会计 成本还原 方法中图分类号:F230文献标识码:A 文章编号:1672-3791(2011)04(a)-0245-02表1产步骤所生产的自制半成品的成本构成进行分解,最后将各生产步骤同一成本项目的金额相加,得到按原始成本项目反映的产品成本。
TiCl4的还原 镁还原

2TiCl3+Mg=2TiCl2+MgCl2 △Go<0
TiCl2+Mg=Ti+MgCl2
△Go<0
YOUR SITE HERE
某些金属氯化物的∆G。值与温度的关系M*、B*·一金属熔点和沸点 ;M、B一氯化物熔点和沸点; 虚线一计算值;实线一实测值
二次反应:还原剂Mg不足的时发生以Ti为还原剂 的歧化反应。极大的降低还原效率。
YOUR SITE HERE
(2)操作过程
A:清洗过的镁锭加入反应 罐内。一 般还原剂过理论 量50%。 B:安装好反应器的大盖并 抽空检漏。 C:反应器吊入还原炉内, 在300℃下恒温脱水1小时, 继续升温,当温度达到 800℃时,加入TiCl4。加料 速度在反应初期比较慢,在 中期稍快,到后期再降低加 料速度。 D:在反应过程中,每隔一 定时间排放一次MgCl2。 (why)
间不会进一步降低 MgCl2含量。 ❖ 海绵钛结构:海绵钛的结构越致密,闭孔率越
1.避免了非联合法生产海绵钛的弊病及能耗高; 周期 长; 有玷污产品的可能。 2.还原蒸馏一体化工艺,实现了原料的闭路循环。所 用设备分。
YOUR SITE HERE
氧化钛电解直接提取钛
90%~95%; (3)930℃~ 960℃高温恒温阶段脱除占总量1%~2%的残
留MgCl2.
YOUR SITE HERE
真空蒸馏影响因素:
❖ 蒸馏温度:提高温度有利,但是过高会生成钛铁合金。 ❖ 压力:真空度高,有利于蒸馏物质的挥发,蒸馏速率越快 ❖ 蒸馏时间:当MgCl2含量降到一定程度以后,延长蒸馏时
YOUR SITE HERE
TiCl4的还原 镁还原
1.热力学分析 2.动力学分析 3.镁还原工艺
科学家证明还原任意魔方最多需20步

科学家15年证明还原任意魔方最多需20步魔方由匈牙利埃尔诺-鲁比克教授于1974年所发明,曾经是世界上最畅销的智力玩具。
据国外媒体报道,相信许多人都玩过魔方,但是此前没有人知道任意组合的魔方的最小还原步数究竟是多少。
这一问题困扰了数学家长达三十多年,这个最小还原步数也被称为“上帝之数”。
美国加利福尼亚州科学家(Morley Davidson, John Dethridge, Herbert Kociemba, 和Tomas Rokicki),近日利用计算机破解了这一谜团,他们证明任意组合的魔方均可以在20步之内还原,“上帝之数”正式定为20(God's Number is 20)。
这支研究团队位于美国加利福尼亚州帕洛阿尔托市。
科学家们通过计算机计算和证明,任意组合的魔方都可以在20步内还原。
这一结果表明,大约有10万多种的起始状态恰好可以在20步内还原。
利用谷歌公司计算机强大的计算能力,研究人员检验了魔方任何可能的混乱状态(确切数字为43,252,003,274,489,856,000约合4.3×1019)。
美国俄亥俄州肯特州立大学数学家莫雷-戴维德森教授也是研究人员之一,他表示,“我们现在可以肯定,这个‘上帝之数’就是20。
对于我来说,我也回到了原地。
魔方伴随着我成长,这也是我为什么深入研究这个数学问题的原因。
这个谜团引起了人们的广泛关注,它也许是人类历史上最受欢迎的谜语了。
”科学家们的初步研究成果发表于在线网站上,但戴维德森表示,他们准备将研究成果提交给杂志正式发表。
程序员托马斯-罗基花了15年的时间,致力于寻找这个谜团的答案。
据罗基介绍,研究团队所采用的算法可以在1秒钟内尝试10亿种可能,此前的计算机算法1秒钟内只能处理4000种可能。
为了让问题简单化,研究团队采用了一种所谓“群论”的数学技术。
他们首先将魔方所有可能的起始状态集分成22亿个集合,每个集合包含了195亿个可能的状态。
氧化还原

§5—1 条件电位一.能斯特方程1.电对的分类(1)可逆电对和不可逆电对可逆电对:在氧化还原反应的任一瞬间都能迅速地建立起氧化还原平衡且实际电位遵从能斯特方程的电对称为可逆电对,如:Fe2+-e Fe3+、Fe3+/Fe2+ .不可逆电对:在氧化还原反应的任一瞬间不能真正建立起按氧化还原反应所示的平衡的电对称为不可逆电对,如:MnO4-/Mn2+.(2)对称电对和不对称电对对称电对:氧化态和还原态的系数相同的电对称为对称电对,如:Fe3++e Fe2+ .不对称电对:氧化态和还原态系数不相同的电对称为不对称电对,如:Cr2O72-+14H++6e2Cr3++7H202.能斯特方程(1)可逆氧化还原电对电位的计算公式—能斯特方程对于均相可逆氧化还原电对aA+bB+…+ne pP+qQ+…式中E—电对电位,E°—电对的标准电位,a A、a B,…表示A、B,…的活度.R—气体常数,8.314J/(K·mol), T—绝对温度,F—法拉第常数,96487C/mol,n—反应中的电子转移数.注意:半反应中所有固态物质的活度为1,稀溶液中水的活度为1.当t=25° C时,(2)利用平衡常数计算电对电位例:(略)二.条件电位1.定义由上述讨论知,要根据能斯特方程计算氧化还原电对的电位,必须知道有关组分的活度,这在实际上常常是不可能的.在分析化学中,参与半反应各物质及生成各物质的总浓度是容易知道的,因此若以总浓度代替活度计算氧化还原电对的电位将带来极大的方便,为此,必须校正由(i)离子强度、(ii)有关组分的副反应引起的误差.要校正这两个因素造成的误差就必须在能斯特方程中引入α和γ对于前述半反应:a A=[A]γA=C AγA/αAa B=[B]γB=C BγB/αB…当浓度比时, 则—条件电位,它是在特定的条件下,氧化态和还原态的条件浓度比(浓度均为1mol/L)为1时的实际电位.在离子强度I、副反应系数α等条件不变时为一常数.关于需作以下说明:(1)许多情况下,I、α不一定不变,故并不真正是一常数,只能用作一些近似计算,但误差比用E°小得多.(2)E°与的关系类似于稳定常数K与条件稳定常数K´的关系.(3)当缺乏相同条件下的时,可用相近条件下的代替.§5—2 氧化还原反应平衡常数和化学计量点电位的计算一.氧化还原平衡常数的计算1.计算公式n1、n2—半反应的电子转移数,n-n1、n2的最小公倍数,—为给定氧化还原反应中氧化剂的标准电位或条件电位,—为给定氧化还原反应中还原剂的标准电位或条件电位,K—平衡常数,K´—条件平衡常数.2.公式推导考虑一般情况,以有不对称电对参加的氧化还原情况进行推导.设氧化还原反应为:O1+n1R2n1O2+n2aR1 (O—氧化剂,R—还原剂)n有关半反应:O1+n1e aR1O2+n2e R2反应达到平衡时必有E1=E2,故两边同乘以n1和n2的最小公倍数n并整理得:考虑溶液种的副反应的影响,以相应的条件电位、总浓度代替上式中的标准电位和活度,则:(证毕).3.欲使反应定量进行对lgK´或的要求(1) 对lgK´的要求以反应n2O1+n1R2n1O2+n2R1为例欲使反应定量进行(TE≤0.1%),则有:若n1=n2=1, K´=106n1=1,n2=2, K´=109 等等.(2)对的要求由得:若n1=n2=1,lgK´≥6若n1=1,n2=2,lgK´≥9一般若>0.4伏,则反应就能定量进行.二.计量点电位的计算(对可逆氧化还原反应而言)1.计算公式对反应(两个均为不对称电对)n2aO1+n1bR2n2cR1+n1dO2对反应(一个为不对称电对)n2O1+n1R2n1O2+n2aR1对反应(两个均为对称电对)n2O1+n1R2n1O2+n2R12.公式推导以反应n2aO1+n1bR2n2cR1+n1dO2计量点时的计算公式为例, 有关半反应:aO1+n1e cR1dO2+n2e bR2计量点时E1=E2=E sp,(1)×n1+(2)×n2得:由反应式可知,计量点时,O1毫摩尔数:R2毫摩尔数=n2a:n1b等体积,则: [O1]sp:[R2]sp=n2a:n1b 或: n1b[O1]sp=n2a[R2]sp由此,同理:把(4),(5)代入(3)得:若以条件电位表示,则:(证毕)余下两个公式自证.3.计算示例例:在合适的酸性溶液中,,. 今以mol/L K2Cr2O7标准溶液滴定0.2000 mol/LFe2+溶液,计算计量点电位.解:将反应式Cr2O72++6Fe2++14H+2Cr3++6Fe3+ 与反应式n2aO1+n1bR2n2cR1+n1dO2相比得:a=1,n1b=6,n2c=2,n1d=6,又n1=6,n2=1. 代入计算公式得:n则:a=1/n2=1,b=6/n1=1,c=2/n22,d=6/n1=1.§5—3 影响氧化还原反应速度的因素一.浓度对反应速度的影响1.质量作用定律对总反应的速度不适用,只适用于基元反应.如:H2O2+2I-+2H+=I2+H2O其反应速度为(假设各反应物的浓度相等):v=KC2而不是, v=KC5这是因为反应分三步进行. (慢) I -+H 2O 2IO -+H 2O (快) IO -+H +HIO (快) HIO+I -+H +I 2+H 2O因为总反应速度取决于各反应中速度最慢的一个,所以v=KC 2. 2.一般讲,增大反应物的浓度,反应速度加快. 二.温度对反应速度的影响 一般说,温度增加10℃,反应速度可加快2—4倍,在反应中应根据需要控制合适的温度. 三.催化剂和诱导反应1.催化剂对反应速度的影响加入催化剂改变了反应的历程从而改变反应的速度,正催化剂加快反应速度,如I -可加速下述反应: Ce 4++As(Ⅲ)─→Ce 3++As(Ⅴ) 2.自动催化反应生成物本身起催化作用的反应叫自动催化反应,如KMnO 4与C 2O 42-反应生成的Mn 2+就可起自动催化作用. 3.诱导反应对反应速度的影响(1)诱导作用 一个反应发生促使另一个反应进行的现象称诱导作用. 如:反应)反应)MnO 4-—作用体,Fe 2+—诱导体,Cl -—受诱体 (2)诱导反应对反应速度的影响加快反应速度,但诱导反应在滴定分析中一般是有害的. §5—4 氧化还原滴定 一.滴定曲线1.可逆氧化还原体系的滴定曲线可逆氧化还原体系的滴定曲线可以用实验方法测绘,也可以根据能斯特方程计算绘制. (1)滴定过程中E 的计算以0.1000 mol/L Ce(SO 4)2滴定20.00 mL 0.1000 mol/L Fe 2+为例. ()a.滴定前溶液组成: Fe 2++Fe 3+(极少量),E 无法计算. b.滴定开始至计量点前溶液组成: Ce 3++Fe 2++Fe 3++Ce 4+(极少量).由Fe 3+/Fe 2+电对计算E,如加入19.98 mL 0.1000 mol/L Ce 4+, c.计量点溶液组成: Ce 3++Fe 3++Fe 2+(极少量)+Ce 4+(极少量). d.计量点后溶液组成: Ce4+(过量)+Fe3++Fe2+(极少量)+Ce3+.由Ce4+/Ce3+电对计算E,如加入20.02 mL 0.1000 mol/L Ce4+,(2)滴定曲线a.滴定曲线b.滴定突跃范围的计算及影响滴定突跃的因素对可逆对对称电对参与的氧化还原反应,n2O1+n1R2n1O2+n2R1滴定突跃范围为:或:若n1=n2,则即E sp在滴定突跃中心,滴定曲线在计量点前后基本对称.若n1≠n2, 不在滴定突跃中心,而是偏向电子转移数较大的一方,滴定曲线在计量点前后不对称.如: Ce4++Fe2+Ce3++Fe3+突跃范围为0.86-1.26,E sp=(0.86+1.26)/2=1.06 恰在突跃中心.而: 2Fe3++Sn2+2Fe2++Sn4+突跃范围为0.23-0.52,E sp=(1×0.70+2×0.14)/(1+2)=0.33≠(0.23+0.52)/2,不在突跃中心. 由上可知,影响突跃范围的因素主要有:(i),差值越大,突跃越大,(ii)n1,n2.2.不可逆体系的滴定曲线因不可逆电对的电位不遵从能斯特方程,故不可逆氧化还原反应体系的滴定曲线只能通过实验测绘.二.氧化还原滴定中的指示剂1.氧化还原指示剂的分类三类:自身指示剂,显色(专用、特殊)指示剂,本身发生氧化还原反应的指示剂.2.自身指示剂利用标准溶液或被滴定物质本身的颜色指示终点(滴定时无需另加指示剂),这种物质叫自身指示剂.如KMnO4法中的KMnO4(紫色)就可作为指示剂.3.显色指示剂本身不能发生氧化还原反应,但能与氧化剂或还原剂生成特殊颜色以指示终点的物质称为显色指示剂.如可溶性淀粉常用作碘量法的显色指示剂.(有人认为碘—淀粉化合物是I5-在淀粉的葡萄糖结构中通过I与H间的范德华力结合而成的络合物,M.Naffemeyer etal., Nature, 259,629 (1976))4.本身发生氧化还原反应的指示剂(1)原理这类指示剂的氧化态和还原态具有不同的颜色.在滴定过程中,指示剂由氧化态变为还原态或由还原态变为氧化态而引起颜色的突变指示滴定终点,如K2Cr2O7测Fe时,用二苯胺磺酸纳作指示剂,终点前无色,终点时溶液显紫色.(2)指示剂变色范围In(O)+ne=In(R)当[In(O)]/[[In(R)]≥10时,显氧化态的颜色,当[In(O)/[In(R)]≤0.1时,显还原态的颜色,故指示剂的变色范围:(3)选择试剂的原则a.指示剂变色的电位范围应在滴定突跃范围内,即:或粗略表示为():b.计量点前后混合色变化应明显.三.氧化还原滴定的预处理1.目的:使待测组分定量的转化为一定价态.§5—5 氧化还原滴定的计算一.百分含量的计算1.化学计量系数的确定设待测组分X经过一系列反应得到Z后,用滴定剂T来滴定,由各步反应的计量关系可得出:aX bY...cZ dT故aX dT2.待测组分X百分含量的计算C T-滴定剂的浓度(mol/L),V T-消耗滴定剂的体积(mL),M X-X的摩尔质量(g/mol),m S-样品的质量.3.计算示例(略)三.终点误差的计算1.计算公式:对反应n2O1+yn1R2n1O2+xn2R1 终点误差:式中,n1、n2分别为半反应中转移的电子数,ΔE=E终-E等(E终为指示剂变色时的电位),由此知ΔE相差越大,TE越大.2.公式推导以反应:n 2O1+yn1R2n1O2+xn2R1为例有关半反应:设n为n1,n2的最小公倍数,则有:又设被滴定还原剂R2在滴定终点与化学计量点(等当点)时的分析浓度分别为C R2终、C R2等;物质O1、R2、R1、O2在滴定终点与化学计量点并达平衡时的平衡浓度为[O1]终、[R2]终、[R1]终、[O2]终;[O1]等、[R2]等、[R1]等和[O2]等.化学计量点时,O1与R2按上述反应式的比例转化为R1和O2;由于滴定反应一般进行比较完全,故此时O1和R2的剩余量均甚微且有以下关系:O1毫摩尔数:R2毫摩尔数=n/n1:yn/n2因等体积则有:[O1]等:[R2]等=n/n1:yn/n2即:(yn/n2)[O1]等=(n/n1)[R2]等如果滴定终点与等当点不一致,则:(yn/n2)[O1]终≠(n/n1)[R2]终根据终点误差的定义因为V终≈V等, (n/n1)[R2]等≈(n/n1)[R2]终, C R2等≈C R2终则设滴定终点与等当点电位的差为ΔE,即:ΔE=E终-E等对半反应: O1+n1e xR1则对半反应:O2+n2e yR2类上处理得:将:(2)、(3)代入得:由前讨论可知,在等当点达平衡时,有(yn/n2)[O1]等=(n/n1)[R2] (5)(5)代入得:又在滴定过程中,R2以一定比例转化为O2,即: C R2等≈C R2终[R2]转:[O2]转=y(n/n2):n/n2=y:1 则:[R2]转=y[O2]转∴ C R2终≈C R2等=[R2]等+y[O2]等=y[O2]等 (7)(7)代入(6)得:由可得:(9)代入(10) 得:(10)式即为计算终点误差公式[详见化学通报(11)52,(1988)]3.计算示例例1: 在H2SO4介质中,用0.1000mol/L的Ce4+滴定0.1000mol/L的Fe2+,指示剂变色点电位为0.94V,试计算终点误差(已知:E°'Ce4+/Ce3+=1.44V, E o'Fe3+/Fe2+=0.68V).解: Ce4++e Ce3+, Fe3++e Fe2+Ce4++Fe2+Ce3++Fe3+因为n1=1, n2=1, x=1, y=1 E等=(1.44+0.68)/2=1.06V ΔE=E终-E等=0.94-1.06=-0.12V例2: 在合适的酸性溶液中,E°'Cr2O72-/Cr3+=1.00V, E°'Fe3+/Fe2+=0.68V,今用0.1000N K2Cr2O7标准溶液滴定0.1000N Fe2+溶液,E终=0.84V,求终点误差.解:Cr2O72-+6e+14H+2Cr3++7H2O Fe3++e Fe2+ Cr2O72-+6Fe2++14H+2Cr3++6Fe3++7H2O因为n1=6,n2=1,x=2,y=1ΔE=E终-E等=0.84-0.97=-0.13V§5—6 常用的氧化还原滴定法一.KMnO4法二.K2Cr2O7法(加H3PO4的作用)三.碘量法(误差的来源)四.其它氧化还原滴定法补充题:1.锌还原器可将Ti(IV)Ti(III),将Fe(III)Fe(II),而银还原器(金属银浸于1M HCl中)只能将Fe(III)Fe(II),不能将Ti(IV)还原,试从电极电位说明之.2.已知E°Pb2+/Pb=-0.126伏PbI2的Ksp=1.0×10-8.求半电池反应:PbI2(s)+2e Pb+2I-的标准电位.3.已知E°Fe3+/Fe2+=0.77伏,1M H2SO4中它的克式量电位是0.68伏,问:(1)在1M H2SO4中,邻二氮菲与Fe3+和Fe2+生成的络合物使铁电对的克式量电位E°'Fe(Ph)33+/Fe(Ph)32+=1.06伏,这两种络合物哪个比较稳定?其稳定常数比为何?(2)计算Fe3+/Fe2+电对在pH=3的10-2M EDTA溶液中的克式量电位(3)从Fe(CN)63-+e Fe(CN)64-的E°=0.36伏及Fe(CN)64-之稳定常数K=1037求Fe(CN)63-的稳定常数.4.计算在0.1M HCl中,Fe(CN)63-/Fe(CN)64-电对的克式量电位,H3Fe(CN)6是强酸,H4Fe(CN)6的Ka3=6×10-3,Ka4=6.8×10-5.5.计算下列反应的平衡常数(在1M HCl介质中): 2Fe3++3I-2Fe2++I3-E°'Fe3+/Fe2+=0.76伏, E I3-/3I-=0.536V.当25mL 0.05M Fe3+与25mL 0.15M I-混合后,溶液中残留的Fe3+还有百分之几?如何才能做到定量测定Fe3+?6.下列电池的电动势是0.3000伏.(一)饱和甘汞|Zn2+, ZnY2-,HgY2-|Hg(+)其中Zn2+, ZnY2-,HgY2-, 摩尔浓度分别为:1.0×10-3,1.0×10-2, 1.0×10-4M,从这些数据中计算ZnY2-的形成常数,(饱和甘汞电极电位为+0.2438V,电池电动势=E+-E-7.若1.00mL KMnO4相当于0.125克Fe2+,1.00mL KHC2O4·H2C2O4溶液可以和0.175mL KMnO4反应;则1.00mL比KHC2O4·H2C2O4可以中和0.200M NaOH多少毫升?8.混合KHC2O4·H2C2O4·2H2O及Na2C2O4,使其配成溶液作还原剂时之当量浓度为用作酸时当量浓度的2.150倍,求此混和物中两者之重量比是多少?解:设WKHC2O4·H2C2O4·2H2O(记为x)与WNa2C2O4(记为y)之比为a .由题可得:解之,a=1.55即:9.对反应n1Ox1+n2Red2+n2C H+n1bOx2+n2aRed1+n2(C/2)H2O证明等当点电位之计算公式为:(参见《大学化学》55,3(3),1988)10.对于氧化还原反应:(1).计算下列条件下得平衡常数值:用0.2000M M3+离子溶液滴定50.00mL 0.1000M A2+离子溶液,当加入49.95mL 滴定剂时,所有的A2+离子基本上已经反应,多加2滴(0.10mL)滴定剂,PA的值改变2个单位.(2)对于以上K值,两个氧化还原电位的标准电位的差是多少?解:(1)由反应A2++2M3+A4++2M2+知:又知:达等量点时,至加入50.00mL的M3+溶液,当加入49.95mL时又再加入0.01mL 对[M2+],[M3+],[A4+]的改变可忽略不计,而[A2+]则降低了100倍故:(2)由,n1=2, n2=1,K=1.0×1011。
经典合成反应操作--酮还原成亚甲基
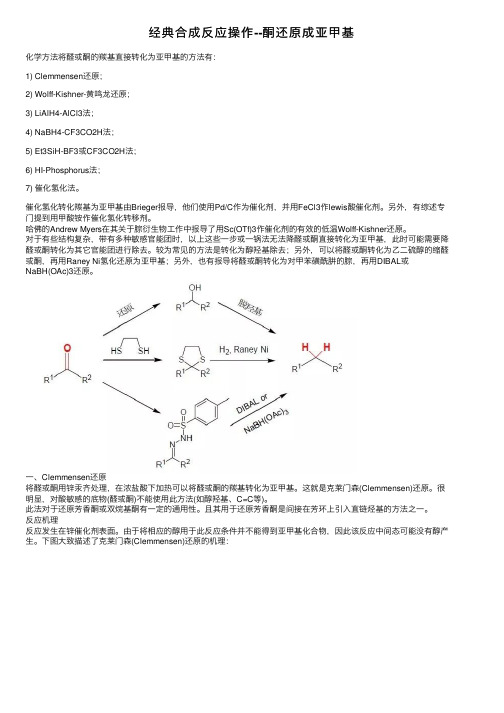
经典合成反应操作--酮还原成亚甲基化学⽅法将醛或酮的羰基直接转化为亚甲基的⽅法有:1) Clemmensen还原;2) Wolff-Kishner-黄鸣龙还原;3) LiAlH4-AlCl3法;4) NaBH4-CF3CO2H法;5) Et3SiH-BF3或CF3CO2H法;6) HI-Phosphorus法;7) 催化氢化法。
催化氢化转化羰基为亚甲基由Brieger报导,他们使⽤Pd/C作为催化剂,并⽤FeCl3作lewis酸催化剂。
另外,有综述专门提到⽤甲酸铵作催化氢化转移剂。
哈佛的Andrew Myers在其关于腙衍⽣物⼯作中报导了⽤Sc(OTf)3作催化剂的有效的低温Wolff-Kishner还原。
对于有些结构复杂,带有多种敏感官能团时,以上这些⼀步或⼀锅法⽆法降醛或酮直接转化为亚甲基,此时可能需要降醛或酮转化为其它官能团进⾏除去。
较为常见的⽅法是转化为醇羟基除去;另外,可以将醛或酮转化为⼄⼆硫醇的缩醛或酮,再⽤Raney Ni氢化还原为亚甲基;另外,也有报导将醛或酮转化为对甲苯磺酰肼的腙,再⽤DIBAL或NaBH(OAc)3还原。
⼀、Clemmensen还原将醛或酮⽤锌汞齐处理,在浓盐酸下加热可以将醛或酮的羰基转化为亚甲基。
这就是克莱门森(Clemmensen)还原。
很明显,对酸敏感的底物(醛或酮)不能使⽤此⽅法(如醇羟基、C=C等)。
此法对于还原芳⾹酮或双烷基酮有⼀定的通⽤性。
且其⽤于还原芳⾹酮是间接在芳环上引⼊直链烃基的⽅法之⼀。
反应机理反应发⽣在锌催化剂表⾯。
由于将相应的醇⽤于此反应条件并不能得到亚甲基化合物,因此该反应中间态可能没有醇产⽣。
下图⼤致描述了克莱门森(Clemmensen)还原的机理:实例1. Clemmensen还原芳基酮于1L的圆底烧瓶中,加⼊120克锌粉、12克氯化汞、200ml⽔,5-6ml浓盐酸,振摇后将液体倒出抛弃。
随后依次加⼊75ml⽔,175ml浓盐酸,100ml甲苯,50克(0.28mol) β-苯甲酰基丙酸。
找回还原精灵密码的七种方法

找回还原精灵密码的七种方法方法一:临时解决办法如果在忘记还原精灵密码后,你安装了一个新程序,该软件提示要求重启计算机,此时不要点击“确定”按钮,选择“以后重启”。
然后在“开始→关闭系统”中选择“重新启动计算机”,注意此时一定要按住Shift按键不放,这样计算机将直接重新加载系统程序,从而绕过还原精灵的保护。
方法二:长期解决办法如果想长期保存自己的文件,就必须卸掉还原精灵或者取得还原精灵的管理员密码,要卸掉还原精灵其实不难,网上有专门清除还原精灵的程序“还原精灵清除器”,运行以后直接清除还原精灵的密码。
不过需要注意,由于还原精灵是在硬盘最重要的主引导记录MBR里面做的文章,所以使用这个还原精灵清除器有一定的危险。
方法三:利用初始密码还原卡都有默认的初始化密码,如果你压根儿就没有修改过它的默认密码的话,就简单多了,因为还原精灵的默认密码是12345678!简单吧?方法四:写信索取密码在安装还原精灵时会带有一个还原精灵辅助工具,即厂商提供的密码读取工具readpwd.exe,运行它也可以得到还原精灵的加密密码,格式类似这样:[DB][B8][5E][79][3E][3B][5E][C5][BD][B2],把该加密密码发送到这个信箱:info@,只需一两天就可以得到软件开发商发来的密码。
这样,无需任何软件,简单的几下就可以得到还原精灵的密码!反过来讲任何人用这个方法都可以得到还原精灵的密码,包括受限制的用户!所以大家要保存好密码读取工具readpwd.exe,将它改名隐藏或干脆删除,这样就安全多了。
方法五:重写主引导扇区还原精灵会截取系统的底层功能调用,在硬盘的主引导区留下自己的痕迹。
硬盘的主引导区存放的是系统的主引导信息、分区信息,一般说来病毒对它非常感兴趣。
如果我们能先于还原精灵占有硬盘的主引导扇区(MBR),那么我们就可以对硬盘拥有最大的管理权限,换句话说,还原精灵已经被我们“干掉”了。
依据上面如上原理,用fidisk/mbr命令重写主引导扇区,然后重新启动计算机,这样还原精灵就没有了方法六:利用16进制文件编辑器WinHex的内存搜索编辑功能可以帮我们找回丢失的还原精灵密码。
镍还原,渣型原理
证硫、磷和夹杂物的去除,以获得所需的合金成分,但渣量过大时,热量和金属的损失也增大。
因此,炉渣在保证冶炼操作的顺利进行,冶炼金属熔体的成分和质量,金属的回收率以及冶炼的各项技术经济指标等方面都起了决定性的作用,渣型的选择对镍铁的还原熔炼具有非常重要的意义。
由于大部分炉渣中常见的氧化物都有很高的熔点,冶炼温度下,这些氧化物很难熔化,因此,为了优化渣的性能,一方面可以加入一定的熔剂造渣,使矿石中的酸性脉石、焦粉中的灰分等相互作用形成熔点低于原氧化物熔点的复杂化合物,降低炉渣的熔点并使炉渣具有良好的流动性,从而易于实现金属相和渣相的分离,提高金属回收率另一方面,可通过添加剂的作用,促使复杂氧化物分解,提高主要金属氧化物的活度,以降低其开始还原的温度。
4.1镍铁还原的热力学原理
4.1.1氧化镍还原的热力学
氧化镍的固体碳还原的反应为:
NiO+C==Ni+CO(4-l)
2NiO+C=2Ni+CO2(4-2)
生成物CO与CO2的相对比例取决于C-CO-),及常压下CO的平衡浓度和温度的关系,当温度低于1000℃时,碳的气化反应平衡成分中CO、CO2共存,反应(4-l)、(4-2)同时存在,即NiO与C反应生成Ni、CO和CO2。
化学方程式——氧化还原反应
1、硝酸银与盐酸及可溶性盐酸盐溶液:Ag++Cl-=AgCl↓2、2、钠与水反应:2Na+2H2O=2Na++2OH–+H2↑3、3、钠与硫酸铜溶液:2Na+2H2O+Cu2+=2Na++Cu(OH)2↓+H2↑4、4、过氧化钠与水反应:2Na2O+2H2O=4Na++4OH–+O2↑5、碳酸氢盐溶液与强酸溶液混合:HCO3-+H+=CO2↑+H2O6、碳酸氢盐溶液与醋酸溶液混合:HCO3-+CH3COOH=CO2↑+H2O+CH3COO-7、7、氢氧化钙溶液与碳酸氢镁反应:Ca2++2OH-+2HCO3-+Mg2+=Mg(OH)2↓+CaCO3↓向碳酸氢钙溶液中加入过量的氢氧化钠:2HCO3-+Ca2++2OH–=CaCO3↓+2H2O+CO32–9、向碳酸氢钙溶液中加入少量的氢氧化钠:Ca2++HCO3-+OH–=CaCO3↓+H2O10、澄清石灰水与少量小苏打溶液混合:Ca2++OH–+HCO3-=CaCO3↓+H2O11、澄清石灰水通入少量CO2:Ca2++2OH–+CO3=CaCO3↓+H2O12、澄清石灰水通入过量CO2:OH–+CO2=HCO3-13、碳酸氢钠溶液与少量石灰水反应:Ca2++2OH–+2HCO3-=CaCO3↓+CO32–+2H2O14、碳酸氢钠溶液与过量石灰水反应:HCO3-+OH–+Ca2+=CaCO3↓+H2O15、等物质的量氢氧化钡溶液与碳酸氢铵溶液混合:Ba2++2OH–+NH4++HCO3-=BaCO3↓+H2O+NH3•H2O16、碳酸钠溶液与盐酸反应:CO32–+H+=HCO3- 或CO32–+2H+=CO2↑+H2O17、向氢氧化钠溶液中通入少量的CO2¬:CO2+2OH–=CO32–+H2O18、过量的CO2通入氢氧化钠溶液中:CO2+OH–=HCO3-19、碳酸氢铵溶液中加入过量氢氧化钠溶液:NH4++HCO3-+2OH–=NH3↑+CO32–+2H2O20、碳酸钙与盐酸反应:CaCO3+2H+=Ca2++CO2↑+H2O21、碳酸钙与醋酸反应:CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑+H2O22、澄清石灰水与稀盐酸反应:H++OH–=H2O23、磷酸溶液与少量澄清石灰水:H3PO4+OH–=H2O+H2PO4–24、磷酸溶液与过量澄清石灰水:2H3PO4+3Ca2++6OH–=Ca3(PO4)2↓+6H2O25、碳酸镁溶于强酸:MgCO3+2H+=Mg2++CO2↑+H2O26、硫酸镁溶液跟氢氧化钡溶液反应:Ba2++2OH–+Mg2++SO42–=BaSO4↓+Mg(OH)2↓27、硫酸溶液跟氢氧化钡溶液反应:Ba2++2OH–+2H++SO42–=BaSO4↓+2H2O28、硫酸氢钠溶液与氢氧化钡反应至中性:2H++SO42–+2OH–+Ba2+=2H2O+BaSO4↓29、硫酸氢钠溶液与氢氧化钡反应至硫酸根完全沉淀:H++SO42–+OH–+Ba2+=BaSO4↓+H2O30、硫酸铝溶液中加入过量氢氧化钡溶液:2Al3++3SO42–+8OH–+3Ba2+=3BaSO4↓+2AlO2–+4H2O31、氢氧化镁与稀硫酸反应:Mg(OH)2+2H+=Mg2++2H2O32、铝跟氢氧化钠溶液反应:2Al+2OH–+2H2O=2AlO2–+3H2↑33、物质的量之比为1:1NaAl合金置于水中:Na+Al+2H2O=Na++AlO2–+2H2↑34、氧化铝溶于强碱溶液:Al2O3+2OH–=2AlO2–+H2O35、氧化铝溶于强酸溶液:Al2O3+6H+=2Al3++3H2O36、氢氧化铝与氢氧化钠溶液:Al(OH)3+OH–=AlO2–+2H2O37、氢氧化铝与盐酸溶液反应:Al(OH)3+3H+=Al3++3H2O38、硫酸铝溶液与碳酸氢钠溶液:Al3++3HCO3-=Al(OH)3↓+CO2↑39、硫酸铝溶液与碳酸钠溶液:2Al3++3CO32–+3H2O=2Al(OH)3↓+3CO2↑40、氯化铝溶液中加入过量氨水:Al3++3NH3•H2O=Al(OH)3↓+3NH4+41、明矾溶液加热水解生成沉淀:Al3++3H2O=Al(OH)3↓+3H+42、氯化铝溶液与偏铝酸钠溶液:Al3++3AlO2–+6H2O=4Al(OH)3↓43、偏铝酸钠溶液中加入氯化铁溶液:Fe3++3AlO2–+6H2O=Fe(OH)3↓+3Al(OH)3↓44、偏铝酸钠溶液中加入少量盐酸:AlO2–+H++H2O=Al(OH)3↓45、偏铝酸钠溶液中加入过量盐酸:AlO2–+4H+=Al3++2H2O46、偏铝酸钠溶液中加入氯化铵溶液:AlO2–+NH4++H2O=Al(OH)3↓+NH3↑47、金属铁溶于盐酸中:Fe+2H+=Fe2++H2↑48、铁粉与氯化铁溶液反应:Fe+2Fe3+=3Fe2+49、铜与氯化铁溶液反应:Cu+2Fe3+=Cu2++3Fe2+50、硫化亚铁与盐酸反应:FeS+H+=Fe2++H2S↑51、硫化钠与盐酸反应:S2–+2H+=H2S↑52、硫化钠溶液中加入溴水:S2–+Br2=S↓+2Br–53、氯化亚铁溶液中通入氯气:2Fe2++Cl2=2Fe3++2Cl–54、向硫酸铁的酸性溶液中通入足量的H2S:2Fe3++H2S=2Fe2++S↓+2H+55、氯化铁溶液中滴加少量硫化钠溶液:2Fe3++S2–=S↓+2Fe2+56、硫化钠溶液中滴加少量氯化铁溶液:2Fe3++3S2–=S↓+2FeS↓57、氯化铁溶液中滴加少量碘化钾溶液:2Fe3++2I–=2Fe2++I258、氯化铁溶液与氢氧化钠溶液反应:Fe3++3OH–=Fe(OH)3↓59、氯化铁溶液跟过量氨水反应:Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+60、氯化铁溶液与硫氰化钾溶液:Fe3++3SCN–=Fe(SCN)361、氯化铁溶液跟过量锌粉反应:2Fe3++3Zn=2Fe+3Zn2+62、锌与稀硫酸:Zn+2H+=Zn2++H2↑63、锌与醋酸:Zn+2CH3COOH=CH3COO–+Zn2++H2↑64、锌与氯化铵溶液:Zn+2NH4+=Zn2++NH3↑+H2↑65、氯化铁溶液加入碘化钾溶液:2Fe3++2I-=2Fe2++I266、硫酸亚铁溶液中加用硫酸酸化的过氧化氢溶液:2Fe2++H2O2+2H+=2Fe3++2H2O67、硫酸亚铁溶液中加用硫酸酸化的高锰酸钾溶液:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O68、四氧化三铁溶于浓盐酸:Fe3O4+8H+=2Fe3++Fe2++4H2O69、氧化铁溶于盐酸:Fe2O3+6H+=2Fe3++3H2O70、氧化铁溶于氢碘酸溶液:Fe2O3+2I-+6H+=2Fe2++I2+3H2O71、用氯化铁与沸水反应制氢氧化铁胶体:Fe3++3H2O Fe(OH)3+3H+72、向溴化亚铁溶液通入足量的氯气:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-73、向溴化亚铁溶液通入少量氯气:2Fe2++Cl2=2Fe3++2Cl-74、向碘化亚铁溶液通入足量氯气:2Fe2++4I-+3Cl2=2Fe3++2I2+6Cl-75、向碘化亚铁溶液通入少量氯气:2I-+Cl2=I2+2Cl-76、碘化钾溶液中加入氯水:2I-+Cl2=I2+2Cl-77、碘化钾溶液中加入过量氯水:I-+3Cl2+3H2O=6H++IO3-+6Cl-78、溴化钠溶液中加入氯水:2Br-+Cl2=Br2+2Cl-79、亚硫酸溶液中加入氯水:H2SO3+Cl2+H2O=4H++2Cl-+SO42-80、亚硫酸溶液中加入氯化铁:H2SO3+2Fe2++H2O=4H++2Fe2++SO42-81、亚硫酸溶液中加入双氧水:H2SO3++H2O2=2H++H2O+SO42-82、氯气通入水中:Cl2+H2O=H++Cl-+HClO83、氯气通入碳酸氢钠溶液中:Cl2+HCO3=Cl-+CO2+HClO84、亚硫酸钠溶液中加入溴水:SO32-+H2O+Br2=SO42-+Br-+2H+85、亚硫酸钠溶液中加入双氧水:SO32-+H2O2=SO42-+2H2O86、二氧化硫通入溴水中:SO2+Br2+2H2O=4H++2Br-+SO42-87、单质铁溶于过量稀硝酸中(NO):Fe+NO3-+4H+=Fe3++NO↑+2H2O88、过量单质铁溶于稀硝酸中(NO):3Fe+2NO3-+8H+=3Fe2++2NO↑+4H2O89、单质铜与稀硝酸反应:3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O90、单质铜与浓硝酸反应:Cu+2NO3-+4H+=Cu2++2NO2↑+2H2O91、铜片插入硝酸银溶液:2Ag++Cu=2Ag+Cu2+92、用氨水吸收少量SO2:SO2+2NH3+H2O=2NH4++SO32-93、用氨水吸收过量的SO¬2 :SO2+NH3+H2O=NH4++HSO3-94、稀硝酸中通入SO2:3SO2+2NO3-+2H2O=3SO42-+2NO↑+4H+95、浓硝酸中通入SO2:SO2+2NO3-=SO42-+2NO2↑96、氯化铵与氢氧化钠两种浓溶液混合加热:NH4++OH- NH3↑+H2O97、向次氯酸钙溶液中通入SO2:Ca2++SO2+ClO-+H2O=CaSO4↓+Cl-+2H+98、用碳酸钠溶液吸收过量SO2:CO32-+H2O+2SO2=CO2↑+2HSO3-99、硫酸铜溶液中通入硫化氢:H2S+Cu2+=CuS↓+2H+100、硫酸铜溶液中加入硫化钠溶液:S2-+Cu2+=CuS↓101、电解饱和食盐水:2Cl-+2H2O 2OH-+H2↑+Cl2↑102、电解硫酸铜溶液:2Cu2++2H2O 2Cu↓+O2↑+4H+103、电解氯化铜溶液:Cu2++2Cl- Cu↓+Cl2↑104、电解熔融氯化钠:2Na++2Cl-(熔融) 2Na+Cl2↑105、电解熔融氧化铝:4Al3+ +6O2- 4Al+3O2↑106、二氧化锰与浓盐酸共热:MnO2+2Cl-+4H+ Mn2++Cl2↑+2H2O107、氯气通入冷的氢氧化钠溶液中:Cl2+2OH-=Cl-+ClO-+H2O108、氯气通入热的氢氧化钾溶液中:3Cl2+6OH-=5Cl-+ClO3-+3H2O109、次氯酸钙溶液通入过量的二氧化碳:ClO-+H2O+CO2=HClO+HCO3-110、次氯酸钠溶液中加入浓盐酸:ClO-+Cl-+2H+=Cl2↑+H2O111、氯酸钾与浓盐酸:ClO3-+5Cl-+6H+=3Cl2↑+3H2O112、硫化钠、亚硫酸钠混合液中加入稀硫酸:2S2-+SO32-+6H+=3S↓+3H2O113、NO2溶于水:3NO2+H2O=2H++NO3-+NO↑114、NO2通入亚硫酸钠溶液:SO32-+NO2=SO42-+NO↑115、硫化钠的第一步水解:S2-+H2O HSO3-+OH-116、碳酸钠的第一步水解:CO32-+H2O HCO3-+OH-117、氯化钡溶液与硫酸反应:Ba2++SO42-=BaSO4↓118、硫溶于热的氢氧化钠溶液:3S+6OH-=2S2-+SO32-+3H2O119、醋酸钡溶液与硫酸反应:Ba2++2CH3COO-+2H++SO42-=BaSO4↓+2CH3COOH120、醋酸与氢氧化钾溶液反应:CH3COOH+OH-=CH3COO-+H2O121、醋酸与氨水反应:CH3COOH+NH3•H2O=CH3COO-+NH4++2H2O122、苯酚溶于氢氧化钠溶液:C6H5OH+OH-=C6H5O-+H2O123、苯酚与氯化铁溶液反应:6C6H5OH+Fe3+=[Fe(C6H5O)6]3-+6H+124、苯酚钠溶于醋酸溶液:C6H5O-+CH3COOH=C6H5OH+CH3COO-125、苯酚钠溶液中通入少量CO2:C6H5O-+H2O+CO2=C6H5OH+HCO3-126、碳酸钠溶液中加入过量苯酚:C6H5OH+CO32-=C6H5O-+HCO3-127、碳酸钙跟甲酸反应:CaCO3+HCOOH=Ca2++CO2↑+H2O+HCOO-128、甲酸钠跟盐酸反应:HCOO-+H+=HCOOH129、小苏打溶液与甲酸溶液反应:HCOOH+HCO3-=CO2↑+H2O+HCOO-130、Na2C2O4溶液中加入酸性高锰酸钾溶液:5C2O42-+2MnO4-+16H+=10CO2↑+2Mn2++8H2O131、酸性高锰酸钾溶液与双氧水:5H2O2+2MnO4-+6H+=5O2↑+2Mn2++8H2O132、酸性氯化亚铁溶液与双氧水:2Fe2++H2O2+2H+=2Fe3++2H2O133、SO2通入酸性高锰酸钾溶液:5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+134、乙烯通入酸性高锰酸钾溶液生成CO2:5C2H4+12MnO4-+36H+=10CO2↑+12Mn2++28H2O135、乙酸乙酯与氢氧化钠溶液:CH3COOCH2CH3+OH-=CH3COO-+HOCH2CH3136、硬脂酸甘油酯与氢氧化钠溶液:(C17H35COO)3(C3H5O3)+3OH-=3C17H35COO-+CH2(OH)CH(OH)CH2OH137、氯乙烷在氢氧化钠溶液中水解:CH3CH2Cl+OH-=CH3CH2OH+Cl-138、硝酸银溶液中滴入少量氨水:Ag++NH3•H2O=AgOH↓+NH4+139、硝酸银溶液中滴加氨水至过量:Ag++2NH3•H2O=[Ag(NH3)2]++2H2O140、葡萄糖发生银镜反应:CH2(OH)(CHOH)4CHO+2[Ag(NH3)2]++2OH-=CH2(OH)(CHOH)4COO-+NH4++3NH3+H2O +2Ag↓141、硫酸铜溶液中加入氢氧化钠溶液:Cu2++2OH-=Cu(OH)2↓142、硫酸铜溶液中加入少量氨水:Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+143、硫酸铜溶液中加入过量氨水:Cu2++4NH3•H2O=[Cu(NH3)4]2++4H2O144、硫酸锌溶液中加入少量氨水:Zn2++2NH3•H2O=Zn(OH)2↓+2NH4+145、硫酸锌溶液中加入过量氨水:Zn2++4NH3•H2O=[Zn(NH3)4]2++4H2O。
氧化还原与电极电位
第六章第六章 氧化还原与电极电位氧化还原与电极电位氧化还原与电极电位氧化还原反应(oxidation-reduction reaction)是化学反应中的极为重要的一大类反应,对生命过程具有重要的作用, 因为体内的许多有关糖类、脂肪、蛋白质等营养物质以及诸多药物的代谢反应是属于氧化还原反应的。
学习氧化还原与电极电位的基础理论对于认识生物体系中氧化还原的规律性以及利用氧化还原反应建立生物医学研究方法是必不可少的。
第一节第一节 氧化还原氧化还原一、氧化还原的概念氧化还原的概念在历史上随着人们对氧化还原反应的不断深入理解而不断完善。
最初是以“结合氧为氧化”,“失去氧为还原”来定义氧化还原反应。
但是,许多氧化还原反应不一定有氧参加,如2Na+Cl 2=2NaCl是氧化还原反应,但与氧无关。
为了更深入、广泛地认识氢化还原反应,1970年,国际纯化学和应用化学学会(IUPAC)提出了氧化数(oxidation number)的概念:元素的氧化数是该元素一个原子的荷电数,这种荷电数是将成键电子指定给电负性较大的原子而求得的。
按照元素氧化数的定义,可以得出求算元素氧化数的几条规则:(l)在单质分子中,元素的氧化数为0。
因为像 F 2, O 2, Cl 2等单质分子,其成共价键电子无偏向性,因此原子的表观荷电数为零。
(2)在电中性化合物中,所有元素的氧化数总代数和为零。
(3)对于单原子离子,元素的氧化数等于离子的电荷数。
如 S 2-的氧化数为-2,Ca 2+的为+2;对于原子团,所有元素的氧化数之和等于离子的电荷数。
根据计算氧化数的规则我们可以方便地计算出下列元素在化合物中的氧化数: 在KMnO 4中,Mn的氧化数为+7; 在MnO 42-中,Mn的氧化数为+6;在Na 2S 4O 6 (连四硫酸钠) 中S氧化数为+2.5氧在化合物中氧化数一般为-2,(如CaO), 但在过氧化物(如H 2O 2)中为-1,在超氧化物(如NaO 2)中为-1/2,在OF 2中为+2,因为F的电负性比O大。
氧化还原反应知识点
高考化学专题复习——氧化还原反应一、氧化还原反应的基本概念反应实质:有电子得失或电子对的偏移。
表现特征:元素化合价有升降。
例1、下列变化中,需要加入氧化剂的是()A.SO2→SO3 B.HCl→H2 C.FeCl2→FeCl3 D.Fe2O3→Fe二、氧化性和还原性强弱的比较1.在氧化还原反应中比较,氧化性:氧化剂>氧化产物;还原性:还原剂>还原产物。
例.根据反应:①I2+SO2+2H2O=H2SO4+2HI ②2F eCl2+Cl2=2FeCl3③2FeCl3+2HI=2FeCl2+I2+2HCl可知:I-、Fe2+、Cl-、SO2的还原性由强到弱的顺序是()A.I->Fe2+>Cl->SO2 B.Cl->Fe2+>SO2>I-C.Fe2+>I->Cl->SO2 D.SO2>I->Fe2+>Cl-判断一个氧化还原反应能否进行,也应遵循“由强到弱”的规律,即反应式中的物质应符合“氧化性:氧化剂>氧化产物;还原性:还原剂>还原产物”。
例已知I-、Fe2+、SO2、Cl-和H2O2均有还原性,它们在酸性溶液中还原性的强弱顺序为Cl-<Fe2+<H2O2<I-<SO2,则下列反应不能发生的是()A.2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ B.I2+SO2+2H2O=H2SO4+2HIC.H2O2+H2SO4=SO2+O2+2H2O D.2Fe2++I2=2Fe3++2I-2.根据元素周期表比较:同周期元素的单质(或原子)从左到右还原性渐弱,氧化性渐强(稀有气体元素除外),同主族元素单质(或原子)从上到下还原性渐强,氧化性渐弱。
例如,单质氧化性:F2>Cl2>Br2>I2>S,还原性:Na<K<Rb<Cs。
离子还原性:F-<Cl-<Br-<I-<S2-,氧化性:Na+>K+>Rb+>Cs+3.根据金属活动顺序:K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag Pt Au还原性渐弱K+ Ca2+ Na+ Mg2+ Al3+ Zn2+ Fe2+ Sn2+ Pb2+(H+)Cu2+Fe3+Ag+氧化性渐强4.①据原电池电极:负极金属比正极金属活泼(还原性强);②据电解池中放电顺序,先得电子者氧化性强,先失电子者还原性强。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
金属复氢化合物:NaBH4、KBH4、LiBH4、LiAlH4
有机合成单元反应------还原
6.2 铁粉还原
• • • • • 反应特点 反应历程 应用范围 铁粉还原的主要影响因素 还原产物的分离
有机合成单元反应------还原
6.2.1 反应特点
• • • • • • 以金属铁为还原剂,反应在电解质溶液中进行 选择性好(硝基或其它含氮的基团) 工艺成熟、简单,适用范围广 副反应少 对设备要求低 产生大量的含胺铁泥和废水
+
+
+
2e
2e
ArNHOH
ArNH2
+
2H
+
+
H2 O
有机合成单元反应------还原
6.2.2铁粉还原影响因素
(1)硝基化合物结构 芳环上有供电子基团时,硝基上的电子云密度增大,反应速度变….. 芳环上有吸电子基团时,硝基上的电子云密度减小,反应速度变…..
有机合成单元反应------还原
• (2)电解质影响 • 微电池作用原理,在电解质溶液中,反应速度加快。 • 常用的电解质是氯化铵和氯化亚铁。电解质的量一 般是硝基的10~20%。 • 通常还原时要加适量盐酸,完成铁的预蚀。 • 整个反应过程中必须保持一定的亚铁离子浓度,如 果检查没有亚铁离子,需加酸来保持亚铁离子浓度。
有机合成单元反应------还原
6.2.4 铁粉还原反应实例
(1)邻甲氧基苯胺
OCH3 NO2 Fe HCl OCH3 NH2
邻硝基苯甲醚加入浓盐酸中,加热搅拌,保持100~110°C, 慢慢加入铁粉,加完后,继续保温1.5小时,加水后,用40%的 NaOH 中和,然后进行水蒸气蒸馏。馏出物油水分离,水层盐析, 再得一部分油层,油层合并,减压蒸馏,收集117~121 °C/20mmHg的馏分,得产品。
4ArNO2
ArNO2
+
+
6Na2S
Na2S2
+ 7H2O
+
H2 O
4ArNH2
+
+
3Na2S2O3
+ 6NaOH
ArNH2
Na2S2O3
ArNO2
+
Na2Sx
+
H2O
ArNH2
+
Na2S2O3
+
(x-2)S
有机合成单元反应------还原
2
从反应方程式看反应介质酸碱性的影响
(1)用硫化钠还原,有氢氧化钠生成,在反应体系变碱 性,在碱性条件下能发生类似锌粉还原硝基芳烃的反应。如果 要避免副反应的发生,就要让体系变成缓冲体系:NH4Cl MgSO4 MgCl2 NaHCO3 (2)用多硫化钠还原,有硫磺生成,反应后需要除掉硫, 操作不便. (3)最常使用的还原剂是二硫化钠.
有机合成单元反应------还原
OEt NH2
邻氨基对甲苯乙醚
CH3
OH OH NO2 NaOH ONa NO2 EtCl OEt NO2 Na2S2 OEt NH2
CH3
CH3
CH3
CH3
CH3
有机合成单元反应------还原
6.5氢负离子转移还原
在第三族元素的硼
Na
+
铝等的氢化物中,氢显负电性.
有机合成单元反应------还原
6.1.1 定义
广义地讲,在还原剂的参与下,能使某 原子得到电子或电子云密度增加的反应称为 还原反应。 狭义地讲,在有机分子中增加氢或减少 氧的反应,或者兼而有之的反应称为还原反 应。
有机合成单元反应------还原
6.1.2 反应的重要性
• 得到具有特定性能的产品 • 制备N-取代产物
有机合成单元反应------还原
• (3)铁粉的影响 • 灰铸铁的铁粉,因为还有大量的锰、硅、磷 等,容易形成原电池,还原速度比较快。 • 比较纯的铁粉,还原速度很慢。 • 铁粉的用量:理论用量 2.25mol/mol硝基,实 际用量 3~4mol/mol硝基。 • 铁粉的目数:60~100目。太粗时,表面积小, 反应慢;太细时,后处理困难。
有机合成单元反应------还原
铁粉在电解质中,对硝基 亚硝基和羟胺表现出强的还原性。 电解质:稀盐酸 稀硫酸 醋酸 氯化铵 氯化亚铁的水溶液等
反应
4ArNO2
Fe
+
9Fe
+ 4H2O
+
2e
4ArNH2
+
3Fe3O4
负极 正极
2+ Fe
ArNO2
+
2H
+
+
2e
ArNO
+
H2O
ArNO
ArNHOH
2H
有机合成单元反应------还原
(4)水和反应溶剂 铁粉还原时,水是必须的,因为水是反应物之一。 一般要求水的摩尔量是硝基的50~100倍。 当反应物在水中的溶解度较低时,可以用甲醇或乙 醇做反应溶剂,但是少量水是必须的。 (5)搅拌 铁粉比重大,容易沉在反应釜底,因此需要良好的 搅拌。
有机合成单元反应------还原
NO2 NHOH H Zn
+
+
有机合成单元反应------还原
硝基苯经锌粉还原为苯基羟胺,在无需分离和纯化的条件下 经重排和精制得到对氨基苯酚 。 NHOH OH
NH2
硝基苯在强碱性介质中用锌粉还原制备1,2-二苯肼 :
NO2 _
+
OH Zn
NH NH
当硝基苯的用量为0.25mol时,硝基苯与锌粉的摩尔比为1:5,溶 剂的醇水体积比为1:1.5,溶剂总量为32mL,反应时间为1.5h, 产率 为90%
有机合成单元反应------还原
6.1.4 还原反应的分类
• • • • • 碳-碳不饱和键的还原 碳-氧双键的还原 含氮基的还原 含硫基的还原 含卤基的还原
有机合成单元反应------还原
6.1.5 不同官能团还原难易的比较
有机合成单元反应------还原
表 各种官能团在催化氢化时由易到难的次序
硼烷加成产物中间体是更温和的还原剂。
有机合成单元反应------还原
1,2-二苯肼类化合物,可以在酸性条件下重排生成联苯胺类化合物.
H3C
H2N NH2
CH3 NH2
H2N
H3C H2N
O
O
CH3 NH2
Cl H2N
Cl NH2
联苯胺类化合物致癌,多数国家禁用.
有机合成单元反应------还原
6.4含硫化物还原
能做还原剂的含硫化合物分两类: 硫化碱:硫化物 硫氢化物 多硫化物 亚硫酸盐:亚硫酸盐 亚硫酸氢盐等 1 还原反应方程式
有机合成单元反应------还原
2-氨基-4-硝基苯酚
OH NH2
Cl NO2 NaOH
ONa NO2 Na2S2
ONa NH2 HCl
OH NH2
NO2
NO2
NO2
NO2
NO2
(a)水解 于水解釜中,加入1400升水,加热到60度,加入750公斤2, 4-二硝基氯苯,升温到90度,1.5小时内,加入780升30%的 液碱,102~104度保温30分钟至全部溶解. (b)还原 上步反应液中,于65~70度加入1225升30%液碱和440 公斤硫磺配成还原剂.最高温度不得超过90度,测试反应终点,然后冷 却到20度,抽滤.滤饼以1300升水和适量盐酸重结晶.最后得产品 300公斤.
Ar-NO2→Ar-NH2→Ar-NHR(ArNR2)
• 将氨基转变为其它取代基
Ar-NH2→Ar-N2+Cl-→-Cl,-I,-F,-CN,N=N-,H
有机合成单元反应------还原
6.1.3 还原方法
均相催化氢化:催化剂溶于反应介质 加氢还原(催化氢化) 液相催化氢化 非均相催化氢化 气固相催化氢化 化学还原法:以化学物质为还原剂 电解还原法:在电极上进行电子转移
序号 1 2 3 4 5 被还原基团 RCOCl R-NO2
RC CR'
还原产物 RCOH
序号
被还原基团
N
还原产物
N H
R-NH2 RCH=CHR’ RCH2OH RCH2CH2R’
9
N
N H
N
N H
RCOH RCH=CHR’
10 11
稠环芳烃 RCOOR’
部分加氢 RCH2OH+R’O H
6
RCOR’ C6H5CH2OR
有机合成单元反应------还原
(2)对氨基甲酚
OH Fe HCl NO2 NH2 OCH3
还原釜内加入母液,升温至60 °C以上,投入1/3的铁粉 和盐酸,加热至沸腾,交替加入剩余的铁粉和对硝基苯酚,保 温30分钟,以碳酸钠调节pH值7.2以上,加入亚硫酸钠,适量 的活性炭和母液,回流10分钟,过滤,冷却结晶。甩滤,滤饼 为对氨基苯酚。收率为90%。 单耗:对硝基苯酚 1388kg,铁粉 1778kg,30%的盐酸 200公斤。
有机合成单元反应------还原
6.2.5 还原产物的分离
• 水溶性小、且易随水蒸气蒸出的芳胺 如:苯胺、氨基氯苯、甲基苯胺 分离方法:水蒸气蒸馏法 • 水溶性大、且可以蒸馏的芳胺
如:间苯二胺、对苯二胺、2,4-二氨基甲苯 分离方法:过滤、浓缩母液、减压蒸馏
有机合成单元反应------还原
• 溶于热水、但在冷水中溶解度低的芳胺
有机合成单元反应------还原
6.3 锌粉还原
锌粉的还原性和反应介质有关。锌粉是有机工业上常用 的还原剂,因为它的还原 范围很广。 在酸性介质中,用锌粉还原对硝基苯胺制备对苯二胺
