--3青蒿素生物合成与基因工程研究进展_刘万宏

·综述·
青蒿素生物合成与基因工程研究进展
刘万宏1, 3,黄玺2,张巧卓3
1. 重庆科技学院化学化工学院,重庆 401331
2. 西南药业股份有限公司,重庆 400038
3. 西南大学生命科学学院,重庆 400715
摘要:青蒿素因其在植物中的量很低并不能满足患者需求,提高青蒿中青蒿素的量是植物次生代谢研究领域的热点之一。综述了青蒿素生物合成途径的相关酶与基因,青蒿素生物合成的部位及特异性基因表达研究,植物激素和诱导子对青蒿素生物合成的影响,以及利用基因工程对青蒿进行遗传改良;提出了基因工程技术是提高青蒿素的理想途径之一。
关键词:青蒿;青蒿素;生物合成;基因工程;诱导子
中图分类号:R282.1 文献标志码:A 文章编号:0253 - 2670(2013)01 - 0101 - 07
DOI: 10.7501/j.issn.0253-2670.2013.01.019
Advances in studies on biosynthesis and genetic engineering of artemisinin
LIU Wan-hong1, 3, HUANG Xi2, ZHANG Qiao-zhuo3
1. School of Chemistry and Chemical Engineering, Chongqing University of Science and Technology, Chongqing 401331, China
2. Southwest Pharmaceutical Co., Ltd., Chongqing 400038, China
3. School of Life Science, Southwest University, Chongqing 400715, China
Key words:Artemisia annua L.; artemisinin; biosynthesis; genetic engineering; elicitor
疟疾是一种严重的流行性疾病,世界卫生组织估计每年至少有380万人感染疟疾,尤其在发展中国家,每年超过100万人因患疟疾而死亡[1]。青蒿素(artemisinin)由于其独特的过氧桥结构,对抗氯喹疟疾和脑型疟疾疗效显著且具有速效和低毒的特点[2]。世界卫生组织推荐青蒿素联合疗法(artemisinin combination therapy,ACT)作为治疗疟疾的首选方法。此外,现代药理学研究发现青蒿素及其衍生物在杀灭寄生虫[3]、抗肿瘤[4-5]及抵御艾滋病毒[6]等方面具有很好的效果,这使得国际上对青蒿素的需求非常巨大。然而,青蒿素目前仅在青蒿(黄花蒿)Artemisia annua L. 中发现,植物体内青蒿素的量很低(质量分数为0.01%~1%),并不能满足患者治疗的需求[7]。
近年来,在诸如微生物改造发酵生产青蒿素前体、揭示青蒿素生物合成分子机制[8]、青蒿转基因、细胞培养合成青蒿素、探索青蒿素与外界环境关系[9]、高产青蒿育种等方面取得大量科研成果。本文从目前了解的青蒿素生物合成途径出发,综述了青蒿素生物合成途径、合成部位、外源激素及诱导子对青蒿素生物合成的影响,以及在青蒿基因工程领域近期研究成果。
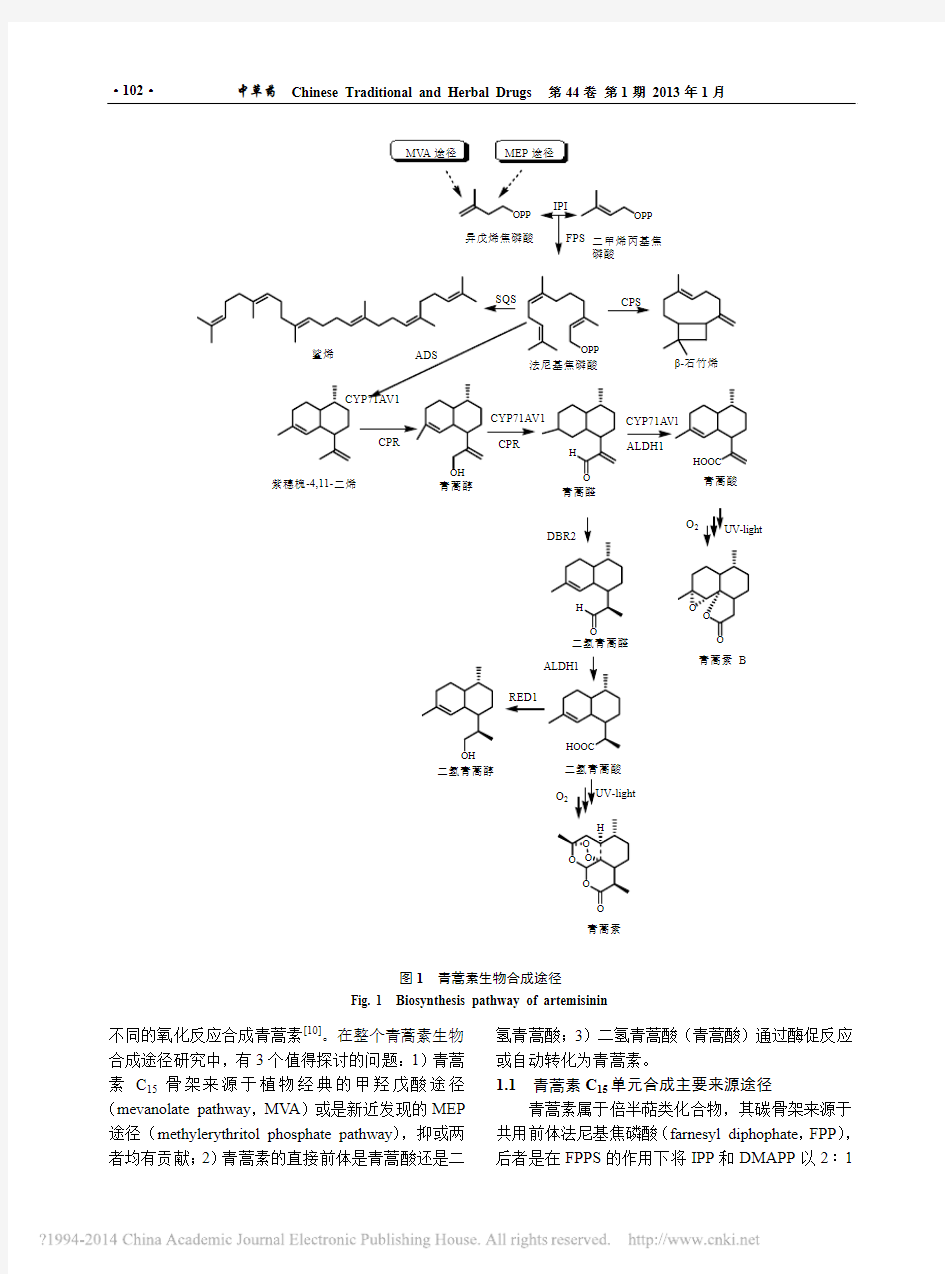
1青蒿素生物合成途径
青蒿素为C15骨架的倍半萜类化合物,其生物合成途径可分为3个阶段(图1):1)萜类化合物C5活性单位异戊烯焦磷酸(isopentenyl diphosphate,IPP)与其异构体二甲基烯丙基焦磷酸(dimethylallyl diphosphate,DMAPP)经过酶促反应合成紫穗槐二烯(amorpha-4, 11-diene,AD);2)AD到二氢青蒿酸(或青蒿酸);3)二氢青蒿酸(或青蒿酸)经过
收稿日期:2012-09-05
基金项目:国家自然科学基金资助项目:DBR2基因超表达与胞内ROS协同作用对青蒿素生物合成的影响(31200223)
作者简介:刘万宏(1979—),男,讲师,主要研究方向为药用植物次生代谢工程。Tel: (023)65022211 E-mail: liuwanh@https://www.360docs.net/doc/ba7000448.html, 网络出版时间:2012-12-19 网络出版地址:https://www.360docs.net/doc/ba7000448.html,/kcms/detail/12.1108.R.20121219.1641.003.html
图1 青蒿素生物合成途径
Fig. 1 Biosynthesis pathway of artemisinin
不同的氧化反应合成青蒿素[10]。在整个青蒿素生物合成途径研究中,有3个值得探讨的问题:1)青蒿素C 15骨架来源于植物经典的甲羟戊酸途径(mevanolate pathway ,MV A )或是新近发现的MEP 途径(methylerythritol phosphate pathway ),抑或两者均有贡献;2)青蒿素的直接前体是青蒿酸还是二
氢青蒿酸;3)二氢青蒿酸(青蒿酸)通过酶促反应或自动转化为青蒿素。
1.1 青蒿素C 15单元合成主要来源途径
青蒿素属于倍半萜类化合物,其碳骨架来源于共用前体法尼基焦磷酸(farnesyl diphophate ,FPP ),后者是在FPPS 的作用下将IPP 和DMAPP 以2∶1
MV A 途径MEP 途径
异戊烯焦磷酸
紫穗槐-4,11-二烯
青蒿醇
青蒿醛
青蒿素 B
二氢青蒿醛 二氢青蒿醇
青蒿素
的比例合成获得[11]。然而在高等植物中,合成C15活性单位的途径有来源于定位于胞质的MV A途径和定位于质体的MEP途径。虽然在萜类化合物的合成过程中,上述两条途径存在“Closs-Talk”[12],然而目前证实在某些化合物合成过程中,这两条途径对活性单位的贡献有主次之分,如萝芙木中萜类吲哚生物碱异戊二烯基团主要来源于MEP途径[13]。
近年来对于青蒿素前体来源途径的研究主要集中在:Weathers小组[14]通过MV A途径特异性阻断剂洛伐他汀(Mevinolin)和MEP途径阻断剂磷胺霉素(Fosmidomycin)分别处理青蒿幼苗,均发现青蒿素的量较对照显著降低,说明两条途径对青蒿素的合成均有重要影响;波兰科学院Abdin小组[15]实验发现MV A途径的关键酶HMGR活性与青蒿素的量密切相关,阻断MEP途径青蒿素量仅降低14.2%,而阻断MV A途径,较对照青蒿素量降低了80.4%,提示MV A途径是青蒿素生物合成中碳骨架的主要贡献者;Schramek等[15]用13CO2作为碳源饲喂青蒿植株,对青蒿素及其碳骨架前体进行了深入研究,发现青蒿素骨架的主要前体为(E, E)-FPP,且MEP途径提供1分子的IPP构成FPP的核心骨架,MV A途径提供另外的1分子IPP和1分子DMAPP,研究结果同时解释了青蒿素合成场所腺毛体中不同细胞的具体功能。由此可见,MV A途径和MEP途径对青蒿素碳骨架的合成均提供了C15基本单元。
1.2二氢青蒿酸是青蒿素直接前体
在早期的研究中,青蒿酸(artemisinic acid)一度被认为是青蒿素生物合成的直接前体。Sangwan 等[17]通过体内实验与无细胞系统实验发现,用14C 标记的青蒿酸能够转化生成青蒿素B及青蒿素,提出青蒿酸可能是青蒿素生物合成的直接前体。然而,如今更多的实验证据显示二氢青蒿素是青蒿素生物合成的直接前体,青蒿酸也被部分学者认为是青蒿素生物途径中的“Dead End”代谢物[10]。Kim等[18]最早在青蒿瘤状物中发现青蒿酸,但其不能转化为二氢青蒿酸,且青蒿酸并不能生成青蒿素,推测青蒿素来源于二氢青蒿酸。Wallaart等[19]发现青蒿素的量较高的植株中二氢青蒿酸量亦较高,而青蒿酸的量相对较低;经过夜间霜冻胁迫,青蒿中的二氢青蒿素的量降低而青蒿素的量增高,推测植株通过二氢青蒿酸能够与细胞中活性氧类物质(reactive oxygen species,ROS)反应抵御胁迫,并生成青蒿素。分别用 [15-13C2H3]- 和 [15-C2H3]- 标记的2种二氢青蒿酸饲喂青蒿根部,分析叶片代谢产物发现二氢青蒿酸是11, 13-二氢-紫穗槐烷类(如青蒿素)和杜松烷类倍半萜的直接前体,而且其可以通过自发的化学反应快速生成代谢产物[20]。Bertea等[21]通过分析青蒿叶片与腺毛体中一系列有关青蒿素合成的氧化还原酶,绘制出青蒿素合成途径的第2阶段,即紫穗槐二烯到二氢青蒿酸;利用同位素标记的青蒿酸饲喂青蒿,发现青蒿素B是青蒿酸的主要代谢产物,而且青蒿酸不能转化为二氢青蒿酸和青蒿素[22]。因此,二氢青蒿素作为青蒿素生物合成直接前体的观点已经被广为接受。由此可见,青蒿植株中二氢青蒿酸的合成是实现青蒿素积累的重要前提。
1.3单线氧激发青蒿素前体自发氧化生成青蒿素
青蒿素合成的最后一个阶段即青蒿素直接前体是否通过酶促反应生产青蒿素的研究具有重要的科学意义与实用价值。由于青蒿素生物合成的最后一步即二氢青蒿酸合成青蒿素的反应机制并不清晰,所以利用微生物工程仅能发酵生产青蒿素的前体二氢青蒿酸及青蒿酸[23]。印度Narasu小组[24]在以青蒿叶片为材料制备无细胞提取液,发现该提取液能够将青蒿素B催化合成青蒿素,提示可能存在催化合成青蒿素的酶;随后该小组在次年报道已纯化并鉴定了上述蛋白质,该酶是由2个相对分子质量分别为2.1×104和1.1×104的亚基组成的二聚体,全酶总相对分子质量为6.6×104,以青蒿素B为底物的K m值为0.5 mmol/L[25]。这一结果首次为青蒿素最后一步是酶促反应的推测提供了证据,并为利用微生物工程生产青蒿素提供了依据。然而很遗憾的是直到现在依然未见该蛋白序列或对应核苷酸序列的报道。
目前更多的实验证据推测二氢青蒿酸转化为青蒿素可能为非酶促反应。Towler等[26]发现二甲基亚砜(DMSO)能够有效刺激青蒿植株中青蒿素的积累,但没有对其机制进行阐述。进一步的研究发现,DMSO提高青蒿素积累的机制并不是提高了关键基因(如ADS、CYP71A V1)的表达,而DMSO诱导ROS的生成可能是提高青蒿素量的关键因素[27]。此外,利用外源水杨酸(SA)喷洒青蒿叶片发现青蒿素量提高,其中原因之一为SA刺激植物体细胞产生ROS,后者促进了二氢青蒿酸转化为青蒿素[28]。在早期的实验中,Wallaart等[29]通过体外感光实验,推测二氢青蒿酸可能起到清除ROS的作用,从而生成青蒿素。二氢青蒿酸自发氧化生成青蒿素的步骤
已通过体外实验得到合理解释[30]。通过以上研究,二氢青蒿酸可能通过自发氧化的形式而非酶促反应生成青蒿素的机制可以获得前期实验结果的支持,而且二氢青蒿酸转化为青蒿素的步骤可能依赖细胞内ROS的爆发。
2青蒿中青蒿素生物合成场所与特异表达基因腺状分泌毛状体(glandular secretory trichomes,GSTs)由植物表皮细胞发育形成,具有腺体状的单(多)细胞结构,通常分布在植物的叶片、茎和花等器官,是许多次生代谢产物合成的场所[31]。目前发现与青蒿素合成紧密相关的GSTs由10个细胞组成,包括2个基细胞、2个颈细胞、4个近顶细胞和2个顶细胞,青蒿素合成反应发生在顶细胞中[32]。然而在腺毛体细胞中,仅近顶细胞具有叶绿体;Schramek 等[15]推测这与青蒿素碳骨架合成相关,即需要由定位于叶绿体的MEP途径提供1分子的IPP为核心形成GPP,后者转运至顶细胞与胞质中MV A途径提供的IPP形成倍半萜的通用前体FPP。事实上,目前发现一大类与青蒿素骨架结构相近的艾莫烷型(amorphane type)化合物在GSTs中合成与储存[33]。
早期的研究已经发现青蒿素在植物体内的积累具有组织特异性,在开花期的花序和叶中青蒿素的量最高[34]。此外,研究结果也证实青蒿叶片和花序中GSTs的密度与青蒿素的积累具有密切关系[35]。然而由于未能分离出GSTs,很难进行GSTs特异表达的基因研究。目前可以通过激光显微切割及压力弹射技术(laser microdissection & pressure catapulting,LMPC)从青蒿不同组织中分离获得GSTs细胞用以基因特异性表达研究[36]。Olsson等[32]利用qPCR分析了青蒿素生物合成下游途径关键酶基因紫穗槐二烯羟化酶(amorpha-4, 11-diene synthase,ADS)、细胞色素P450氧化酶(cytochrome P450 monooxygenase,CYP71A V1)以及青蒿醛Δ11 (13) 还原酶(artemisinic aldehyde Δ11 (13) reductase,DBR2)仅在腺毛体顶端细胞表达,而MEP途径关键酶基因5-磷酸脱氧木酮糖还原异构酶(DXR)仅在近顶细胞中表达。将以上基因作为重要的靶点基因,通过基因工程改良青蒿,培育高产青蒿素转基因新品种是目前的研究热点之一,并且取得了良好的效果。
3植物激素和诱导子对青蒿素合成的影响
3.1外源激素对青蒿素合成的影响
利用外源赤霉素(GA3)处理青蒿发现可显著增加青蒿素的量以及叶片生物量,在野生型及FPS 超表达植株中,GA3均能上调青蒿素合成关键基因FPS、ADS及CYP71A V1的表达[37];脱落酸(ABA,10 μmol/L)处理青蒿后青蒿素平均量达到干质量的1.84%,较对照提高了65%;基因表达分析显示ABA 诱导CYP71A V1等青蒿素合成相关基因表达,而ADS表达未见显著增加,推测ABA的生物合成途径与青蒿素合成途径存在“对话”[38];通过分析青蒿经茉莉酸甲酯(MeJA)处理后的次生代谢产物发现,青蒿素、青蒿酸及二氢青蒿酸分别提高了49%、80%、28%;除此之外,甲基青蒿酸和鲨烯分别提高了50%和67%[39];青蒿悬浮细胞能在30 min内对外源MeJA产生响应,CYP71A V1基因表达上调且青蒿素量增加3倍[40];不同化学型的青蒿植株对MeJA 的诱导存在不同的响应方式,I型青蒿在MeJA的刺激下能够促进二氢青蒿酸和青蒿素的积累,而II型青蒿却表现出青蒿酸和青蒿素量的降低[41];SA促进青蒿素积累主要表现在2个方面:一是导致胞内ROS 产生,催化二氢青蒿酸转化为青蒿素;二是上调青蒿素合成途径关键酶基因ADS的表达[28]。
3.2外源诱导子对青蒿素合成的影响
利用100 mg/L壳聚糖处理青蒿叶片,能够诱导ADS基因和DBR2基因表达,并且发现活性氧物质H2O2及O2?有明显增加,青蒿素及其前体二氢青蒿酸量较对照分别提高了53%和72%[42];将脑苷脂加入青蒿毛状根培养体系中,青蒿素量达22.4 mg/L,较对照提高了2.3倍[43];紫外线不仅能够改变青蒿生长、生物量、色素量及胞内氧化酶活性,而且能够提高青蒿素和类黄酮的量。在青蒿花期采用UV-B和UV-C 辐射处理后,青蒿素的量分别提高了10.5%和15.7%,且青蒿素合成相关基因HMGR、CPR及ADS表达量上调[44]。虽然咪康唑能够促进青蒿悬浮细胞中CPR 与DBR2基因表达,而且使青蒿素的量较对照增加2.5倍,但是其对细胞的生长存在毒副作用[40];糖类物质作为信号分子影响植物乙醛酸途径和花青素合成途径次生代谢产物的积累已有报道,葡萄糖与果糖的添加比例对青蒿素的合成起到重要作用,葡萄糖有利于青蒿素合成,而果糖具有抑制合成作用[45]。Weather 小组[46]进一步研究发现,在葡萄糖刺激下,6个涉及青蒿素合成的关键酶基因如HMGR、DXS、DXR、FPS、ADS和CYP71A V1转录水平显示不同程度上调,该研究从分子水平揭示了葡萄糖对青蒿素积累的重要影响。
4青蒿基因工程研究
4.1超表达青蒿素合成途径基因对青蒿素合成影响
青蒿素代谢工程是植物基因工程研究领域热点之一,利用转基因技术超表达青蒿素生物合成途径关键酶基因或抑制支路重要基因表达已有诸多报道。在青蒿中超表达IPI基因发现细胞分裂素、叶绿素及青蒿素的量有不同程度的提高,其中青蒿素的量较对照提高30%~70%[47]。将青蒿FPS基因超表达后,转基因植株中青蒿素量最高可达0.9%,较对照提高了34.4%[48]。构建来源于长春花的HMGR 基因及青蒿的ADS基因植物高效表达载体,获得的双基因转基因株系中青蒿素的量最高达 1.73 mg/g,较对照有大幅度提高[49]。景福远等[50]超表达腺毛体特异表达的细胞色素P450蛋白CYP71A V1及其伴体蛋白CPR基因,转基因青蒿中青蒿素的量约为对照组2.4倍。
4.2抑制旁路基因促进代谢流朝靶标产物积累
在青蒿转基因研究中,已有利用代谢工程中的通过反义RNA技术或RNAi技术,降低特定代谢途径上重要基因的表达,减少非目的产物的生成,从而促进代谢流朝向目标产物积累。FPP是植物体内合成倍半萜及三萜的前体,在不同的倍半萜合酶的作用下可以形成不同类型的萜类化合物。在青蒿中利用反义技术下调鲨烯合酶基因SQS表达,qPCR 考察发现转基因青蒿中SQS表达量显著下降,青蒿素生物合成途径的ADS、CYP71AV1及CPR基因表达得到大幅度提高[51]。Zhang等[52]利用RNAi 技术抑制SQS基因表达,GC-MS分析固醇在转基因青蒿中量大幅降低,而青蒿素最高量可达31.4 mg/g。
由此可见,利用转基因技术提高青蒿中青蒿素的量是行之有效的策略。上述研究中均对青蒿素生物合成途径中的不同基因进行了遗传操作,由于遗传改造选择了不同的靶点基因,转基因株系中青蒿素提高效果存在很大的区别。因此,靶点基因的选择在青蒿代谢工程研究中起到了至关重要的作用。5展望
随着青蒿素生物合成途径基因的不断克隆与鉴定,很大程度地提升了人们对青蒿素生物合成过程的认识。然而要实现青蒿素低成本生产还具有一定的距离,尽管利用微生物发酵的方式可以获得青蒿素前体,后者可以通过化学修饰半合成青蒿素。由于青蒿素的合成场所目前已经明确,深入了解青蒿GSTs的发育及特异表达基因将对青蒿素的合成产生重要的影响。外界环境对青蒿素的积累具有重要影响,揭示不同诱导子对青蒿素合成的时空影响,对利用植株获得高产量青蒿素具有重要的指导意义。利用成熟的转基因技术,超表达合适的靶基因对野生青蒿加以改良,获得高产青蒿素植株是目前可行的策略,为将来实现培育优质高产的青蒿新品系奠定基础。
参考文献
[1]Weathers P J, Arsenault P R, Covello P S, et al.
Artemisinin production in Artemisia annua: studies in
planta and results of a novel delivery method for treating
malaria and other neglected diseases [J]. Phytochem Rev,
2011, 10(2): 173-183.
[2]Liu C X, Xiao P G, Peng Y, et al. Challenges in research
and development of traditional Chinese medicines [J].
Chin Herb Med, 2009, 1(1): 1-28.
[3]Utzinger J, Xiao S, Keiser J, et al. Current progress in the
development and use of artemether for chemoprophylaxis
of major human schistosome parasites [J]. Curr Med
Chem, 2001, 8(15): 1841-1860.
[4]Crespo-Ortiz M P, Wei M Q. Antitumor activity of
artemisinin and its derivatives: from a well-known antimalarial agent to a potential anticancer drug [J]. J
Biomed Biotechnol, 2011/2012: 1-18.
[5]陈立军, 靳秋月, 于利人, 等. 青蒿素及其衍生物抗肿
瘤研究进展 [J]. 中草药, 2005, 36(11): 1754-1755. [6]Lubbe A, Seibert I, Klimkait T, et al. Ethnopharmacology
in overdrive: the remarkable anti-HIV activity of Artemisia annua [J]. J Ethnopharmacol, 2012, 141(3):
854-859.
[7]Delabays N, Simonnet X, Gaudin M. The genetics of
artemisinin content in Artemisia annua L. and the breeding of high yielding cultivars [J]. Curr Med Chem,
2001, 8(15): 1795-1801.
[8]杨瑞仪, 卢元媛, 杨雪芹, 等. 低温诱导黄花蒿中青蒿
素的生物合成及其机制研究 [J]. 中草药, 2012, 43(2):
350-354.
[9]漆小雪, 韦霄, 陈宗游, 等. 黄花蒿干物质的积累及
青蒿素与N、P、K量的动态变化研究 [J]. 中草药, 2011,
42(12): 2541-2544.
[10]Brown G D. The biosynthesis of artemisinin (Qinghaosu)
and the phytochemistry of Artemisia annua L. (Qinghao)
[J]. Molecules, 2010, 15(11): 7603-7698.
[11]Ku B, Jeong J C, Mijts B N, et al. Preparation,
characterization, and optimization of an in vitro C30
carotenoid pathway [J]. Appl Environ Microbiol, 2005,
71(11): 6578-6583.
[12]Hemmerlin A, Hoeffler J F, Meyer O, et al. Cross-talk
between the cytosolic mevalonate and the plastidial
methylerythritol phosphate pathways in tobacco bright
yellow-2 cells [J]. J Biol Chem, 2003, 278(29): 26666-26676.
[13]Liu W, Chen R, Chen M, et al. Tryptophan decarboxylase
plays an important role in ajmalicine biosynthesis in
Rauvolfia verticillata [J]. Planta, 2012, 236(1): 239-250. [14]Towler M J, Weathers P J. Evidence of artemisinin
production from IPP stemming from both the mevalonate
and the nonmevalonate pathways [J]. Plant Cell Rep,
2007, 26(12): 2129-2136.
[15]Ram M, Khan M A, Jha P, et al. HMG-CoA reductase
limits artemisinin biosynthesis and accumulation in Artemisia annua L. plants [J]. Acta Physiol Plant, 2010,
32(5): 859-866.
[16]Schramek N, Wang H, Romisch-Margl W, et al.
Artemisinin biosynthesis in growing plants of Artemisia
annua A 13CO2 study [J]. Phytochemistry, 2009, 71(2/3):
179-187.
[17]Sangwan R S, Agarwal K, Luthra R, et al. Biotrans-
formation of arteannuic acid into arteannuin-B and artemisinin in Artemisia annua [J]. Phytochemistry, 1993,
34(5): 1301-1302.
[18]Kim N, Kim S. Biosynthesis of artemisinin from 11,
12-dihydroateannuic acid [J]. J Kor Agric Chem Soc,
1992, 35: 106-109.
[19]Wallaart T E, Pras N, Beekman A C, et al. Seasonal
variation of artemisinin and its biosynthetic precursors in
plants of Artemisia annua of different geographical
origin: proof for the existence of chemotypes [J]. Planta
Med, 2000, 66(1): 57-62.
[20]Brown G D, Sy L K. In vivo transformations of
dihydroartemisinic acid in Artemisia annua plants [J].
Tetrahedron, 2004, 60: 1139-1159.
[21]Bertea C M, Freije J R, van der Woude H, et al.
Identification of intermediates and enzymes involved in
the early steps of artemisinin biosynthesis in Artemisia
annua [J]. Planta Med, 2005, 71(1): 40-47.
[22]Brown G D, Sy L K. In vivo transformations of
artemisinic acid in Artemisia annua plants [J].
Tetrahedron, 2007, 63: 9548-9566.
[23]Ro D K, Paradise E M, Ouellet M, et al. Production of the
antimalarial drug precursor artemisinic acid in engineered
yeast [J]. Nature, 2006, 440(7086): 940-943.
[24]Dhingra V, Rajoli C, Narasu M L. Partial purification of
proteins involved in the bioconversion of arteannuin B to
artemisinin [J]. Biores Technol, 2000, 73: 279-282.
[25]Dhingra V, Narasu M L. Purification and characterization
of an enzyme involved in biochemical transformation of
arteannuin B to artemisinin from Artemisia annua [J].
Biochem Biophys Res Commun, 2001, 281(2): 558-561. [26]Towler M, Weathers P. Evidence of artemisinin
production from IPP stemming from both the mevalonate
and the nonmevalonate pathways [J]. Plant Cell Rep,
2007, 26: 2129-2136.
[27]Mannan A, Liu C, Arsenault P R, et al. DMSO triggers
the generation of ROS leading to an increase in artemisinin and dihydroartemisinic acid in Artemisia
annua shoot cultures [J]. Plant Cell Rep, 2010, 29(2):
143-152.
[28]Pu G B, Ma D M, Chen J L, et al. Salicylic acid activates
artemisinin biosynthesis in Artemisia annua L. [J]. Plant
Cell Rep, 2009, 28(7): 1127-1135.
[29]Wallaart T E, van Uden W, Lubberink H G, et al. Isolation
and identification of dihydroartemisinic acid from Artemisia annua and its possible role in the biosynthesis
of artemisinin [J]. J Nat Prod, 1999, 62(3): 430-433. [30]Brown G D, Sy L K. The mechanism of the spontaneous
autoxidation of dihydroartemisinic acid [J]. Tetrahedron,
2002, 58: 897-908.
[31]Nguyen K T, Arsenault P R, Weathers P J. Trichomes +
roots + ROS = artemisinin: regulating artemisinin bio-
synthesis in Artemisia annua L. [J]. In Vitro Cell Dev Biol
Plant, 2011, 47(3): 329-338.
[32]Olsson M E, Olofsson L M, Lindahl A L, et al.
Localization of enzymes of artemisinin biosynthesis to
the apical cells of glandular secretory trichomes of
Artemisia annua L. [J]. Phytochemistry, 2009, 70(9):
1123-1128.
[33]Covello P S, Teoh K H, Polichuk D R, et al. Functional
genomics and the biosynthesis of artemisinin [J].
Phytochemistry, 2007, 68(14): 1864-1871.
[34]Ferreira J F, Simon J E, Janick J. Developmental studies
of Artemisia annua: flowering and artemisinin production
under greenhouse and field conditions [J]. Planta Med,
1995, 61(2): 167-170.
[35]Lommen W J, Schenk E, Bouwmeester H J, et al.
Trichome dynamics and artemisinin accumulation during
development and senescence of Artemisia annua leaves
[J]. Planta Med, 2006, 72(4): 336-345.
[36]Olofsson L, Lundgren A, Brodelius P E. Trichome
isolation with and without fixation using laser microdissection and pressure catapulting followed by
RNA amplification: expression of genes of terpene
metabolism in apical and sub-apical trichome cells of
Artemisia annua L. [J]. Plant Sci, 2011, 183: 9-13.
[37]Banyai W, Mii M, Supaibulwatana K. Enhancement of
artemisinin content and biomass in Artemisia annua by
exogenous GA3 treatment [J]. Plant Growth Regul, 2011,
63: 45-54.
[38]Jing F, Zhang L, Li M, et al. Abscisic acid (ABA)
treatment increases artemisinin content in Artemisia
annua by enhancing the expression of genes in artemisinin biosynthetic pathway [J]. Biologia, 2009,
64(2): 319-323.
[39]Wang H, Ma C, Li Z, et al. Effects of exogenous methyl
jasmonate on artemisinin biosynthesis and secondary
metabolites in Artemisia annua L. [J]. Ind Crops Prod,
2010, 31(2): 214-218.
[40]Caretto S, Quarta A, Durante M, et al. Methyl jasmonate
and miconazole differently affect arteminisin production
and gene expression in Artemisia annua suspension
cultures [J]. Plant Biol, 2010, 13(1): 51-58.
[41]Wu W, Yuan M, Zhang Q, et al. Chemotype-dependent
metabolic response to methyl jasmonate elicitation in
Artemisia annua [J]. Planta Med, 2011, 77(10): 1048-1053.
[42]Lei C Y, Ma D M, Pu G B, et al. Foliar application of
chitosan activates artemisinin biosynthesis in Artemisia
annua L. [J]. Ind Crops Prod, 2011, 33(1): 176-182. [43]Wang J W, Zheng L P, Zhang B, et al. Stimulation of
artemisinin synthesis by combined cerebroside and nitric
oxide elicitation in Artemisia annua hairy roots [J]. Appl
Microbiol Biotechnol, 2009, 85(2): 285-292.
[44]Rai R, Meena R P, Smita S S, et al. UV-B and UV-C
pre-treatments induce physiological changes and artemisinin biosynthesis in Artemisia annua L. —an
antimalarial plant [J]. J Photochem Photobiol B, 2011,
105(3): 216-225.
[45]Wang Y, Weathers P J. Sugars proportionately affect
artemisinin production [J]. Plant Cell Rep, 2007, 26(7):
1073-1081.
[46]Arsenault P R, Vail D R, Wobbe K K, et al. Effect of
sugars on artemisinin production in Artemisia annua L.:
transcription and metabolite measurements [J].
Molecules, 2010, 15(4): 2302-2318.
[47]Sa G, Mi M, He-chun Y, et al. Effects of ipt gene
expression on the physiological and chemical characteristics of Artemisia annua L. [J]. Plant Sci, 2001,
160(4): 691-698.
[48]Han J L, Liu B Y, Ye H C, et al. Effects of overexpression
of the endogenous farnesyl diphosphate synthase on the
artemisinin content in Artemisia annua L. [J]. J Integr
Plant Biol, 2006, 48(4): 482-487.
[49]Alam P, Abdin M Z. Over-expression of HMG-CoA
reductase and amorpha-4, 11-diene synthase genes in
Artemisia annua L. and its influence on artemisinin
content [J]. Plant Cell Rep, 2011, 30(10): 1919-1928. [50]景福远, 张凌, 李美芽, 等. 过量表达cyp71av1和
cpr基因提高青蒿中青蒿素的含量 [J]. 中国农业科技
导报, 2008, 10(3): 64-70.
[51]Yang R Y, Feng L L, Yang X Q, et al. Quantitative
transcript profiling reveals down-regulation of A sterol
pathway relevant gene and overexpression of artemisinin
biogenetic genes in transgenic Artemisia annua plants [J].
Planta Med, 2008, 74(12): 1510-1516.
[52]Zhang L, Jing F, Li F, et al. Development of transgenic
Artemisia annua (Chinese wormwood) plants with an
enhanced content of artemisinin, an effective anti-malarial
drug, by hairpin-RNA-mediated gene silencing [J].
Biotechnol Appl Biochem, 2009, 52(3): 199-207.
基因工程和细胞工程
第一讲基因工程和细胞工程 1.(2014·广东卷,25)(双选)利用基因工程技术生产羧酸酯酶(CarE)制剂的流程如图所示,下列叙述正确的是( ) A.过程①需使用逆转录酶 B.过程②需使用解旋酶和PCR获取目的基因 C.过程③使用的感受态细胞可用NaCl溶液制备 D.过程④可利用DNA分子杂交鉴定目的基因是否已导入受体细胞 解析:过程①是以mRNA为模板合成DNA的过程,即逆转录过程,需要逆转录酶的催化,A正确;过程②表示利用PCR扩增目的基因,在PCR过程中,不需要解旋酶,是通过控制温度来达到解旋的目的,B错误;利用氯化钙处理大肠杆菌,使之成为感受态细胞。C错误;检测目的基因是否成功导入受体细胞的染色体DNA中,可以采用DNA分子杂交技术,D正确。 答案:AD 2.(2014·浙江卷,3)下列关于动物细胞培养的叙述,正确的是( ) A.连续细胞系的细胞大多具有二倍体核型 B.某些癌细胞在合适条件下能逆转为正常细胞 C.由多个祖细胞培养形成的细胞群为一个克隆 D.未经克隆化培养的细胞系细胞具有相同的性状 解析:连续细胞系的细胞其核型已发生改变;一个祖细胞培养形成的细胞群才为一个克隆;未经克隆化培养的细胞系细胞可能是不同细胞分裂形成的,其性状可能不同。 答案:B
3.(2014·重庆卷,4)如图是利用基因工程培育抗虫植物的示意图。以下相关叙述,正确的是( ) A.②的构建需要限制性核酸内切酶和DNA聚合酶参与 B.③侵染植物细胞后,重组Ti质粒整合到④的染色体上 C.④的染色体上若含抗虫基因,则⑤就表现出抗虫性状 D.⑤只要表现出抗虫性状就表明植株发生了可遗传变异 解析:构建载体需要限制酶和DNA连接酶,A错误;③侵染植物细胞后,重组Ti质粒上的T-DNA整合到④的染色体上,B错误;染色体上含有目的基因,但目的基因也可能不能转录或者不能翻译,或者表达的蛋白质不具有生物活性,C错误;植株表现出抗虫性状,说明含有目的基因,属于基因重组,为可遗传变异,D正确。 答案:D 4.(2014·江苏卷,23改编)下列关于基因工程技术的叙述,正确的是( ) A.切割质粒的限制性核酸内切酶均特异性地识别6个核苷酸序列 B.PCR反应中温度的周期性改变是为了DNA聚合酶催化不同的反应 C.载体质粒通常采用抗生素合成基因作为筛选标记基因 D.抗虫基因即使成功地插入到植物细胞染色体上也未必能正常表达 解析:限制性核酸内切酶大多是特异性识别6个核苷酸序列,但也有识别序列由4、5或8个核苷酸组成的,A错误;PCR中耐高温的DNA聚合酶只是在延伸阶段发挥催化作用,B 项错误;载体质粒上抗生素抗性基因可作为标记基因,供重组DNA的鉴定和选择,不是抗生素合成基因,C错误;目的基因导入了受体细胞不一定就都能正常表达,D正确。 答案:D 5.(2014·广东卷,29)铁皮石斛是我国名贵中药,生物碱是其有效成分之一,应用组
高中生物技术与生物工程基因工程和蛋白质工程第1节基因工程的原理学案
第一章基因工程和蛋白质工程 第一节基因工程的原理 1.简述基因工程的诞生。 2.简述基因工程的原理及技术。(重点) 3.尝试DNA的提取与鉴定。(难点) 1.诞生历程 2. (1)核酸限制性内切酶——“基因手术刀” (2)DNA连接酶——“基因缝纫针” ①作用:将两个DNA片段连接起来,修复被限制性内切酶切开的切口,拼接成新的DNA 分子。 ②种类:T4DNA连接酶(把限制性内切酶切开的黏性末端的缝隙“缝合”起来)。 (3)载体——“分子运输车” ①载体的特点 ⅰ.外源DNA的插入不影响载体在宿主细胞内的自我复制。 ⅱ.有适宜的限制性内切酶酶切位点,最好是对多种限制性内切酶有单一切点。 ⅲ.具有某些标记基因。 ⅳ.载体应对受体细胞无害。
②载体的种类: ⅰ.质粒:它是细菌中独立于细菌DNA之外的小型环状DNA分子。 ⅱ.噬菌体或其他一些病毒。 [合作探讨] 探讨1:下图表示限制性内切酶切割某DNA分子的过程,从下图中可知,该限制性内切酶能识别的碱基序列及其切割位点是什么? 提示:GAATTC,切点在G和A之间。 探讨2:结合DNA复制的过程分析,限制性内切酶和DNA解旋酶的作用部位有何不同? 提示:限制性内切酶作用于磷酸和脱氧核糖之间的磷酸二酯键,DNA解旋酶作用于两个碱基之间的氢键。 探讨3:如图,两个核酸片段在适宜条件下,经X酶的催化作用,发生了下述变化,则X酶是什么? 提示:DNA连接酶。 [思维升华] 1.核酸限制性内切酶 (1)来源和种类 切割DNA的工具是核酸限制性内切酶,又叫限制酶,这类酶主要是从原核生物中分离纯化出来的。迄今已分离出的约有4 000种。 (2)作用 限制酶能够识别双链DNA分子的某种特定核苷酸序列,并且使每一条链中特定部位的两个核苷酸之间的磷酸二酯键断开。 (3)识别序列的组成 一般由6个核苷酸组成,少数由4、5或8个核苷酸组成。 (4)作用结果 当限制酶在它识别序列的中心轴线两侧将DNA的两条链分别切开时,产生的是黏性末端;而当限制酶在它识别序列的中心轴线处切开时,产生的则是平末端。
合成生物学研究进展及其风险
合成生物学研究进展及其风险 关正君魏伟徐靖 1合成生物学研究概况 合成生物学(synthetic biology)是在现代生物学和系统科学基础上发展起来的、融入工程学思想的多学科交叉研究领域。其包括了与人类自身和社会发展相关的研究方向和内容,为解答生命科学难题和人类可持续发展所面临的重大挑战提供了新的思路、策略和手段。2004年,合成生物学被美国麻省理工学院出版的Technology Review评为“将改变世界的十大新技术之一”。2010年12月,Nature杂志盘点出2010年12件重大科学事件,Science杂志评出的科学十大突破,合成生物学分别排名第4位和第2位。为此,世界各国纷纷制定合成生物学发展战略及规划,开展合成生物学研究,以抢占合成生物学研究和发展先机,促进了合成生物学基础研究和应用研究的快速发展。同时合成生物学的巨大应用潜力,还吸引了众多公司及企业参与到该领域的研究开发,推动着合成生物学产业化的进程。 合成生物学作为后基因组时代生命科学研究的新兴领域,其研究既是生命科学和生物技术在分子生物学和基因工程水平上的自然延伸,又是在系统生物学和基因组综合工程技术层次上的整合性发展。与传统生物学通过解剖生命体以研究其内在构造不同,合成生物学旨在将工程学的思想用于生物学研究中,以设计自然界中原本不存在的生物或对现有生物进行改造,使其能够处理信息、加工化合物、制造材料、生产能源、提供食物、处理污染等,从而增进人类的健康,改善生存的环境,以应对人类社会发展所面临的严峻挑战。 作为一个新的基础科学研究领域,合成生物学综合生物化学、生物物理和生物信息技术与知识,涵盖利用基因和基因组的基本要素及其组合,设计、改造、重建或制造生物分子、生物体部、生物反应系统、代谢途径与过程,乃至整个生物活动的细胞和生物个体。合成生物学使人们可以利用与物理学方法类似的模块构建和组装形成新的生命有机体,从而人工设计新的高效生命系统。中科院《2013年高技术发展报告》指出,DNA测序技术、DNA合成技术和计算机建模是支撑合成生物学发展的关键技术。近年来,大量物种的全基因组测序,为合成生物学家构建功能组件的底盘生物体系提供了丰富的遗传信息。快速、廉价的测序技术也促进了新的系统和物种的识别和解析。 2 合成生物学应用研究进展 2.1 合成生物学在医药工业领域的应用 2.1.1 天然药物合成生物学 天然药物合成生物学是在基因组学研究的基础上,对天然药物生物合成相关元器件进行发掘和表征,借助工程学原理对其进行设计和标准化,通过在底盘细胞中装配与集成,重建生物合成途径和代谢网络,从而实现药用活性成分定向、高效的异源合成,以解决天然药物
青蒿素的化学全合成.总结
青蒿素的合成与研究进展 摘要:青蒿素是目前世界上最有效的治疗疟疾的药物之一,存在活性好、毒副作用小、市场需求大、来源窄等特点。目前,青蒿素的获取途径主要有直接从青蒿中提取、化学合成和生物合成。本综述将针对近年来青蒿素的发展特点及合成方法进行论述。 关键词:青蒿素;合成方法;研究进展 青蒿素是中国学者在20世纪70年代初从中药黄花蒿( Artem isia annua L1 )中分离得到的抗疟有效单体化合物,是目前世界上最有效的治疗脑型疟疾和抗氯喹恶性疟疾的药物, 对恶性疟、间日疟都有效, 可用于凶险型疟疾的抢救和抗氯喹病例的治疗。青蒿素还具有抑制淋巴细胞的增殖和细胞毒性的用1;具有影响人体白血病U937细胞的凋亡及分化的作用2;还具有部分逆转MCF-7/ARD细胞耐药性作用3;还具有抑制人胃癌裸鼠移植瘤的生长的作用4;还具有一定的抗肿瘤作用5等。除此之外,青蒿素及其衍生物还具有生物抗炎免疫作用、生物抗肿瘤作用、抑制神经母细胞瘤细胞增殖的作用等。世界卫生组织确定为治疗疟疾的首选药物, 具有快速、高效、和低毒副作用的特征。6。因在发现青蒿素过程中的杰出贡献,屠呦呦先后被授予2011年度拉斯克临床
医学研究奖和2015年诺贝尔医学奖。 1 青蒿素的理化性质及来源 青蒿素的分子式为C15H22O5, 相对分子质量为282. 33。是一种含有过氧桥结构的新型倍半萜内酯,有一个包括过氧化物在内的1,2,4-三烷结构单元,它的分子中还包括7个手性中心,合成难度很大。中国科学院有机所经过研究,解决了架设过氧桥难题,在1983年完成了青蒿素的全合成。青蒿素也有一些缺点, 如在水和油中的溶解度比较小, 不能制成针剂使用等。 2 青蒿中提取青蒿素 青蒿素是从菊科植物黄花蒿中提取出来的含有过氧桥的倍半萜内酯类化合物,在治疗疟疾方面具有起效快、疗效好、使用安全等特点。目前主要的提取方法有溶剂提取法、超临界提取法、超声波萃取法、微波萃取法、其他萃取法等。2.1有机溶剂萃取青蒿素 水蒸气蒸馏(steam distillation,SD)法由于其具有设备简单,操作安全,不污染环境,成本低,避免了提取过程中有机溶剂残留对油质造成影响等特点,是有效提取中药挥发油的重要方法。有机溶剂提取法是目前青蒿中许多有效成分的提取目前仍然常用的方法,常用的溶剂有醇类(甲醇、乙醇
基因工程(现代生物技术)应用前景与发展
基因工程的发展现状及前景 摘要: 从20世纪70年代初发展起来的基因工程技术,经过30多年来的进步与发展,已成为生物技术的核心内容。许多科学家预言,生物学将成为21世纪最重要的学科,基因工程及相关领域的产业将成为21世纪的主导产业之一近年来随着生物工程技术的发展,许多基因工程抗体陆续问世。基因工程研究和应用范围涉及农业、工业、医药、能源、环保等许多领域。 关键字: 基因工程;基因工程抗体;前景;现状;发展 一、基因工程介绍 1、基本定义 生物学家于20世纪50年代发现了DNA的双螺旋结构,从微观层面更进一步认识了人类及其他生物遗传的物质载体,这是人类在生物研究方面的一次重大突破。60年代以后,科学家开始破译生物遗传基因的遗传密码,简单地说,就是将控制生物遗传特征的每一种基因的核苷酸排列顺序弄清楚。在搞清楚某些单个基因的核苷酸排列顺序基础上,进而进行有计划、大规模地对人类、水稻等重要生物体的全部基因图谱进行测序和诠释。美国从1991年起,准备用15年时间完成人体基因组测序计划。[5] 基因工程(Genetic engineering)原称遗传工程。从狭义上讲,基因工程是指将一种或多种生物体(供体)的基因与载体在体外进行拼接重组,然后转入另一种生物体(受体)内,使之按照人们的意愿遗传并表达出新的性状。因此,供体、受体和载体称为基因工程的三大要素,其中相对于受体而言,来自供体的基因属于外源基因。除了少数RNA病毒外,几乎所有生物的基因都存在于DNA 结构中,而用于外源基因重组拼接的载体也都是DNA分子,因此基因工程亦称为重组DNA技术(DNA recombination)。另外,DNA重组分子大都需在受体细胞中
鬼臼毒素生物合成研究进展_陆炜强
·综述· 鬼臼毒素生物合成研究进展 陆炜强,傅承新,赵云鹏 * (浙江大学生命科学学院濒危野生动植物保护生物学教育部重点实验室,浙江杭州310058) [摘要]鬼臼毒素(podophyllotoxin )是一种成功商品化的天然木脂素,其衍生物依托泊苷(etoposide )、替尼泊苷(tenipo-side )等在临床上广泛应用于抗肿瘤、抗病毒治疗。植物提取是鬼臼毒素的主要来源,面对野生资源压力,人们分别开展了植物野生变栽培、 植物细胞或器官培养、化学全合成等研究,以扩大鬼臼毒素来源。鬼臼毒素生物合成研究是开展植物规范化栽培和代谢工程的重要前提。20多年来尤其是近10年来,鬼臼毒素生物合成研究进展迅速,但鬼臼毒素的下游代谢以及整个合成途径基因水平的评述仍不足,因此作者专门针对鬼臼毒素的生物合成,对相关文献尤其是近10年的文献进行综述,重点介绍其合成途径关键环节的过程、主要产物、酶的特点与功能、已报道的酶编码基因等内容,以合理推测和概括鬼臼毒素的生物合成途径,同时对目前研究仍存在的问题和将来研究方向进行了讨论。 [关键词]鬼臼毒素;生物合成;规范化栽培;代谢工程[稿件编号]20101116002 [基金项目]国家科技支撑计划项目(2006BAI21B07);浙江省科技厅中药现代化专项(2006C13077)[通信作者]* 赵云鹏, Tel :(0571)88206463,E-mail :ypzhao @https://www.360docs.net/doc/ba7000448.html, [作者简介]陆炜强, Tel :(0571)88206463,E-mail :lwq-711@ 163.鬼臼毒素(podophyllotoxin , PTOX )是植物来源天然产物成功商品化的经典案例。从其发现至今已有近1个世纪的历史,其具有良好的抗肿瘤、抗尖锐湿疣、抗艾滋病毒活性 [1-3] ,虽然自身毒副作用较大,但其半合成衍生物在保证治 疗效果的同时,大大降低了毒性,在临床治疗淋巴癌、肺癌等多种癌症中得到广泛应用, 如依托泊苷(etoposide ,VP-16),替尼泊苷(teniposide ,VM-26),依托泊苷磷酸酯(etopophos ),azatoxin ,tafluposide 等[4]。鬼臼毒素的传统和主要来源是植物提取,来源植物主要分布于小檗科足叶草属Podophyllum 、桃儿七属Sinopodophyllum 、八角莲属Dysosma 、山荷叶属Diphylleia 、Jeffersonia 属,其他还有亚麻科亚麻属Linum ,柏科刺柏属Juniperus 、崖柏属Thuja 、Callitris 属,唇形科山香属Hyptis 、百里香属Thymus 、香科科属Teucrium 、荆芥属Nepeta 、Eriope 属等[5-7]。由于过度采挖、生境破坏和植物自身生长缓慢等原因,鬼臼类野生植物资源逐渐枯竭、物种濒危,已难以满足鬼臼毒素生产的需求,人工规范化栽培势在必行,但目前桃儿七S .hexandrum (异名:Podophyllum hex-andrum ,P .emodi )、八角莲D .versipellis 的栽培刚刚起步,其他来源植物的新资源开发程度也有待进一步深入 [8-10] 。此外,虽然化学全合成技术已经有所突破,但是 复杂的合成过程、极低的合成效率(约为5%),使人工全合成鬼臼毒素目前仍难以实现商业化 [3,11] 。近年来基于 生物技术的植物代谢工程快速发展,为鬼臼毒素替代资源的开发提供了更多途径,如植物细胞或器官培养、生物转化等,但仍存在效率低、成本高的共性问题,目前尚未产业化 [5,12-14] 。因此,要彻底解决鬼臼毒素的来源问题, 仍需要对上述3种途径的关键科学和技术问题深入研究。 实现药用植物规范化栽培和植物细胞或器官培养生产鬼臼毒素的前提之一是必须充分阐明鬼臼毒素的生物合成途径及其调控机制。因此,自20世纪80年代末以来,学者们以足叶草Podophyllum spp.、亚麻Linum spp.等植物的组织或细胞培养体系为研究系统,探讨了鬼臼毒素的生物合成途径,取得了长足进展。前人综述了不同时期鬼臼毒素生物合成不同方面的研究进展 [6,12,15-19] ,揭示了合成途径的大体 框架,为后续的研究提供了良好的基础和背景。但是前人的综述大多是对鬼臼毒素的资源、化学、药理、生物合成、细胞或器官培养等内容的全面评述,或者是对整个木脂素类生物合成的综述, 对于鬼臼毒素生物合成的论述不够全面、详细,比如对鬼臼毒素下游的代谢往往没有讨论,而且对近几年已有新进展的相关酶编码基因的分离、扩增、表达也较少涉及。因此,本文专门针对鬼臼毒素的生物合成,对相关文献尤其是近10年的文献进行综述,重点介绍其合成途径关键环节的过程、主要产物、酶的特点与功能、鬼臼毒素下游代谢、已报道的酶编码基因等内容,以期继续推动该领域的研究,实现优质种源筛选、株系改良、栽培和培养条件优化、生产体系调控,为鬼臼类植物规范化栽培和代谢工程的产业化奠定
基因工程和细胞工程
基因工程和细胞工程 一、单选题 1.如图是基因工程主要技术环节的一个基本步骤,这一步骤需要用到的工具是 A. DNA连接酶和解旋酶 B. DNA聚合酶和限制酶 C. 限制酶和DNA连接酶 D. DNA聚合酶和RNA聚合酶 【答案】C 【解析】图示表示基因表达载体的构建过程,该过程首先需要用限制酶切割含有目的基因的外源DNA分子和质粒,其次还需要用DNA连接酶将目的基因和质粒连接形成重组质粒,故选C。 2.下面关于植物细胞工程的叙述,正确的是() A.叶肉细胞已经高度分化,无法表现出全能性 B.叶肉细胞经再分化过程可形成愈伤组织 C.融合植物叶肉细胞时,应先去掉细胞膜 D.叶肉细胞离体培养时,可以表现出全能性 【答案】D 【解析】 试题分析:叶肉细胞已经高度分化,但在体外培养的条件下也能表现出全能性,A错误;叶肉细胞经脱分化过程可形成愈伤组织,B错误;融合植物叶肉细胞时,应先去掉细胞壁,C错误;叶肉细胞离体培养时,可以表现出全能性,形成完整植株,D正确 考点:本题考查植物组织培养的相关知识,要求考生识记植物组织培养的原理、过程、条件等基础知识,掌握植物细胞具有全能性的原因,能结合所学的知识准确判断各选项。 3.如图为白菜一甘蓝杂种植株的培育过程。下列说法正确的是() A.图示白菜一甘蓝植株不能结籽 B.愈伤组织的代谢类型是自养需氧型 C.上述过程中包含着有丝分裂、细胞分化和减数分裂
D.白菜一甘蓝杂种植株具有的性状是基因选择性表达的结果 【答案】D 【解析】白菜和甘蓝都是二倍体,它们的体细胞杂交后培育的“白菜-甘蓝”杂种植株中2个染色体组来自白菜,2个染色体组来自甘蓝,因为“白菜-甘蓝”属于异源四倍体,是可育的,能产籽,故A错误;愈伤组织是一种高度液泡化的呈无定型状态的薄壁细胞,不能进行光合作用产生有机物,因此愈伤组织的代谢类型是异养需氧型,故B错误;上述过程包括去壁、原生质体融合、植物组织培养等过程,其结果是形成“白菜-甘蓝”幼苗,并未发育到性成熟个体,因此整个过程中有有丝分裂和细胞分化,没有减数分裂过程,故C错误;任何性状都是基因选择性表达的结果,故D正确. 【考点定位】植物体细胞杂交的应用 【名师点睛】据图分析,植物细胞壁的成分是纤维素和果胶,去壁所用的是纤维素酶和果胶酶;原生质体融合所用的方法有物理法和化学法.物理法包括离心、振动、电激等,化学法一般是用聚乙二醇;再生细胞壁形成杂种细胞;脱分化形成愈伤组织,再分化形成“白菜一甘蓝”幼苗. 4.下列有关细胞工程的叙述中正确的一项是() A.克隆不是无性繁殖 B.用体细胞克隆动物是通过核移植实现的 C.灭活病毒通过溶解磷脂双分子层诱导动物细胞融合 D.动物细胞培养与植物组织培养所用的培养基成分一样 【答案】B 【解析】 试题分析:克隆属于无性繁殖,故A错误。用体细胞克隆动物必须通过核移植才能实现,故B正确。灭活病毒诱导动物细胞融合不是溶解磷脂双分子层而是通过改变膜脂分子排列实现的,故C错误。动物细胞培养液通常需要加入血清,植物组织培养通常需要加入植物激素,故D错误。 考点:本题考查细胞工程相关知识,意在考察考生对知识点的识记理解掌握程度。5.以下哪种物质不可以用于植物细胞的诱导融合剂() A.PEG B.灭活的病毒 C.离心 D.振动电激 【答案】B 【解析】 试题分析:灭活的病毒是动物细胞工程的诱导剂,不能用于植物细胞工程,故选B。 考点:本题考查植物细胞工程等相关知识,意在考察考生对知识点的识记理解掌握程度。6.下列有关植物细胞工程的叙述,正确的是() A.在植物组织培养过程中,细胞的遗传物质一般都发生改变 B.植物细胞只要在离体状态下即可表现出全能性 C.植物组织培养过程中始终要保持适宜的光照 D.植物耐盐突变体可通过添加适量NaCl 的培养基培养筛选而获得 【答案】D 【解析】 试题分析:在植物组织培养过程中,细胞的遗传物质一般不发生改变,A错误;植物细胞的全能性指离体的组织器官的经过培养,发育成完整个体的潜能,B错误;植物组织培养过程中开始是要避光,C错误;植物耐盐突变体可通过添加适量NaCl 的培养基培养筛选而获得,D正确;答案是D。 考点:本题考查植物细胞工程的相关知识,意在考查考生理解所学知识的要点,把握知识间的内在联系的能力。 7.植物组织培养的过程可以归纳为:①? ?再分化③→④;对此叙述有错误的 ?→ ?→ ?脱分化②? 是( ) A.②→③的再分化过程中,培养基中需要添加细胞分裂素与生长素
青蒿素综述
青蒿素综述 刘兵情 (井冈山大学11级药本(1)班学号:111116023) 摘要:青蒿素类抗疟药物的发现是全球抗疟药物发展史上继奎宁之后的又一里程碑[1], 是目前治疗疟疾的特效药.本文简要介绍青蒿素的发现过程、药源、生物合成、应用前景和青蒿素及其衍生物药理活性,重点在于介绍青蒿素生物合成过程。 关键词:青蒿素发现过程药源生物合成药理活性前景 引言:青蒿素是在科研计划组织下,全国多部门、多学科专家尽心协作、相互 配合取得的重大成果,是继承发扬我国传统医药宝库的成功范例[2]。青蒿素主要有抗疟、抗孕、抗纤维化、抗吸血虫等药理作用[3]。青蒿素生物合成三个阶段分为从乙酰辅酶A 到法呢基焦磷酸的“上游”途径、从法呢基焦磷酸到双氢青蒿酸的“中游”途径和从双氢青蒿酸到青蒿素的“下游”途径,其中上游途径青蒿及其他高等植物与酵母等真核微生物完全相同,因而只需在酵母中额外增加一个青蒿素合成代谢支路, 就能让酵母全合成青蒿素。而中游的酶促反应在酵母中已经完全建立,下游途径的反应条件在酵母中则未建立[4]。而且青蒿素及其衍生物在抗肿瘤和葡萄膜炎免疫治疗上也具有应用前景 。 一.青蒿素药物来源 1967 年北京《5·23 抗疟计划》付诸实施, 1969 年1 月北京中医研究院加入 5·23 计划,任命屠呦呦为科研组组长, 在全国多个研究单位协作下, 组织植物化学与药理学等专业200 多人参加, 并与中医药工作者密切合作[5].从追索我国历代抗疟方剂入手, 科研组调查了 2 000 种中草药制剂, 从中选出可能具抗疟活性的达640 种. 余亚纲梳理开列了有808 个中药的单子,其中有乌头、乌梅、鳖甲、青蒿等[6]共用约200种国产草药制成380 多种抽提物, 再筛查它们对小鼠疟疾模型的疗效,但实验不易获得明显结果[7]军事医学科学院用鼠疟模型筛选了近百个药方,青蒿提取物的抑制率虽达60%~80%, 而效力不够稳定[6]继后, 研究组经余亚纲和顾国明复筛, 肯定了青蒿的抗疟作用[8]他们也研究了中药常山,其抗疟作用虽强, 但呕吐的副作用亦强而妨碍推广应用. 转折点出现在黄花蒿的抽提物. 传统中药青蒿包括两个品种: 学名黄花蒿(Artemisia an-nua L.)的抽提物能对小鼠疟原虫的生长显示良好的抑制作用;而学名青蒿(Artemisia apiaceaHance)则无任何抗疟作用[7][9],继后的实验中, 上述结果未能重复, 这同中医文献的记载相矛盾. 为解开此疑惑, 再深入查阅古代医学文献, 最后在晋朝葛洪著《肘后备急方》中找到“青蒿一握, 以水二升渍, 绞取汁, 尽服之”的抗疟记录. 惯常煎熬中药的高温抽提法已破坏了抗疟的活性组分;温度高于60 ℃将使青蒿素完全分解. 在较低温度下进行青蒿抽提后, 获得了很满意的效果[7][9][10]
生物 选修三 基因工程
高中生物选修3第一章基因工程习题 一.单选题:每小题只有一个选项最符合题意。 1.下列有关基因工程的叙述,正确的是:() A.DNA连接酶的作用是将两个黏性末端的碱基连接起来 B.目的基因导入受体细胞后,受体细胞即发生基因突变 C.目的基因与运载体结合的过程发生在细胞外 D.常使用的运载体有大肠杆菌、噬菌体和动植物病毒等 2.下列关于基因工程的叙述,正确的是:() A.基因工程经常以抗菌素抗性基因为目的基因 B.细菌质粒是基因工程常用的运载体 C.通常用一种限制性内切酶处理含目的基因的DNA,用另一种处理运载体DNA D.为育成抗除草剂的作物新品种,导入抗除草剂基因时只能以受精卵为受体 3.限制性内切酶的作用实际上就是把DNA上某些化学键打断,一种能对GAATTC专一识别的限制酶,打断的化学键是:() A.G与A之间的键 B.G与C之间的键 C.A与T之间的键 D.磷酸与脱氧核糖之间的键 4.下面图中a、b、c、d代表的结构正确的是:() A.a—质粒RNA B.b—限制性外切酶 C.c—RNA聚合酶D.d—外源基因 5.苏云金芽孢杆菌的抗虫基因导入棉花细胞是否已表达,其检测方法是:()A.是否有抗生素抗性 B.是否能检测到标记基因 C.是否有相应的性状 D.是否能分离到目的基因 6.科学家已能运用基因工程技术,让羊合成并由乳腺分泌抗体,相关叙述中正确的是 ①该技术将导致定向变异②DNA连接酶把目的基因与运载体黏性末端的碱基对连接起来③蛋白质中的氨基酸序列可为合成目的基因提供资料④受精卵是理想的受体A.①②③④ B.①③④C.②③④D.①②④ 7.随着转基因技术的发展,基因污染也逐渐产生。下列有关基因污染的说法不正确的是:()A.转基因作物可通过花粉扩散到它的近亲作物上,从而污染生物基因库 B.杂草、害虫从它的近亲获得抗性基因,可能破坏生态系统的稳定性 C.基因污染是一种不能增殖的污染 D.基因污染较难清除 8.美国农业部指导农民在种植转基因农作物时,要求农民在转基因农作物的行间种植一些普通的非转基因农作物,供害虫取食,这种做法的主要目的是:() A.保护物种多样性 B.保护害虫的天敌
微生物药物合成生物学研究进展
微生物药物合成生物学研究进展 武临专, 洪斌* (中国医学科学院、北京协和医学院医药生物技术研究所, 卫生部抗生素生物工程重点实验室, 北京100050) 摘要: 微生物次级代谢产物结构复杂多样, 具有抗细菌、抗真菌、抗肿瘤、抗病毒和免疫抑制等多种生物活性, 是微生物药物开发的源泉。当前, 微生物药物研究面临一些挑战: 快速发现结构新颖、生物活性突出的化合物; 理性化提高产生菌的发酵效价; 以及以微生物为新宿主, 实现一些重要天然药物的工业生产。合成生物学是在系统生物学和代谢工程等基础上发展起来的一门学科。本文对合成生物学在发现微生物新次级代谢产物、提高现有微生物药物合成水平和创制微生物次级代谢产物方面的研究进展进行了阐述。 关键词: 微生物药物; 合成生物学; 次级代谢产物; 生物合成 中图分类号: Q939.9; Q81; R914.5 文献标识码:A 文章编号: 0513-4870 (2013) 02-0155-06 Synthetic biology toward microbial secondary metabolites and pharmaceuticals WU Lin-zhuan, HONG Bin* (Key Laboratory of Biotechnology of Antibiotics of Ministry of Health, Institute of Medicinal Biotechnology, Peking Union Medical College and Chinese Academy of Medical Sciences, Beijing 100050, China) Abstract: Microbial secondary metabolites are one of the major sources of anti-bacterial, anti-fungal, anti- tumor, anti-virus and immunosuppressive agents for clinical use. Present challenges in microbial pharmaceutical development are the discovery of novel secondary metabolites with significant biological activities, improving the fermentation titers of industrial microbial strains, and production of natural product drugs by re-establishing their biosynthetic pathways in suitable microbial hosts. Synthetic biology, which is developed from systematic biology and metabolic engineering, provides a significant driving force for microbial pharmaceutical development. The review describes the major applications of synthetic biology in novel microbial secondary metabolite discovery, improved production of known secondary metabolites and the production of some natural drugs in genetically modified or reconstructed model microorganisms. Key words: microbial pharmaceuticals; synthetic biology; secondary metabolites; biosynthesis 来源于微生物的药物称为微生物药物(microbial medicine, microbial pharmaceuticals), 主要包括来源于微生物(特别是放线菌和真菌) 次级代谢产物的药物。 收稿日期: 2012-09-25; 修回日期: 2012-11-01. 基金项目: 国家“重大新药创制”科技重大专项资助项目(2012ZX09301002-001-016); 国家自然科学基金资助项目 (31170042, 81172964). *通讯作者 Tel: 86-10-63028003, E-mail: binhong69@https://www.360docs.net/doc/ba7000448.html,, hongbin@https://www.360docs.net/doc/ba7000448.html, 微生物药物例如抗生素, 在控制感染、免疫调节和治疗癌症等方面发挥了重要作用。目前, 已经从放线菌和真菌中发现了2万多种具有生物活性的次级代谢产物, 其中百余种成为微生物药物。随着对放线菌和真菌的持续开发利用, 直接从放线菌和真菌研制微生物新药难度越来越大, 主要原因在于: ①化合物排重难度很大(从微生物已经发现了25 000多种化合物); ②新微生物资源的分离培养工作没有突破性进展, 获得大量的、具有产生新次级代谢产物能 ·专题报道·
【免费下载】青蒿素生物合成
青蒿素生物合成 10生物技术(2)班 曾庆辉 201024112211 青蒿素是我国科研人员从传统中医药黄花蒿中提取出来并自主研发的一种抗疟疾特效药[1]。20世纪70年代,我国科技工作者从黄花蒿中分离提纯出一种抗疟活性单体——青蒿素,以后又确定了它的分子结构和构型。1986年我国自主研发的蒿甲醚油针剂、青蒿琥酯钠盐的水针剂以及青蒿素栓剂等抗疟疾药作为一类新药在我国批准生产。1995年蒿甲醚率先被收入国际药典,这是我国首次得到国际认可的自主研发新药。目前,青蒿素系列抗疟药已有5种新药(青蒿素、青蒿琥酯、蒿甲醚、双氢青蒿素、复方蒿甲醚)共9种剂型上市并在世界各国销售,每年挽救了数百万重症疟疾患者的生命。除了独特的抗疟作用外,青蒿素系列药物还具有抗血吸虫、肺吸虫、红斑狼疮、皮炎以及免疫调节,抗流感等多种疗效[2]。但是,目前国际抗疟药市场上青蒿素类药物只占有很少的份额,其原因主要在于青蒿素原料缺乏。由此,有研究者另辟蹊径,设想通过生物合成青蒿素。时至今日,青蒿素的生物合成已经取得一定进展,介绍如下:早在20世纪80年代,中国科学院上海有机化学研究所汪猷院士领导的研究小组就利用放射性同位素标记的2-14C-青蒿酸与青蒿匀浆(无细胞系统)保温法证明,青蒿酸和青蒿B 是青蒿素的共同前体[3]。青蒿素生物合成途径仅见于青蒿,但其“上游”途径为真核生物所共有,可望通过“下游”途径重建,在真核微生物(如酵母)中全合成青蒿素。过去10年来,青蒿素合成基因被国内外研究团队陆续克隆并导入酿酒酵母细胞,已成功合成青蒿酸及双氢青蒿酸等青蒿素前体。由于酵母缺乏适宜的细胞环境,尚不能将青蒿素前体转变成青蒿素。因此,青蒿依然是青蒿素的唯一来源,凸显出继续开展青蒿种质遗传改良的必要性。同时,青蒿素生物合成的限速步骤尤其是终端反应机制已基本得到阐明,有助于开展青蒿素形成与积累的环境模拟及仿生,从而为彻底缓解青蒿素的供求矛盾创造先机[4]。若以双氢青蒿酸为青蒿素的直接前体,则青蒿素生物合成过程如下:首先是从乙酰辅酶A 经异戊烯基焦磷酸(IPP)、二甲基烯丙基焦磷酸(DMAPP)、法呢基焦磷酸到紫穗槐-4,11-二烯的合成途径,其中DMAPP 与IPP 受IPP 异构酶(IPPI)催化发生互变,二者再被法呢基焦磷酸合成酶(FDS)作用生成法呢基焦磷酸,并在紫穗槐二烯合酶(ADS)催化下闭环产生紫穗槐-4,11-二烯;其次是从紫穗槐-4,11-二烯到双氢青蒿酸的合成途径,紫穗槐-4,11-二烯在细胞色素P450单加氧酶(CYP71AV1)催化下,经连续氧化依次生成青蒿醇、青蒿醛和青蒿酸,其中青蒿醛受青蒿醛双键还原酶2(DBR2)催化而还原成双氢青蒿醛,后者再在青蒿醛脱氢酶1(ALDH1)催化下氧化成双氢青蒿酸。双氢青蒿醇转变成双氢青蒿醛由ALDH1/CYP71AV1催化,其逆反应则由双氢青蒿酸还原酶1(RED1)催化,最后是从双氢青蒿酸到青蒿素的合成途径,双氢青蒿酸经过未知的多个非酶促反应最终生成青蒿素。此外,青蒿酸可能经多步反应合成青蒿素B 后再转变成青蒿素[5]。 青蒿素的生物合成主要任务有:①青蒿素前体合成工程菌的构建。在这里为了便于叙述,将上述青蒿素生物合成过程分为“上游”、“中游”和“下游”三个途径,分别是从乙酰辅酶A 到法呢基焦磷酸的“上游”途径、从法呢基焦磷酸到双氢青蒿酸的“中游”途径和从双氢青蒿酸到青蒿素的“下游”途径。、管路敷设技术通过管线敷设技术,不仅可以解决吊顶层配置不规范问题,而且可保障各类管路习题到位。在管路敷设过程中,要加强看护关于管路高中资料试卷连接管口处理高中资料试卷弯扁度固定盒位置保护层防腐跨接地线弯曲半径标高等,要求技术交底。管线敷设技术中包含线槽、管架等多项方式,为解决高中语文电气课件中管壁薄、接口不严等问题,合理利用管线敷设技术。线缆敷设原则:在分线盒处,当不同电压回路交叉时,应采用金属隔板进行隔开处理;同一线槽内,强电回路须同时切断习题电源,线缆敷设完毕,要进行检查和检测处理。、电气课件中调试对全部高中资料试卷电气设备,在安装过程中以及安装结束后进行高中资料试卷调整试验;通电检查所有设备高中资料试卷相互作用与相互关系,根据生产工艺高中资料试卷要求,对电气设备进行空载与带负荷下高中资料试卷调控试验;对设备进行调整使其在正常工况下与过度工作下都可以正常工作;对于继电保护进行整核对定值,审核与校对图纸,编写复杂设备与装置高中资料试卷调试方案,编写重要设备高中资料试卷试验方案以及系统启动方案;对整套启动过程中高中资料试卷电气设备进行调试工作并且进行过关运行高中资料试卷技术指导。对于调试过程中高中资料试卷技术问题,作为调试人员,需要在事前掌握图纸资料、设备制造厂家出具高中资料试卷试验报告与相关技术资料,并且了解现场设备高中资料试卷布置情况与有关高中资料试卷电气系统接线等情况,然后根据规范与规程规定,制定设备调试高中资料试卷方案。、电气设备调试高中资料试卷技术电力保护装置调试技术,电力保护高中资料试卷配置技术是指机组在进行继电保护高中资料试卷总体配置时,需要在最大限度内来确保机组高中资料试卷安全,并且尽可能地缩小故障高中资料试卷破坏范围,或者对某些异常高中资料试卷工况进行自动处理,尤其要避免错误高中资料试卷保护装置动作,并且拒绝动作,来避免不必要高中资料试卷突然停机。因此,电力高中资料试卷保护装置调试技术,要求电力保护装置做到准确灵活。对于差动保护装置高中资料试卷调试技术是指发电机一变压器组在发生内部故障时,需要进行外部电源高中资料试卷切除从而采用高中资料试卷主要保护装置。
基因工程和细胞工程测试题(附答案,可用于考试)
5 高二生物《基因工程和细胞工程》测试题姓名班级 (时间:90分钟分数:100分) 一.选择题(本大题包括25题,每题2分,共50分。每题只有一个选项符合题意。) 1.以下说法正确的是() A.所有的限制酶只能识别一种特定的核苷酸序列 B.质粒是基因工程中惟一的运载体 C.运载体必须具备的条件之一是:具有多个限制酶切点,以便与外源基因连接D.质粒是广泛存在于细菌细胞中的一种颗粒状细胞器 2.植物体细胞杂交与动物细胞工程中所用技术与原理不.相符的是() A.纤维素酶、果胶酶处理和胰蛋白酶处理——酶的专一性 B.植物组织培养和动物细胞培养——细胞的全能性 C.植物体细胞杂交和动物细胞融合——生物膜的流动性 D.紫草细胞培养和杂交瘤细胞的培养——细胞分裂 3.有关基因工程的叙述正确的是() A.限制性内切酶只在获得目的基因时才用 B.重组质粒的形成在细胞内完成 C.质粒都可作运载体 D.蛋白质的结构可为合成目的基因提供资料 4.能克服远缘杂交障碍培育农作物新品种的技术是() A.基因工程 B.组织培养 C.诱变育种 D.杂交育种 5.下列关于动物细胞培养的叙述,正确的是( ) A.培养人的效应T细胞能产生单克隆抗体 B.培养人的B细胞能够无限地增殖 C.人的成熟红细胞经过培养能形成细胞株 D.用胰蛋白酶处理肝组织可获得单个肝细胞 6.PCR技术扩增DNA,需要的条件是( ) ①目的基因②引物③四种脱氧核苷酸 ④DNA聚合酶等⑤mRNA⑥核糖体 A、①②③④ B、②③④⑤ C、①③④⑤ D、①②③⑥ 7.以下对DNA的描述,错误的是() A.人的正常T淋巴细胞中含有人体全部遗传信息 B.同种生物个体间DNA完全相同 C.DNA的基本功能是遗传信息的复制与表达 D.一个DNA分子可以控制多个性状 8. 蛋白质工程中直接需要进行操作的对象是() A.氨基酸结构 B.蛋白质空间结构 C.肽链结构 D.基因结构 9.细胞工程的发展所依赖的理论基础是() A.DNA双螺旋结构模型的建立 B.遗传密码的确立及其通用性的发现 C.生物体细胞全能性的证明 D.遗传信息传递的“中心法则”的发现 10.下列不是基因工程中的目的基因的检测手段的是:() A.分子杂交技术 B.抗原—抗体杂交 C.抗虫或抗病的接种 D.基因枪法 11.在以下4种细胞工程技术中,培育出的新个体中,体内遗传物质均来自一个亲本的是() A.植物组织培养 B. 单克隆抗体 C. 植物体细胞杂交 D.细胞核移植 12.动物细胞融合与植物细胞融合相比特有的是() A.基本原理相同 B.诱导融合的方法类 C.原生质体融合 D.可用灭活的病毒作诱导剂 13.下列哪一项属于克隆() A.将鸡的某个DNA片段整合到小鼠的DNA分子中 B.将抗药菌的某基因引入草履虫的细胞内 C.将鼠骨髓细胞与经过免疫的脾细胞融合成杂交瘤细胞
诺贝尔生理医学奖青蒿素相关高中生物试题
2015年诺贝尔生理医学奖青蒿素相关高中生物试题 屠呦呦获2015年诺贝尔生理医学奖,这是国人的骄傲,我们第一时间采编了抗疟药青蒿素相关高中生物试题。 1.中国女科学家屠呦呦获2015年诺贝尔生理医学奖,她研制的抗疟药青蒿素挽救了数百万人的生命。在野生植物中提取青蒿素治疗疟疾,这体现了野生生物的( ) A. 直接使用价值 B. 间接使用价值 C. 潜在使用价值 D. A与B的总和 【答案】A 2.中国女科学家屠呦呦获2015年诺贝尔生理医学奖,她研制的抗疟药青蒿素挽救了数百万人的生命。青蒿素是从植物黄花蒿的组织细胞中所提取的一种代谢产物,其作用方式目前尚不明确,推测可能是作用于疟原虫的食物泡膜,从而阻断了营养摄取的最早阶段,使疟原虫较快出现氨基酸饥饿,迅速形成自噬泡,并不断排出虫体外,使疟原虫损失大量胞浆而死亡。从上述的论述中,不能得出的是( ) A.疟原虫对外界食物的获取方式主要是胞吞,体现了细胞膜的流动性特点B.细胞质是细胞代谢的主要场所,如果大量流失,甚至会威胁到细胞生存C.疟原虫寄生在寄主体内,从生态系统的成分上来看,可以视为分解者 D.利用植物组织培养的方式,可以实现青蒿素的大规模生产 【答案】C 3.中国女科学家屠呦呦获2015年诺贝尔生理医学奖,她研制的抗疟药青蒿素挽救了数百万人的生命。但是青蒿中青蒿素的含量很低,且受地域性种植影响较大。研究人员已经弄清了青蒿细胞中青蒿素的合成途径(如图实线框内所示),并且发现酵母细胞也能够产生青蒿素合成的中间产物FPP(如图虚线框内所示)。请回答问题: (1)在FPP合成酶基因表达过程中,完成过程①需要酶催化,完成过程②需要的物质有、、等,结构有。 (2)根据图示代谢过程,科学家在设计培育能生产青蒿素的酵母细胞过程中,需要向酵母细胞中导入、等基因。
基因工程与微生物
基因工程与微生物 基因工程(genetic engineering)又称基因拼接技术和DNA重组技术,是以分子遗传学为理论基础,以分子生物学和微生物学的现代方法为手段,将不同来源的基因按预先设计的蓝图,在体外构建杂种DNA分子,然后导入活细胞,以改变生物原有的遗传特性、获得新品种、生产新产品。基因工程技术为基因的结构和功能的研究提供了有力的手段。 一、基因工程的概况 基因工程是生物工程的一个重要分支,它和细胞工程、酶工程、蛋白质工程和微生物工程共同组成了生物工程。所谓基因工程(genetic engineering)是在分子水平上对基因进行操作的复杂技术。是将外源基因通过体外重组后导入受体细胞内,使这个基因能在受体细胞内复制、转录、翻译表达的操作。它是用人为的方法将所需要的某一供体生物的遗传物质——DNA大分子提取出来,在离体条件下用适当的工具酶进行切割后,把它与作为载体的DNA分子连接起来,然后与载体一起导入某一更易生长、繁殖的受体细胞中,以让外源物质在其中“安家落户”,进行正常的复制和表达,从而获得新物种的一种崭新技术。它克服了远缘杂交的不亲和障碍。 1974年,波兰遗传学家斯吉巴尔斯基(Waclaw Szybalski)称基因重组技术为合成生物学概念,1978年,诺贝尔生医奖颁给发现DNA 限制酶的纳森斯(Daniel Nathans)、亚伯(Werner Arber)与史密斯(Hamilton Smith)时,斯吉巴尔斯基在《基因》期刊中写道:限制酶将带领我们进入合成生物学的新时代。2000年,国际上重新提出合成生物学概念,并定义为基于系统生物学原理的基因工程 二、基因工程的基本步骤 (1)提取目的基因 获取目的基因是实施基因工程的第一步。如植物的抗病(抗病毒抗细菌)基因,种子的贮藏蛋白的基因,以及人的胰岛素基因干扰素基因等,都是目的基因。 要从浩瀚的“基因海洋”中获得特定的目的基因,是十分不易的。科学家们经过不懈地探索,想出了许多办法,其中主要有两条途径:一条是从供体细胞的DNA中直接分离基因;另一条是人工合成基因。 直接分离基因最常用的方法是“鸟枪法”,又叫“散弹射击法”。鸟枪法的具体做法是:用限制酶将供体细胞中的DNA切成许多片段,将这些片段分别载入运载体,然后通过运载体分别转入不同的受体细胞,让供体细胞提供的DNA(即外源DNA)的所有片段分别在各个受体细胞中大量复制(在遗传学中叫做扩增),从中找出含有目的基因的细胞,再用一定的方法把带有目的基因的DNA片段分离出来。如许多抗虫抗病毒的基因都可以用上述方法获得。 用鸟枪法获得目的基因的优点是操作简便,缺点是工作量大,具有一定的盲目性。又由于真核细胞的基因含有不表达的DNA片段,一般使用人工合成的方法。 目前人工合成基因的方法主要有两条。一条途径是以目的基因转录成的信使RNA 为模版,反转录成互补的单链DNA,然后在酶的作用下合成双链DNA,从而获得所需要的基因。另一条途径是根据已知的蛋白质的氨基酸序列,推测出相应的信使RNA序列,然后按照碱基互补配对的原则,推测出它的基因的核苷酸序列,再通过化学方法,
