大豆分离蛋白生产工艺
多级逆流固液提取技术提取大豆分离蛋白

2011年4月 The Chinese Journal of Process Engineering Apr. 2011收稿日期:2010−12−13,修回日期:2011−03−09基金项目:国家水体污染控制与治理科技重大专项基金资助项目(编号2008ZX07207-003-3)作者简介:高建萍(1987−),女,山东省潍坊市人,硕士研究生,主要研究方向为蛋白质分离纯化;通讯联系人,张贵锋,E-mail: gfzhang@,王明林,E-mail: mlwang@.多级逆流固液提取技术提取大豆分离蛋白高建萍1,2, 刘 琳1, 张贵锋2, 王明林1, 黄永东2, 刘永东2, 苏志国2(1. 山东农业大学食品科学与工程学院,山东 泰安 271018;2. 中国科学院过程工程研究所生化工程国家重点实验室,北京 100190)摘 要:采用液相色谱和生物质谱技术对豆粕中不同蛋白质在提取过程中的释放行为进行了研究,并将多级逆流固液提取技术用于大豆分离蛋白提取. 结果表明,豆粕中的2S 组分由于分子量低和高水溶性在提取过程中释放速率较快,提取2次总释放量超过80%, 3次提取7S 和11S 组分总释放量约为69%,提高固相和液相间7S 和11S 的浓度梯度或延长提取时间有助于7S 和11S 组分释放. 采用该提取技术可提高提取液中的总蛋白浓度,在相同蛋白质收率下可节水11%,同时较高的蛋白质浓度可增加酸沉过程中蛋白质收率.关键词:大豆分离蛋白;高效液相色谱−质谱联用技术;蛋白质识别;释放;多级逆流固液提取 中图分类号:X522 文献标识码:A 文章编号:1009−606X(2011)02−0312−061 前 言大豆分离蛋白(Soybean Protein Isolate, SPI)是从脱脂豆粕中提取的一种植物蛋白,总蛋白质含量超过90%,良好的保水性、乳化性、吸油性和凝胶性等使其广泛用作食品添加剂和食品原料[1]. 大豆中的蛋白质根据离心过程中的沉降系数可分为2S, 7S (Conglycinin), 11S (Glycinin)和15S 四种组分,所占比例约为9.4%, 34%, 42%, 4.6%[2,3]. 7S 组分中主要是7S 球蛋白(β-Conglycinin),是由α(70.6 kDa), α′(80.2 kDa), β(48.4 kDa)三种亚基组成的三聚体结构糖蛋白,分子量约为180 kDa ,等电点5.2∼6.2[1,4,5]. 11S 组分中主要是11S 球蛋白,是一种由6个亚基对组成的多聚亚基蛋白,分子量320∼380 kDa ,每个亚基对由1个酸性亚基和1个碱性亚基通过二硫键连接而成,等电点为4.6[6,7]. 7S 和11S 组分的含量是影响SPI 功能特性的关键因素.目前,我国普遍采用的SPI 提取工艺属碱溶酸沉工艺,即豆粕经pH 7.8 (NaOH 调节)的水溶液浸提后离心去除不溶物,提取液经酸沉处理后再进行离心以分离出凝乳,凝乳经水洗、中和后直接进行喷雾干燥,获得SPI 粉[8,9],提取液去除凝乳后获得的乳清水属高浓度有机废水. 豆粕中蛋白质的提取多采用传统的罐式提取,存在用水量大、7S 和11S 组分提取率低等缺陷. 提取1 t SPI 需用豆粕约2.4 t ,用水量超过29 t ,产生24 t 高浓度乳清废水(COD>20%);此外,低提取率导致豆渣中7S 和11S 残留量高,亚基解离导致SPI 性能降低. 因此,研究新型SPI 提取工艺以降低用水量并提高7S 和11S 组分收率具有重要的现实意义. 多级逆流固液提取 (Multi-stage countercurrent solid −liquid extraction)技术是固相物料和溶剂运动方向相反、连续定量加入固相物料和溶剂、导出残留物和提取液的连续分离技术[10,11]. 根据提取设备差异,多级逆流固液提取工艺可分为罐组式、连通器式、螺旋式及离心式等多种形式. 在多级逆流固液提取过程中不同部位的溶剂存在浓度梯度,增加了溶剂和固相物料间的浓度差异,从而加快了目标物释放速率并获得较高的提取液浓度[12]. 多级逆流固液提取技术由于溶剂用量少、提取时间短和生产效率高等优点[13],近年来在食品、中药、天然产物等领域中的应用日益增多.针对SPI 提取过程中存在的用水量大、7S 和11S 提取率低并导致高浓度有机废水产生量大等共性问题,本研究以蛋白质释放行为研究为基础,比较了不同条件下蛋白质的释放速率差异,研究了多级逆流固液提取技术用于提取大豆分离蛋白以降低用水量的可行性.2 材料与方法2.1 材料与试剂脱脂豆粕由大庆日月星公司提供,胰蛋白酶(序列纯)购自美国Promega 公司,三氟乙酸(TFA)和乙腈购自美国Fisher 公司,其他试剂均为市售分析纯. 2.2 仪器高效液相色谱−质谱联用系统(HPLC −MS)由美国Agilent 公司1100液相色谱和美国Thermo Fisher 公司LCQ Deca XP 电喷雾质谱组成,数据采集与处理软件为Xcalibur 1.3,数据分析软件为Biowork 3.1(含Turbosequest), Ultrospec 2000紫外分光光度计(瑞典Pharmacia 公司).2.3 实验方法2.3.1 蛋白质释放过程分析称取100 g 豆粕,加入800 mL pH 7.8的NaOH 溶液,50℃摇床中连续振荡10 min ,快速抽滤,收集滤液;向残余豆粕中加入400 mL pH 7.8的NaOH 溶液,重复上述过程4次. 将收集到的滤液离心(10000 r/min, 5 min),上清液用HPLC 分离,收集分离出的各色谱峰,酶解后进行液质联用分析以进行蛋白质识别;通过HPLC 各色谱峰面积研究不同蛋白质释放过程.将上述实验获得的蛋白质提取液合并,调节pH 值至4.5,冷却至4~6℃,以10000 r/min 离心5 min ,收集上清液,酶解处理后用液质联用技术进行蛋白质种类分析.2.3.2 多级逆流固液提取实验多级逆流固液提取工艺实验装置系统图见图1. 在提取过程中清水从右向左移动,豆粕相对于提取液从左向右移动,整体上豆粕与提取液运动方向相反,其中S 0为新鲜豆粕,S 1, S 2和S 3分别为提取一、二和三次后的豆粕,W 为清水,提取液E 1为豆粕S 2与清水混合后的提取液,提取液E 2为豆粕S 1与E 1混合后的提取液,提取液E 3为新鲜豆粕S 0与E 2混合后的提取液. 多级逆流固液萃取实验启动时3个提取罐装满水溶液,向第1个罐中加入新鲜豆粕,连续搅拌并离心分离,洗涤后的豆粕依次导入第2和第3个提取罐直至稳态操作;在稳态多级逆流固液萃取过程中,清水W 与提取过2次的豆粕S 2均匀混合,通过旋流分离器分离后产生的豆粕残渣S 3不再使用,产生的提取液为一次蛋白提取溶液E 1;该提取液与提取过1次的豆粕S 1混合均匀,连续离心后的豆粕残渣为2次提取的残渣S 2,产生的提取液为二次蛋白提取溶液E 2;该提取液与新鲜的豆粕S 0均匀混合,连续离心后产生豆粕残渣S 1,产生的提取液为3次蛋白提取溶液E 3.图1 多级逆流固液提取实验装置系统图Fig.1 Schematic diagram of experimental apparatus for multi-stage countercurrent solid −liquid extraction2.4 分析方法 2.4.1 蛋白质含量测定蛋白质含量测定采用福林酚法. 2.4.2 凝胶过滤色谱分析大豆蛋白提取溶液用凝胶过滤色谱法(HPSEC)分析,色谱柱为TSK3000SW[300 mm×7.5 mm (I.D.), 10 µm],流动相为0.02 mol/L 磷酸缓冲液(pH 7.0),流速0.4 mL/min ,检测波长280 nm ,进样量10 µL. 2.4.3 HPLC 分析大豆蛋白提取溶液用去离子水稀释后用HPLC 分析,色谱条件:色谱柱Zorbax 300 SB C 18[250 mm×4.6 mm (I.D.), 5 µm],流动相A 为水(含0.1% TFA),流动相B 为乙腈(含0.1% TFA),梯度:0~45 min 5%~60% B ,45~50 min 60%~90% B ,流速0.75 mL/min ,波长280 nm. 2.4.4 酶解方法将上节分离出的色谱峰在100℃下热变性处理10 min ,真空干燥,然后溶于200 µL 0.05 mol/L NH 4HCO 3溶液(pH 8.0)中,加入50 µg 胰蛋白酶[溶于50 µL 0.05mol/L NH 4HCO 3 (pH 8.0)中],混合均匀后于37℃恒温8 h ,酶解产物直接进行HPLC −MS 分析. 蛋白质提取液经酸沉淀处理后的上清液于100℃下热变性处理10 min ,将pH 值调至8.0后加入胰蛋白酶,酶解条件同上. 2.4.5 HPLC −MS 分析色谱柱为Zorbax SB C 18[150 mm×2.1 mm (I.D.), 5 µm];流动相A 为水(含0.1% TFA), B 为乙腈(含0.1% TFA);梯度0~80 min 10%~90% B ,进样量30 µL. 质谱条件:离子源喷雾电压4.5 kV ,毛细管温度300℃,扫描范围m /z 300~2000. 精确质量数扫描和二级质谱扫描(MS/MS)均为数据依赖型扫描,MS/MS 碰撞能量为35%. 质谱数据用Turbosequest 软件进行检索,数据库为从Swiss-Prot 下载的包括大豆中已发现的全部蛋白质的氨基酸序列.3 结果与讨论3.1 豆粕提取液中蛋白质种类识别采用HPLC对豆粕提取液及其后续处理样品进行S 0. Fresh soybean mealS 1, S 2, S 3. Soybean meal after extraction byone, two and three timesW. Fresh waterE 1. Supernatant from the mixture of W with S 2E 2. Supernatant from the mixture of E 1 with S 1E 3. Supernatant from the mixture of E 2 with S 01. Extraction container 2. Pump3. Cyclone separator分析. 图2是豆粕提取液、经酸沉处理乳清废水和沉淀物重新溶解后的HPLC 图谱,可见豆粕提取液中不同种类成分的保留时间分布范围较宽,乳清废水中主要成分集中在23 min 以前,而沉淀物的保留时间主要集中在24 min 以后. 大豆中蛋白质主要是2S, 7S, 11S 和15S 组分,其中2S 中主要是蛋白酶抑制剂类及细胞色素C, 7S 中主要是球蛋白和少量的血球凝集素、脂肪氧化酶及β-淀粉酶,11S 中主要是球蛋白. 大豆中蛋白质分子量范围较宽,许多蛋白质以多聚亚基形式存在. 这些多亚基蛋白在提取过程中可能发生解离或聚集,且不同蛋白质组分及其亚基的等电点、分子量和亲疏水性不同.图2 豆粕提取液、乳清废水和沉淀物的HPLC 分析图谱 Fig.2 HPLC chromatograms of extraction solutions of soybeanmeal, supernatant and precipitation precipitate收集图2中不同保留时间的色谱峰,酶解产物用HPLC −MS 进行分析,质谱数据用Turbosequest 软件进行数据库检索以识别每个色谱峰中的蛋白质种类. 图3(a)是提取的上清液中保留时间为35.4 min 的色谱峰经胰蛋白酶处理后的总离子流图,表明酶解产物存在离子m /z 575.6;精确质量数扫描图谱表明离子m /z 575.6带双电荷[图3(c)],该离子对应的多肽在图3(a)中的保留时间为15.1 min ,数据库检索表明该离子对应的多肽序列为VFDGELQEGR ,存在于11S 球蛋白G1 (A1aBx)亚基序列中,表明图2(a)保留时间为35.4 min 的色谱峰中存在11S 球蛋白. 确定了大豆中主要蛋白质在色谱图中的保留时间,其中2S 组分蛋白质主要分布于20 min 以前的色谱峰;保留时间为23 min 的色谱峰中检测出11S 球蛋白的碱性亚基和2S 中的Kunitz-trypsin Inhibitor (KTI)蛋白;保留时间为24.3 min 的色谱峰中主要是7S 的α亚基和11S 的A5A4B3亚基等;保留时间为24~36 min 的是完整的7S 和11S 球蛋白及发生部分解离的7S 和11S 球蛋白.图3 图2中保留时间为35.4 min 的色谱峰酶解产物的色谱−质谱分析Fig.3 HPLC −MS analysis of the digested chromatographic peakin 35.4 min of retaining time [(a) total ion, (b) peak in 15.1 min of retaining time, (c) zoom scan, m /z 575.3 and (d) MS/MS spectrum, m /z 575.3]反相色谱主要根据样品极性进行分离,但样品分子量超过一定范围时其保留时间随分子量增加而延长. 从整体上分析,大豆内丰度较高的4类蛋白质组分中2S 组分的分子量较小,较易分散于水溶液中,在色谱图中的整体保留时间较短. 7S 和11S 中的球蛋白均属多亚基蛋白质,图2中有些色谱峰中只检测出了7S 和11S 球蛋白的部分亚基,表明在提取过程中存在多亚基球蛋白的亚基解离. 24 min 之后的色谱峰中可检测出7S 和11S 的全部亚基,表明这些色谱峰中主要是完整的7S 和11S 球蛋白. 文献[14]报道15S 组分较难溶于溶液而残留于粕渣中.3.2 大豆中蛋白质的释放行为为比较豆粕中不同组分的释放行为,重点以2S 组分及7S 和11S 球蛋白为指标,考察了不同提取条件下提取液中各组分相对含量的变化. 图4是不同提取次数所得豆粕提取液的HPLC 图谱. 从图可以看出,随提取次数增加,上清液中2S 组分(保留时间为14.98~20 min)含量逐渐降低,保留时间为23 min 的色谱峰中存在11S 球蛋白的碱性亚基和2S 中的KTI ,该色谱峰面积随提取次数增加逐渐降低,HPLC −MS/MS 分析结果表明,提取2次后该色谱峰中主要是11S 球蛋白的碱性亚基,而2S 中的KTI 含量较低,表明2S 组分具有较快的释放速率. 含7S 和11S 球蛋白的各色谱峰(保留时间为24.67, 29.7和36.2 min)面积变化趋势表明,随提取次数逐渐增加,上清液中7S 和11S 球蛋白所占比例逐渐增加. 用HPSEC 对不同提取次数的上清液进行了分析,图5表明,随提取次数增加,提取液中高分子量组分增加,与HPLC −MS 和反相色谱分析结果一致.05010005010001020304005010035.3929.6223.0720.7014.623.90(a) Soybean meal (b) SupernatantR e l a t i v e a b s o r b a n c e 36.1424.3122.9720.0613.7010.535.2635.3929.6424.8020.0713.6110.534.22(c) PrecipitationprecipitateTime (min)01020304050050100150600800100012001400050100572574576578580501002004006008001000050100(a)45.5043.0139.0937.6527.8823.0520.1911.196.01R e l a t i v e a b u n d a n c eTime (min)(b)1149.6955.5697.0667.5575.6(c)578.7576.7575.7575.3573.0571.3(d)904.3903.3788.4602.2525.9489.2361.1246.8m /z图4 提取一次、三次和五次的豆粕提取液HPLC 图谱 图5 提取一次、二次和三次的豆粕提取液HPSEC 图谱Fig.4 HPLC chromatograms of protein solutions extracted Fig.5 HPSEC chromatograms of protein solutions extractedonce, thrice and five times from soybean meal once, twice and thrice from soybean meal以二级质谱中检测出的目标多肽对应的一级质谱峰面积计算不同种类蛋白质在提取过程中的动态变化. 图6是以提取液中KTI 、亚基A5A4B3和α亚基的多肽峰面积代表的2S, 7S 和11S 组分在提取过程中的相对释放量随提取次数的变化. 2S 组分在第1次提取时的相对释放量高达55%左右,提取2次时相对释放量超过80%,分子量较高的7S 和11S 组分的相对释放量较2S 组分低,4次提取总释放量不足90%. 可见,7S 和11S 组分由于释放速率低于2S 组分,其提取过程需更长的时间;此外,在提取过程中增加豆粕与提取液之间7S 和11S 的浓度梯度有利于提高其释放速率,释放出的高分子量组分及时移出有助于增加豆粕与提取液之间的浓度梯度并提高豆粕中7S 和11S 组分的释放量.图6 大豆蛋白质提取过程中2S 组分中KTI, 11S 组分中的A5A4B3亚基和7S 球蛋白中的α亚基释放量动态变化 Fig.6 Relative release rate of KTI of 2S fraction, A5A4B3 subunitof 11S fraction and α subunit of β-conglycinin of 7S fraction in extraction of proteins from soybean meal3.3 多级逆流固液提取利用多级逆流固液提取法提取了大豆分离蛋白,研究了不同固液比下豆粕中蛋白质释放过程、总蛋白释放量、提取液中不同蛋白质相对含量及所制大豆分离蛋白的分子量范围.图7是固液比为1:10 g/mL 和单级停留时间为6 min 条件下不同提取级数蛋白提取液的HPLC 和HPSEC 图谱. 由于2S 等低分子量蛋白经2次提取后释放较完全,豆粕S 2中残留的蛋白质主要是7S 和11S 蛋白,E 1曲线表明保留时间为29 min 的组分所占比例较高,因此提取液E 1中7S 和11S 组分所占比例较高;HPSEC 图谱中保留时间为13.43 min 的色谱峰强度较高也表明提取液E 1中主要是分子量较高的蛋白质[图7(b)],该结果与7S 和11S 组分释放行为研究结果(图4)一致. S 1与E 1充分混合后S 1中的7S 和11S 组分继续释放,提取液E 2中7S 和11S 组分绝对含量增加. 同时,图7中提取液E 2中低分子量的组分含量也有所升高,原因在于第1次提取过程中未完全释放的2S 组分由于溶出速率高于7S 和11S 组分,相对比例逐渐增加. 在多级逆流固液提取过程中,不同提取级数中2S, 11S 和7S 组分的相对释放量的动态变化见图8,与图7结果一致.在多级逆流固液提取过程中,随提取次数增加豆粕中蛋白组分由左向右逐渐被释放,由于大豆蛋白中不同蛋白组分释放行为的差异,7S 和11S 组分从E 3到E 1的相对比例逐渐增加,从E 1到E 3逐级提取后7S 和11S 绝对含量逐渐升高. 实验比较了基于多级逆流法提取和传统提取过程获得的蛋白质溶液中7S 和11S 所占比例,结果表明多级逆流固液提取法获得的蛋白质溶液中7S 和11S 所占比例提高了8%. 可见在多级逆流固液提取过程中豆粕S 0经1次提取后仍有大量未完全释放的7S 和11S 组分,在第2次和第3次提取时释放量较大,从而提高了蛋白提取液中7S 和11S 组分的比例,这对增加SPI 中高分子量组分相对含量并改善SPI 功能特性十分关键.5010005010001020304005010036.0729.5419.9622.9919.365.34(a) OnceR e l a t i v e a b s o r b a n c e35.3429.5723.0220.0214.573.85(b) Thrice 41.0634.2629.5823.0020.0313.694.24(c) Five times Time (min)0501000501000102030405005010035.3124.9113.49(a) OnceR e l a t i v e a b s o r b a n c e 29.9435.3528.7616.6413.45(b) Twice46.4128.7519.1513.40(c) ThriceTime (min)1234530405060708090100R e l a t i v e r e l e a s e r a t e (%)Extraction times图7 多级逆流固液提取过程中不同提取级数豆粕提取液的HPLC 图谱和HPSEC 图谱Fig.7 HPLC and HPSEC chromatograms of protein solutions during multi-stage countercurrent solid −liquid extraction图8 多级逆流固液提取过程中不同提取级数的提取液中2S组分中KTI 和11S 组分中A5A4B3亚基、7S 球蛋白中 的α亚基释放量的动态变化Fig.8 Relative release rate of KTI of 2S fraction, A5A4B3subunit of 11S fraction and α subunit of β-conglycinin of 7S fraction in three extraction stages during multi-stage countercurrent solid −liquid extraction实验采用福林酚法测定了多级逆流固液提取大豆分离蛋白提取液中的蛋白质浓度,进行3次多级逆流平行实验. 豆粕中蛋白质含量为55%,多级逆流固液提取工艺中大豆分离蛋白的提取率为77.6%,而目前工业上每生产1 t 大豆蛋白粉需2.4 t 豆粕,大豆蛋白粉中的蛋白质含量按90%计算,则原料豆粕中蛋白质的收率不足70%. 大豆中2S, 7S, 11S 和15S 四种组分的含量分别为9.4%, 34%, 42%和4.6%,经过提取后15S 中主要蛋白质存在于豆渣中,但仍有少量溶出;2S 组分尽管平均分子量较低且易溶解,但部分蛋白质的等电点接近 4.5,因此,酸沉阶段会有部分2S 组分与7S 和11S 共同沉淀. 蛋白质等电点沉淀过程主要与溶液pH 有关,但蛋白质浓度会影响沉淀过程的收率,本实验中蛋白质收率提高的主要原因是提取液的浓度较高. 多级逆流固液提取技术是一种有效提高大豆分离蛋白提取率的方法.目前工业上使用的大豆分离蛋白提取过程属错流提取工艺,第1次提取时豆粕与水的比例为1:8 g/mL ,离心后向残余豆粕中加入清水,加入量与第1次提取时豆粕用量的比例为4:1 mL/g ,整体上豆粕与水的比例为1:12 g/mL. 由于错流提取工艺用水量较高,提取液中蛋白质浓度与用水量近似呈反比,7S 和11S 组分的浓度降低后导致其在酸沉阶段沉淀不完全,乳清废水中存在一定量的7S 和11S 球蛋白及其亚基,增加了后续水处理过程负荷,同时也降低了大豆分离蛋白的收率. 本研究采用多级逆流固液提取过程中的固液比为1:8 g/mL ,降低了用水量. 结果表明提取液中7S 和11S 组分的总释放率可达75%左右,在酸沉淀阶段7S 和11S 组分的收率提高了3%,降低了乳清废水中7S 和11S 组分的总量,同时降低用水量后乳清废水中2S 组分浓度比错流提取工艺有所增加.比较了固液比分别为1:7, 1:8和1:9 g/mL 条件下多级逆流固液提取工艺中大豆中蛋白质的释放量及7S 和11S 组分的相对含量变化,结果(表1)表明,固液比为1:8和1:9 g/mL 条件下大豆分离蛋白的相对释放量比固液比为1:7 g/mL 条件下分别提高了12.9%和20.7%,其中7S 和11S 组分在提取物中的总含量分别提高了14.6%和20.8%. 在提取过程中固液比越高,多级逆流固液提表1 不同固液比条件下大豆分离蛋白的相对释放量及7S 和11S 组分的相对含量Table 1 Relative release rate of SPI and content of 7Sand 11S fractions in extraction process with different ratios of solid to liquidRatio of solid to liquid(g/mL) Relative release rateof SPI (%) Relative content of 7S and 11S fractions (%)1:7 1:8 1:971.3 84.2 92.069.2 83.8 90.005010005010001020304005010036.1728.9622.9320.055.42E 1(a) HPLCR e l a t i v e a b s o r b a n c e 36.6128.9822.9620.0513.565.44E 236.1428.8322.8719.985.39E 3Time (min)501000501000102030405005010035.3228.7516.6313.43(b) HPSECE 1R e l a t i v e a b s o r b a n c e 35.5428.8021.6516.7313.50E 238.8835.5029.5521.6313.52E 3Time (min)20406080100123R e l a t i v e r e l e a s e r a t e (%)Extraction solution取工艺对离心分离过程要求越高,在工业上会增加动力消耗. 同时,固液比过高将导致7S和11S组分浓度过高,也会影响其释放行为. 与传统的蛋白提取工艺相比,固液比为1:10 g/mL条件下用水量节省了11%,同时由于提取液中较高的7S和11S浓度,在酸沉阶段7S和11S的收率较传统工艺中的酸沉阶段提高了3%.4 结 论(1)以脱脂豆粕为原料,利用碱溶酸沉法提取大豆分离蛋白,利用高效液相色谱−质谱联用系统对大豆分离蛋白提取液中的蛋白质种类进行了分析,识别出提取液中2S, 7S和11S等主要成分,而分子量较大的15S组分则残留于豆粕残渣中.(2)在蛋白质组分识别的基础上,对不同蛋白质组分在提取过程中的释放行为进行了研究. 结果表明,2S组分具有相对较快的释放速率,而7S和11S组分的释放速率相对较低.(3)利用多级逆流固液提取技术提取大豆分离蛋白可有效提高7S和11S组分的相对释放量,且可使大豆分离蛋白的提取率比传统提取方法提高8%.参考文献:[1] Castro R F, Marina M L, Garfa M C. Perfusion Reversed-phaseHigh-performance Liquid Chromatography/Mass Spectrometry Analysis of Intact Soybean Proteins for the Characterization of Soybean Cultivars [J]. J. Chromatogr. A, 2007, 1170: 34−43.[2] Panthee D R, Kwanyuen P, Sams C E, et al. Quantitative Trait Locifor β-Conglycinin (7S) and Glycinin (11S) Fractions of Soybean Storage Protein [J]. J. Am. Oil Chem. Soc., 2004, 81(11): 1005−1012.[3] Renkema J M S, Lakemond C M M, De Jongh H H J, et al. The Effectof pH on Heat Denaturation and Gel Forming Properties of Soy Proteins [J]. J. Biotechnol., 2000, 79(3): 223−230.[4] Delwiche S R, Pordesimo L O, Panthee D R, et al. Assessing Glycinin(11S) and β-Conglycinin (7S) Fractions of Soybean Storage Protein by Near-infrared Spectroscopy [J]. J. Am. Oil Chem. Soc., 2007, 84(12): 1107−1115.[5] Liu C, Wang H L, Gui Z M, et al. Optimization of Extraction andIsolation for 11S and 7S Globulins of Soybean Seed Storage Protein [J]. Food Chem., 2007, 102(4): 1310−1316.[6] Zarkadas C G, Gagnon C, Poysa V, et al. Protein Quality andIdentification of the Storage Protein Subunits of Tofu and Null Soybean Genotypes, Using Amino Acid Analysis, One- and Two-dimensional Gel Electrophoresis and Tandem Mass Spectrometry [J]. Food Res. Int., 2007, 40(1): 111−128.[7] Yuan Y J, Velev O D, Chen K, et al. Effect of pH and Ca2+-inducedAssociations of Soybean Proteins [J]. J. Agric. Food Chem., 2002, 50(17): 4953−4958.[8] Duranti M, Barbiroli A, Scarafoni A, et al. One-step Purification ofKunitz Soybean Trypsin Inhibitor [J]. Protein Express. Purif., 2003, 30(2): 167−170.[9] 赵西周,陈春佳,张效伟,等. 连续性碱溶酸沉生产大豆分离蛋白特点分析 [J]. 中国油脂, 2002, 5(5): 61−63.[10] Wang Q E, Ma S M, Fu B Q, et al. Development of Multi-stageCountercurrent Extraction Technology for the Extraction of Glycyrrhizic Acid (GA) from Licorice (Glycyrrhiza uralensis Fish) [J]. Biochem. Eng. J., 2004, 21(3): 285−292.[11] 胡小中,温光源,李里特. 多级逆流醇浸法制取大豆浓缩蛋白工艺的研究 [J]. 食品工业科技, 2009, 30(3): 272−275.[12] 王英,崔政伟. 连续动态逆流提取的动态和现状 [J]. 包装与食品机械, 2009, 27(1): 49−53.[13] Li W, Zheng C, Wang J S, et al. Microwave Multi-stageCountercurrent Extraction of Dihydromyricetin from Ampelopsis Grossedentata [J]. Food Technol. Biotechnol., 2007, 45(4): 374−380. [14] 周兵,周瑞宝. 大豆球蛋白的性质 [J]. 西部粮油科技, 1998,23(4): 39−43.Extraction of Soybean Protein Isolate UsingMulti-stage Countercurrent Solid−Liquid Extraction MethodGAO Jian-ping1,2, LIU Lin1, ZHANG Gui-feng2, WANG Ming-lin1, HUANG Yong-dong2, LIU Yong-dong2, SU Zhi-guo2(1. College of Food Science and Engineering, Shandong Agricultural University, Taian, Shandong 271018, China;2. State Key Laboratory of Biochemical Engineering, Institute of Process Engineering, CAS, Beijing 100190, China) Abstract: Release behavior of proteins in soybean meal during their extraction process using high performance liquid chromatography−mass spectrometry was investigated. The possibility for extraction of soybean protein isolate using multi-stage countercurrent solid−liquid extraction (MSCSLE) was also studied. The result indicated that 2S protein showed a higher release rate and more than 80% of total 2S proteins were released after extraction in two times. The total release rate of 7S and 11S proteins reached 69% after three times of extraction, indicating that 7S and 11S fractions had a lower release rate during extraction process. Increasing the concentration gradient between the solid and liquid or extending the extraction time enhanced the release of 7S and 11S fractions. The concentration of total proteins obtained using MSCSLE was higher than that obtained by multi-time extraction, resulting in higher 7S and 11S recovery rate. Under the same recovery rate of soybean protein isolate, 11% of water could be saved. During precipitation, 8% of total 7S and 11S protein could be recovered.Key words: soybean protein isolate; high performance liquid chromatography−mass spectrum; protein identification; release; multi-stage countercurrent solid−liquid extraction。
大豆蛋白提取技术研究进展

大豆蛋白提取技术研究进展系别:食品工程系专业:食品科学与工程班级:食科13-2班学号:************姓名:***摘要大豆蛋白产品分为三类,即大豆蛋白粉、大豆浓缩蛋白和大豆分离蛋白。
大豆分离蛋白含有人体所必需的八种氨基酸,不含胆固醇,具有许多优良的食品性能,添加在食品中可以改善食品的品质和性能,提高食品营养价值。
是一种重要的植物蛋白,在食品工业中得到了广泛的应用,是近年来的研究重点。
其中,大豆浓缩蛋白的提取方法有稀酸浸提法、酒精浸提法和湿热浸提法。
大豆分离蛋白有碱溶酸沉法、离子交换法、超滤膜分离法等。
本文以研究方向和工艺改进方面为着力点解释大豆浓缩蛋白和分离蛋白这两种主要的提取方法的发展脉络。
关键词大豆浓缩蛋白;大豆分离蛋白;稀酸浸提法;酒精浸提法;碱溶酸沉法;离子交换法;超过滤法;湿热浸提法大豆分离蛋白(soy protein isolate,SPI )是把脱皮大豆中的除蛋白质以外的可能性物质和纤维素、半纤维素物质都除掉,得到的蛋白质含量不低于90% 的制品,又称等电点蛋白。
与大豆浓缩蛋白相比,生产大豆分离蛋白不仅要从低温脱溶豆粕中除去低分子可溶性糖等成分,而且还要去除不溶性纤维素、半纤维素等成分。
其生产方法主要有碱溶酸沉法、超过滤法和离子交换法。
一、碱溶酸沉法1. 提取原理低温豆粕中的蛋白质大部分能溶于稀碱溶液。
将低温豆粕用稀碱溶液浸提后,用离心分离法除去原料中的不溶性物质,然后用酸把浸出物的PH调至4.5左右,蛋白质由于处于等电点状态而凝聚沉淀,经分离可得到蛋白质沉淀,再经洗涤、中和、干燥得到大豆分离蛋白。
2. 提取工艺豆粕的质量直接影响大豆分离蛋白的功能特性和提取率,只有高质量的豆粕才能获得高质量和高得率的大豆分离。
要求原料无霉变,豆皮含量低,残留溶剂少,蛋白质含量高(45沖上),脂肪含量低,NSI高(不低于80%。
豆粕粉碎后过40-60目筛。
首先利用弱碱溶液浸泡低温豆粕,使可溶性蛋白质、糖类等溶解出来,利用离心机除去溶液中不溶性的纤维素和残渣。
提取大豆分离蛋白的工艺研究_邵佩兰

·油脂工程· 粮油加工与食品机械 MACHIN ERY FO R CEREA LS OI L AN D FOOD PROCESSING提取大豆分离蛋白的工艺研究邵佩兰1 徐 明2(1.宁夏大学农学院 2.宁夏大学生命科学学院) 【摘 要】研究了采用碱法工艺提取大豆分离蛋白的影响因素。
通过试验,确定了提取大豆分离蛋白的最佳工艺条件,即pH值9.0、浸提温度50℃、固液比1∶10的条件下浸提50min,提取率可达79.35%。
【关键词】提取;大豆;分离蛋白中图分类号:TS224 文献标识码:A 文章编号:1009-1807(2005)09-0047-03 大豆蛋白是一种可与动物蛋白相媲美的优质蛋白,大豆中蛋白质含量高达40%,且所含氨基酸组分齐全,被誉为“绿色奶牛”、“植物肉”。
同时还含有丰富的不饱和脂肪酸、钙、磷、铁、膳食纤维、低聚糖等,不含胆固醇,不易引起心脑血管疾病,具有很高的营养价值。
大豆蛋白质是优质的植物蛋白质资源,在人们摄入的蛋白质中,大豆蛋白质占20%以上,但国内豆制品加工业存在的突出问题是大豆蛋白质利用率低,平均利用率仅为60%,这就意味着在加工过程中造成了40%左右的蛋白质损失,从而造成了资源的巨大浪费。
因此,为提高蛋白质的提取率,本文就pH值、固液比、浸提温度、浸提时间等因素对大豆分离蛋白提取的影响进行了研究,以确定其最佳的提取条件,以便进一步开发利用大豆蛋白,促进大豆蛋白资源的综合利用。
1 仪器和材料1.1 试验材料大豆:市售陈年大豆,去皮后置于45℃的烘箱中干燥、粉碎、过80目筛,得大豆粉。
经测定蛋白质含量为34.12%。
试剂:盐酸、氢氧化钠、硫酸、乙醇、过氧化氢、硼酸、硫酸铜、硫酸钾、硒粉、甲基红、溴甲酚绿等(均为分析纯)。
1.2 试验仪器pH-2型酸度计、800型离心机、磁力搅拌可调控制器、鼓风恒温干燥箱、B-N电子分析天平、分光光度计、电热恒温水浴锅、组织捣碎机、凯氏定氮装置、循环水多用真空泵。
大豆分离蛋白的生产工艺

O 引 言
大豆 的蛋 白含 量较 高且营 养丰 富 ,一般 含 蛋 白质量 分数
量 、设 备 运 行 情 况 , 以及 员工 素 质 等 方 面论 述 了 生产 高 品 质 产 品 的 关 键 。介 பைடு நூலகம் 了 大豆 分 离蛋 白的 最 佳 生产 工 艺条 件 和 生 产
过 程 中应 注 意 的 问题 。
关 键 词 :大 豆 分 离 蛋 白 ;生 产 工 艺 ;质 量 控 制
中 图分 类 号 :T 22 1 S 5 . 文 献 标 识 码 :A 文 章 编 号 : 10 2 3 (0 2 0 0 1 0 1— 20 2 0 )5— l0—0 3
Pr c s i g t c o e sn e hno o y a l g nd qua iy c n r lo s l t d s y a r t i lt o t o fio a e o be n p o e n
例 比较合 理 ,只有赖 氨酸相 对较 高 ,而蛋氨酸 和半胱 氨酸含
量 较 低 。 目前 大 豆 蛋 白 已成 为 重 要 的 蛋 白资 源 ,特 别 是 大 豆
1 生 产 工 艺
大 豆 分 离 蛋 白 的 生 产 方 法 ,普 遍 采 用 的 是 “ 提 酸 沉 ” 碱 工 艺 , 即 脱 脂 大 豆 片 经 水 浸 提 , 离 心 分 离 除 去 不 溶 物 ,从 而 获 得 一 个 分 散 有 可 溶 性 蛋 白和 某 些 非 蛋 白质 的 溶 液 ( 液 ) 母 , 母 液 被 酸 沉 ,分 离 出 凝 乳 和 乳 清 ,凝 乳 经 清 洗 尽 量 除 去 非 蛋 白溶 质 ,再 经 喷 雾 干 燥 ,就 可 得 到 大 豆 分 离 蛋 白 粉 。在 进 行 喷 雾 干燥 前 ,可 对 分 离 蛋 白凝 乳 进 行 不 同类 型 的 工 艺 处 理 , 通 过 加 双 氧 水 、老化 、酶 解 、 中 和处 理 ,调 整 N I S 、均 质 、改 性 、 高 温 巴 氏 杀 菌 等 方 法 ,最 后 进 行 喷 雾 干 燥 就 可 得 到 不 同 特 性 的 大 豆 分 离 蛋 白粉 『。先 进 的 生 产 工 艺 是 从 萃 取 到 喷 雾 2
大豆蛋白膜法提取工艺介绍
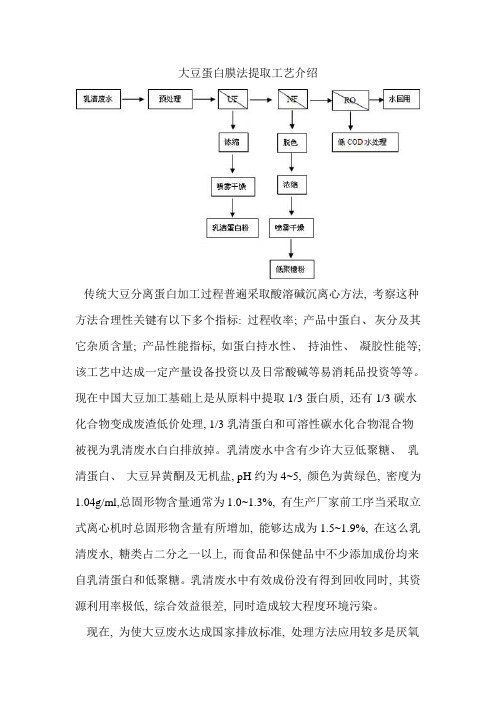
大豆蛋白膜法提取工艺介绍传统大豆分离蛋白加工过程普遍采取酸溶碱沉离心方法, 考察这种方法合理性关键有以下多个指标: 过程收率; 产品中蛋白、灰分及其它杂质含量; 产品性能指标, 如蛋白持水性、持油性、凝胶性能等; 该工艺中达成一定产量设备投资以及日常酸碱等易消耗品投资等等。
现在中国大豆加工基础上是从原料中提取1/3蛋白质, 还有1/3碳水化合物变成废渣低价处理, 1/3乳清蛋白和可溶性碳水化合物混合物被视为乳清废水白白排放掉。
乳清废水中含有少许大豆低聚糖、乳清蛋白、大豆异黄酮及无机盐, pH约为4~5, 颜色为黄绿色, 密度为1.04g/ml,总固形物含量通常为1.0~1.3%, 有生产厂家前工序当采取立式离心机时总固形物含量有所增加, 能够达成为1.5~1.9%, 在这么乳清废水, 糖类占二分之一以上, 而食品和保健品中不少添加成份均来自乳清蛋白和低聚糖。
乳清废水中有效成份没有得到回收同时, 其资源利用率极低, 综合效益很差, 同时造成较大程度环境污染。
现在, 为使大豆废水达成国家排放标准, 处理方法应用较多是厌氧-好氧生物处理法, 蒸发浓缩法等, 对于厌氧-好氧生物处理法其处理效果不稳定, 且易造成污泥膨胀; 而蒸发浓缩法能耗较大、运行费用较高, 难以工业推广。
膜技术作为一个新型分离工艺, 现在已经在多种产品上得到适宜应用, 采取膜分离集成技术, 对大豆蛋白生产过程中乳清废水进行多级分离处理, 提取回收了其中含有较高经济价值生物活性物质——大豆乳清蛋白和大豆低聚糖, 同时膜系统最终出水仍可回用于工艺用水, 基础达成了零排放, 实现了清洁生产工艺。
与传统处理工艺相比, 膜分离技术及成套设备以超滤、纳滤和反渗透进行组合, 含有分离效率高、抗污染性强、系统运行稳定特点。
它不仅降低了废水污染, 同时也是对大豆传统生产加工工艺进行改革, 既提升了产品质量, 又增加了产品品种。
具体介绍1、在采取酸溶碱沉离心法提取大豆蛋白因为有对酸溶液加碱中和沉淀方法, 成品中将带进大量盐份, 同时在生产中需要添加大量水进行洗涤, 工艺线路长。
大豆分离蛋白执行标准

大豆分离蛋白执行标准大豆分离蛋白是一种重要的食品原料,广泛应用于各种食品加工中。
为了确保大豆分离蛋白的质量和安全性,需要制定相应的执行标准。
以下是大豆分离蛋白执行标准的1000字分析:一、定义和分类大豆分离蛋白是一种从大豆中提取出来的蛋白质,具有高营养价值和多种应用。
根据其提取方法和蛋白质含量的不同,大豆分离蛋白可分为多种类型,如大豆浓缩蛋白、大豆蛋白粉等。
每种类型的大豆分离蛋白都有其特定的执行标准。
二、执行标准的主要内容1.原料要求大豆分离蛋白的原料应为优质大豆,品质应符合国家有关标准。
在采购原料时,应进行严格的检验和控制,确保原料无污染、无霉变、无虫蛀等问题。
1.生产工艺要求大豆分离蛋白的生产工艺应采用物理分离方法,如超滤、离子交换等。
生产过程中应严格控制温度、压力、流量等参数,确保产品质量稳定。
同时,应定期对生产设备进行维护和清洗,防止设备故障和交叉污染。
1.产品质量要求大豆分离蛋白的产品质量应符合国家有关标准,如蛋白质含量、水分含量、灰分含量、脂肪含量等指标。
此外,产品还应符合微生物指标、卫生指标等方面的要求。
在产品出厂前,应对产品进行严格的检验和控制,确保产品质量合格。
1.食品安全要求大豆分离蛋白作为食品原料,应符合国家食品安全法的规定。
生产企业应建立完善的质量安全管理体系,包括原料采购、生产过程控制、产品检验等方面。
同时,应定期对食品安全管理体系进行自查和改进,确保产品质量安全。
1.标签标识要求大豆分离蛋白的产品标签应符合国家有关法规和标准的要求。
标签上应注明产品的名称、型号、净重、生产日期、保质期、生产企业名称等信息。
此外,标签上还应注明产品的营养成分表和营养声称等内容,以便消费者了解产品的营养价值。
三、执行标准的制定和实施大豆分离蛋白的执行标准是由国家相关部门制定和发布的。
在制定执行标准时,应综合考虑大豆分离蛋白的原料品质、生产工艺、产品质量、食品安全等方面的要求,以确保产品的质量和安全性能。
大豆分离蛋白生产工艺探讨_肇立春
4 结束语
目前, 大豆分离蛋白已在全世界 50 多个国家被广泛应 用于肉制品、奶制品、烘烤食品、儿童食品、保健食品、 调味食品、冷饮食品、快餐食品、特需食品等。据统计 , 我国大豆分离蛋白的年需要量约 20 000t, 而年产量为 3 000 ~ 4 000t, 市场满足率仅为 15% ~ 20% , 因此 , 必须大力发 展大豆蛋白生产工业。
1 工艺流程
原料 ( 低温脱溶豆粕) 清液 酸沉淀 干燥 成品 先进的工艺即是从碱萃取到喷雾干燥整个过程中对工 艺参数与生产操作过程的科学控制。 | 离心分离 碱萃取 离心分离 萃取液 | 豆渣 水洗 中和 改质
蛋白凝聚物
粮油加工与食品机械 2006 年第 1 期
51
粮油加工与食品机械 MACHINERY FOR CEREALS OIL AND FOOD PROCESSING 液将蛋白质从豆粕中萃取出来的过程。这是整个工艺中的 关键工序, 如果萃取不好 , 造成蛋白质流失, 产率就不会 高。这一工段的关键是萃取温度、碱液 pH 值与水量 3 项工 艺参数的控制。 适宜的温度为 30~ 55 , 适宜的 pH 值为 7 0~ 8 5。若 采用二次萃取, 则一次萃取的 pH 值为 8 0~ 8 5, 二次 pH 值为 7 2~ 7 4。 pH 值如果超过这个范围 , 对蛋白质的风 味、营养价值与功能性质均会产生影响。同时会使蛋白质 中的聚集体发生解聚, 甚至导致肽键的断裂。使蛋白质分 子中分子量大的组分含量减少, 这也是国产大豆分离蛋白 分子量较国外产品低的原因。pH 值最低不可低于 6 8, 否 则得率太低; 温度一般在 30~ 55 , 由于这个温度很适合 某些细菌、微生物的繁殖, 因此应十分注意生产环境的卫 生条件, 并在生产的初期添加一些杀菌、抗菌剂, 这些添 加剂在后续凝乳处理过程中可以被除去, 不会影响产品的 质量; 水量的控制与原料的含水及原料的粒度有关 , 当原 料含水在 10% ~ 12% 时 , 水与料的比例为8 1~ 16 1 之间。 料在润湿前应该进行脱气处理, 以便于原料与水充分混合, 缩短萃取的时间。 3 3 分离 分离是提高产品得率与质量的关键工序, 此工序中设 备的选择是关键。在整个生产工艺中, 涉及分离的工序有 3 个: 豆渣与萃取液的分离, 蛋白凝聚物与清液的分离, 蛋白凝乳与洗液之间的分离。设备的选择应针对分离物质 的特点进行。通常有卧螺式与叠片式两种。卧螺式因能自 动根据物料浓度的不同调节速度, 适用于豆渣与萃取液及 蛋白凝乳与洗液的分离; 叠片式适用于初级凝聚物的分离。 3 4 酸沉淀 酸沉淀是用酸调节萃取液的 pH 值, 使蛋白质凝聚沉 淀的过程。通常可采用盐酸或磷酸来调节 pH 值至蛋白质 的等电点 ( pH= 4 2~ 4 6) , 这时蛋白质方可凝聚。 实际生产中, 当用盐酸调节 pH 值时, 如果控制不好, 超越等电点的 pH 值, 则会导致蛋白质的再溶解 , 从而使 产品得率降低; 此外, 酸沉时常使对酸敏感的蛋白质形成 一种不溶性蛋白质复合物, 降低等电点附近蛋白质的稳定 性; 且由于加酸过程中造成的局部酸浓度过大, 会导致蛋 白质的变性。针对上述问题, 生产中应采用连续酸沉和程 序自动控制 , 效果会好得多。 3 5 水洗 酸沉液经分离机分离后, 凝乳固体物质量份数一般在 12% ~ 13% , 凝乳中残留着大量的氢离子、盐类和部分可 溶性的糖类等非蛋白类物质, 须经水洗除去。水洗采用 48
实验7大豆分离蛋白的制备 (1)
综合实验7大豆分离蛋白的制备1. 实验目的蛋白质是人们日常生活中必需的重要营养物质,通常可以从动物的乳汁或天然植物(如花生、大豆等)中提取。
大豆(黄豆)是目前植物中蛋白质含量最为丰富的一种,蛋白质含量高达40 %以上,大豆蛋白含有人体必需的8种氨基酸,还含有丰富的不饱和脂肪酸、钙、磷、铁、膳食纤维等,不含胆固醇,具有很高的营养价值。
蛋白的提取方法有许多种,例如: 碱提酸沉、酶提酸沉、超声酸沉、酶解提取、膜分离法等。
本实验采用超声波辅助碱提酸沉法提取大豆蛋白,通过粉碎、正己烷低温浸提脱脂、纤维素酶酶解增溶等预处理方法,采用超声波辅助“碱提酸沉法”使蛋白质在等电点状态下析出。
通过本实验,掌握超声波、酶解、离心分离、浸提、等电点析出等蛋白质分离手段,了解植物蛋白制备的常用技术。
2. 材料、仪器与设备2.1实验材料黄豆,1mol/LNaOH、10%HCl、正己烷、纤维素酶2.2实验仪器恒温水浴锅、粉碎机、高速离心机、超声波仪、pH计、烘箱、电子天平、250mL三角瓶、平皿、大烧杯、玻棒、药匙3. 实验内容与步骤3.1实验流程黄豆粉碎→正己烷低温浸提(脱脂)30min→离心分离→收集沉淀→烘干20min→纤维素酶酶解→离心分离→收集沉淀→碱溶(调pH11)→超声波处理20min→离心分离→收集上清→等电点酸沉析出(调pH4.5)→离心分离→收集沉淀→烘干30min称重→计算蛋白质粗提回收率3.2实验步骤(1)黄豆预处理选择果粒饱满,色泽明亮的黄豆为原料,称取黄豆250g用小型粉碎机粉碎,破碎粉末用60目的不锈钢网筛过筛,去除夹杂物,备用。
(2)溶剂低温浸出法制取脱脂豆粕粉取250mL三角瓶,加入粉碎后的豆粉20g,100mL正己烷,瓶口用平皿覆盖,恒温水浴60℃浸提30min使大豆中的油脂溶出,5000rpm离心15min后去上清液,将沉淀收集后放烘箱内50℃,20min烘干,得脱脂豆粕粉样品。
以下周四完成(3)纤维素酶酶解辅助提高大豆蛋白溶出率取10g 烘干的脱脂豆粕粉,按1:15料液比加入150mL 蒸馏水,用10%HCl 溶液调至pH5.0,按0.5%(脱脂豆粉)的酶量加入纤维素酶,在恒温水浴锅里加热至48℃,并恒温酶解90min 。
大豆分离蛋白在肉制品工业中的应用范本
大豆分离蛋白在肉制品工业中的应用范本一、大豆分离蛋白在火腿类、肠类中的应用火腿、肠类生产工艺流程如下:1、大豆分离蛋白直接添加表1 大豆分离蛋白直接添加法大豆分离蛋白添加量添加方法添加后效果2%——6.5%在打料过程中同其他辅料一起添加。
◆添加后可明显改善产品粗糙的口感,使产品口感细腻、切面光亮;◆明显提高嫩度和切片性;◆明显提高保水、保油性;◆明显改善产品结构,增加弹性;◆增加冷藏持水率,延长货架期。
2、做成预制胶之后再添加表2 预制胶胶体添加法预制胶胶体添加量添加方法添加后效果15%——30%,按照火腿类或使用前先将大豆分离蛋白胶体斩拌成◆增加产品出品率,降低成本;◆使火腿口感细腻、表面光亮;肠类的不同要求,添加不同的比例数。
糜状,将糜状物同原料肉一起添加,或滚揉、或斩拌、或搅拌均匀即可。
◆提高嫩度和切片性;◆提高保水、保油性;◆改善产品结构,增加弹性;◆减少冷藏的失水率,延长保质期。
3、直接替代原料肉添加表3 替代原料肉添加法预制胶添加量添加方法添加后效果18%——32%,按照火腿类或肠类产品的不同要求添加不同比例数。
使用之前需将胶块用绞肉机绞成6mm大小的块状,将块状物同原料肉一起添加,或滚揉、或斩拌、或搅拌均匀即可。
◆可替代部分原料肉,降低成本;◆增加产品出品率。
4、注射产品、培根类产品注射用料5、在高温火腿肠中的应用大豆分离蛋白与水形成的胶体随着温度的不断升高,硬度会不断增强。
用在高温杀菌的产品中,可弥补经过高温杀菌后产品结构和口感下降的缺陷。
可直接添加添加量为2—3.8%,因产品及价位不同,使用的量应根据产品的结构和价位相结合进行调整。
二、大豆分离蛋白在肉丸中的应用。
肉丸生产工艺如下:1、直接添加法表1 大豆分离蛋白直接添加法大豆分离蛋白添加量添加方法添加后效果2—10%在斩拌过程中同其他辅料一起添加。
◆添加后可明显改善肉丸粗糙的口感,使肉丸口感细腻、表面光亮;◆显著提高保水、保油性,明显改善产品结构;2、做成蛋白浆添加法表2 预制蛋白浆胶体添加法预制胶胶体添加量添加方法添加后效果25%—56%,根据不同肉丸的产品要求添加不同的比例数。
脱脂豆粕中大豆分离蛋白提取工艺的研究
脱脂豆粕中大豆分离蛋白提取工艺的研究王喜刚;况楠;裴云生;史永革【摘要】The production technology of isolation soyprotein was introduced and the process of extraction was mainly studied. Using defatted soybean meal as the starting material, the pro- tein was first solubilized in water. The solution was separated from the solid residue. Finally, the protein was precicipitated from the solution, separated and dried. The optimum conditions of soybean protein isolate extraction which were evaluated by single factor and orthogonal experi- ments was as follows. 1.0 g/L NaOH,50 ℃and 40 min.%介绍了大豆分离蛋白的生产工艺,以脱脂豆粕为原料,经过碱提、分离残渣、酸沉、分离蛋白、再干燥得到产品。
其中,对从脱脂豆粕中碱提过程进行了重点研究,通过单因素和正交试验,确定了碱提的最佳条件:NaOH溶液质量浓度为1.0g/L,温度为50℃,时间为40min。
【期刊名称】《粮食与食品工业》【年(卷),期】2012(019)006【总页数】4页(P58-61)【关键词】大豆分离蛋白;碱提;脱脂豆粕【作者】王喜刚;况楠;裴云生;史永革【作者单位】九三集团天津大豆科技有限公司,天津300461;九三集团天津大豆科技有限公司,天津300461;九三集团天津大豆科技有限公司,天津300461;九三集团天津大豆科技有限公司,天津300461【正文语种】中文【中图分类】TQ645.99;TQ936.2大豆分离蛋白含有人体所必需的8种氨基酸,且比例比较合理,由于其蛋白质含量在90%以上,使其以成为重要的蛋白资源和优良的食品原料[1]。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
大豆分离蛋白生产工艺
1.清洗:将采购的大豆籽进行清洗和筛选,去除杂质,并将符合质量
要求的大豆籽送入仓库准备下一步的加工。
2.蒸煮:将清洗后的大豆籽进行蒸煮处理。
蒸煮的目的是软化大豆籽,破坏大豆籽内部的脂肪膜结构,使蛋白质更容易与水进行分离。
3.破碎:蒸煮后的大豆籽送入碾磨机进行破碎处理,以打开大豆籽内
部的细胞,使蛋白质与水进行充分接触。
4.分离:将破碎后的大豆浆通过离心机进行分离,分离出固体部分和
液体部分。
固体部分主要是蛋白质,液体部分则主要是淀粉、纤维等。
5.过滤:分离后的大豆浆通过过滤器进行进一步的分离,去除较大的
颗粒和杂质。
过滤的目的是得到更纯净的分离蛋白。
6.浓缩:将过滤后的大豆浆送入浓缩设备进行浓缩处理,去除多余的
水分,提高蛋白质的浓度。
7.离心分离:将浓缩后的大豆浆再次通过离心机进行离心分离,以进
一步提高分离蛋白的纯度。
8.脱色:离心分离后的蛋白溶液中可能还含有一些颜色物质,需要进
行脱色处理。
常见的脱色方法有活性炭吸附和氢氧化钠沉淀。
9.调节pH值:脱色后的蛋白溶液进行pH值的调节,一般需要将pH
值调整为4.5-5.0之间,以利于后续的凝胶和凝集作用。
10.凝胶:将调节后的蛋白溶液进行加热处理,使蛋白质发生凝胶作用。
凝胶温度一般在80-85℃之间。
11.凝集:凝胶后的分离蛋白进行凝集处理,一般采用盐酸、硫酸和
醋酸等酸性物质进行凝集。
12.离心:凝集后的蛋白溶液进行离心处理,分离出固体部分和液体
部分,固体部分就是经过凝结处理的大豆分离蛋白。
13.干燥:将分离后的大豆蛋白固体进行干燥处理,通常有喷雾干燥、真空干燥、凝固干燥等方法可选。
14.粉碎:干燥后的大豆蛋白固体进行粉碎处理,得到所需的粉状产品。
以上就是大豆分离蛋白的生产工艺。
通过上述工艺,可以得到高纯度
的大豆分离蛋白,为食品工业生产提供了重要的原料。
但需要注意的是,
生产中需要确保设备的清洁、操作的卫生和原料的质量,以确保最终产品
的质量和食品安全。
