硝酸根鉴定
地表水硝酸根测试方法

地表水硝酸根测试方法
地表水中硝酸根的测试方法一般有以下几种:
1. 紫外光谱法:硝酸根在紫外光谱中吸收较强的峰位在200-220nm,可以通过紫外光谱仪测定水样中硝酸根的吸光度,进
而计算出硝酸根的浓度。
2. 离子选择电极法:使用硝酸盐选择电极,将其插入水样中,根据电极测量电位变化来判断硝酸根的浓度。
3. pH指示剂法:将pH指示剂加入水样中,当硝酸根浓度较
高时,水样呈现碱性,指示剂颜色发生改变,通过颜色的变化来判断硝酸根的浓度。
4. 高效液相色谱法:通过高效液相色谱仪分离和检测水样中的硝酸根,通过峰面积或峰高来计算硝酸根的浓度。
5. 倍卤法:将水样与含有Cl-、Br-、HNO3溶液混合,硝酸根
通过氯、溴与亚铁离子生成五卤化合物沉淀,通过测定沉淀的重量或测定亚铁离子的浓度来计算硝酸根的浓度。
需要注意的是,不同的测试方法适用于不同范围的硝酸根浓度,选择合适的测试方法确保准确度和可靠性。
同时,测试前应提前校准所用仪器和检测试剂,遵循相应的操作规程。
硝酸根实验报告

一、实验目的1. 掌握硝酸根的鉴定方法;2. 熟悉实验操作技巧;3. 提高化学实验的观察和分析能力。
二、实验原理硝酸根(NO3-)在酸性条件下与Fe2+反应,生成Fe3+,Fe3+与SCN-反应生成红色的Fe(SCN)3,从而鉴定硝酸根。
三、实验仪器与试剂1. 仪器:试管、试管架、滴管、酒精灯、烧杯、玻璃棒等。
2. 试剂:硝酸钾溶液、硫酸铁溶液、硫氰酸钾溶液、稀盐酸、蒸馏水。
四、实验步骤1. 取一支试管,加入2ml硝酸钾溶液。
2. 滴加几滴稀盐酸,观察现象。
3. 滴加几滴硫酸铁溶液,观察现象。
4. 滴加几滴硫氰酸钾溶液,观察现象。
五、实验现象与结果1. 加入稀盐酸后,无明显现象。
2. 滴加硫酸铁溶液后,溶液呈浅黄色。
3. 滴加硫氰酸钾溶液后,溶液变为红色。
六、实验分析与讨论1. 在实验过程中,首先加入稀盐酸是为了排除其他阴离子的干扰,因为硝酸根在酸性条件下与Fe2+反应。
2. 加入硫酸铁溶液后,溶液呈浅黄色,说明Fe2+被氧化成Fe3+。
3. 加入硫氰酸钾溶液后,溶液变为红色,说明Fe3+与SCN-反应生成了红色的Fe(SCN)3,从而鉴定出硝酸根。
七、实验总结1. 本实验成功鉴定了硝酸根,实验过程简单,现象明显。
2. 在实验过程中,应注意控制实验条件,避免其他离子的干扰。
3. 通过本实验,提高了自己的化学实验操作技能和观察分析能力。
八、实验拓展1. 尝试使用其他方法鉴定硝酸根,如沉淀法、氧化还原滴定法等。
2. 研究硝酸根在不同环境下的性质变化,如在不同pH值、不同浓度下的反应情况。
硝酸根测定方法

硝酸根测定方法嘿,朋友们!今天咱来聊聊硝酸根的测定方法,这可真是个有趣又重要的事儿呢!你想想看,硝酸根就像是个调皮的小精灵,在各种物质里藏着,我们得想办法把它给揪出来。
那怎么揪呢?这就得靠一些巧妙的办法啦。
比如说,有一种方法就像是猎人追踪猎物的足迹一样。
我们通过一些化学反应,让硝酸根现形。
就好像猎物总会在地上留下脚印,硝酸根在特定的条件下也会露出马脚。
然后我们根据这些迹象,就能判断出它到底在不在那里。
还有一种方法呢,就像是给硝酸根做个独特的标记。
利用一些特殊的试剂,和硝酸根产生特别的反应,就好像给它贴上了一个只有我们能认得出来的标签。
这样一来,我们就能轻松地找到它啦。
你说这是不是很有意思呀?就好像我们在玩一个找宝藏的游戏,而硝酸根就是我们要找的那个大宝藏!测定硝酸根的过程也像是一场冒险呢。
有时候可能会遇到一些小挫折,就像路上的小石子会绊你一下,但咱可不能怕呀!要鼓起勇气继续往前冲。
想象一下,如果我们没有掌握好这些方法,那岂不是就像在黑暗中摸索,找不到方向呀?那可不行,我们得把这个小调皮给抓住,搞清楚它的情况。
而且呀,这些方法都不是随随便便就能成功的,得细心,得耐心。
就跟做饭一样,火候不到不行,调料放错了也不行。
咱得认真对待,才能得到准确的结果。
在实际操作中,每一步都要小心谨慎,可不能马虎大意哦。
就像走钢丝一样,稍有不慎就可能掉下去。
但只要我们掌握了技巧,保持平衡,就能顺利走到对岸。
总之呢,硝酸根的测定方法可真是一门大学问呀!我们要不断地学习、实践,才能把这个小精灵给牢牢抓住。
朋友们,加油吧,让我们一起在这个奇妙的化学世界里探索,找出那些隐藏的硝酸根!相信自己,我们一定能行!原创不易,请尊重原创,谢谢!。
测定土壤中硝酸根

测定土壤中硝酸根(NO3-)离子浓度的方法基本分析仪器和用品的要求:硝酸根离子选择电极(ELIT 8021 固态晶体膜)参考电极:双液接LiAc(ELIT 003)双极电极插座(ELIT 201)标准溶液:一般为含有1000ppm S-2的Na2NO3溶液,详见系统校正缓冲溶液:2M (NH4)SO4离子分析仪/ 计算机接口(ELIT8902或8901)和台式或笔记本电脑100或者150ml的烧杯,100ml的烧瓶,1,2,5,10,25ml的移液管系统校正:在开始测量之前,电极必须要用一系列已知浓度的标准溶液进行校正,这些溶液是由1000ppm的标准溶液逐级稀释而成的,一个完整的离子选择电极校正过程,需要配备一系列100ml的标准溶液,其硝酸根离子浓度(NO3-)分别为:1000ppm,100ppm,10ppm,1ppm。
如果已知样品的大致浓度范围,以及所采用的离子选择电极所对应的特定线性范围,则只需配置包括该浓度范围的两个溶液:例如,如果样品浓度处于30到130ppm之间,则可以用10ppm和200ppm或者20ppm和150ppm的标准溶液。
注意:在每100ml标准液中加入2ml缓冲液并使之充分混合以补偿样品与标准溶液之间不同的活度系数。
以上的工作准备就绪,就可以依照离子分析仪(计算机接口)的软件操作步骤来测量这些标准溶液并制作校正曲线。
样品的制备:准确秤取50g的经过碾磨干燥处理的土壤样品,加入100ml的去离子水,而每1L的去离子水中应含有1ml的生物抑制剂(将0.1g苯汞基醋酸盐溶于20ml的二氧杂环乙烷中,再加入100ml的水稀释)搅拌溶解最少一小时,经过过滤后,取50ml的滤液再加入1ml的缓冲溶液即可。
样品测量:按照离子分析仪(计算机接口)的软件操作步骤以及电极操作说明来进行的一系列样品测量并记录结果。
要着重注意的是,如果测量是在烧杯中进行,则在每个样品测量之间,应该把电极清洗并用实验拭纸擦干,以防止交叉污染影响测量结果。
硝酸根的测定方法

硝酸根的测定方法嘿,朋友们!今天咱来聊聊硝酸根的测定方法。
这可真是个有意思的事儿呢!你想想看,硝酸根就像个调皮的小精灵,藏在各种物质里,我们得想办法把它给揪出来。
那怎么揪呢?有一种常见的方法是分光光度法。
就好像我们拿着一个特别的“照妖镜”,让硝酸根在特定的光线照射下现形。
通过一系列的操作和试剂的加入,让它乖乖地显色,然后我们就能根据颜色的深浅来判断硝酸根的含量啦。
这是不是很神奇?就像我们能看到肉眼看不到的东西一样。
还有一种离子色谱法,这就像是给硝酸根开辟了一条专属通道,让它顺着这条道儿跑出来,然后我们在终点等着抓住它。
这个方法可厉害了,能把硝酸根分得清清楚楚,一点都不含糊。
再说说还原滴定法吧,这就像是一场和硝酸根的“捉迷藏”游戏。
我们先把它变成别的形态,然后再通过滴定的方式慢慢找到它,就像一点点揭开它的神秘面纱。
哎呀,这硝酸根的测定方法可真是各有各的妙处啊!你说要是没有这些方法,我们怎么能知道那些物质里到底有多少硝酸根呢?那岂不是像在黑暗中摸索一样。
在实际操作中,可得小心谨慎哦!每一步都要像走钢丝一样稳稳当当的,不然一不小心就可能出错啦。
就好比搭积木,一块没放好,可能整个就垮了。
而且,不同的方法适用的情况也不一样哦,就像不同的鞋子适合不同的场合,我们得根据具体情况来选择合适的方法。
总之,硝酸根的测定可不是一件简单的事儿,但也绝对不是什么难到登天的任务。
只要我们认真对待,掌握好方法,就一定能把这个调皮的小精灵给抓住。
大家可别小瞧了这小小的硝酸根测定,它在很多领域都有着重要的作用呢!比如环境监测、化工生产等等。
所以啊,学会它,用处可大着呢!这就是我对硝酸根测定方法的一些分享啦,大家觉得怎么样呢?。
检验硝酸根离子的方法

检验硝酸根离子的方法硝酸根离子是无机化学中的一个重要离子,它的检验方法有很多种。
其中比较常用的方法有沉淀法、还原法、气体检验法等。
接下来我将介绍这些方法的具体步骤和原理。
首先,我们来说说沉淀法。
沉淀法是通过加入适当的沉淀试剂,使硝酸根离子与沉淀试剂生成不溶性沉淀物,从而进行检验的方法。
常用的沉淀试剂有银离子和铁离子。
对于银离子,我们可以用氯化银溶液或溴化银溶液来进行检验。
当硝酸根离子存在时,会生成白色的沉淀。
对于铁离子,我们可以用硫化氢气体或硫化铵溶液来进行检验。
当硝酸根离子存在时,会生成暗棕色的沉淀。
通过观察沉淀的颜色和形态,我们就可以判断硝酸根离子的存在与否。
其次,还原法也是一种常用的检验方法。
还原法是通过将硝酸根离子还原成氨气或氮氧化物,然后进行检验的方法。
常用的还原剂有亚硫酸氢钠、亚硫酸钠等。
当硝酸根离子存在时,会生成特有的气体或气味,从而进行检验。
最后,气体检验法也是一种常用的方法。
气体检验法是通过将硝酸根离子与适当的试剂反应,生成气体,然后进行检验的方法。
常用的试剂有铁粉、铜粉等。
当硝酸根离子存在时,会生成特有的气体,通过观察气体的性质和特点,我们就可以进行检验。
在实际操作中,我们可以根据具体的情况选择合适的检验方法。
在进行检验时,需要注意实验条件的控制,以及对实验结果的准确观察和判断。
通过这些方法,我们可以准确地检验硝酸根离子的存在与否,为化学分析和实验提供重要的依据。
总之,检验硝酸根离子的方法有很多种,每种方法都有其特点和适用范围。
在实际应用中,我们可以根据具体的情况选择合适的方法进行检验。
通过这些方法,我们可以准确地检验硝酸根离子的存在与否,为化学实验和分析提供重要的支持。
硝酸根紫外检测标准

硝酸根紫外检测标准1. 检测方法本标准采用紫外检测法测定硝酸根。
该方法基于硝酸根在紫外光照射下能产生特征光吸收的原理,通过比较样品溶液和标准溶液在相同波长下的光吸收值,计算出样品中硝酸根的浓度。
2. 试剂和材料2.1 试剂:超纯水、硝酸标准溶液(已知浓度)。
2.2 材料:紫外分光光度计、比色皿(适用波长范围190-400nm)、容量瓶(100ml)、移液管(1ml、5ml)。
3. 样品处理3.1 采集样品,用超纯水洗涤样品容器,确保无污染。
3.2 将样品放入离心管中,加入适量超纯水,充分混匀。
3.3 用移液管准确移取5ml样品溶液,放入容量瓶中。
4. 试验条件4.1 紫外分光光度计预热30分钟,确保仪器稳定。
4.2 设置波长为220nm,带宽为10nm,以超纯水为参比,调零。
4.3 将样品溶液加入比色皿中,放入紫外分光光度计,记录吸光度。
4.4 根据标准曲线计算硝酸根浓度。
5. 结果分析5.1 根据吸光度和标准曲线计算硝酸根浓度。
5.2 重复测定3次,取平均值作为最终结果。
6. 精度和误差6.1 精度:本方法精度较高,相对标准偏差小于5%。
6.2 误差来源:误差主要来源于仪器稳定性、操作熟练程度、标准溶液的准确性等方面。
为减少误差,应定期对仪器进行校准,提高操作技能,使用可靠的标样。
7. 适用范围本标准适用于水样中硝酸根的紫外检测。
不适用于具有强烈吸收紫外光、高浓度悬浮物、含有大量有机物和还原性物质的样品。
对于这些特殊样品,需采用其他方法进行测定。
8. 注意事项8.1 试验过程中要避免样品污染,使用一次性手套和移液管等干净器材。
8.2 比色皿使用前应清洗干净,避免影响测试结果。
测试完毕后妥善保管比色皿以备用。
8.3 紫外分光光度计应放置在无尘、无强光干扰的环境中,避免影响测试结果。
水中硝酸根的测定
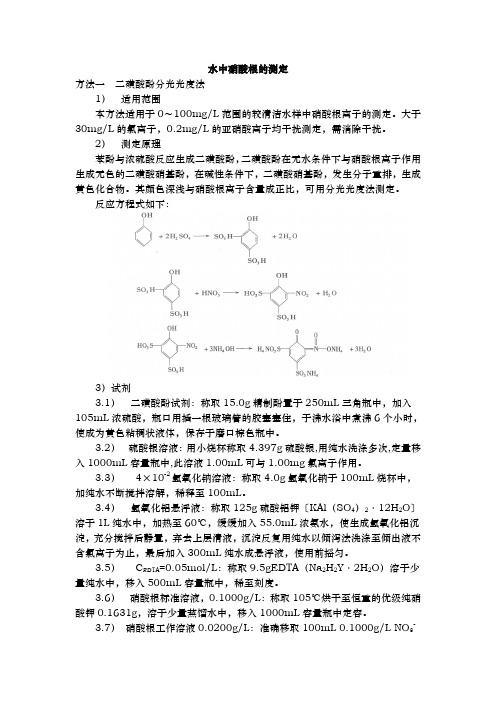
水中硝酸根的测定方法一二磺酸酚分光光度法1)适用范围本方法适用于0~100mg/L范围的较清洁水样中硝酸根离子的测定。
大于30mg/L的氯离子,0.2mg/L的亚硝酸离子均干扰测定,需消除干扰。
2)测定原理苯酚与浓硫酸反应生成二磺酸酚,二磺酸酚在无水条件下与硝酸根离子作用生成无色的二磺酸硝基酚,在碱性条件下,二磺酸硝基酚,发生分子重排,生成黄色化合物。
其颜色深浅与硝酸根离子含量成正比,可用分光光度法测定。
反应方程式如下:3)试剂3.1)二磺酸酚试剂:称取15.0g精制酚置于250mL三角瓶中,加入105mL浓硫酸,瓶口用插一根玻璃管的胶塞塞住,于沸水浴中煮沸6个小时,使成为黄色粘稠状液体,保存于磨口棕色瓶中。
3.2)硫酸银溶液:用小烧杯称取4.397g硫酸银,用纯水洗涤多次,定量移入1000mL容量瓶中,此溶液1.00mL可与1.00mg氯离子作用。
3.3)4×10-2氢氧化钠溶液:称取4.0g氢氧化钠于100mL烧杯中,加纯水不断搅拌溶解,稀释至100mL。
3.4)氢氧化铝悬浮液:称取125g硫酸铝钾〔KAl(SO4)2·12H2O〕溶于1L纯水中,加热至60℃,缓缓加入55.0mL浓氨水,使生成氢氧化铝沉淀,充分搅拌后静置,弃去上层清液,沉淀反复用纯水以倾泻法洗涤至倾出液不含氯离子为止,最后加入300mL纯水成悬浮液,使用前摇匀。
3.5)C EDTA=0.05mol/L:称取9.5gEDTA(Na2H2Y·2H2O)溶于少量纯水中,移入500mL容量瓶中,稀至刻度。
3.6)硝酸根标准溶液,0.1000g/L:称取105℃烘干至恒重的优级纯硝酸钾0.1631g,溶于少量蒸馏水中,移入1000mL容量瓶中定容。
3.7)硝酸根工作溶液0.0200g/L:准确移取100mL 0.1000g/L NO3-标准溶液于500mL容量瓶中,用水稀释至刻度即可。
(20mg/L)3.8)1+1氨水。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
硝酸根离子的鉴定通常涉及化学反应,这些反应可以用来检测溶液中是否存在硝酸根离子。
以下是一些常用的鉴定方法:
1. 硝酸银法(silver nitrate test):
硝酸根离子与银离子反应生成不溶于水和酸的白色沉淀,即银硝化物(AgNO3)。
反应方程式:Ag+ (aq) + NO3 (aq) → AgNO3 (s)
这个方法适用于检测溶液中的硝酸根离子。
如果出现白色沉淀,则表明溶液中含有硝酸根离子。
2. 盐酸酸化的硝酸银法:
在酸性条件下,硝酸根离子与银离子反应生成白色沉淀。
反应方程式:Ag+ (aq) + Cl (aq) → AgCl (s)
这个方法用于检测氯离子,但也可以用来间接检测硝酸根离子,因为如果溶液中有硝酸根离子,它们会与银离子反应生成沉淀,而不会产生氯银沉淀。
3. 硝酸钡法(barium nitrate test):
硝酸根离子与钡离子反应生成不溶于水和酸的白色沉淀,即钡硝化物(Ba(NO3)2)。
反应方程式:Ba2+ (aq) + NO3 (aq) → Ba(NO3)2 (s)
这个方法可以用来检测硝酸根离子,如果出现白色沉淀,则表明溶液中含有硝酸根离子。
4. 滴定法:
可以使用滴定方法,如Volhard滴定或F滴定,使用标准溶液(如硫酸或盐酸)滴定含有硝酸根离子的溶液。
通过滴定过程中消耗的标准溶液的体积,可以计算出硝酸根离子的浓度。
5. 离子色谱法:
离子色谱是一种用于分离和定量离子分析的技术,可以用来测定溶液中的硝酸根离子浓度。
在实验室中,硝酸根离子的鉴定通常需要专业的化学知识和实验技能。
在进行鉴定之前,应确保遵守实验室安全规程,并使用适当的实验室设备。
