乙醇催化脱水制乙烯
化学实验报告制取乙烯(3篇)

第1篇实验名称:制取乙烯实验日期:2023年X月X日实验目的:1. 学习实验室制取乙烯的方法。
2. 掌握乙醇脱水反应的原理和操作步骤。
3. 了解反应条件对产物的影响。
4. 培养实验操作技能和安全意识。
实验原理:乙醇在浓硫酸的催化作用下,加热至170℃左右时,会发生消去反应,生成乙烯和水。
反应方程式如下:\[ C_2H_5OH \xrightarrow{H_2SO_4, 170℃} C_2H_4 + H_2O \]实验仪器与试剂:1. 仪器:酒精灯、试管、试管夹、烧杯、铁架台、导管、集气瓶、橡胶塞、玻璃片、温度计。
2. 试剂:无水乙醇、浓硫酸、碎瓷片。
实验步骤:1. 取一支干燥的试管,加入约5ml无水乙醇。
2. 慢慢加入浓硫酸,边加边振荡,使混合液均匀。
3. 在试管中加入少量碎瓷片,防止暴沸。
4. 用橡胶塞密封试管,插入温度计,温度计的水银球应位于液面以下。
5. 将试管固定在铁架台上,用酒精灯加热,控制温度在170℃左右。
6. 观察反应现象,当观察到有气体产生时,将导管插入集气瓶中,收集乙烯气体。
7. 实验结束后,关闭酒精灯,将试管中的液体倒入烧杯中,用水冲洗试管。
8. 将收集到的乙烯气体用点燃的火柴检验,观察火焰的颜色和声音。
实验现象:1. 加热过程中,试管内出现大量气泡,表明有气体产生。
2. 集气瓶中收集到的气体,用火柴点燃,火焰明亮,伴有“嘭”的一声,表明气体为乙烯。
实验结果:1. 成功制取乙烯气体。
2. 实验过程中,温度控制在170℃左右,反应现象明显。
实验分析:1. 本实验成功制取了乙烯气体,验证了乙醇在浓硫酸催化下加热至170℃左右可以发生消去反应生成乙烯。
2. 实验过程中,温度对反应有重要影响,温度过高或过低都会影响产物的生成。
3. 实验过程中,应注意安全操作,避免发生意外。
实验总结:1. 本实验学习了实验室制取乙烯的方法,掌握了乙醇脱水反应的原理和操作步骤。
2. 通过实验,了解了反应条件对产物的影响,培养了实验操作技能和安全意识。
乙醇在活性氧化铝催化下脱水制乙烯的实验研究

乙醇在活性氧化铝催化下脱水制乙烯的实验研究作者:周仁鸽来源:《化学教学》2009年第02期文章编号:1005-6629(2009)02-0012-03中图分类号:G633.8文献标识码:C普通高中课程标准实验教科书《有机化学基础》(选修)[1]的第69页中曾提到:乙醇可在Al2O3作用下发生脱水反应。
教材虽然没有对其作进一步描述,但由于这一内容在以往的高中化学教材从未提及,因此,教师们对此既迷惑又很感兴趣,苦于各套高中教材均没有给出乙醇在Al2O3作用下发生脱水反应的具体条件与实验的装置,教师们相继尝试了各套教材中实验室制己烯的装置与方法来做上述实验,但均未能成功。
笔者查阅了国内的相关资料,也未发现对该实验的深入研究,由此笔者对其进行了如下的探索。
从反应机理来看,乙醇脱水反应是按照单分子消除(E1)机理进行的[2]:在酸的作用下, 乙醇分子上不容易离去的基团—C—OH转变成易离去的基团—C—O+H2, C—O键断裂脱水形成C+, C+的邻位碳原子上失去一个质子, 一对电子转移过来中和正电荷形成双键。
从反应机理上看, 生成C+的一步是整个反应的速控步骤, 且醇的脱水反应是一个可逆反应。
可以通过控制H+的浓度即用较浓的酸来使反应向右进行, 因此宜采用酸性物质作为催化剂。
那么,Al2O3能否作为乙醇脱水的催化剂呢?大学教材《基础有机化学》[3]第277页提到:在工业上,常用醇于350℃~400℃(另有资料显示为350℃~450℃[4])在氧化铝或硅酸盐表面脱水,此反应不发生重排,如:C2H5OH CH2=CH2+H2O活性氧化铝是工业上乙醇法制乙烯的主要催化剂,其反应温度一般为420℃左右。
从理论分析,氧化铝作为乙醇脱水制乙烯的催化剂是可行的,根据上述反应条件,笔者设计了如下的实验:1 反应装置2 实验过程与现象3 实验分析与结论从上述实验中可知,将乙醇吸附在石棉绒中,有利于乙醇产生稳定的蒸汽,同时也可作为催化剂的载体,而石棉绒本身在这种状况下并没有起到明显的催化效果,因此,此处的石棉绒也可用其他具有一定耐温性与吸附性的材料代替,如:用红砖砸成赤豆大小的颗粒。
实验室制备乙烯方程式

实验室制备乙烯方程式
乙烯是一种重要的有机化合物,广泛应用于化工、医药、塑料等领域。
实验室制备乙烯的方法有很多种,其中最常用的方法是通过脱水剂将乙醇脱水制备乙烯。
乙烯的制备方程式如下:
C2H5OH → C2H4 + H2O
在实验室中,可以使用浓硫酸或浓磷酸作为脱水剂,将乙醇中的水分去除,使其分解为乙烯和水。
这个反应是一个典型的脱水反应,也是一个烷基化反应。
乙烯的制备过程中,需要注意以下几点:
1. 实验室中制备乙烯需要使用专门的设备,如反应釜、冷凝器等。
2. 在制备过程中,需要控制反应温度和反应时间,以保证反应的效率和产物的纯度。
3. 乙烯是一种易燃易爆的气体,需要注意安全操作,避免产生火灾和爆炸等危险。
乙烯的制备方法不仅在实验室中有应用,也在工业生产中得到广泛应用。
随着科技的不断发展,乙烯的制备方法也在不断改进和创新,以满足不同领域的需求。
乙烯的制备方程式是C2H5OH → C2H4 + H2O,通过脱水剂将乙醇脱水制备乙烯。
在实验室中制备乙烯需要注意安全操作和反应条件的控制,以保证反应的效率和产物的纯度。
随着科技的不断发展,乙烯的制备方法也在不断创新和改进,以满足不同领域的需求。
实验室制备乙烯

实验室制备乙烯乙烯是一种重要的有机化合物,也是世界上最重要的工业原料之一。
乙烯的制备技术有很多种,其中最常用的是石油天然气的裂解法和乙醇的脱水法。
然而,在实验室中也可以通过不同的方法制备乙烯。
本文就来介绍一下实验室制备乙烯的方法及其原理。
方法一:酸催化脱水法实验室中制备乙烯最常用的方法之一是酸催化脱水法,这是一种通过酸的作用将乙醇分解成水和乙烯的方法。
该方法适用于小规模实验,操作简单。
所需材料:1. 乙醇(醇类)2. 浓硫酸(酸类)3. 烘干管(玻璃器皿)操作方法:1. 在一个烘干管中加入约2毫升的浓硫酸。
2. 将1毫升的乙醇滴入烘干管中,并充分搅拌。
3. 把烘干管倾斜放在三角巾上或支架上进行加热,加热温度为80-100℃,加热时间为10-15分钟。
4. 加热后,将得到的气体收集在干净的试管中,可以使用气液分离装置将液体和气体分离。
5. 最后将收集到的气体称量,可以测定收率和纯度。
原理:乙醇在浓硫酸催化下失去一个水分子并形成乙烯。
具体反应式如下:CH3CH2OH → CH2CH2 + H2O浓硫酸在此反应中充当了脱水剂的角色,同时起到了催化剂的作用。
方法二:碘代氢酸脱碘反应法碘代氢酸脱碘反应法是另一种实验室制备乙烯的方法。
该方法是通过加热Zn-Cu粉末和碘代氢酸的混合物得到的,其中碘代氢酸起到催化作用。
1. 碘代氢酸2. 锌粉3. 铜粉4. 三角瓶5. 钨丝1. 在一个三角瓶中加入碘代氢酸、锌粉和铜粉,混合均匀。
2. 在三角瓶底部放置一个石棉网,并在网上方放置一个小锅,在锅中加入适量的水。
3. 将三角瓶通过橡皮塞固定在小锅中,并将三角瓶的嘴部通过另一个橡皮塞连接到钨丝上。
4. 打开钨丝的电源,加热三角瓶,控制温度在250-270℃之间。
5. 加热后,将三角瓶中产生的气体通过气液分离器或气体瓶收集。
碘代氢酸脱碘反应是通过碘代氢酸的催化作用将乙烷氧化成乙烯的过程。
具体反应式如下:这种方法有其优点,即制备的乙烯非常纯净,但操作稍有复杂,需要控制温度和气体产生速度。
化学乙烯的制备方法有哪些

化学乙烯的制备方法有哪些
乙烯的制备方法有以下几种:
1. 石油裂解法:通过加热石油馏分,使其裂解产生乙烯和其他烃类化合物。
2. 乙烯水解法:将乙烷与水加热反应,利用催化剂将乙烷转化为乙烯。
3. 乙醇脱水法:将乙醇加热至高温,去除水分,生成乙烯。
4. 乙烯烷酮法:通过乙烯与酸烷醇的酯类反应,在碱性催化剂存在下,生成相应的烷酮,并通过加热酮类产物解离生成乙烯。
5. 乙烯氯化法:将乙烷与氯气在高温条件下反应,生成1,2-二氯乙烷,再通过碱性催化剂的作用分解生成乙烯。
以上是常用的乙烯制备方法,具体使用哪种方法取决于实际生产需求和技术条件。
乙醇脱水制乙烯:碱性氧化物能否作催化剂

谱一 质谱联用 ( G C — MS ) 对实验的检测结果 表明教材 中
关于P , O 是催化 剂的结论带 有片面性。“ 设 计 实验方 案, 比较 P , 0 、 浓硫酸、 A 1 , 0 不同催化剂的催化效果” 这一要求也不够严 谨, 因为不经过实验 只设 计方案, 是 不能 比较催 化剂效 果的 l 。 此外, 在该教材 内容 教学过 程中, 不少 中学教 师和学生认 为乙醇脱 水反应 必须在 如浓硫酸、 五氧化二磷 、 氧化铝等具有酸性 的物质催化
氧化铝的催化效率 , 结果如图 2 至图 5所示 。
选 择中学 阶段有代 表性 的氧化镁 、 氧化钙、 氧化铁 等碱 性金 属氧化物 和 一 A 1 O 作为催 化剂 , 在等温 固 定床加 热反应 条件下完成不 同温度下 ( 3 5 0 — 4 4 0  ̄ C ) 乙
文章 编号 : 1 0 0 5 — 6 6 2 9 ( 2 0 1 3 ) 1 — 0 0 6 0 — 0 3
中图分 类 号 : G 6 3 3 . 8
文 献标 识 码 : B
1 问题的提出
下才能进行, 而碱性物质对此反应 无催化作用。 乙醇 的 脱水 反应 , 究竟碱性 氧化物 能否作为催 化剂 , 效 果如
索了氧化镁 、 氧化钙 、 氧化铁 等常见碱性 氧化物 和氧化铝 为催 化 剂时 的乙醇脱 水 情况 , 通 过气相 色谱 对反应 产物 进行 了定性 、 定 量在线
检测, 并通 过氨气 程序 升温 脱附 考察 了催化 剂 的表 面酸 性 , 结合文 献初 步解 析了碱性 氧化 物不能高 效催化 乙醇脱 水制 乙烯 的机理 。 关键 词 : 乙醇脱 水 ; 乙烯 ; 催 化剂 ; 氧化 物
色谱 分
实验一 乙醇气相脱水制乙烯
密度 1 M2w 0.789 M3w 0.7134 M4w 5.008691 2.510561 6.883202
M1乙烯 M2水 M3乙醇 M4乙醚
乙醇进料量ml/hr 乙醇进料量mol 0.048743 乙醇转化率 5.041179 乙烯收率 2.512983 6.884638
627110.4651 16.33100169 0.846121912 0.002984704
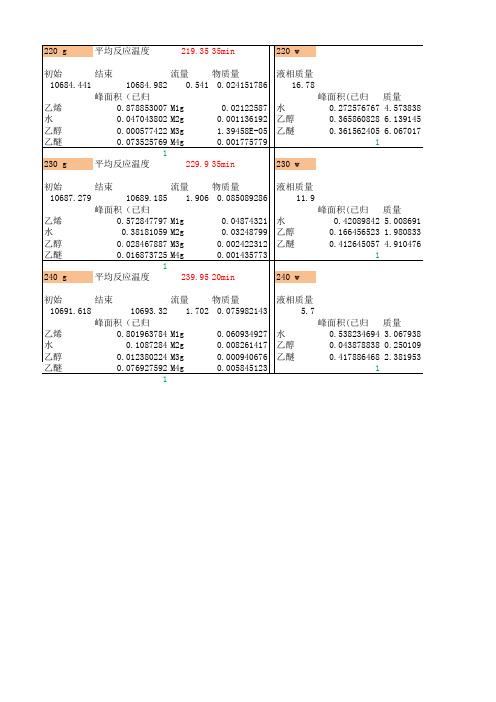
220 g 平均反应温度 219.35 初始 结束 流量 10684.441 10684.982 0.541 峰面积(已归一) 乙烯 0.878853007 M1g 水 0.047043802 M2g 乙醇 0.000577422 M3g 乙醚 0.073525769 M4g 1 230 g 平均反应温度 229.9 初始 结束 流量 10687.279 10689.185 1.906 峰面积(已归一) 乙烯 0.572847797 M1g 水 0.38181059 M2g 乙醇 0.028467887 M3g 乙醚 0.016873725 M4g 1 240 g 平均反应温度 239.95 初始 结束 流量 10691.618 10693.32 1.702 峰面积(已归一) 乙烯 0.801963784 M1g 水 0.1087284 M2g 乙醇 0.012380224 M3g 乙醚 0.076927592 M4g 1
35min 220 w 物质量 液相质量 0.024151786 16.78 0.02122587 水 0.001136192 乙醇 1.39458E-05 乙醚 0.001775779 35min 230 w 物质量 液相质量 0.085089286 11.9 0.04874321 水 0.03248799 乙醇 0.002422312 乙醚 0.001435773 20min 240 w 物质量 液相质量 0.075982143 5.7 0.060934927 水 0.008261417 乙醇 0.000940676 乙醚 0.005845123 峰面积(已归一)质量 0.538234694 3.067938 0.043878838 0.250109 0.417886468 2.381953 1 峰面积(已归一)质量 0.42089842 5.008691 0.166456523 1.980833 0.412645057 4.910476 1 峰面积(已归一)质量 0.272576767 4.573838 0.365860828 6.139145 0.361562405 6.067017 1
实验室制乙烯的方程式

实验室制乙烯的方程式
实验室制乙烯的方程式
乙烯是一种重要的有机化合物,广泛应用于化工、医药、橡胶等领域。
实验室制乙烯的方法有很多种,其中最常用的是通过酸催化剂催化乙
醇脱水反应制得。
实验步骤:
1.将纯乙醇倒入反应瓶中,加入适量的浓硫酸作为催化剂。
2.将反应瓶与冷却器连接,冷却器的另一端连接到水泵,用于抽取反应产生的水蒸气。
3.在反应瓶上方加热器,加热器的另一端连接到冷却水循环器,用于控制反应温度。
4.开启水泵和冷却水循环器,开始加热反应瓶。
5.反应进行时,观察冷却器中的水量,当产生的水蒸气被完全抽出时,停止反应。
6.将反应产物通过冷却器和收集瓶收集。
反应方程式:
C2H5OH → C2H4 + H2O
乙醇经过酸催化剂的作用,发生脱水反应,生成乙烯和水。
实验注意事项:
1.实验过程中应注意安全,避免接触浓硫酸和乙醇等有害物质。
2.反应时应控制反应温度,避免产生过高的温度,导致反应失控。
3.反应产生的水蒸气应及时抽出,以免影响反应的进行。
4.实验结束后,应及时清洗反应瓶和冷却器等设备,避免产生危险。
总结:
实验室制乙烯的方法简单、易操作、成本低廉,适用于小规模制备。
但是,该方法反应产物纯度较低,需要经过后续的分离纯化处理,才能得到高纯度的乙烯。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
▪ 乙烯是合成纤维、合成橡胶、合成塑料(聚乙烯及聚氯乙 烯)、合成乙醇(酒精)的基本化工原料,也用于制造氯 乙烯、苯乙烯、环氧乙烷、醋酸、乙醛、乙醇和炸药等, 尚可用作水果和蔬菜的催熟剂,是一种已证实的植物激素。
在固定床反应器中进行乙醇脱水反应研究,通过改变反应 的进料速度,可以得到不同反应条件下的实验数据,通过 对气体和液体产物的分析,可以得到在一定反应温度条件 下的反应最佳工艺条件和动力学方程。
▪ 该反应为微吸热反应,需在催化剂作用下进行,催化剂为 Al2O3,常压下即可反应,反应温度为330-340℃,反应催
实验原理
▪ 乙醇脱水生成乙烯和乙醚,是一个吸热、分子数 增不变的可逆反应。提高反应温度、降低反应压 力,都能提高反应转化率。乙醇脱水可生成乙烯 和乙醚,但高温有利于乙烯的生成,较低温度时 主要生成乙醚,有人解释这大概是因为反应过程 中生成的碳正离子比较活泼,尤其在高温,它的 存在寿命更短,来不及与乙醇相遇时已经失去质 子变成乙烯。而在较低温度时,碳正离子存在时 间长些,与乙醇分子相遇的机率增多,生成乙醚。 有人认为在生成产物的决定步骤中,生成乙烯要 断裂C-H键,需要的活化能较高,所以要在高温 才有乙烯的生成。
▪ 学习气体在线分析的方法和定性、定量分析,学习如何手动进样分 析液体成分。
▪ ▪ 学习柱塞计量泵的原理和使用方法,学会使用湿式流量计测量流体
流量。
实验仪器和药品
▪ 一、装置 ▪ 乙醇脱水固反应器,气相色谱及计算
机数据采集和处理系统,柱塞计量泵。 ▪ 二、物料 ▪ 乙醇脱水催化剂,分析纯乙醇
(95%),蒸馏水。
▪ 外观与性状:无色气体,略具烃类特有的臭味[1]。少量乙烯具有淡淡的甜味。 ▪ 吸收峰:吸收带在远紫外区
pH:水溶液是中性
▪ 乙烯有4个氢原子的约束,碳原子之间以双键连接。所有6个原子组 成的乙烯是共面。H-C-C角是121.3°;H-C-H角是117.4 °,接近 120 °,为理想sp 2混成轨域。这种分子也比较僵硬:旋转C=C键是 一个高吸热过程,需要打破π键,而保留σ键之间的碳原子。VSEPR 模型为平面矩形 立体结构也是平面矩形。
实验总结
▪ 装填催化剂时,一定要轻轻拍打,使之堆 积密集。
▪ 安装流程是应合理布局,管道连接尽量横 平竖直。
▪ 升温要缓慢进行,实验中注意安全。 ▪ 注意每个细ห้องสมุดไป่ตู้,争取最大化产量。
易挥发。能与水、氯仿、乙醚、甲醇、丙酮和其
他多数有机溶剂混溶,相对密度(d15.56)0.816, 密度是0.789g/cm^3,沸点是78.4℃,熔点是114.3℃,易燃,蒸气能与空气形成爆炸性混合物, 能与水以任意比互溶。
危险特征
▪ 本品易燃,其蒸气与空气可形成爆炸性混合物。遇明火、 高热能引起燃烧爆炸。与氧化剂接触发生化学反应或引起 燃烧。在火场中,受热的容器有爆炸的危险。其蒸气比空 气重,能在较低处扩散到相当远的地方,遇明火会引着回 燃。
实验步骤
1、催化剂的制备与活化 2、安装实验装置
(1)凝液瓶称重 (2)反应管内添催化剂,管外绕电阻丝。 (3)乙烯贮瓶量体积 (4)安装实验装置 (5)试漏 3、脱水反应 其中包含置换、升温、加料等等反 应。
反应特点
▪ 乙醇在催化剂存在下受热发生脱水反应,既可分子内脱水 生成乙烯,也可分子间脱水生成乙醚。本实验采用催化剂,
酸)接触而完成的:
实验室制法
▪ 在实验室中,以乙醇脱水制备乙烯,一般使用 液体型催化脱水剂和一固体接触催化剂二 种. 属于液体型催化脱水剂中,浓硫酸的使 用较为普遍。即是将一份乙醇和三份浓硫 酸混合,于170℃反应来实现的。但是生成 物中乙烯产量较低,并付产相当数量的乙醚 以及二氧化硫。况且,象浓硫酸这样的
▪ 毕业答辩
乙醇催化脱水制乙烯
乙醇催化脱水制乙烯简易法
在实验室中,以乙醇脱水制备乙烯,一般使用液体型 催化脱水剂和固体接触催化剂二种。属于液体型催化脱 水剂中,浓硫酸的使用较为普遍。即是将一份乙醇和三份 浓硫酸混合,于170℃反应来实现的。但是生成物中乙烯 产量较低,并付产相当数量的乙醚以及二氧化硫。况且,象 浓硫酸这样的腐蚀性液体的存在,便给制备、演示等实验 操作带来了若干缺点和不安全性。在固体型接触催化剂 中,常用的有活性氧化铝和吸收(或悬浮)在多孔性固体载 体※1上的磷酸。(其它还有:高岭土、陶土以及石墨等,于 较高温度下,也具有一定的催化脱水效能)二者催化脱水效 能较高。利用它们对乙醇催化脱水生成乙烯的反应,是将 乙醇的蒸气与温度为360℃—380℃的活性氧化铝(或磷
结合生成新的化合物的反应。 ▪ 加聚反应: nCH2═CH2→-(CH2—CH2)- n (制聚乙烯)
▪ 工业制法 ▪ 乙烯制取方程式
▪ 工业上所用的乙烯,主要是从石油炼制工厂和石油化工厂所生产的气 体里分离出来的。[6]
乙醇催化脱水制乙烯方案
一、实验目的 二、实验仪器和药品 三、实验原理 四、实验步骤 五、反应特点
化剂需阶段性活化。
▪
乙醇脱水属于平行反应。既可以进行分子内脱水
生成乙烯,又可以进行分子间脱水生成乙醚。一般而言,
较高的温度有利于生成乙烯,而较低的温度有利于生成乙
醚。因此,对于乙醇脱水这样一个复合反应,随着反应条
件的变化,脱水过程的机理也会有所不同。
成品乙烯
新鲜的乙醇原料经加料漏斗加料管进入管式 反应器,控制反应温度为330-340℃,在催化剂 氧化铝的作用下发生脱水反应生成乙烯。产物经 冷凝器冷凝后进入缓冲罐。顶部气相产物乙烯经 由碱洗瓶收集在乙烯贮槽中,液相产物水和未反 应的原料乙醇由下方采出
▪ 用途 ▪ 溶剂;有机合成;各种化合物的结晶;洗涤剂;萃取剂;
食用酒精可以勾兑白酒;用作粘合剂;硝基喷漆;清漆、 化妆品、油墨、脱漆剂等的溶剂以及农药、医药、橡胶、 塑料、人造纤维、洗涤剂等的制造原料、还可以做防冻剂、 燃料、消毒剂等。 ▪ 75%(体积分数)的乙醇溶液常用于医疗消毒。[2]
成品乙烯性质
▪ 乙烯是世界上产量最大的化学产品之一,乙烯工业是石油 化工产业的核心,乙烯产品占石化产品的70%以上,在国 民经济中占有重要的地位。世界上已将乙烯产量作为衡量 一个国家石油化工发展水平的重要标志之一。
物理性质
▪ 通常情况下,乙烯是一种无色稍有气味的气体,密度为1.25g/L,比空气的密 度略小,难溶于水,易溶于四氯化碳等有机溶剂。
原材料简介
乙醇 ▪ 1
乙醇的结构简式为C2H5OH,俗称酒精,它在常温、常压下是一种
易燃、易挥发的无色透明液体,它的水溶液具有特殊的、令人愉快的香味,
并略带刺激性。乙醇的用途很广,可用乙醇来制造醋酸、饮料、香精、染料、
燃料等。医疗上也常用体积分数为70%——75%的乙醇作消毒剂等。
▪ 无色透明液体(纯酒精),有特殊香味的气味,
▪ 双键是一个电子云密度较高的地区,因而大部分反应发生在这个位置。
化学性质
▪ ①常温下极易被氧化剂氧化。如将乙烯通入酸性KMnO4溶液,溶液的紫色褪 去,乙烯被氧化为二氧化碳,由此可用鉴别乙烯。
▪ ②易燃烧,并放出热量,燃烧时火焰明亮,并产生黑烟。 ▪ CH2═CH2+3O2→2CO2+2H2O ▪ ③烯烃臭氧化: ▪ CH2=CH2+O3,在锌保护下水解→2HCHO ▪ CH2=CH2+(1/2)O2—Ag、加热,酸性水解→CH3—CHO ▪ 加成反应: ▪ CH2═CH2+Br2→CH2Br—CH2Br(常温下使溴水褪色) ▪ 加成反应:有机物分子中双键(或三键)两端的碳原子与其他原子或原子团直接
实验目的
▪ 掌握乙醇脱水实验的反应过程和反应机理、特点,了解针对不同目 的产物的反应条件对正、副反应的影响规律和生成的过程。
▪ 学习气固相管式催化反应器的构造、原理和使用方法,学习反应器 正常操作和安装,掌握催化剂评价的一般方法和获得适宜工艺条件 的研究步骤和方法。
▪ 学习动态控制仪表的使用,如何设定温度和加热电流大小,怎样控 制床层温度分布。
乙醇催化脱水制乙烯历史背景
▪ 工业上乙醇脱水制乙烯已有较悠久的历史。早在 13世纪,人们就知道了乙醇催化脱水可制取乙烯。 1797年,荷兰化学家发现了Al2O3对乙醇脱水有 催化作用, 目前,该催化剂一直还在乙醇脱水工 业装置上使用。国内外对于乙醇脱水制乙烯的工 艺研究主要集中在研制高效催化剂和反应器上。 对于催化剂的研究有两个方向:一是对传统 Al2O3催化剂的改进,主要是添加一些金属元素 来增加活性,延长使用寿命;另一个方向是开发 活性较高的分子筛催化剂。
