重要官能团的典型性质
高中化学常见官能团的性质
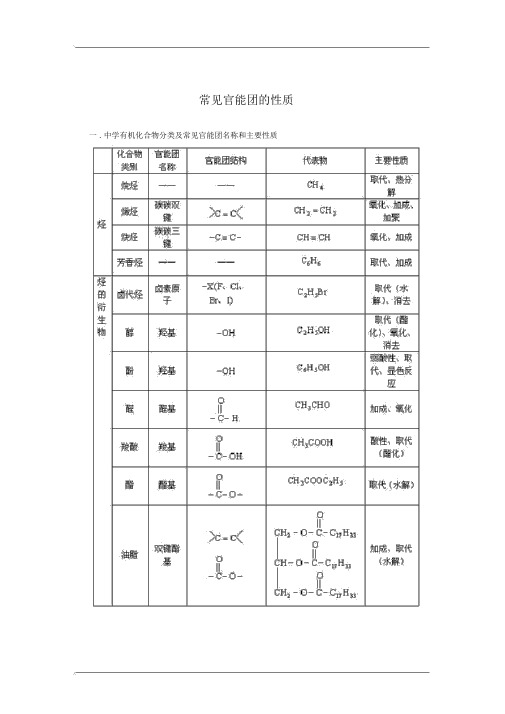
常见官能团的性质一 . 中学有机化合物分类及常见官能团名称和主要性质注:烷烃中的烷基,芳香烃中的苯基都不是官能团。
二 . 有机官能团的化学性质与有机基本反应1.氧化反应(1)燃烧。
凡是含碳氢的有机化合物燃烧都生成二氧化碳和水。
烃的燃烧通式:烃的含氧衍生物的燃烧通式:(2)被酸性高锰酸钾氧化。
能使酸性高锰酸钾褪色的有机物有:①不饱和烃、不饱和烃的衍生物(含碳碳双键、碳碳三键);②苯的同系物(苯基上的烃基易被氧化);③含醛基的有机物:醛、甲酸、甲酸酯、甲酸盐、葡萄糖;④石油产品(裂解气、裂化气)。
(3)羟基的催化氧化。
某些含羟基的有机物在催化剂的作用下,能被氧气氧化成醛或酮。
当与羟基相连的碳原子上有两个氢原子时,羟基能被氧化成醛基。
如:2CH 3CH 2OH O2Cu2CH 3CHO 2H 2O当与羟基相连的碳原子上有一个氢原子时,羟基能被氧化成羰基(碳氧双键)。
如:当与羟基相连的碳原子上没有氢原子时,羟基不能被氧化。
(4)醛基的氧化。
有机物中的醛基,不仅可以被氧气氧化成羧基;而且还能被两种弱氧化剂(银氨离子和铜离子)氧化成羧基。
醛基被氧气氧化。
如:2CH 3CHO O2催化剂2CH 3COOH银镜反应,醛基被Ag NH 3 2氧化。
如:CH 3CHO 2 Ag ( NH 3 ) 22OH △CH 3 COONH 42Ag3NH 3 H 2 O醛基被 Cu(OH ) 2氧化。
如:CH 3CHO 2Cu( OH) 2CH 3COOH Cu 2O2H 2 O2.取代反应。
有机物分子中的某些原子或原子团被其他原子或原子团所代替的反应叫做取代反应。
中学常见的取代反应有:( 1)烷烃与卤素单质在光照下的取代。
如:CH 4 Cl 2光CH 3Cl HCl( 2)苯与苯的同系物与卤素单质、浓硝酸等的取代。
如:( 3)酚与浓溴水的取代。
如:(4)酯化反应。
酸和醇在浓硫酸作用下生成酯和水的反应,基和水的反应。
如:其实质是羧基与羟基生成酯CH 3CH 2 OH CH 3 COOH CH 3COOCH 2 CH 3H 2O(5)水解反应。
高中化学中有机物的各种官能团及其性质一览-精选文档

高中化学中有机物的各种官能团及其性质一览1。
卤化烃:官能团,卤原子在碱的溶液中发生“水解反应”,生成醇在碱的醇溶液中发生“消去反应”,得到不饱和烃2。
醇:官能团,醇羟基能与钠反应,产生氢气能发生消去得到不饱和烃(与羟基相连的碳直接相连的碳原子上如果没有氢原子,不能发生消去)能与羧酸发生酯化反应能被催化氧化成醛(伯醇氧化成醛,仲醇氧化成酮,叔醇不能被催化氧化)3。
醛:官能团,醛基能与银氨溶液发生银镜反应能与新制的氢氧化铜溶液反应生成红色沉淀能被氧化成羧酸能被加氢还原成醇4。
酚,官能团,酚羟基具有酸性能钠反应得到氢气酚羟基使苯环性质更活泼,苯环上易发生取代,酚羟基在苯环上是邻对位定位基能与羧酸发生酯化5。
羧酸,官能团,羧基具有酸性(一般酸性强于碳酸)能与钠反应得到氢气不能被还原成醛(注意是“不能”)能与醇发生酯化反应6。
酯,官能团,酯基能发生水解得到酸和醇醇、酚:羟基(-OH);伯醇羟基可以消去生成碳碳双键,酚羟基可以和NaOH反应生成水,与Na2CO3反应生成NaHCO3,二者都可以和金属钠反应生成氢气醛:醛基(-CHO);可以发生银镜反应,可以和斐林试剂反应氧化成羧基。
与氢气加成生成羟基。
酮:羰基(>C=O);可以与氢气加成生成羟基羧酸:羧基(-COOH);酸性,与NaOH反应生成水,与NaHCO3、Na2CO3反应生成二氧化碳硝基化合物:硝基(-NO2);胺:氨基(-NH2).弱碱性烯烃:双键(>C=C<)加成反应。
炔烃:三键(-C≡C-)加成反应醚:醚键(-O-)可以由醇羟基脱水形成磺酸:磺基(-SO3H)酸性,可由浓硫酸取代生成腈:氰基(-CN)酯:酯(-COO-)水解生成羧基与羟基,醇、酚与羧酸反应生成注:苯环不是官能团,但在芳香烃中,苯基(C6H5-)具有官能团的性质。
苯基是过去的提法,现在都不认为苯基是官能团官能团:是指决定化合物化学特性的原子或原子团.或称功能团。
《有机官能团的性质及结构》 讲义

《有机官能团的性质及结构》讲义一、引言有机化学是研究有机化合物的组成、结构、性质、制备方法与应用的科学。
在有机化合物中,官能团决定了化合物的主要性质。
了解有机官能团的性质和结构对于理解有机化学的基本原理和应用至关重要。
二、常见的有机官能团1、羟基(OH)羟基是醇类化合物的官能团。
醇具有一定的极性,能与水形成氢键,因此醇在水中有一定的溶解性。
从结构上看,羟基中的氧原子与氢原子以共价键相连,氧原子上还有两对孤对电子。
这使得羟基具有一定的反应活性。
醇可以发生氧化反应,例如伯醇可以被氧化为醛,进一步氧化为羧酸;仲醇可以被氧化为酮。
此外,醇还能与酸发生酯化反应,生成酯类化合物。
2、羧基(COOH)羧基是羧酸类化合物的官能团。
羧酸具有酸性,能在水中部分电离出氢离子。
羧基中的羰基和羟基相互影响,使得羧基的化学性质较为活泼。
羧酸可以与醇发生酯化反应,也能与碱发生中和反应。
3、羰基(>C=O)羰基存在于醛、酮等化合物中。
醛基(CHO)具有还原性,能与银氨溶液、新制氢氧化铜等试剂发生反应。
酮基(>CO<)相对醛基较为稳定,但在一定条件下也能发生反应。
4、氨基(NH₂)氨基是胺类化合物的官能团。
胺具有碱性,能与酸反应生成盐。
氨基中的氮原子有一对孤对电子,使其具有一定的亲核性,能参与一些亲核取代反应。
5、卤素原子(X,X 代表氟、氯、溴、碘)卤代烃中的卤素原子使得化合物具有一定的化学活性。
例如,卤代烃可以发生水解反应生成醇,也能在一定条件下发生消去反应生成烯烃。
三、官能团的性质对有机化合物性质的影响1、溶解性官能团的极性和非极性性质会影响有机化合物在不同溶剂中的溶解性。
例如,含有羟基、羧基等极性官能团的化合物通常在极性溶剂(如水)中有较好的溶解性;而含有烷基等非极性官能团的化合物则更易溶于非极性溶剂(如有机溶剂)。
2、化学反应性不同的官能团决定了有机化合物能参与的化学反应类型。
例如,羟基能发生氧化、酯化等反应;羧基能发生酯化、中和等反应;羰基能发生加成反应等。
有机化合物的官能团反应性质的关键

有机化合物的官能团反应性质的关键有机化合物是由碳元素和氢元素以及其他一些元素组成的化合物。
官能团是有机化合物中具有一定特征和功能的原子团或功能团。
不同官能团的反应性质不同,它们在化学反应中扮演着至关重要的角色。
一、羟基官能团——羟基的反应性质羟基(-OH)是一种常见的官能团,它赋予了化合物许多重要的性质和反应。
羟基在酸碱中起着重要的中介作用,在有机合成和生物化学中也扮演着重要的角色。
1. 酸性性质:羟基与强酸反应可以生成酸盐,例如,乙醇和稀硫酸反应生成乙醋酸盐。
酸性性质使羟基可以被还原剂还原。
2. 碱性性质:羟基可以与酸发生酸碱反应,生成相应的盐和水。
例如,乙醇和盐酸反应生成乙酰氯。
3. 脱水反应:两个羟基之间的脱水反应会生成醚。
例如,乙醇和浓硫酸反应生成乙醚。
4. 氧化反应:羟基在氧化剂的作用下可以被氧化成醛或酮。
例如,乙醇在氧气的存在下可以氧化成乙醛或乙酸。
二、羰基官能团——羰基的反应性质羰基(C=O)是有机化合物中另一个非常重要的官能团,具有很高的反应活性。
1. 加成反应:羰基可以与亲电试剂进行加成反应,生成相应的醇。
例如,醛或酮可以与水反应生成相应的醇。
2. 还原性:醛可以被还原剂还原为相应的醇,而酮不易被常见的还原剂还原。
3. 氧化反应:醛可以在氧化剂的作用下氧化为相应的羧酸,而酮在常规条件下不容易被氧化。
4. 缩合反应:二个醛分子或一个醛和一个酮分子之间通过缩合反应可以生成缩酮。
三、胺基官能团——胺基的反应性质胺基(-NH2)是含氮有机化合物中常见的官能团,其反应性质多样。
1. 缩合反应:胺基与羰基化合物之间可以发生缩合反应,生成相应的酰胺。
2. 脱水反应:两个胺基之间的脱水反应可以生成亚胺或二胺。
3. 反应性:胺基可以与酸、酰化试剂等发生酸碱反应或缩合反应。
四、卤素官能团——卤素的反应性质卤素官能团(-X)是一类包含卤素(氟、氯、溴、碘)的化合物。
不同的卤素官能团在化学反应中表现出不同的特性。
高中化学常见官能团

高中化学常见官能团化学是一门研究物质性质和变化的学科,它涵盖了广泛的知识领域,其中官能团是化学中非常重要的概念之一。
在有机化学中,官能团是指由原子团组成的具有一定性质和化学反应的结构单元。
本文将介绍高中化学中常见的官能团及其特点。
一、羟基官能团羟基官能团是指由氧原子和氢原子组成的结构单元,通常表示为-OH。
羟基官能团在有机化合物中非常常见,它们可以参与酸碱反应、酯化反应、醚化反应、酸催化反应等多种反应。
此外,羟基官能团还是多种重要化合物的基础,如醇、酚、糖等。
二、羰基官能团羰基官能团是指由碳原子和氧原子组成的结构单元,通常表示为-C=O。
羰基官能团在有机化合物中也非常常见,它们可以参与酸碱反应、加成反应、还原反应等多种反应。
此外,羰基官能团还是多种重要化合物的基础,如酮、醛、羧酸等。
三、羧基官能团羧基官能团是指由碳原子、氧原子和羟基组成的结构单元,通常表示为-COOH。
羧基官能团是有机化合物中非常重要的官能团之一,它们可以参与酸碱反应、酯化反应、酰化反应等多种反应。
此外,羧基官能团还是多种重要化合物的基础,如酸、酯、氨基酸等。
四、氨基官能团氨基官能团是指由氮原子和氢原子组成的结构单元,通常表示为-NH2。
氨基官能团在有机化合物中也非常常见,它们可以参与酸碱反应、缩合反应、偶联反应等多种反应。
此外,氨基官能团还是多种重要化合物的基础,如胺、氨基酸等。
五、硫醇官能团硫醇官能团是指由硫原子和氢原子组成的结构单元,通常表示为-SH。
硫醇官能团在有机化合物中也非常常见,它们可以参与酸碱反应、烷化反应、酯化反应等多种反应。
此外,硫醇官能团还是多种重要化合物的基础,如半胱氨酸、硫酸酯等。
六、卤素官能团卤素官能团是指由卤素原子组成的结构单元,通常表示为-F、Cl、Br、I等。
卤素官能团在有机化合物中也非常常见,它们可以参与取代反应、消除反应等多种反应。
此外,卤素官能团还可以影响有机化合物的性质和反应活性。
以上是高中化学中常见的官能团及其特点,它们在有机化学中起着非常重要的作用。
有机化合物的官能团与物理性质

有机化合物的官能团与物理性质有机化合物是由碳和氢元素组成的化合物,其中碳元素与其他元素(如氧、氮、硫等)形成化学键,并具有不同的官能团。
官能团是有机化合物中具有化学反应活性的基团,不仅决定了有机化合物的化学性质,还对其物理性质产生重要影响。
本文将探讨一些常见官能团及其与有机化合物物理性质之间的关系。
一、羟基(-OH)官能团羟基是有机化合物中最常见的官能团之一,也是醇、酚类化合物的特征性官能团。
羟基的存在会显著影响化合物的物理性质。
首先,羟基的极性使得醇类化合物具有较高的溶解度,特别是在极性溶剂中。
这是因为羟基可以与水分子形成氢键,提高溶解度。
其次,羟基还能形成分子内氢键,从而提高醇类化合物的沸点。
同时,羟基的存在使得醇类化合物具有较高的表面张力和比热容,因此醇类化合物通常具有较高的沸点和融点。
二、羰基(C=O)官能团羰基是由碳氧双键连接的碳氧化合物,它是醛、酮类化合物的典型官能团。
羰基的存在会对有机化合物的物理性质产生显著影响。
首先,羰基的极性使得醛、酮类化合物具有较高的沸点和溶解度。
这是因为羰基可以与水分子形成氢键,促进溶解。
其次,羰基的共振结构使醛、酮类化合物具有较高的化学反应活性,容易发生亲核加成和氧化反应。
另外,酮类化合物中的羰基可以极大地增加它们的极性,使得它们与极性溶剂的相容性更好。
三、羧基(-COOH)官能团羧基是由羰基和羟基组成的官能团,是酸类化合物的特征性官能团。
羧基的存在对有机化合物的物理性质产生显著影响。
首先,羧基的极性使得酸类化合物具有较高的沸点和溶解度。
羧基中的羧酸氢可以与水分子形成氢键,促进溶解。
其次,羧基的酸性使得酸类化合物在溶液中呈酸性反应,能够与碱发生酸碱中和反应。
此外,羧基通过与金属离子形成络合物,使得酸类化合物在有机合成中具有催化作用。
四、氨基(-NH2)官能团氨基是由氮和氢元素组成的官能团,是胺类化合物的特征性官能团。
氨基的存在对有机化合物的物理性质产生显著影响。
有机物官能团的性质及相关反应
有机物官能团的性质及相关反应下属反应涉及官能团或有机物类型其它注意问题取代反应卤代烃水解(强碱水溶液)、酯水解(强酸或者强碱溶液)、卤代、硝化、磺化、醇成醚、氨基酸成肽、皂化、多糖水解、肽和蛋白质水解等等烷、苯、醇、羧酸、酯和油脂、卤代烃、氨基酸、糖类、蛋白质等等卤代反应中卤素单质的消耗量(1个H消耗1个卤素分子,同时生成一个HX分子。
条件:光照);苯环上H取代定位规则(甲基,羟基等活化苯环邻对位H);酯皂化时消耗NaOH的量(酚跟酸形成的酯水解时要特别注意,水解得到的酚亦能中和NaOH)。
加成反应氢化、油脂硬化C=C、C≡C、C=O、苯环酸和酯中的碳氧双键一般不加成;C=C和C≡C能跟水、卤化氢、氢气、卤素单质等多种试剂反应,但C=O一般只跟氢气、氰化氢等反应。
特征:断一加二,1个C=C 消耗1个X2(或者H2)分子;1个C≡C 消耗2个X2(或者H2)分子;1个C≡C相当于2个C=C;1个苯环在特定条件下加成相当于相当于3个C=C消去反应醇分子内脱水卤代烃脱卤化氢(强碱醇溶液)醇、卤代烃等、等不能发生消去反应。
(与羟基或卤素相连C的邻位C上面无H)氧化反应有机物燃烧、烯和炔催化氧化、醛的银镜反应、醛氧化成酸等绝大多数有机物都可发生氧化反应醇氧化规律(伯醇氧化为醛,仲醇氧化为酮,叔醇不能氧化);醇和烯都能被氧化成醛;银镜反应、新制氢氧化铜反应中消耗试剂的量;(1个醛基均消耗2个银氨溶液或者氢氧化铜)苯的同系物被KMnO4氧化规律(苯环上有烃基均能被氧化)。
还原反应加氢反应、硝基化合物被还原成胺类烯、炔、芳香烃、醛、酮等复杂有机物加氢反应中消耗H2的量。
加聚反应乙烯型加聚、不同单烯烃间共聚烯烃由单体判断加聚反应产物;由加聚反应产物判断单体结构。
缩聚反应酚醛缩合、二元酸跟二元醇的缩聚、氨基酸成肽等酚、醛、多元酸和多元醇、氨基酸等加聚反应跟缩聚反应的比较;化学方程式的书写。
2. 官能团与有机物性质的关系官能团 化学性质-C =C -1.加成反应:(与H 2、X 2、HX 、H 2O 等)CH 2=CH 2 + Br 2 →CH 2Br -CH 2Br (乙烯使溴水褪色) 2.氧化反应:能燃烧、使酸性KMnO 4褪色 3.加聚反应: a b 催化剂 a bn C =C [ C -C ]nc d c d-C ≡C -1.加成反应:(与H 2、X 2、HX 、H 2O 等)如:乙炔使溴水褪色CH ≡CH+Br 2→CHBr=CHBr CHBr=CHBr+Br 2→CHBr 2—CHBr 2 2.氧化反应:能燃烧、使酸性KMnO 4褪色 醇-OH1. 与活泼金属(Al 之前)的反应 如:2R -OH+2Na →2RONa + H 2↑2.取代反应 :(1)与HX ROH +HX△RX +H 2O(2)分子间脱水:2R -OH ROR + H 2O 3.氧化反应:①燃烧:C 2H 5OH+3O 2→2CO 2+3H 2O (淡蓝色火焰) ②催化氧化:2C 2H 5OH+ O 2催化剂 △2CH 3CHO +2H 2O4.消去反应:C 2H 5OH CH 2=CH 2 +H 2O5.酯化反应: C 2H 5OH +CH 3COOH CH 3COOC 2H 5 +H 2O注意:醇氧化规律(1)R -CH 2OH → R -CHO (2)-OH 所连碳上连两个烃基,氧化得酮 (3)-OH 所连碳上连三个烃基,不能被氧化(不完全氧化)但可燃烧。
《有机官能团的性质及结构》 讲义
《有机官能团的性质及结构》讲义一、有机官能团的概念在有机化学中,官能团是决定有机化合物化学性质的原子或原子团。
它们赋予了有机化合物独特的性质和反应活性。
就好像人的五官赋予了每个人不同的特征一样,官能团让有机化合物变得丰富多样。
常见的官能团包括羟基(OH)、羧基(COOH)、醛基(CHO)、酮基(>C=O)、氨基(NH₂)、硝基(NO₂)等等。
二、常见有机官能团的结构1、羟基(OH)羟基由一个氧原子和一个氢原子组成,氧原子与碳原子相连。
在醇类化合物中,如乙醇(CH₃CH₂OH),羟基使得醇具有一定的极性,能够与水形成氢键,从而具有一定的水溶性。
2、羧基(COOH)羧基由一个羰基(>C=O)和一个羟基(OH)组成。
在羧酸类化合物中,如乙酸(CH₃COOH),羧基的存在使得羧酸具有酸性,能够在水溶液中电离出氢离子。
3、醛基(CHO)醛基由一个羰基(>C=O)和一个氢原子组成。
在醛类化合物中,如甲醛(HCHO)、乙醛(CH₃CHO),醛基具有还原性,能够与许多试剂发生氧化反应。
4、酮基(>C=O)酮基由一个羰基(>C=O)连接两个烃基组成。
在酮类化合物中,如丙酮(CH₃COCH₃),酮基的化学性质相对醛基较为稳定,但在一定条件下也能发生反应。
5、氨基(NH₂)氨基由一个氮原子和两个氢原子组成。
在胺类化合物中,如甲胺(CH₃NH₂),氨基使得胺具有碱性,能够与酸发生中和反应。
6、硝基(NO₂)硝基由一个氮原子和两个氧原子组成。
在硝基化合物中,如硝基苯(C₆H₅NO₂),硝基的引入会使苯环的化学性质发生改变,使其变得更加活泼。
三、有机官能团的性质1、物理性质(1)溶解性含有羟基、羧基等官能团的有机化合物通常能够与水形成氢键,因而具有一定的水溶性。
而含有长链烃基、苯环等官能团的有机化合物通常难溶于水,易溶于有机溶剂。
(2)沸点和熔点官能团的极性和分子间作用力会影响有机化合物的沸点和熔点。
例如,含有羟基、羧基等极性官能团的有机化合物,分子间作用力较强,沸点和熔点相对较高。
高中化学常见官能团的性质.总结
常见官能团的性质二.有机官能团的化学性质与有机基本反应1. 氧化反应(1)燃烧。
凡是含碳氢的有机化合物燃烧都生成二氧化碳和水。
烃的燃烧通式:C K H7+^+^02=X CO34-|H20烃的含氧衍生物的燃烧通式:C x H y03+ 0+ 七一丿6 = 8 + J H a0(2)被酸性高锰酸钾氧化。
能使酸性高锰酸钾褪色的有机物有:①不饱和烃、不饱和烃的衍生物(含碳碳双键、碳碳三键);②苯的同系物(苯基上的烃基易被氧化);③含醛基的有机物:醛、甲酸、甲酸酯、甲酸盐、葡萄糖;④石油产品(裂解气、裂化气)。
(3)羟基的催化氧化。
某些含羟基的有机物在催化剂的作用下,能被氧气氧化成醛或酮。
当与羟基相连的碳原子上有两个氢原子时,羟基能被氧化成醛基。
如:Cu2CH3CH2OH O22CH3CHO 2H2O当与羟基相连的碳原子上有一个氢原子时,羟基能被氧化成羰基(碳氧双键)。
如:CH30I Cu II2CH3-CH-OH+ 02— 2CH3- C-CH3 +2H a0当与羟基相连的碳原子上没有氢原子时,羟基不能被氧化。
(4)醛基的氧化。
有机物中的醛基,不仅可以被氧气氧化成羧基;而且还能被两种弱氧 化剂(银氨离子和铜离子)氧化成羧基。
醛基被氧气氧化。
如:2CH 3CHO O 2 催化剂》2CH 3COOHA银镜反应,醛基被JAg (NH 3 2 ]氧化。
如:CH 3CHO +2 Ag (NH 3)2 ]+ + 2OH-—CH 3COO-+ NH 4 + + 2Ag J +3NH 3 + H 2O醛基被C U (OH )2氧化。
如:CH 3CHO 2C U (OH )2」CH 3COOH C U 2O JS :;2H 2O2. 取代反应。
有机物分子中的某些原子或原子团被其他原子或原子团所代替的反应叫做取代反应。
中 学常见的取代反应有:(1) 烷烃与卤素单质在光照下的取代。
如:CH 4 Cl 2 — 光—CH 3CI HCl(2) 苯与苯的同系物与卤素单质、浓硝酸等的取代。
有机化学的官能团性质反应类型
高中化学所有有机化学的官能团性质,反应类型,引入官能团,反应条件一、卤基(卤原子):水解也称取代(氢氧化钠溶液),消去(氢氧化钠醇溶液)酚羟基:显色(Fecl3)羧基:和醇发生酯化(浓硫酸加热)还原(+H2)中和醇羟基:酯化,取代,消去CC双键和叁建:加成,聚合反应(加聚)羰基:银镜酯基:水解(生成醇和羧酸)苯基:加成,取代,磺化,硝化都能发生氧化反应(+O2点燃)同时带羟基和羧基的化合物还能发生缩聚取代反应:有机物分子里的某些原子或原子团被其他原子或原子团所代替的反应。
加成反应:有机物分子里不饱和的碳原子跟其他原子或原子团直接结合的反应。
聚合反应:一种单体通过不饱和键相互加成而形成高分子化合物的反应。
加聚反应:一种或多种单体通过不饱和键相互加成而形成高分子化合物的反应。
消去反应:从一个分子脱去一个小分子(如水.卤化氢),因而生成不饱和化合物的反应。
氧化反应:有机物得氧或去氢的反应。
还原反应:有机物加氢或去氧的反应。
酯化反应:醇和酸起作用生成酯和水的反应。
水解反应:化合物和水反应生成两种或多种物质的反应(有卤代烃、酯、糖等)1.氧化反应:有机物得氧或去氢的反应。
甲烷燃烧CH4+2O2→CO2+2H2O(条件为点燃)甲烷隔绝空气高温分解甲烷分解很复杂,以下是最终分解。
CH4→C+2H2(条件为高温高压,催化剂)乙烯燃烧 CH2=CH2+3O2→2CO2+2H2O(条件为点燃)乙炔燃烧C2H2+3O2→2CO2+H2O (条件为点燃)苯燃烧 2C6H6+15O2→12CO2+6H2O (条件为点燃)乙醇完全燃烧的方程式C2H5OH+3O2→2CO2+3H2O (条件为点燃)乙醇的催化氧化的方程式2CH3CH2OH+O2→2CH3CHO+2H2O(条件为催化剂)(这是总方程式)2. 取代反应:有机物分子里的某些原子或原子团被其他原子或原子团所代替的反应。
甲烷和氯气发生取代反应CH4+Cl2→CH3Cl+HCl CH3Cl+Cl2→CH2Cl2+HClCH2Cl2+Cl2→CHCl3+HCl CHCl3+Cl2→CCl4+HCl (条件都为光照。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
重要官能团的典型性质
碳碳双键氧化 加成(H2、X2 、HX 、H2O)、加聚、氧化
碳碳三键 加成(H2、X2 、HX )、氧化
卤素原子(-X) 水解、消去
醇羟基(-OH) Na、催化氧化、消去、酯化
酚羟基(-OH) 酸性、取代(苯环)、显色 加成
醛基(-CHO) 加成、氧化[催化氧化、银镜反应、新制Cu(OH) 2]
羧基(-COOH) 酸性、酯化
酯基(-COO-) 水解
官能团的变化
操作 方 法 示 例
引入羟基
①卤代烃水解法
②醛还原法
③酯水解法
④烯烃水化法
⑤酚钠酸化法
消去羟基
①脱水法
②氧化法
③酯化法
官能团的变化
操作 方 法 示 例
引入卤原子
①烷烃取代
䦋㌌㏒㧀좈琰茞㵂Ü
②烯烃(炔烃)加成
䦋㌌㏒㧀좈琰茞㵂Ü
③苯环取代
䦋㌌㏒㧀좈琰茞㵂Ü
消去卤原子
①卤代烃水解
䦋㌌㏒㧀좈琰茞㵂Ü
②卤代烃消去
䦋㌌㏒㧀좈琰茞㵂Ü
引入双键 ①醇、卤代烃的消去
䦋㌌㏒㧀좈琰茞㵂Ü
②炔烃加成
䦋㌌㏒㧀좈琰茞㵂Ü
③醇催化氧化
䦋㌌㏒㧀좈琰茞㵂Ü
成环 酯化法
䦋㌌㏒㧀좈琰茞㵂Ü
各类有机物的衍变关系
重要的有机化学反应
(1)取代反应(烷烃光卤代、苯的卤代及硝化、卤代烃水解、醇酯化、羧酸酯化、酯水解)
(2)加成反应(不饱和烃、醛)
(3)消去反应(卤代烃、醇)
(4)聚合反应(重点是加聚反应)
(5)连续氧化(醇醛酸)
从反应过程中化学键的变化判断反应类型,总结高中有机化学中的常见试剂与反应类
型的对应关系。
有机化学反应中的重要试剂
酯类
RCOOR`
卤代烃 R—X 醇类 R—OH 醛类
R—CHO
羧酸
R—COOH
卤代 消去 取代 水解 氧化 加氢 酯化
水解
氧化
烃
R—H
CH3CH3 CH2=CH2 CH=CH CH2=CHCl CH3CH2OH CH2Br CH2Br CH2OH CH2OH CHO CHO COOH COOH [ CH2—CH ]n Cl CH3CHO CH3COOH CH3COOC2H5 CH3CH2Br
O=C
O=C CH2 CH2
O
O
NaOH
CH2CH
BrH
NaOH/醇
△
NaOH/H2O
OH
CH3COOCH2CH
3
CHCHOHOHCO
O
CH2CH2Br
练习:
有机化学反应中的重要试剂
H+(稀H2SO4) ONa银镜反应的产物CH3COONH4 酯碱性水解反应的产物CH3COONa 酯酸性水解 糖水解 浓H2SO4
醇消去
醇脱水成醚
酯化反应(催化剂是H+)
苯硝化
酸化
酸化
酸化
有机化学反应中的重要试剂
H2/Ni
烯烃
炔烃
醛
Br
2
水
褪色
烯烃、炔烃 酚 醛 加成
取代(浓溴水)
氧化还原
CHCHCH
3
OH
OH
有机化学反应中的重要试剂
新制Cu(OH)2悬浊液
葡萄糖、麦芽糖
醛类
乙醇
加热
红色沉淀
乙酸
沉淀消失,成蓝色透明溶液
突破口三:物质的转化关系
重要的转化关系
(1)重要的中心物质: 烯烃
(2)一个重要转化关系
:
(3)重要的中心反应:
酯的生成和水解及肽键的生成和水解
(4)高分子化合物的形成:
加聚反应,缩聚反应(羟基酸的酯化,氨基酸脱水)
(5)有机物成环反应:
a.二元醇与二元羧酸的酯化,
b.羟基酸的分子内或分子间酯化,
c.氨基酸脱水,
