下期无机化应化专业A卷
年无机及分析化学期末考试A卷及答案

一、判断题。
(每题1分,共10分)(√)1.电负性综合地表征了原子得失电子的能力。
(×)2.酸碱指示剂在酸性溶液中呈酸色,在碱性溶液中呈碱色。
(√)3.速率常数大小总是与系统中所有物质的浓度无关。
(×)4.当可逆反应达到平衡时,反应即停止,且反应物和生成物的浓度相等。
(√)5.强碱滴定强酸的滴定突跃范围决定于溶液的浓度。
(×)6.色散作用只存在于非极性分子之间。
(√)7.非极性分子中有极性键。
(√)8.某一元酸越强,则其共轭碱越弱。
(×)9.液体的蒸气压与温度无关。
(√)10.偏差的大小可表示分析结果的精密度。
二、选择题。
(每题2分,共20分)1.下列数据中有效数字为3位的是:( C )A .0.030%B .pH =2.03 C.0.0234 D.8.9×10-42.根据有效数字运算规则,算式01120.010.3514.21031.0⨯⨯计算结果正确的是:(B)A .2×103 B.2.1×103 C.2.05×103 D.2.054×1033.理想气体是指:( A )A .气体分子本身体积和相互之间的作用力均可忽略B .气体分子本身体积不可忽略,相互之间的作用力可以忽略C .气体分子本身体积可忽略,相互之间存在着作用力D .气体分子本身体积和相互之间的作用力均不可以忽略4.增大压强,能使化学平衡向正反应方向移动的反应是:(D )A .N2O 4(g)2NO 2(g) B .Fe 3O 4(s) + 4CO(g) 3Fe(s) + 4CO 2(g) C .CaCO3(s) CaO(s) + CO 2(g) D .2NO(g) + O 2(g) 2NO 2 (g) 5.下列可逆反应2HI(g) H2(g) + I 2 (g) -Q 在密闭容器中进行,当达到平衡时,欲使混合气体的颜色加深,应采取的措施是:(D )A .减少容器体积B .降低温度C .加入催化剂D .充入HI 气体6. [Co(SCN)4]2-离子中钴的价态和配位数分别是………………( B )(A) -2,4 (B) +2,4 (C) +3,2 (D) +2,127.下列各组元素中,有一组元素原子的第一电离能分别为1086 kJ/mol、1402kJ/mol和1314 kJ/mol,该组元素为:(A)A.C N O B.F Ne Na C.Be B C D.S Cl Ar 8.比较O,S,As三种元素的电负性和原子半径大小的顺序,正确的是:(A)A.电负性O>S>As 原子半径O<S<AsB.电负性O<S<As原子半径O<S<AsC.电负性O<S<As 原子半径O>S>AsD.电负性O>S>As原子半径O>S>As9.电子构型相同的阳离子,其极化力最强的是:(C )A.高电荷和半径大的离子B.低电荷和半径大的离子C.高电荷和半径小的离子D.低电荷和半径小的离子10.共价键最可能存在于:(B)A.金属原子之间B.非金属原子之间C.金属原子和非金属原子之间D.电负性相差很大的元素的原子之间三、填空题。
无机化学试卷AB答案

无机化学试卷A一、单项选择题,(共24分,每题一分)1.下列物质中可以认为具有最大摩尔熵的是A.Li(g)B.Li(s)C.LiCl·H 2O(s)D.LiCO 3(s)2.下列说法正确的是( )A.放热反应均为自发反应B.∆S m 为正的反应均为自发反应 C.∆∆r S m 为正、∆r H m 为负的反应均为自发反应 D.∆r S m 为负、∆r H m 为正的反应均为自发反应3. 一个气相反应mA (g) + nB (g)qC (g) ,达到平衡时,下列说法正确的是( )A. 0=∆θmr G B. J =1 C. θK J = D. 反应物分压和等于产物分压和 4. 向平衡体系 2SO 2 (g) + O 2 (g)2SO 3 (g) 中加入惰性气体,若体系体积保持不变,则平衡() A.不移动 B. 向右移动 C. 向左移动 D.无法判断5.下列各组量子数(n,l,m ),不合理的是( )A.(3,2,0)B.(3,3,2)C.(3,1,0)D.(3,1,-1)6.下列离子的原子序数分别是25、26、27、28,其电子构型可以用[Ar]3d 6表示的是( )A.Mn 2+B.Fe 2+C.Co 3+D.Ni 2+7.下列元素原子半径排列顺序正确的是( )A.Mg>B>Si>ArB.Ar>Mg>Si>BC.Si>Mg>B>ArD.B>Mg>Ar>Si8.下列物质熔化时需要克服离子键的是( )A. H 2OB. SiO 2C. MgCl 2D.Na9.下列分子中极性最小的是( )A .H 2OB .NH 3C .H 2SD .CO 210.卤化银的溶解度依Cl—Br—I 的次序减小,能解释这种现象的理论是( )A .杂化理论B .分子间力C .共价键D .离子极化11. 0.1 mol·L –1的一元弱碱(8100.1-⨯=θbK )溶液与等体积水混合后,溶液的pH 值为( )A.8.7B.8.85C.9.0D.10.512.下列溶液中,其pH 值最小的是( )A. 0.010mol·L –1NaOHB. 0.010mol·L –1H 2SO 4C. 0.010mol·L –1HClD. 0.010mol·L –1H 2C 2O 413. 某一弱酸强碱盐MA (5100.1)(-⨯=HA K a θ),则MA 的水解常数θh K 为( )A. 1.0×10-9B. 1.0×10-2C. 1.0×10-19D. 1.0×10-514.在饱和H 2S 水溶液中,c (S 2–)近似为( )mol·L –1A. θ1a KB. θ2a KC. θ1a K ×θ2a KD. 0.115.Ag 2CrO 4的12100.9-⨯=θsp K ,则其饱和溶液中Ag +离子浓度为( )mol·L –1A. 1.3×10-4B. 2.1×10-4C. 2.6×10-4D. 4.2×10-416.在Mg(OH)2(11108.1-⨯=θsp K )饱和溶液中加入MgCl 2,使Mg 2+浓度为0.010mol·L –1,则该溶液的pH 值为( )A. 5.26B. 8.75C. 9.63D. 4.3717. 溴的元素电势图,-V 07.12V 45.0-V 54.0-3Br Br BrO BrO −−→←−−→←−−→←+++,则可求得)(--θBr /BrO E 为( )A. 1.52VB. 0.62VC.0.76VD. 0.35V18.向原电池 (-)Zn∣Zn 2+(1mol·L -1)‖Cu 2+(1mol·L -1)∣Cu(+)的正极中通入HS 气体,则电池的电动势将( )A. 增大B. 减小C. 不变D. 无法判断19.已知)(++24θ/E Sn Sn =+0.14V ,)(++23θF /F E e e =+0.77V ,则不能共存于同一溶液中的离子( )A. Sn 4+,Fe 2+B. Sn 4+,Sn 2+C. Fe 3+,Fe 2+D. Fe 3+,Sn 2+20.根据碱性溶液中溴的元素电势图,能自发歧化的物质是( )-V 07.12V 45.0-V 54.0-3Br Br BrO BrO −−→←−−→←−−→←+++A. BrO 3-B. BrO -C. Br 2D. Br -21. 在热碱溶液中,Cl 2的歧化产物是( )A. Cl -和ClO -B. Cl -和ClO 2-C. Cl -和ClO 3-D. Cl -和ClO 4-22.在Al 2(SO 4)3溶液中加入Na 2CO 3,其主要产物是( )。
无机分析化学试卷A卷2017-2018下

2017——2018 下期无机分析化学试卷(A卷)班级:姓名:________ 学号:____ 得分:______一、填空题(25分,每空1分)1、以滴定试液达,再根据所用体积和浓度计算被测组分含量的化学分析法,称为滴定分析法。
2、用重铬酸钾法测定亚铁盐中的铁(用容量瓶配置样品溶液,以二苯胺磺酸钠为指示剂),如果滴定管未洗净,滴定时管内壁挂有液滴,将导致测定结果偏_________,如果不加H3PO4, 将导致测定结果偏___________.测定操作中需用操作液润洗的仪器有_________ ________.3、按有效数字规则记录测量结果,得到如下数据,请分别写出所用仪器和规格:称取 5.0g试样用的是________________;称取 5.0000g试样用的是___________________;量取5.0ml溶液用的是___________________,量取5.00ml 溶液用的是______________________。
4、配位滴定法是以为基础的滴定分析法。
本法中应用最广泛的配位剂是以为代表的氨羧配位剂。
5、高锰酸钾法是利用作标准溶液直接滴定一些还原性物质的方法,反应只能在性溶液中进行。
6、根据滴定终点所选用指示剂的不同,银量法分为莫尔法、、。
7、试样的称取方法有固定质量称量法、、。
8、常用的氧化还原滴定法,根据所用滴定剂不同主要有:、、等。
9、Na2S2O3标准溶液用法制备,用基准试剂进行标定,以为指示剂进行滴定。
二、选择题(30分,每题3分)1、高锰酸钾法一般在性介质中进行。
(A)酸性(B)碱性(C)中性(D)不限制酸碱2、需用间接法制备标准溶液的是()A. ZnOB. Na2S2O3C. K2Cr2O7D. Na2CO33、用KMnO4法测定H2O2水时,一般用来控制溶液的酸度。
(A)HCl (B)H2SO4(C)HNO3(D)HF4、下列溶液中适于装在棕色酸式滴定管中的有()A、H2SO4B、NaOHC、KMnO4D、K2Cr2O75、沉淀滴定的银量法中,莫尔法使用的滴定终点指示剂是()A、224K Cr O溶液B、24K CrO溶液C、FeCl3溶液D、4NH SCN溶液6、莫尔法测定天然水中的Cl-,酸度控制为()A、酸性B、碱性C、中性至弱碱性范围D、强碱性7、莫尔法可以测定下列那种试样中Cl-的含量?()A、NaClB、2BaCl C、2CaCl D、3FeCl8、使用移液管吸取溶液时,应将其下口插入液面以下()A、0.5—1cmB、5—6cmC、1—2cmD、10cm以上9、高锰酸钾法测定H2O2水的滴定反应开始时,滴定速度应。
无机化学试卷(A卷
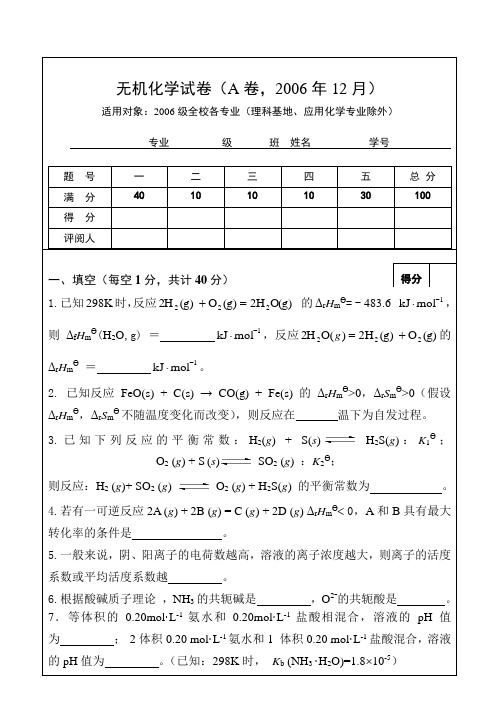
无机化学试卷(A卷,2006年12月) 适用对象:2006级全校各专业(理科基地、应用化学专业除外) 专业 级 班 姓名 学号 题 号 一 二 三 四 五 总 分 满 分 40 10 10 10 30 100
得 分 评阅人
一、填空(每空1分,共计40分) 1.已知298K时,反应O(g)H2(g)O (g)2H222 的ΔrHmӨ= - 483.6 1molkJ,
则ΔfHmӨ(H2O,g) = 1molkJ,反应(g)O (g)H2)(O2H222g的ΔrHm
Ө
= 1molkJ。
2. 已知反应 FeO(s) + C(s) → CO(g) + Fe(s) 的ΔrHmӨ>0,ΔrSmӨ>0(假设ΔrHmӨ,ΔrSm
Ө
不随温度变化而改变),则反应在 温下为自发过程。
3.已知下列反应的平衡常数:H2(g) + S(s) H2S(g):K1Ө; O2 (g) + S (s) SO2 (g) :K2Ө; 则反应:H2 (g)+ SO2 (g) O2 (g) + H2S(g) 的平衡常数为 。 4.若有一可逆反应2A (g) + 2B (g) = C (g) + 2D (g) ΔrHmӨ 0,A和B具有最大转化率的条件是 。 5.一般来说,阴、阳离子的电荷数越高,溶液的离子浓度越大,则离子的活度系数或平均活度系数越 。 6.根据酸碱质子理论 ,NH3的共轭碱是 ,O2-的共轭酸是 。 7.等体积的0.20mol·L-1氨水和0.20mol·L-1盐酸相混合,溶液的pH值为 ; 2体积0.20 mol·L-1氨水和1 体积0.20 mol·L-1盐酸混合,溶液的pH值为 。(已知:298K时, Kb (NH3 ·H2O)=1.810-5)
得分 8.已知298K时:H2CO3的Ka1=4.30 10-7,Ka2=5.61 10-11,则0.10 mol·L-1 NaHCO3溶液的pH约为 。 9.298K时Mg(OH)2的KSP = 1.210-11,则Mg(OH)2在水中的溶解度 为 mol·L-1。向Mg(OH)2的饱和溶液中加入MgCl2,使Mg2+浓度为0.01 mol·L-1,则Mg(OH)2的溶解度为 mol·L-1。 10.在配制SnCl2 溶液时,既要加入盐酸,又要加入Sn片,前者是为了 ,后者是为了 。 11.在298K时,将锌电极(φӨ= -0.763V)与标准甘汞电极(φӨ=0.2678V)组成原电池,该原电池的电池反应为 ;在标准态时电池符号为 ;电池反应的平衡常数K Ө为 __ 。 12.已知:φӨ (Sn4+/Sn2+) = 0.15V,φӨ (Fe3+ /Fe2+ ) = 0.77V,则在两电对中,最强的还原剂是 。
2022年无机及分析化学期末考试试题及答案A卷

一、单项选择题(每题2分,共40分。
请将答案填入下表中,未填入表中则不计分):(A) H+(B) H2O (C) H3O+(D) O2-2. 同温同浓度的下列水溶液中, 使溶液沸点升高最多的溶质是(A) CuSO4(B) K2SO4(C) Al2(SO4)3(D) KAl(SO4)23. 有一原电池:Pt│Fe3+(1 mol·dm-3),Fe2+(1 mol·dm-3)‖Ce4+(1 mol·dm-3),Ce3+(1 mol·dm-3)│Pt 则该电池的电池反应是(A) Ce3+ + Fe3+ = Ce4+ + Fe2+(B) Ce4+ + Fe2+ = Ce3+ + Fe3+(C) Ce3+ + Fe2+ = Ce4+ + Fe (D) Ce4+ + Fe3+ = Ce3+ + Fe2+4. 某铁矿试样含铁约50%左右,现以0.01667mol/L K2Cr2O7溶液滴定,欲使滴定时,标准溶液消耗的体积在20 mL至30 mL,应称取试样的质量范围是[A r(Fe)=55.847](A) 0.22至0.34 g (B) 0.037至0.055 g(C) 0.074至0.11 g (D) 0.66至0.99 g5. 以下产生误差的四种表述中,属于随机误差的是(1)指示剂变色点与化学计量点不一致(2)滴定管读数最后一位估计不准(3)称量过程中天平零点稍有变动(4)天平的砝码未经校准(A)1, 2 (B) 3, 4 (C) 2, 3 (D) 1, 46. 下列表述中,最能说明系统误差小的是(A) 高精密度(B) 与已知的质量分数的试样多次分析结果的平均值一致(C) 标准差大(D) 仔细校正所用砝码和容量仪器等7. 以下物质必须采用间接法配制标准溶液的是(A) K2Cr2O7(B) Na2S2O3(C) Zn (D) H2C2O4·2H2O8. 下列溶液中不能组成缓冲溶液的是(A) NH3和NH4Cl (B) H2PO4-和HPO42-(C) HCl和过量的氨水(D) 氨水和过量的HCl9. 用Ce4+滴定Fe2+,当体系电位为0.68V时,滴定分数为[ϕ' (Fe3+/Fe2+)=0.68V]ϕ' (Ce4+/Ce3+)=1.44V,(A) 0 (B) 50% (C) 100% (D) 200%10. 影响气体在液体中溶解度的因素有(A) 溶质的性质(B) 温度(C) 压力(D) 以上三种都是11. 下列哪个因素不影响氧化还原速度(A) 反应物浓度(B) 溶液温度(C) 催化剂(D) 指示剂的敏感性12. 将浓度相同的下列溶液等体积混合后,能使酚酞指示剂显红色的溶液是(A) 氨水+醋酸(B) 氢氧化钠+醋酸(C) 氢氧化钠+盐酸(D) 六次甲基四胺+盐酸13. Fe3+,Al3+对铬黑T有(A) 氧化作用(B) 封闭作用(C) 沉淀作用(D) 僵化作用14. 指出下列叙述中错误的结论(A) 辅助络合效应使络合物的稳定性降低(B) 金属离子的水解效应使络合物的稳定性降低(C) 络合剂的酸效应使络合物的稳定性降低(D) 各种副反应均使络合物的稳定性降低15. 符合朗伯-比尔定律的一有色溶液,当有色物质的浓度增加时,最大吸收波长和吸光度分别是(A) 增加、不变(B) 不变、减少(C) 减少、不变(D) 不变、增加16. 摩尔吸光系数(ε)的单位为(A) g/(mol·cm) (B) mol/(L·cm) (C) mol/(g·cm) (D) L/(mol·cm)17. 利用Cu(NH3)42+的蓝色以吸光光度法测Cu2+,所用滤光片(滤光片是塑料或玻璃片再加入特种染料做成的,红色滤光片只能让红光通过,如此类推。
无机化学类出试题(A卷)元素化学试题

2008年下学期《无机化学》元素化学试题(A卷)卷面20分一、单选题(每小题2分,共 4 分)(A卷)6、下列氯化物中熔点高低次序错误的是(B)A.LiCl<NaCl B.BeCl2>MgCl2C.CaCl2>HgCl2D.ZnCl2<BaCl27、下列物质中热稳定性最差的是(D)A. BaCO3B. CaCO3C. K2CO3D. Ca(HCO3)28、下列化学反应方程式错误的是B。
(A)Cr2O72- + 4Ag+ + H2O = 2Ag2CrO4↓(砖红色)+ 2H+;(B)Co2O3+6HCl = 2CoCl3+3H2O;(C)Fe2O3+6HCl→2FeCl3+3H2O;(D)Cr2O72- + 2Ba2+ + H2O = 2BaCrO4↓(柠檬黄色)+ 2H+。
二、填空题(每空1分,共12 分)(A卷)7、NH3、PH3、AsH3的沸点由大到小的顺序是。
答案:NH3>AsH3> PH3 (说明:沸点NH3(-33.4℃)存在分子间氢键,AsH3(-62.9℃)极化作用大于PH3 ((-87.9℃)8、在实验室,常用组成式为的黄血盐溶液通过产生红棕色沉淀来检验Cu2+的存在;若向Fe3+溶液中加入少量的黄血盐溶液,即生成俗称为的蓝色沉淀。
答案:K4[Fe(CN)6] ,普鲁士蓝9、根据对角线规则,周期表中处于斜线位置的、、Li 与Mg性质十分相似。
答案:Be 与Al、B 与Si10、MnSO4+NaOH的主要产物为,曝露在空气中放置转化为;AgNO3+ NaOH(适量) 的主要产物为;Hg(NO3)2+ KI(适量) 的主要产物为;Hg2(NO3)2+ KI(适量) 的主要产物为。
答:Mn (OH)2↓(白);Mn O (OH)2↓(褐);Ag2O↓(棕);HgI2↓(橘红);Hg2I2↓(草绿)11、乙硼烷是最简单的硼氢化合物,它是缺电子化合物。
B原子的杂化方式为,B 与B之间存在。
2007-2008无机化学试卷A2卷-2
课程________________________班级________________________姓名__________________________学号________________________……………………………… 密 ……………………………… 封 ………………………………… 线 ………………………………安 徽 工 业 大 学 试 题 纸(一)2007~2008学年第二学期期末考试《无机化学A2》试卷(A )一、是非题(20%,每小题2分,正确的画“√”,错误的画“×”)⒈ 极性分子之间存在取向力和诱导力,而没有色散力。
……………………………………………………..……………………………………( ) ⒉ 晶体具有规则的几何外形,固定的熔点,呈现各向异性。
……………………………………………………….……………………………( ) ⒊ 弱场配位体可形成高自旋配合物,强场配位体可形成低自旋配合物。
…..……………………………………………………………………..( ) ⒋ 用NaBiO 3将Mn 2+氧化为MnO 4-的反应中,可以使用任意酸作为酸化条件。
……………………………………………….……….……..( ) ⒌ H 2O 2是直线型分子。
……………………………………………………………………………………………………………….….………..... ( ) ⒍ 化合物CaH 2是离子型氢化物,其中氢的氧化值为-1。
…………………………………………………………………….….……………..... ( ) ⒎ 硼酸H 3BO 3是一元酸。
…………………………………………………………………………………………………………………….………( ) ⒏ 因为 r (K +)/ r (Br -)=0.678,所以KBr 晶体属于NaCl 型。
………………………………………………………………………………………( ) ⒐ 碳酸、碳酸氢盐、碳酸盐的热稳定性顺序为:碳酸盐<碳酸氢盐<碳酸。
无机化学试题及答案
无机化学试题及答案公司内部档案编码:[OPPTR-OPPT28-OPPTL98-OPPNN08]2009-2010无机化学考试试卷(A )一、选择题:本大题共25个小题,每小题1分,共25分.选择出符合题意的一个答案,将其字母填在题后的括号内.1.下列物质碱性的大小顺序正确的是 [ ] A. NH 3<N 2H 4<NH 2OH B. NH 3>N 2H 4<NH 2OH C. N 2H 4>NH 3 >NH 2OH D. NH 3>N 2H 4>NH 2OH2.熔点最高的金属是 [ ] A. Cr B. W C. Au D. Tc3.现有ds 区某元素的硫酸盐 A 和另一元素氯化物 B 水溶液,各加入适量KI 溶液,则 A 生成某元素的碘化物沉淀和 I 2。
B 则生成碘化物沉淀,这碘化物沉淀进一步与KI 溶液作用,生成配合物溶解,则硫酸盐和氯化物分别是 [ ]A. ZnSO 4, Hg 2Cl 2B. CuSO 4, HgCl 2C. CdSO 4, HgCl 2D. Ag 2SO 4,Hg 2Cl 23.下列不属于二元质子酸的是 [ ]A. H 3PO 3B. H 2SO 4C. H 3PO 2D. NaH 2PO 44.既能溶于NaOH 又能溶于NH 3·H 2O 的氢氧化物是 [ ]A. Fe(OH)3B. Zn(OH)2C. Al(OH)3D. Cd(OH)25.AgBr 晶体在1L 1 mol/L 氨水中的饱和溶液浓度为(mol/L) (已知Ag(NH 3)2+的稳定常数为×107,AgBr 的K sp =×10-13). [ ]A. ×10-3B. ×10-3C. ×10-3D. ×10-26.PCl3和水反应的产物是 [ ],HCl B. H3PO3,HCl C. H3PO4,HCl D. PH3,HClO7.下列难溶于水的硫化物中,不溶于硝酸但可溶于Na2S溶液的是[ ]A. CuSB. ZnSC. MnSD. HgS8.将过量SiF4通入NaOH溶液中,主要产物是 [ ]A. H4SiO4,NaF B. Na2SiO3,NaF C. Na2SiO3,Na2SiF6D. SiO2,HF10. 下列含氧酸的氧化性顺序正确的是 [ ]A. HClO>HBrO>HIOB. HIO>HBrO> HclOC. HClO4>HClO3>HClO D. HClO3>HClO> HClO411.下列各组元素中,性质最相似的两个元素是 [ ]A. Zr和HfB. Mg和AlC. Ag和AuD. Fe和Co12.下列物质的强氧化性与惰性电子对效应无关的是 [ ]A. PbO2 B. NaBiO3C. K2Cr2O7D. TlCl313.下列那种分子不含桥链结构 [ ]A. AlCl3 B. FeCl3C. CuCl2D. FeCl214.仅一种试剂,即可将Ag+, Hg2+, Zn2+, Fe3+, Ni2+五种离子区分开,可选用 [ ]15.A. NH3·H2O B. NaOH C. H2S D. Na2S16.含有下列离子的溶液,与Na2S溶液反应不生成黑色沉淀的一组是[ ]A. Fe2+, Bi3+B. Cd2+, Zn2+C. Fe3+, Cu2+D. Mn2+, Pb2+17.下列含氧酸中属于一元酸的是[ ]A. H3BO3B. H3AsO3C. H3PO3D. H4SiO418.下列物质与盐酸反应,能生成三价氯化物的是 [ ]A. Co2O3B. Fe2O3C. Ni2O3D. Pb3O419.下列碳酸盐中,热稳定性最好的是 [ ]A. BeCO3 B. MgCO3C. SrCO3D. BaCO320.通常鉴定镍离子的试剂是 [ ]A.硫脲B.二苯基联苯胺C.硝基苯偶氮间苯二酚D.丁二酮肟21.向Hg2Cl2溶液中加入过量的氨水后生成的产物是 [ ]A. Hg2(OH)42- B. [Hg(NH3)4]2+ C. Hg↓+ HgNH2Cl↓ D.HgNH2Cl↓22.含有П46离域大п键的是 [ ]A. ClO3- B. SO32- C. SO3(g) D. SOCl223.在HCl、 HBr 、HI 、HF中,沸点最低的是 [ ]A. HFB. HClC. HBrD. HI24.在Cr2(SO4)3溶液中,加入Na2S溶液,其沉淀产物为 [ ]A. Cr2S3(OH)325.在NaH2PO4溶液中加入AgNO3溶液后,主要产物是 [ ]B. AgOHC. AgH 2PO 4D. Ag 3PO 426. 在酸性介质中,欲使Mn 2+氧化为MnO 4-,可加下列哪种氧化剂[ ]A. KClO 3B. K 2Cr 2O 7C. 王水D. PbO 2 二、用化学反应方程式说明下列现象(要求配平,每小题2分,共10分)27. HgS 溶解于王水 28. CuO与氢碘酸反应29. 铜器在潮湿空气中缓慢生成一层绿色的铜锈 30. 铅制品中硫化铅黑斑可用过氧化氢处理去除 31. 热分解CuCl 2·2H 2O 产生黑色物质三、填空题(每空1分,共20分)32. 要除去N 2O(g)中的NO(g), 选用的试剂是( )。
08-09下无机化学答卷(A1)
08-09下⽆机化学答卷(A1)中国药科⼤学⽆机化学期末答卷(A1卷)2008-2009学年第⼆学期专业 yaoxue 班级学号姓名核分⼈:⼀、单项选择题(每⼩题2分,共40分)(从A 、B 、C 、D 四个选项中选择⼀个正确答案)1. 对于下列各化学反应计量⽅程式,其对应的反应速率表⽰式正确的是() (A) 222H I H + I ??→22H I HI d d d 12d d d c c c ttt==(B) 222N O 2N O + O ??→ 22O NO NO d d d 11d 2d 2d c c c ttt=-=(C) 3333C H + C H C H C H ??→ 3332CH CH CH d d 12d d c c t t-=(D) 3333C H + C H C H C H ??→ 333CH CH CH d d 1d 2d c c tt-=2. 假设基元反应2A + B 2C ??→,反应开始时,1A 0.4 m ol L c -=?,1B 0.3 m ol L c -=?,当反应进⾏到A 还有⼀半时,此时反应速率是开始时的() (A) 1/2(C) 1/6(D) 1/83. 当⼀个化学反应处于平衡状态时,则() (A) 平衡混合物中各种物质的浓度都相等 (B) 正反应和逆反应速度都是零(C) 体系中各物质的浓度不随时间⽽改变 (D) 反应的热效应是零4. 在“碘钟”实验中,I 3-离⼦形成的起始速率⽤淀粉—碘络合物显蓝⾊所需的时间t 来度量。
反应3I – +S O 282-?→?I 3-+ 2SO 42-的速率⽤碘钟技术来研究得下列数据:若编号5⽤ [I –]0 = 0.120 mol·dm –3,[S O 282-]0 = 0.0400 mol·dm –3,溶液显蓝⾊的时间应为() (A) 29 s (B) 33 s(C) 44 s(D) 66 s5. HCN 的解离常数为K a ,AgCl 的溶度积常数为K sp ,2A g (C N )-的稳定常数为K st ,反应+2A gC l + 2H C N A g (C N ) + 2H + C l--的平衡常数K 为()(A) K a ·K sp ·K st (B) K a + K sp + K st (C) 2K a + K sp + K st(D) K a 2·K sp ·K st6. 25℃时,反应N 2(g) + 3H 2(g) = 2NH 3(g),?H θ =192.38 kJ mol --?。
无机化学试卷A-1
《无机化学》试卷A-1一.单选题(30小题,30分)1.根据价层电子对互斥理论可判断XeF4的几何构型为( )A.正八面体B.正四面体C.平面正方形D.变形四面体2.在常温下卤素单质与NaOH溶液作用,正确的是( )A.Br2生成NaBr、NaBrO4B.Cl2生成NaCl、NaClO3C.I2生成NaI、NaIO D.Cl2生成NaCl、NaClO3.在氯的含氧酸中,下列性质排列顺序正确的是( )A.稳定性:HClO > HClO3 > HClO4 B.氧化性:HClO > HClO4 > HClO3C.还原性:HClO4 > HClO > HClO3 D.酸性:HClO4 >HClO3 >HClO4.氧族元素氢化物的稳定性由弱到强的顺序是( )A.H2Te < H2O < H2S < H2Se B.H2Se< H2Te< H2O < H2SC.H2S < H2Se < H2Te< H2O D.H2Te < H2Se < H2S < H2O5.有关亚硫酸盐性质,下列说法正确的是( )A.热稳定性强于硫酸盐B.水溶液呈弱酸性C.具有漂白性D.既有氧化性又有还原性6.常用来与Fe2O3,Al2O3等难溶金属氧化物共熔生成可溶性硫酸盐的试剂是( )A.Na2S2O8 B.K 2S2O7 C.Na2S2O4 D.Na2SO37.下列氢化物中,在室温下与水反应不产生氢气的是( )A.LiAlH4B.CaH2 C.SiH4D.NH38.氮的氢化物碱性强弱比较,正确的是( )A.NH3<N2H4< HN3;B.NH3>N2H4<HN3;C.NH3 <N2H4 >HN3;D.NH3 >N2H4 >HN39.向任何一种硼酸盐溶液中加足量强酸时,总是得到( )A.偏硼酸B.硼酸C.多硼酸D.硼砂10.NO+、NO、NO–键长关系正确的是():A.NO>NO–>NO+B.NO+>NO>NO–C.NO–>NO>NO+D.NO+>NO–>NO11.硫化铵溶液放置久了变成黄棕甚至红棕色,原因是生成以下哪种物质( )A.S和Fe(OH)3 B.NO2C.(NH4)2S x D.S和NH4OH12.下列关于锂和镁性质上的相似性说法不正确的是( ) .A.锂和镁的碳酸盐受热时,可分解为相应的氧化物B.锂和镁的氟化物、碳酸盐和磷酸盐都难溶于水;C.锂和镁的氯化物既能溶于水又能溶于有机溶剂,D.锂和镁的固体密度都小于1g.cm-1,熔点都很低。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
衡阳师范学院2008年下期2008级应用化学专业《无机化学》期末考试试题A卷电子云是…………………………………………………………………………()(A) 波函数ψ在空间分布的图形(B) 波函数|ψ|2在空间分布的图形(C) 波函数径向部分R (r)的图形(D) 波函数角度部分平方Y 2(θ,φ)的图形2.0103现有 1 mol 理想气体, 若它的摩尔质量为M,密度为d,在温度T下体积为V,下述关系正确的是……………………………………………………………………() (A) pV=(M/d)RT (B) pVd = RT(C) pV=(d/n)RT (D) pM/d = RT3.0147若标准状态下,气体A的密度为 2 g·dm-3,气体B的密度为0.08 g·dm-3,则气体 A 对气体 B 的相对扩散速率为……………………………………………………………()(A) 25:1 (B) 1:2 (C) 5:1 (D) 1:54.3669CaC2O4的K sp = 2.6x10-9,在含0.020 mol·dm-3 Ca2+ 的溶液中形成沉淀时,所需C2O42-离子浓度至少应为………………………………………………………()(A) 1.1x10-9 mol·dm-3 (B) 1.3x10-7 mol·dm-3(C) 2.2x10-5 mol·dm-3 (D) 2.2x10-7 mol·dm-35.0670过量AgCl溶解在下列各物质中,问哪种溶液中Ag+浓度最小………………() (A) 100 cm3水 (B) 1000 cm3水(C) 100cm3 0.2mol·dm-3 KCl溶液 (D) 1000 cm3 0.5mol·dm-3 KNO3溶液6.3420下列反应中,△f H0m< 0的是……………………………………………………()(A) K(g) = K+(g) + e-(B) Cl(g) + e- = Cl- (g)(C) KCl(s) = K+(g) + Cl- (g)(D) Cl2(g) = 2Cl(g)7.06180.2 mol·dm-3甲酸溶液中有 3.2% 的甲酸电离,它的电离常数是………………()(A) 9.6x10-3 (B) 4.8x10-5(C) 1.25x10-6 (D) 2.0x10-48.0969下述离子中半径最小的是………………………………………………………() (A) Rb+ (B) Sc3+ (C) Ti4+ (D) Ti3+9.0587分几步完成的化学反应的总平衡常数是………………………………………() (A) 各步平衡常数之和 (B) 各步平衡常数之平均值(C) 各步平衡常数之差 (D) 各步平衡常数之积10.4063CH4分子中,C─H键是属于……………………………………………………() (A) 离子键 (B) p-p π键(C) s-sp3 σ键 (D) 配位共价键11.0584在300 K时,反应(1)的K p值为2.46,则反应(2)的K p值为…………………()(1) NO2(g) N2O4(g)(2) 2NO2(g) N2O4(g)(A) 6.05 (B) 4.92 (C) 2.46 (D) 1.5712.0403已知 2PbS(s) + 3O2(g) = 2PbO(s) + 2SO2(g) △rH0m = -843.4 kJ·mol-1则该反应的Q V值是………………………………………………………………() (A) 840.9 (B) 845.9 (C) -845.9 (D) -840.913.0589某温度下,反应N2(g) + 3H2(g) 2NH3(g) 的K c = 0.56,若N2浓度为 0.1 mol·dm-3、H2浓度为0.2 mol·dm-3、NH3浓度为0.05 mol·dm-3,按热力学角度则反应是……………………………………………………………………………………() (A) 正向进行 (B) 达到平衡状态(C) 逆向进行 (D) 方向无法判断14.0508某一气相反应A=B,同一温度下G0A=G0B,则该反应的平衡常数K0是……() (A) 0 (B) 大于1(C) 小于1 (D) 115.3918电子的波动性是…………………………………………………………………() (A) 一种机械波 (B) 一种电磁波(C) 一种概率波 (D) 电子运动时呈波浪式的前进16.0672在有足够量AgCl固体存在的饱和AgCl溶液中,欲使AgCl的溶解度加大,应加入等体积的…………………………………………………………………………() (A) 1 mol·dm-3 NaCl 溶液 (B) 1 mol·dm-3 AgNO3溶液(C) H2O (D) 2 mol·dm-3 NaNO3水溶液17.0957在下列元素的原子中,第一电离能最低的是…………………………………() (A) Be (B) B (C) C (D) N18.4066为确定分子式为XY2的共价化合物是直线型还是弯曲型的,最好要测定它的() (A) 与另一个化合物的反应性能 (B) 偶极矩(C) 键能 (D) 离子性百分数19.0301某温度下 1 mol·dm-3糖水的饱和蒸气压为p1,1 mol·dm-3的盐水的饱和蒸气压为p2, 则……………………………………………………………………………………()(A) p2>p1 (B) p2<p1(C) p2=p1 (D) 无法判断20.0363室温时, 下列溶液中, 凝固点最低的是…………………………………………( )(A) 0.01 mol·kg-1 Na2SO4 (B) 0.02 mol·kg-1 NaAc(C) 0.02 mol·kg-1 HAc (D) 0.03 mol·kg-1尿素溶液二、填空(每小题4分,共20分)1.4056离子的相互极化作用导致离子间距离缩短和轨道重叠,使得__________键向__________键过渡,这使化合物在水中的溶解度__________,颜色_________。
2.0935符号"5p"表示电子的主量子数n等于_________,角量子数l等于__________,该电子亚层最多可以有_________种空间取向,该电子亚层最多可容纳_________个电子。
3.0938第50号元素的原子的电子排布是________________它位于第_______周期____________族,其化学符号是________。
4.1027氧分子的分子轨道式为__________________________,键级为____________。
过氧化钠中O22-的分子轨道式为________________________,键级为___________。
5.1083原子晶体,其晶格结点上的微粒之间的力是__________________,这类晶体一般熔沸点________,例如__________ 和 __________两种晶体就是原子晶体。
三、计算(每小题5分,共20分)1.(0816)已知在967 K时,反应N2O N2+ 1/2 O2的速率常数k = 0.135 s-1;在1085 K时k = 3.70 s-1,求此反应的活化能E a。
2.640410 mol氧气在99.97 kPa下加热,使其体积从1000 dm3一次等温膨胀到2000dm3,求系统所做的膨胀功W。
3.(0453)已知在298K:C(石墨) CO2(g) CO(g)△H0m (298)/ kJ·mol-10 -393.5 -110.5fS0m/ J·K-1·mol-1 5.69 213.6 197.9判断在900℃时, C(石墨) + CO2(g) = 2CO(g) 反应能否自发进行?4.(0689)若配制pH为5.00的缓冲溶液,需称取多少克NaAc·3H2O固体溶解于300 cm3 ,0.500 mol·dm-3的HAc中?(K(HAc) =1.8 x10-5,NaAc·3H2O的摩尔质量为136 g·mol-1)四、问答题(每小题4分,共20分)1.9990根据分子轨道理论判断,在下述离子化过程中键级和键长可能发生什么样的变化?(1) O2 →O2++ e- (2) N2→N2-+ e- (3) NO→NO+ + e-2.6917下列各层或轨道可以填充多少个电子?(1) 主量子数为n的一个壳层?(2) 量子数为n和l的一个亚层?(3) 一个轨道?3.3948将氢原子核外电子从基态激发到2s或2p所需要的能量有无差别? 若是氦原子情况又会如何?4.3645分别写出以下反应的K p和K c:(1) CO(g) + H2O(g)= CO2(g) + H2(g)(2) COCl2(g)= CO(g) + Cl2(g)5.2687下列两个反应在298 K和标准态时均为非自发反应,其中在高温下仍为非自发反应的是哪一个?为什么?= 2Fe(s) +3/2CO2(g)(1) Fe2O3(s) +3/2C(石墨)(2) 6C(+ 6H2O(g) = C6H12O6(s)石墨)衡阳师范学院2008年下期2008级应用化学专业《无机化学》期末考试试题A卷答案部分一、选择(每小题2分,共40分)二、填空(每小题4分,共20分)1.答案4056离子共价,变小,加深。
2.答案09355, 1, 3, 63.答案09381s22s22p63s23p63d104s24p64d105s25p25, IVA, Sn4.答案1027KK (σ 2s )2 (σ *2s )2 (σ 2px )2 (π 2py )2 (π 2pz )2 (π *2py )1 (π *2pz )1 键级为8-4/2 = 2KK (σ 2s )2 (σ *2s )2 (σ 2px )2 (π 2py )2 (π 2pz )2 (π *2py )2 (π*2pz )2 键级为8-6/2 = 15.答案1083共价键力,高,金刚石,二氧化硅(或立方氮化硼等)三、计算(每小题5分,共20分) (5 分)1.答案0816令 T 1 = 967 K , k 1 = 0.135 s -1 T 2 = 1085 K , k 2 = 3.70 s -1 即得:).(104.2135.070.3lg967108510859671031.830.2123--⨯=-⨯⨯⨯⨯=mol kj E a2.答案6404 W = p ΔV --3= 99.97 (kJ)(5 分)3.答案0453△Rh 0m = 2△f H 0m (CO, g) –△f H 0m (石墨) –△f H 0m (CO 2, g) = 2 (-110.5) - 0 - (-393.5) = 172.5 (kJ·mol -1)△rS 0m= 2S 0m (CO) –S 0m (石墨) –S 0m (CO 2) = 2x197.9 - 5.69 - 213.6 = 176.5 (J·K -1·mol -1) 在假定△rH ○m ,△rS 0m 随温度变化很小的条件下: 在900℃时,△rG ○m =△rH ○m - T △rS 0m = 172.5 -176.5/1000= -34.5 (kJ·mol -1) < 0 因△rG ○m < 0,所以能自发进行 (5 分)4.答案0689设须 W g NaAc·3H 2O , 因为M(NaAc·3H 2O) = 136 g·mol -1)()(lg --=AcHAc a C C pK pHW300.0136500.0lg )108.1lg(00.55⨯⨯-⨯-=-lg W = 5.00 - 4.74 + lg (0.500x136x0.300) = 1.57W = 37四、问答题(每小题4分,共20分) 1.答案9990(1) +0.5,变短;(2) -0.5,变长;(C) +0.5,变短2.答案6917(1) 2n 2;(2) 2 (2l + 1);(3) 23.答案3948因为氢原子为单电子体系,E 2s = E 2p 能量相同。
