氯气溶于水化学方程式
高中常用化学方程式

高中常用化学方程式无机化学一、碱金属( Li 、 Na、 K、 Rb、 Cs )1. 钠放在空气中:4Na+O2===2Na2O(金属钠表面很快变暗)2. 钠在空气中燃烧:(淡黄色固体)3. 钠与水反应:2Na+2HO===2NaOH+H↑(浮、熔、游、响)4. 钠与硫酸铜盐溶液反应:2Na+CuSO4+2H2O===Na2SO4+Cu(OH)2↓+H2↑5. 氧化钠与水反应: Na2O+H2O===2NaOH6. 氧化钠与二氧化碳反应: Na2O+CO2===Na2CO37. 过氧化钠与水反应:2Na2O2+2H2O===4NaOH+O2↑(过氧化钠即是氧化剂又是还原剂)8. 过氧化钠与二氧化碳反应:2Na2O2+2CO===2Na2CO3+O2(常用于呼吸面具、潜水艇作供氧剂)9. 过氧化钠与稀硫酸反应:2Na2O2+2H2SO4===2NaSO4+2H2O+O2↑10. 盐酸中滴加纯碱溶液:Na2CO3+2HCl===2NaCl+HO+CO2↑11. 纯碱溶液中滴加少量稀盐酸:Na2CO3+HCl===NaHCO3+NaCl12. 碳酸钠溶液与二氧化碳反应:Na2CO3+CO2+H2O===2NaHCO313. 小苏打固体受热分解:14. 小苏打与氢氧化钠的反应:NaHCO3+ NaOH===Na2CO3+ H2O15. 金属锂在空气中燃烧:4Li+O 2===2Li 2O(仅生成氧化锂)16. 小苏打溶液与稀盐酸反应:NaHCO3+HCl===NaCl+H2O+CO2↑17. 金属钠与硫粉混合爆炸:2Na+S===NaS(不需要任何条件)二、镁.铝.铁1. 氧气作用:2. 镁与氮气作用:3. 金属镁能在二氧化碳中燃烧:(CO2不能用扑灭由Mg,Ca,Ba,Na,K等燃烧的火灾) 4. 镁与稀硫酸的反应:Mg+H2SO4===MgSO4+H2↑5. 镁能与与沸水反应:6. 氧化镁的反应: MgO+SO3===MgSO4MgO+H2SO4===MgSO4+H2O7. 氢氧化镁与氯化铵反应:Mg(OH)2+2NH4Cl===MgCl2+2NH3·H2O8. 铝箔在空气中燃烧:9. 铝箔在氯气中燃烧:10. 铝与稀盐酸反应:2Al+6HCl===2AlCl 3+3H2↑11. 铝与稀硫酸反应:2Al+3H2SO4===Al 2(SO4) 3+3H2↑12. 铝与氢氧化钠溶液反应:2Al+2NaOH+2HO===2NaAlO+3H2↑13. 铝热反应:14. 氧化铝的两性:Al 2O3+3H2SO4===Al 2(SO4) 3+3H2OAl2O3+2NaOH===2NaAlO+H2O15 氯化铝与过量的氨水:AlCl 3+3NH· H2O===Al(OH)3↓ +3NH4Cl16 氢氧化铝的两性:Al(OH) 3+NaOH===NaAlO2+2H2OAl(OH)3+3HCl===AlCl3+3H2O17 氢氧化铝的不稳定性:3+18.Al与强碱的反应:AlCl 3+3NaOH===Al(OH)↓+3NaCl(碱不足)19. 偏铝酸盐与二氧化碳的反应:2NaAlO2+CO2+3H2O===2Al(OH)3↓+Na2CO320. 铁与水蒸汽的高温反应:21. 铁与稀盐酸的反应:Fe+2HCl===FeCl2+H2↑22. 铁与氯化铜的反应: Fe+CuCl2===FeCl2+Cu23. 铁与氯化铁的反应: 2FeCl 3+Fe===3FeCl224. 铁的氧化物与稀盐酸的反应: FeO+2HCl===FeCl2+3H2OFe2O3+6HCl===2FeCl3+3H2O Fe 3O4+8HCl===FeCl 2+2FeCl 3+4H2O25. 制还原铁粉:26.2FeCl 3+Cu===2FeCl2+CuCl2 ( 用于雕刻铜线路版)27. 氯化铁与过量的氨水反应:FeCl 3+3NH· H2O===Fe(OH)3↓ +3NH4Cl28. 氢氧化铁的不稳定性:29.4Fe(OH)2+O2+2HO===4Fe(OH)3(空气中白色固体转化为红褐色固体)30. 镁铁之间的置换反应: FeCl 2+Mg===Fe+MgCl231. 氢氧化铜的不稳定性:32. 氢氧化镁的不稳定性:33.FeCl 3 ↓ +3NaCl(有红褐色沉淀生成)+3NaOH===Fe(OH)34. 用硫氰化钾验证3+3+ - Fe :Fe +3SCN=== Fe(SCN)(血红色物质出现)335.MgCl +2NH· H O===Mg(OH)↓ +NHCl2 3 2 2 4三、卤族元素(F 、 Cl 、 Br 、I 、 At )1. 铜、铁在氯气中燃烧:(棕色的烟,水溶液为蓝色)(生成相对的高价态)(棕色的烟,水溶液为黄色)2. 钠在氯气中燃烧:3. 氢气在氯气中燃烧:(安静燃烧,苍白色火焰)光照氯气和氢气的混合气体:Cl 2+H2===2HCl(爆炸)4. 磷在氯气中燃烧:(大量的白色烟雾)5. 冷暗处: F2 + H 2 === 2HF6. 氟气的强氧化性: 2F2 +2H2O===4HF+O27. 氯气溶于水的部分与水反应: Cl 2+H2 O===HCl+HClO(新制的氯水为黄绿色,由于内部溶解了氯气新制的氯水的成分: Cl 2、 Cl -、 H+、 ClO-、 HClO、H2 O)8. 实验室制氯气:9.16HCl+2KMnO4==2KCl+2MnCl2 +5Cl 2↑ +8H2O10. 次氯酸不稳定:11. 氯气与碱的反应: Cl 2+2NaOH===NaCl+NaClO+H3Cl2+6KOH(热、浓 )===5KCl+KClO +3H O3 212. 工业制漂白粉及漂白粉的应用和失效:2Cl 2+2Ca(OH)2===CaCl2+Ca(ClO) 2+2H2O(用于工业制漂白粉。
化学必修1化学方程式

化学必修1化学方程式化学必修1化学方程式一、钠及其化合物1. 钠在空气中燃烧:2Na +O 2点燃Na 2O 22. 钠在氧气中燃烧:4Na +O 22Na 2O3. 钠与水反应:2Na +2H 2O=2NaOH+H 2↑4. 氧化钠与水反应:Na 2O +H2O=2NaOH5. 过氧化钠与水反应:2Na 2O 2+2H 2O=4NaOH+O 2↑6. 氧化钠与盐酸反应:Na 2O +2HCl=2NaCl+H 2O7. 钠与盐酸反应:2Na +2HCl=2NaCl+H 2↑8. 氧化钠与二氧化碳反应:Na 2O +CO 2=Na2CO 3 9. 过氧化钠与二氧化碳反应: 2Na 2O 2+2CO 2=2Na2CO 3+O 2 10. 电解氯化钠(工业制钠):2Na Cl 11. 碳酸钠与水和二氧化碳反应: Na 2CO 3+H 2O +CO 2=2NaHCO3 12.碳酸氢钠遇热分解:△点燃通电2Na+Cl2↑2NaHCO 3 Na 2CO 3+H 2O +CO 2↑ 13.碳酸氢钠与氢氧化钠反应:NaHCO 3+NaOH=Na2CO 3+H 2O 14. 碳酸钠与盐酸反应:Na 2CO 3+2HCl=2NaCl+H 2O +CO 2↑ Na 2CO 3+HCl=NaHCO3;NaHCO 3+HCl=NaCl +H 2O +CO 2↑ 15. 碳酸氢钠与盐酸反应:NaHCO 3+HCl=NaCl +H 2O +CO 2↑16. 碳酸钠与氯化钙反应:Na 2CO 3+C a Cl2=CaCO3↓+2NaCl 17. 候氏治碱法:①NaCl+NH3+CO 2+H 2O=NaHCO3+NH 4Cl;△②HCO 3Na 2CO 3+H 2O +CO 2↑18. 钠与四氯化钛反应:TiCl 4+4Na 700℃~800℃Ti+4NaCl19. 钠与硫酸铜溶液反应:①有水环境下:2Na +2H 2O=2NaOH+H 2↑; NaOH+CuSO4=Cu (OH) 2+Na 2SO 4 ②熔融条件下:Na +CuSO4熔融Cu+Na2SO 420. 钠与硫反应:Na +SNa 2S 二、铝及其化合物的转化关系△研磨1. 高温灼烧氢氧化铝:2Al(OH)3Al 2O 3+3H 2O2. 电解氧化铝:Al 2O 34Al+3O2↑3. 铝与盐酸反应:2Al +6HCl=2AlCl3+3H 2↑4. 铝与氢氧化钠反应:2Al +2NaOH +2H 2O=2NaAlO2+3H 2↑5. 铝与稀硫酸反应:2Al+3H2SO 4=Al 2(SO4) 3+3H 2↑6. 氧化铝与盐酸反应:Al 2O 3+6HCl=2AlCl3+3H 2O7. 氧化铝与氢氧化钠反应:Al 2O 3+2NaOH=2NaAlO2+H 2O 8. 氧化铝与稀硫酸反应:Al 2O 3 +3H2SO 4=Al 2(SO4) 3 +3H 2O9. 氯化铝与氨水反应(实验室制氢氧化铝): AlCl 3+3NH 3·H 2O=Al(OH)3↓+3NH 4Cl 10. 往氯化铝中滴加氢氧化钠至过量:(先有白色沉淀,后沉淀逐渐溶解)①AlCl 3+3NaOH=Al(OH)3↓+3N a Cl ;②Al(OH)3+NaOH = NaAlO2+2H 2O 11. 往氢氧化钠中滴加氯化铝至过量:(先无现象,后有白色沉淀)①AlCl 3+4NaOH = NaAlO2+3NaCl +2H 2O ;②3NaAlO 2+6H 2O+AlCl3 = 4Al(OH)3↓+3N a Cl 12. 偏铝酸钠与盐酸反应:NaAlO 2+HCl +H 2O =Al(OH)3↓+NaCl 若盐酸过量:NaAlO 2+HCl +H 2O =Al(OH)3↓+NaCl ;通电②Al(OH)3↓+HCl=AlCl3+3H 2O 13. 偏铝酸钠与二氧化碳反应:NaAlO 2+2H 2O +CO 2=Al(OH)3↓+NaHCO 3 14. 铝还原氧化铁(焊接铁轨): 2Al+Fe2O 32Fe (铁水)+Al2O 3(铝热反应)三、氯及其化合物的转化关系1. 铁在氯气中燃烧:2Fe +3Cl 2 2FeCl 3(棕褐色烟)点燃2. 铜在氯气中燃烧:Cu +Cl 2 CuCl 2(棕黄色烟)高温点燃3. 氢气在氯气中燃烧:H 2+Cl 2 H 2+Cl 2点燃2HCl (苍白色火焰)光2HCl (会发生爆炸)4. 实验室制氯气(浓盐酸与氧化锰反应): MnO 2+4HCl(浓)△MnCl 2+Cl 2↑+2H 2O5. 工业制氯气(电解饱和食盐水) : 2NaCl+2H 2O通电2NaOH+H 2↑+Cl 2↑(氯碱工业)6. 氯气溶于水:Cl 2+H 2O ? HCl +HClO7. 次氯酸遇光分解:2HClO8. 氯气与氢氧化钠反应:Cl 2+2NaOH = NaCl+NaClO +H 2O (吸收氯气尾气)光照2HCl +O 2↑9. 氯气与氢氧化钙反应:2Cl 2+2Ca(OH)210. 2 Ca(ClO)2+2H 2O +2CO 2 = Ca(HCO3) 2+2HClO 11. 氯气与碘化钾反应:Cl 2+2KI=I2 +2KCl(检验氯气) 四、铁及其化合物的转化关系1. 铁与水反应:气态) +3Fe高温Fe 3O 4+4H 2点燃2. 铁在氧气中燃烧:3Fe +2O 2 Fe 3O 43. 铁和盐酸反应:Fe +2HCl=FeCl2+H 2↑4. 铁和稀硫酸反应: Fe+H2SO 4 = FeSO4+H 2↑5. 铁和氯化铁反应:Fe +2FeCl 3 =3FeCl2 6. 铁和氯化铜反应:Fe +2C u Cl 2=FeCl 2+Cu(制造电路板) 7. 铁在氯气中燃烧:2Fe +3Cl 2 =2FeCl 38. 氯化亚铁和氯气反应:2FeCl 2+Cl 2 = 2FeCl3 9. 氯化亚铁和氢氧化钠反应:(白色沉淀迅速变成灰绿色,最后变成红褐色)①FeCl 2+;②4Fe(OH)2+O 2+2H 2 (氢氧化亚铁被氧化)10. 氯化铁氢氧化钠反应:FeCl 3+3NaOH = Fe(OH)3↓+3NaCl 11. 氢氧化亚铁与盐酸反应: Fe(OH)2+2HCl = FeCl2+2H 2O12. 氢氧化铁与盐酸反应:Fe(OH)3+3HCl = FeCl3+3H 2O 13. 氧化铁与盐酸反应:Fe 2O 3+6HCl = 2FeCl3+3H 2O14. 四氧化三铁与盐酸反应:Fe 3O 4+8HCl =2FeCl 2+FeCl 3+4H 2O15. 氧化亚铁与盐酸反应:FeO +2HCl =FeCl 2+H 2O△16. 一氧化碳还原四氧化三铁:Fe 3O 4+4CO 17. 一氧化碳还原氧化铁: Fe 2O 3 +3CO3Fe +4CO 2 2Fe +3CO 2△18. 高温煅烧氢氧化铁:2Fe(OH)319. 铁在高温条件下与浓硫酸反应:△高温Fe 2O 3+3H 2O2Fe+6H2SO 4(浓) 2(SO 4)3+3SO 2↑+6H 2O△常温下,铝,铁遇浓硫酸,浓硝酸被钝化,表面形成一层致密的氧化膜,阻止反应的进一步进行。
卤素及其化合物地化学方程式和离子方程式

卤素及其化合物的化学方程式和离子方程式一、氟气、氯气、溴、碘1、铁在氯气中燃烧:2Fe+3Cl22FeCl32、铁粉和液体溴反应:2Fe+3Br22FeBr33、铁与固体碘加热:Fe+I2FeI24、氟气和水反应:2F2+2H2O4HF+O2↑5、氯气溶于水:Cl2+H2O HCl+HClOCl2+H2O H++Cl-+HClO6、二氧化硫通入氯水:SO2+Cl2+2H2O H2SO4+2HClSO2+Cl2+2H2O4H++SO42-+2Cl-7、二氧化硫通入溴水:SO2+Br2+2H2O H2SO4+2HBrSO2+Br2+2H2O4H++SO42-+2Br-8、二氧化硫通入碘水:SO2+I2+2H2O H2SO4+2HISO2+I2+2H2O4H++SO42-+2I-9、氢硫酸和氯水混合:H2S+Cl22HCl+S↓H2S+Cl22H++2Cl-+S ↓10、氢硫酸和溴水混合:H2S+Br22HBr+S↓H2S+Br22H++2Br-+S↓11、氢硫酸和碘水混合:H2S+I22HI+S↓H2S+I22H++2I-+S↓12、氢碘酸与氯水混合:2HI+Cl22HCl+I22I-+Cl2I2+2Cl-13、氢碘酸与溴水混合:2HI+Br22HBr+I22I-+Br2I2+2Br-14、氢溴酸与氯水混合:2HBr+Cl22HCl+Br22Br-+Cl2Br2+2Cl-15、亚硫酸与氯水混合:H2SO3+Cl2+H2O H2SO4+2HClH2SO3+Cl2+H2O4H++SO42-+2Cl-16、亚硫酸与溴水混合:H2SO3+Br2+H2O H2SO4+2HBrH2SO3+Br2+H2O4H++SO42-+2Br-17、亚硫酸与碘水混合:H2SO3+I2+H2O H2SO4+2HIH2SO3+I2+H2O4H++SO42-+2I-18、氯气溶于氢氧化钠溶液:Cl2+2NaOH NaCl+NaClO+H2OCl2+2OH-Cl-+ClO-+H2O19、溴溶于氢氧化钠溶液:Br2+2NaOH NaBr+NaBrO+H2OBr2+2OH-Br-+BrO-+H2O20、碘溶于氢氧化钠溶液:I2+2NaOH NaI+NaIO+H2OI2+2OH-I-+IO-+H2O21、氯气与热的氢氧化钠溶液反应:3Cl2+6NaOH5NaCl+NaClO3+3H2O3Cl2+6OH-5Cl-+ClO3-+3H2O 22、溴与热的氢氧化钠溶液反应:3Br2+6NaOH5NaBr+NaBrO3+3H2O3Br2+6OH-5Br-+BrO3-+3H2O23、碘与热的氢氧化钠溶液反应:3I2+6NaOH5NaI+NaIO3+3H2O3I2+6OH-5I-+IO3-+3H2O24、氯化亚铁溶液中通入氯气:2FeCl2+Cl22FeCl32Fe2++Cl22Fe3++2Cl-25、氯化亚铁中加入溴:6FeCl2+3Br24FeCl3+2FeBr32Fe2++Br22Fe3++2Br-26、溴化亚铁中通入少量氯气:6FeBr2+3Cl22FeCl3+2FeBr32Fe2++Cl22Fe3++2Cl-27、溴化亚铁中通入足量氯气:2FeBr2+3Cl22FeCl3+2Br22Fe2++4Br-+3Cl22Fe3++2Br2+6Cl-28、碘化亚铁溶液中通入少量氯气:FeI2+Cl2FeCl2+I22I-+Cl2I2+2Cl-29、碘化亚铁溶液中通入足量氯气:2FeI2+3Cl22FeCl3+2I22Fe2++4I-+3Cl22Fe3++2I2+6Cl-30、溴化钠溶液中通入氯气:2NaBr+Cl22NaCl+Br22Br-+Cl2Br2+2Cl-31、碘化钾溶液中加入溴水:2KI+Br22KBr+I22I-+Br2I2+2Br-32、碘化钾溶液中通入氯气:2KI+Cl22KCl+I22I-+Cl2I2+2Cl-33、硫化钠溶液中加入氯水:Na2S+Cl22NaCl+S↓S2-+Cl22Cl-+S ↓34、硫化钠溶液中加入溴水:Na2S+Br22NaBr+S↓S2-+Br22Br-+S↓35、硫化钠溶液中加入碘水:Na2S+I22NaI+S↓S2-+I22I-+S↓36、亚硫酸钠溶液中加入氯水:Na2SO3+Cl2+H2O Na2SO4+2HClSO32-+Cl2+H2O2H++SO42-+2Cl-37、亚硫酸钠溶液中加入溴水:Na2SO3+Br2+H2O Na2SO4+2HBrSO32-+Br2+H2O2H++SO42-+2Br-38、亚硫酸钠溶液中加入碘水:Na2SO3+I2+H2O Na2SO4+2HISO32-+I2+H2O2H++SO42-+2I-39、氟气和硅反应:Si+2F2SiF440、氯气与硅共热:Si+2Cl2SiCl4二、氟化氢、氯化氢、溴化氢、碘化氢1、钠与稀盐酸反应:2Na+2HCl2NaCl+H2↑2Na+2H+2Na++H2↑2、锌与稀盐酸反应:Zn+2HCl ZnCl2+H2↑Zn+2H+Zn2++H2↑3、铝与稀盐酸反应:2Al+6HCl2AlCl3+3H2↑2Al+6H+2Al3++3H2↑4、铁与稀盐酸反应:Fe+2HCl FeCl2+H2↑Fe+2H+Fe2++H2↑5、硅与氢氟酸反应:Si+4HF SiF4+2H2↑6、氢溴酸与氯水混合:2HBr+Cl22HCl+Br22Br-+Cl2Br2+2Cl-7、氢碘酸与氯水混合:2HI+Cl22HCl+I22I-+Cl2I2+2Cl-8、氢碘酸与溴水混合:2HI+Br22HBr+I22I-+Br2I2+2Br-9、氧化钠与稀盐酸反应:Na2O+2HCl2NaCl+H2ONa2O+2H+2Na++H2O10、氧化铜与稀盐酸反应:CuO+2HCl CuCl2+H2OCuO+2H+Cu2++H2O11、氧化铁与稀盐酸反应:Fe2O3+6HCl2FeCl3+3H2OFe2O3+6H+2Fe3++3H2O12、四氧化三铁与稀盐酸反应:Fe3O4+8HCl FeCl2+2FeCl3+4H2OFe3O4+8H+Fe2++2Fe3++4H2O13、氧化铁与氢碘酸反应:Fe2O3+6HI2FeI2+I2+3H2OFe2O3+6H++2I-2Fe2++I2+3H2O14、四氧化三铁与氢碘酸反应:Fe3O4+8HI3FeI2+I2+4H2OFe3O4+2I-+8H+3Fe2++I2+4H2O 15、二氧化锰与浓盐酸共热:MnO2+4HCl MnCl2+Cl2↑+2H2OMnO2+4H++2Cl-Mn2++Cl2↑+2H2O 16、二氧化锰与浓氢溴酸共热:MnO2+4HBr MnBr2+Br2+2H2OMnO2+4H++2Br-Mn2++Br2+2H2O 17、二氧化锰与浓氢碘酸共热:MnO2+4HI MnI2+I2+2H2OMnO2+4H++2I-Mn2++I2+2H2O18、二氧化硅与氢氟酸反应:SiO2+4HF SiF4+2H2O19、氢氧化钠与盐酸反应:HCl+NaOH NaCl+H2OH++OH-H2O20、氢氧化镁与盐酸反应:Mg(OH)2+2HCl MgCl2+2H2OMg(OH)2+2H+Mg2++2H2O21、氢氧化铁与盐酸反应:Fe(OH)3+3HCl FeCl3+3H2OFe(OH)3+3H+Fe3++3H2O22、氢氧化铁与氢碘酸反应:2Fe(OH)3+6HI2FeI2+I2+6H2O2Fe(OH)3+6H++2I-2Fe2++I2+6H2O 23、硝酸银溶液与盐酸反应:AgNO3+HCl AgCl↓+HNO3Ag++Cl-AgCl↓24、硝酸银溶液与氢溴酸反应:AgNO3+HBr AgBr↓+HNO3Ag++Br-AgBr↓25、硝酸银溶液与氢碘酸反应:AgNO3+HI AgI↓+HNO3Ag++I-AgI↓26、溴化氢通入浓硫酸中:2HBr+H2SO4Br2+SO2↑+2H2O27、碘化氢通入浓硫酸中:2HI+H2SO4I2+SO2↑+2H2O28、溴化氢通入浓硝酸中:2HBr+2HNO3Br2+2NO2↑+H2O29、碘化氢通入浓硝酸中:2HI+2HNO3I2+2NO2↑+H2O30、氢碘酸与氯化铁溶液混合:2FeCl3+2HI2FeCl2+I2+2HCl2Fe3++2I-2Fe2++I231、氯酸钾与浓盐酸反应:KClO3+6HCl KCl+3Cl2↑+3H2OClO3-+6H++5Cl-3Cl2↑+3H2O32、溴酸钾与浓氢溴酸反应:KBrO3+6HBr KBr+3Br2+3H2OBrO3-+6H++5Br-3Br2+3H2O33、碘酸钾与浓氢碘酸反应:KIO3+6HI KI+3I2+3H2OIO3-+6H++5I-3I2+3H2O34、高锰酸钾与浓盐酸反应:2KMnO4+16HCl 2KCl+5Cl2↑+2MnCl2+8H2O2MnO4-+16H++10Cl-2Mn2++5Cl2↑+8H2O35、高锰酸钾与浓氢溴酸反应:2KMnO4+16HBr 2KBr+5Br2+2MnBr2+8H2O2MnO4-+16H++10Br-2Mn2++5Br2+8H2O36、高锰酸钾与浓氢碘酸反应:2KMnO4+16HI 2KI+5I2+2MnI2+8H2O2MnO4-+16H++10I-2Mn2++5I2+8H2O三、氟化钠、氯化钠、溴化钠、碘化钠1、硝酸银溶液与氯化钠溶液反应:AgNO3+NaCl AgCl↓+NaNO3Ag++Cl-AgCl↓2、硝酸银溶液与溴化钠溶液反应:AgNO3+NaBr AgBr↓+NaNO3Ag++Br-AgBr↓3、硝酸银溶液与碘化钠溶液反应:AgNO3+NaI AgI↓+NaNO3Ag++I-AgI↓4、氟化钠溶液与氯化钙溶液混合:2NaF+CaCl2CaF2↓+2NaClCa2++2F-CaF2↓5、氟化钠溶液呈碱性:NaF+H2O HF+NaOHF-+H2O HF+OH-6、氟化钠溶液与稀盐酸反应:NaF+HCl NaCl+HFF-+H+HF7、氟化钠溶液与氯化铁溶液反应:FeCl3+3NaF+3H2O Fe(OH)3↓+3NaCl+3HFFe3++3F-+3H2O Fe(OH)3↓+3HF8、氯化钠固体与浓硫酸共热:NaCl+H2SO4Na2SO4+2HCl9、溴化钠固体与浓硫酸共热:2NaBr+H2SO4Na2SO4+SO2↑+Br2+H2O10、碘化钠固体与浓硫酸共热:2NaI+H2SO4Na2SO4+SO2↑+I2+H2O11、溴化钠固体与浓磷酸共热:NaBr+H3PO4NaH2PO4+HBr↑12、溴化钠固体与浓磷酸共热:NaI+H3PO4NaH2PO4+HI↑13、碘化钠固体溶于浓硝酸:2NaI+4HNO32NaNO3+2NO2↑+I2+2H2O14、溴化钠溶液中通入氯气:2NaBr+Cl22NaCl+Br22Br-+Cl2Br2+2Cl-15、碘化钠溶液加入溴水:2NaI+Br22NaBr+I22I-+Br2I2+2Br-16、碘化钠溶液通入氯气:2NaI+Cl22NaCl+I22I-+Cl2I2+2Cl-17、碘化钠溶液与氯化铁溶液混合:2FeCl3+2NaI2FeCl2+I2+2NaCl2Fe3++2I-2Fe2++I218、氯酸钠、氯化钠的混合液中加稀硫酸:NaClO3+5NaCl+3H2SO4Na2SO4+3Cl2↑+3H2OClO3-+5Cl-+6H+3Cl2↑+3H2O19、溴酸钠、溴化钠的混合液中加稀硫酸:NaBrO3+5NaBr+3H2SO4Na2SO4+3Br2+3H2OBrO3-+5Br-+6H+3Br2+3H2O20、碘酸钠、碘化钠的混合液中加稀硫酸:NaIO3+5KNa+3H2SO4Na2SO4+3I2+3H2OIO3-+5I-+6H+3I2+3H2O四、次氯酸1、二氧化硫通入次氯酸中:SO2+HClO+H 2O H2SO4+HClSO2+HClO+H2O3H ++SO42-+Cl-2、氢硫酸与次氯酸混合:H2S+HClO S↓+H2O+HClH2S+HClO S↓+H++Cl-+H2O3、亚硫酸与次氯酸混合:H2SO3+HClO H2SO4+HClH2SO3+HClO3H++SO42-+Cl-4、氢碘酸与次氯酸混合:2HI+HClO I2+HCl+H2O2I-+HClO +H+I2+Cl-+H 2O6、次氯酸与氢氧化钠溶液反应:HClO+NaOH NaClO+H2OHClO+OH-ClO-+H2O7、氯化亚铁溶液与次氯酸混合:2FeCl2+2HClO2FeCl3+H2O2Fe2++2HClO 2Fe3++2Cl-+H2O 8、硫化钠与次氯酸混合:Na 2S+2HClO2NaCl+S↓+H2OS2-+2HClO2Cl-+S ↓+H2O9、亚硫酸钠与次氯酸混合:Na2SO3+HClO Na2SO4+HClSO32-+HClO SO42-+H++Cl-10、碘化钾与次氯酸混合:2KI+2HClO2KCl+I2+H2O2I-+2HClO I2+2Cl-+H2O见光或受热11、次氯酸见光分解:2HClO2HCl+O2↑五、次氯酸钠1、二氧化硫通入次氯酸钠溶液中:SO2+NaClO+H2O NaCl+H2SO4SO2+ClO-+H2O Cl-+2H++SO42-2、次氯酸钠溶液呈碱性:NaClO+H2O HClO+NaOHClO-+H2O HClO+OH-3、次氯酸钠与稀硫酸反应:2NaClO+H2SO42HClO+Na2SO4ClO-+H+HClO4、次氯酸钠溶液通入二氧化碳:NaClO+CO2+H2O HClO+NaHCO3ClO-+CO2+H2O HClO+HCO3-5、次氯酸钠溶液与氯化铁溶液混合:FeCl3+3NaClO+3H2O Fe(OH)3↓+3NaCl+3HClOFe3++3ClO-+3H2O Fe(OH)3↓+3HClO6、次氯酸钠与氢硫酸反应:NaClO+H2S NaCl+S↓+H2OClO-+H2S S↓+Cl-+H2O7、次氯酸钠与氢碘酸反应:NaClO+2HI I2+NaCl+H2OClO-+2H++2I-I2+Cl-+H2O8、次氯酸钠与浓盐酸反应:NaClO+2HCl NaCl+Cl2↑+H2OClO-+2H++Cl-Cl2↑+H2O9、次氯酸钠与亚硫酸反应:NaClO+H2SO3NaCl+H2SO4ClO-+H2SO3Cl-+2H++SO42-10、次氯酸钠与硫化钠反应:Na2S+NaClO+H2O NaCl+S↓+2NaOHS2-+ClO-+H2O S↓+Cl-+2OH-11、次氯酸钠与碘化钾反应:2KI+NaClO+H2O I2+NaCl+2KOH2I-+ClO-+H2O I2+Cl-+2OH-12、次氯酸钠与亚硫酸钠反应:NaClO+Na2SO3Na2SO4+NaClClO-+SO32-SO42-+Cl-13、次氯酸钠与氯化亚铁反应:2FeCl2+5NaClO+5H2O2Fe(OH)3↓+5NaCl+4HClO2Fe2++5ClO-+5H2O2Fe(OH)3↓+Cl-+4HClO14、次氯酸钠与氯化钠的混合溶液中加入稀硫酸:NaClO+NaCl+H2SO4Na2SO4+Cl2↑+H2OClO-+Cl-+2H+Cl2↑+H2O六、氯酸钾、溴酸钾、碘酸钾1、氯酸钾与二氧化锰共热:2KClO32KCl+3O2↑2、氯酸钾与浓盐酸反应:KClO3+6HCl KCl+3Cl2↑+3H2OClO3-+6H++5Cl-3Cl2↑+3H2O 3、溴酸钾与浓氢溴酸反应:KBrO3+6HBr KBr+3Br2+3H2OBrO3-+6H++5Br-3Br2+3H2O 4、、碘酸钾与浓氢碘酸反应:KIO3+6HI KI+3I2+3H2OIO3-+6H++5I-3I2+3H2O 5、氯酸钾、氯化钾的混合液中加稀硫酸:KClO3+5KCl+3H2SO4K2SO4+3Cl2↑+3H2OClO3-+5Cl-+6H+3Cl2↑+3H2O6、溴酸钾、溴化钾的混合液中加稀硫酸:KBrO3+5KBr+3H2SO4K2SO4+3Br2+3H2OBrO3-+5Br-+6H+3Br2+3H2O7、碘酸钾、碘化钾的混合液中加稀硫酸:KIO3+5KI+3H2SO4K2SO4+3I2+3H2OIO3-+5I-+6H+3I2+3H2O。
第12课 氯气的性质——氯气与水、与碱的反应(原卷版)-2024-2025学年高一化学同步学与练(
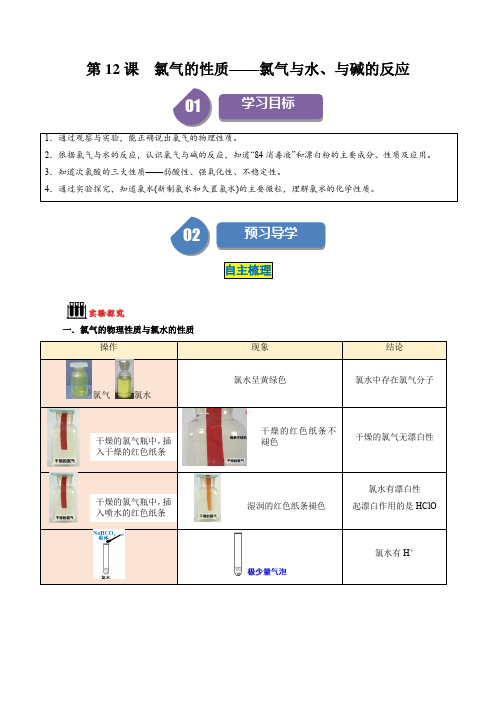
问题探究Biblioteka 1.氯气与水反应的化学方程式为__________________________________,氯水中起漂白作用的物质
是__________。
2.氯气通入碱性草木灰(即氢氧化钾)的溶液中,发生的反应有:Cl2+H2O
HCl+HClO,
_________________________、__________________________________。
要点归纳
一、氯气的物理性质
颜色 状态
气味
密度
黄绿色 气体 刺激性气味 比空气大
二、氯气的化学性质
1.与水的反应
化学方程式:Cl2+H2O
HCl+HClO
溶解性 1 体积水可溶解约 2 体积 Cl2
沸点 较高(易液化)
毒性 有毒
离子方程式:Cl2+H2O
H++Cl-+HClO
2.与碱的反应
(1)与氢氧化钠溶液反应——制取漂白液
(2)需要在 D 处连接如图所示装置,气体应该由______(填“a”或“b”)管通入。该装置 作用是 ____________________,用离子方程式表示其原理___________________________。
的 ►环节二 次氯酸与氯水
情境材料
法国化学家贝托莱根据他自己的想法继续进行了舍勒关于氯气的研 究,于 1785 年证明氯可用来漂白。他将氯水露置在阳光下(见右图),发现 了氯水中奇妙的变化。氯水在光照条件下有气体产生,贝托莱研究后认为 是氧气。
典例精讲
【例 1】(2022·河南平顶山期末)用图 1 所示装置向装有一瓶氯气的集气瓶中添加适量的蒸馏水,振荡, 先利用注射器滴加 NaOH 溶液,再利用注射器滴加稀盐酸,用压强传感器测得集气瓶内的压强随时间变化 的曲线如图 2 所示。下列说法错误的是
《氯气的性质及用途》 知识清单

《氯气的性质及用途》知识清单一、氯气的物理性质氯气在常温常压下是一种黄绿色、有强烈刺激性气味的剧毒气体。
它的密度比空气大,易压缩,可液化为金黄色液态氯。
氯气能溶于水,常温下 1 体积水大约能溶解 2 体积氯气,但在饱和氯化钠溶液中的溶解度较小。
在低温和加压的条件下,氯气可以转变为液态或固态。
二、氯气的化学性质1、与金属反应氯气具有强氧化性,能与大多数金属发生反应。
例如,与钠反应生成氯化钠,剧烈燃烧,发出黄色火焰;与铁反应生成氯化铁,产生棕褐色的烟;与铜反应生成氯化铜,产生棕黄色的烟。
2、与非金属反应氯气可以与氢气在光照或点燃的条件下发生反应,生成氯化氢。
纯净的氢气在氯气中安静地燃烧,发出苍白色火焰,瓶口有白雾产生。
3、与水反应氯气与水反应生成盐酸和次氯酸,化学方程式为:Cl₂+ H₂O ⇌HCl + HClO。
次氯酸具有强氧化性,能杀菌消毒,也具有漂白性。
4、与碱反应氯气能与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,这是实验室吸收多余氯气的常用方法。
反应方程式为:Cl₂+ 2NaOH = NaCl + NaClO + H₂O 。
氯气也能与氢氧化钙反应生成氯化钙、次氯酸钙和水,这是工业上制取漂白粉的原理。
5、与还原性物质反应氯气可以与许多具有还原性的物质发生反应,如碘化钾溶液,反应生成氯化钾和碘单质,使淀粉溶液变蓝。
三、氯气的制取1、实验室制法实验室通常用二氧化锰与浓盐酸在加热的条件下制取氯气,化学方程式为:MnO₂+ 4HCl(浓)=△= MnCl₂+ Cl₂↑ + 2H₂O 。
实验装置包括发生装置(固液加热型)、净化装置(除去氯化氢和水蒸气)、收集装置(向上排空气法或排饱和食盐水法)和尾气处理装置(用氢氧化钠溶液吸收)。
2、工业制法工业上通过电解饱和食盐水来制取氯气,化学方程式为:2NaCl +2H₂O =电解= 2NaOH + H₂↑ + Cl₂↑ 。
四、氯气的用途1、消毒杀菌由于氯气生成的次氯酸具有强氧化性,能杀死水中的细菌和病毒,所以在自来水厂中常用于消毒杀菌。
化学方程式总结

学考方程式归纳1、氯气的工业制法(氯碱工业):2NaCl+2H 2O Cl 2↑+H 2↑+2NaOH2、氯的实验室制法: MnO 2 +4HCl(浓) MnCl 2+Cl 2↑+2H 2O A.离子方程式:3、氯气的性质:A 、金属和氯气的反应:(1)铜丝在氯气中剧烈燃烧(棕色烟):Cu + Cl 2点燃CuCl 2(2)氯气和金属钠反应:2Na + Cl 2点燃2NaCl(3)铁在氯气中剧烈燃烧,产生棕褐色烟:2Fe + 3Cl 2点燃3FeCl 3(4)氢气在氯气中燃烧(苍白色火焰):H 2 + Cl 2点燃2HCl(5)氟气与氢气反应(黑暗处即可爆炸):H 2+F 2=2HF (6)钠在氯气中燃烧,产生白烟:2Na + Cl 2点燃2 NaClB 、氯气与水反应(6)氯气溶于水(新制氯水中含H + 、Cl -、ClO -、OH -、Cl 2、HClO 、H 2O )Cl 2 + H 2O = HCl + HClO B.离子方程式:新制氯水注入盛溴化钠溶液的试管中(7)Cl 2 + 2NaBr = Br 2 + 2NaCl Cl 2 + 2Br - = Br 2 + 2Cl - (8)Cl 2 + 2NaI = 2NaCl + I 2 Cl 2 +2I - =I 2 + 2Cl - (9)次氯酸见光分解(强氧化剂、杀菌消毒,漂白剂):2HClO 2HCl + O 2↑ C 、氯气和碱和的反应:(10)工业制漂白粉的原理:2Ca(OH)2 + 2Cl 2 =Ca(ClO)2 + CaCl 2 + 2H 2O 2Ca(OH)2 +2Cl 2 =2Ca 2++2ClO -+2Cl -+2H 2O (11)漂白粉长期置露在空气中失效的原理:Ca(ClO)2+CO 2+H 2O =CaCO 3↓+2HClO 2HClO HCl + O 2↑ (12)制漂白液(或氯气尾气处理): Cl 2 +2NaOH = NaCl + NaClO + H 2O 二、钠1、钠在空气中燃烧(黄色的火焰):2Na + O 2 Na 2O 22、钠块在空气中变暗 :4Na +O 2=2Na 2O3、Na 2O 在空气中加热(变黄):2Na 2O +O 2 △2Na 2O 24、钠与水反应(浮、熔、游、响、红):2Na + 2H 2O = 2NaOH + H 2 ↑光照 光照 通电电解5、电解熔融NaCl:2NaCl(熔融)====2Na + Cl2↑6、Na从钛、锆、铌等金属的氯化物中置换出金属单质:700-800℃TiCl4 + 4Na ========= Ti + 4NaCl三、Na2O 、Na2O2的相关反应:1、碱性氧化物Na2O与水的反应:Na2O+H2O=2NaOH2、过氧化钠与水的反应(放热反应、Na2O2是强氧化剂,可用于漂白)2Na2O2+2H2O =4NaOH +O2↑3、碱性氧化物Na2O与CO2的反应Na2O +CO2=Na2CO34、过氧化钠可用在呼吸面具和潜水艇中作为氧气来源(供氧剂),原因是:2Na2O2+2CO2=2Na2CO3+O25、Na2O +SO2=Na2SO3Na2O2+SO2=Na2SO46、Na2O +2HCl =2NaCl +H2O四、NaHCO3与Na2CO31、小苏打受热分解:2NaHCO3△Na2CO3+H2O +CO2 ↑2、固体氢氧化钠和碳酸氢钠混合物在密闭容器中加热NaHCO3+NaOH △Na2CO3+H2O3、若是氢氧化钠和碳酸氢钠溶液中反应有离子方程式:NaHCO3+NaOH =Na2CO3+H2O HCO3-+OH -=H2O +CO32-4、向NaOH溶液中通入少量CO2 :2NaOH + CO2 = Na2CO3 + H2O5、继续通入过量CO2 :Na2CO3 + CO2 + H2O = 2 NaHCO3总反应方程式:NaOH + CO2 = NaHCO36、苏打(纯碱)与盐酸反应:①盐酸中滴加纯碱溶液Na2CO3+2HCl =2NaCl +H2O +CO2↑ CO32-+2H+=H2O +CO2↑②纯碱溶液中滴加盐酸,至过量Na2CO3+HCl =NaHCO3+NaCl CO32-+H+=HCO3-NaHCO3+HCl=NaCl+H2O+CO2↑ HCO3-+H+=H2O +CO2↑7、(1)Na2CO3溶液、NaHCO3溶液与Ca(OH)2反应:Na2CO3+Ca(OH)2 =CaCO3↓+2 NaOHNaHCO3+Ca(OH)2(多)=CaCO3↓+NaOH +H2O2NaHCO3+Ca(OH)2(少)=CaCO3↓+Na2CO3+2H2O8、Na2CO3溶液、NaHCO3溶液与CaCl2反应:Na 2CO 3 +CaCl 2 = CaCO 3↓+2 Na Cl NaHCO 3溶液与CaCl 2 不反应;9、侯氏制碱法:NaCl + NH 3 + CO 2 + H 2O == NaHCO 3 + NH 4Cl2NaHCO 3 △Na 2CO 3 + H 2O +CO 2 ↑五、镁 1、3Mg+N 2Mg 3N 2 2Mg+O 22MgO (Mg 在空气中燃烧的主要反应) 2、2Mg+CO 22MgO+C (金属单质置换出非金属单质典型反应) 3、Mg+2H 2O (热)Mg(OH)2+H 2↑六、铁1、高炉炼铁——工业炼铁相关反应式:C + O 2 ===CO 2点燃高温C + CO 2 === CO高温3CO + Fe 2O 3=== 2Fe + 3CO 2高温CaCO 3 === CaO + CO 2↑高温CaO + SiO 2 ==== CaSiO 32、Fe 在氧气里灼烧:3Fe+2O 2Fe 3O43、铁与硫反应 Fe + S FeS4、铁与氧气反应 3Fe +2O 2 Fe 3O 45、铁在氯气中加热反应 2Fe +3Cl 2 2FeCl 36、高温下铁与水蒸气反应 : 3Fe + 4H 2O (g ) 高温Fe 3O 4 + 4H 2 7、铁的氧化物FeO 、Fe 2O 3 、Fe 3O 4溶于盐酸中: (1)FeO + 2HCl = FeCl 2 + H 2O(2)Fe 2O 3 + 6HCl = 2FeCl 3 + 3H 2O(3)Fe 3O 4 + 8HCl = FeCl 2 +2FeCl 3 +4H 2O8、Fe(OH)2 、Fe(OH)3 的制备:(1) FeSO 4 + 2NaOH = Fe(OH)2 ↓+Na 2SO 4 Fe 2+ + 2OH - = Fe(OH)2 ↓(2)FeCl 3 + 3NaOH = Fe(OH)3 ↓+3NaCl Fe 3+ + 3OH - = Fe(OH)3 ↓ (3)氢氧化亚铁在空气中被氧化(白色絮状沉淀迅速变成灰绿色,最后变为红褐色)C.化学方程式: (4)不稳定性:2Fe(OH)3 △Fe 2O 3 + 3H 2O 9、Fe 2+ 、Fe 3+ 之间的转化:(1)氯化亚铁溶液中通入氯气(或者加氯水):2FeCl 2 + Cl 2 = 2FeCl 3 2 Fe 2+ + Cl 2 = 2 Fe 3+ + 2Cl -(2)氯化铁溶液中加入铁粉:2FeCl3+Fe =3FeCl2 2Fe3++Fe =3Fe2+10、用KSCN检验Fe3+的存在:Fe3++3SCN-= Fe (SCN)3 (血红色溶液)11、D.印刷电路板:十、硅1、工业制单质硅相关反应:SiO2+2C 高温Si +2CO↑(粗硅的制取)Si +2Cl2高温SiCl4SiCl4+2H2高温Si(高纯硅)+4HCl↑2、硅单质与氢氟酸、Si +4HF = SiF4↑+ 2H2↑3、硅单质与NaOH溶液反应:Si + 2NaOH + H2O = Na2SiO3 +2H2↑4、Si及其化合物:5、二氧化硅(1)二氧化硅与氢氧化钠反应SiO2+2NaOH =Na2SiO3+H2O SiO2+2OH -=SiO32-+H2O (2)二氧化硅与氧化钙高温反应:SiO2 + CaO 高温CaSiO3(3)二氧化硅与氢氟酸反应:SiO2 + 4HF = SiF4↑+ 2H2O6、硅酸(H2SiO3)(1)往硅酸钠溶液中通入二氧化碳:Na2SiO3 + CO2 + H2O = Na2CO3 + H2SiO3↓(2)硅酸钠与盐酸反应:Na2SiO3 + 2HCl = 2NaCl + H2SiO3(胶体)(3)硅酸受热分解:H2SiO3△SiO2+H2O(4)工业制玻璃原理:SiO2 + Na2CO3高温Na2SiO3 + CO2↑SiO2 + CaCO3高温Ca SiO3 + CO2↑十一、硫1、硫与非金属:S + O2点燃SO2H2+ S △H2S2、硫与金属:Fe + S △FeS 2Cu + S△Cu2S3、二氧化硫与水反应:SO2+H2O H2SO3 2H2SO3+O2=2H2SO44、二氧化硫与碱反应:SO2+2NaOH=Na2SO3+H2O(少量SO2)SO2+NaOH=NaHSO3(足量SO2)5、二氧化硫与硫化氢气体反应:2H2S +SO2 = 3S↓+ 2H2O6、E.二氧化硫通入氯水中,离子方程式:7、F.SO2通入酸性高锰酸钾溶液中,离子方程式:催化剂8、二氧化硫被O2氧化:2SO2 + O22SO39、三氧化硫与水反应:SO 3 + H 2O = H 2SO 410、三氧化硫与碱反应:SO 3 + Ca(OH)2 = CaSO 4↓ + H 2O 11、硫化氢气体通入氯水:H 2S + 2Cl2==S ↓+2HCl12、工业制硫酸:4FeS 2+11O 22Fe 2O 3+ 8SO 2↑ 2SO 2+O 22SO 3SO 3+H 2O =H 2SO 413、实验室制取SO 2:Na 2SO 3+H 2SO 4(浓)=Na 2SO 4+H 2O+SO 2↑ 14、Cu+2H 2SO 4(浓)CuSO 4+ SO 2↑+2H 2O (也可用于实验室制备SO 2) 15、浓硫酸与木炭反应:C+2H 2SO 4(浓)CO 2↑+2SO 2↑+2H 2O有机化学方程式总结甲烷1.甲烷燃烧 2O 2+CH 4CO 2+2H 2O2.甲烷与氯气光照(①→②→③→④)分步 ①CH 4+Cl 2CH 3Cl+HCl ②CH 3Cl+Cl 2CH 2Cl 2+HCl ③CH 2Cl 2+Cl 2CHCl 3+HCl ④CHCl 3+Cl 2CCl 4+HCl3. 甲烷高温分解 CH 4C+2H 24.十六烷裂化:C 16H 34C 8H 18+C 8H 16乙烯1.乙烯燃烧 CH 2=CH 2+3O 22CO 2+2H 2O2.乙烯与溴水反应 CH 2=CH 2+Br 2CH 2BrCH 2Br (1,2-二溴乙烷)3.乙烯与水反应 CH 2=CH 2+H 2OCH 3CH 2OH4.乙烯与氢气、氯气、氟化氢反应 CH 2=CH 2+H 2CH 2CH 3 CH 2=CH 2+Cl 2CH 2ClCH 2Cl5.乙烯反应生成聚乙烯 nCH 2=CH 2 [CH 2 CH 2]n乙烯与氧气反应 2CH 2=CH 2+O 22CH 3CHOCH 2=CH 2+O 2CH 3COOH苯(1)氧化反应(与O 2的反应):2C 6H 6+15O 2 −−→−点燃12CO 2+6H 2O (2)取代反应:光照 点燃点燃光照光照 光照高温催化剂加热、加压催化剂催化剂 催化剂催化剂 催化剂催化剂催化剂十六烷 辛烷 辛烯① 与Br 2的反应:+ Br 2−−→−3FeBr+ HBr② 苯与硝酸: + HO-NO 2浓硫酸 △+ H 2O(3)加成反应用镍做催化剂,苯与氢发生加成反应:+ 3H 2−−→−催化剂乙醇1.乙醇与钠反应 2C 2H 5OH+2N a →2C 2H 5ONa+H 2↑2.乙醇燃烧 C 2H 5OH+3O 22CO 2+3H 2O3.乙醇催化氧化 总式 2C 2H 5OH+O 22CH 3CHO+2H 2O (催化剂为铜或银) 分式 2Cu+O 22CuO 2CuO+2C 2H 5OH 2Cu+2CH 3CHO+2H 2O 乙酸1.乙醛氧化 2CH 3CHO+O 22CH 3COOH 2.乙酸与镁反应 2CH 3COOH+Mg (CH 3COO)2Mg+H 2↑ 3.乙酸与氧化铜反应 2CH 3COOH+CuO(CH 3COO)2Cu+H 2O 4.乙酸与氢氧化钠反应 CH 3COOH+NaOH CH 3COONa+H 2O 5.乙酸与碳酸钠反应 2CH 3COOH+ Na 2CO 32CH 3COONa+H 2O+CO 2↑ 6.乙酸与乙醇反应CH 3CH 2OH+CH 3COOH H SO 24垐垐垐?噲垐垐?△浓CH 3COOCH 2CH 3+H 2O 酯1.乙酸乙酯与水反应 CH 3COOCH 2CH 3+H 2O CH 3CH 2OH+CH 3COOH2.乙酸乙酯与氢氧化钠反应 CH 3COOCH 2CH 3+ NaOH CH 3COONa+ CH 3CH 2OH3.油脂碱性水解:C 17H 35COOCH 2 CH 2—OHC 17H 35COOCH + 3 NaOH 3C 17H 35COONa+ CH —OHC 17H 35COOCH 2 CH 2—OH糖类1.葡萄糖与氧气反应 C 6H 12O 6+6O 26CO 2+6H 2O2.葡萄糖发酵 C 6H 12O 62C 2H 5OH+2CO 2↑酒化酶催化剂△ △△催化剂点燃稀H 2SO 4△ △NO 2 Br。
氯气的物理化学性质
氯气的物理化学性质氯气,化学式为Cl₂。
常温常压下为黄绿色气体,有强烈刺激性气味的有毒气体,密度比空气大,可溶于水,易压缩经压缩可液化为金黄色液态氯,是氯碱工业的主要产品之一,用作强氧化剂与氯化剂。
下面店铺给你分享氯气的物理化学性质,欢迎阅读。
氯气的物理性质状态通常情况下为有强烈刺激性气味的黄绿色的有毒气体。
密度氯气密度是空气密度的2.5倍,标况下ρ=3.21kg/m³。
易液化熔沸点较低,常温常压下,熔点为-101.00℃,沸点-34.05℃,常温下把氯气加压至600~700kPa或在常压下冷却到-34℃都可以使其变成液氯,液氯即Cl₂,液氯是一种油状的液体,其与氯气物理性质不同,但化学性质基本相同。
溶解性可溶于水,且易溶于有机溶剂(例如:四氯化碳),难溶于饱和食盐水。
1体积水在常温下可溶解2体积氯气,形成黄绿色氯水,密度为 3.170g/L,比空气密度大。
结构原子结构:氯原子最外层有7个电子,反应中易得到1个电子或共用一个电子对达到稳定结构(共价键)分子结构:氯分子为双原子分子,分子式Cl₂。
离子结构:氯离子最外层有8个电子,因而很稳定。
氯气的化学性质毒性氯气是一种有毒气体,它主要通过呼吸道侵入人体并溶解在黏膜所含的水分里,生成次氯酸和盐酸,对上呼吸道黏膜造成损伤:次氯酸使组织受到强烈的氧化;盐酸刺激黏膜发生炎性肿胀,使呼吸道黏膜浮肿,大量分泌黏液,造成呼吸困难,所以氯气中毒的明显症状是发生剧烈的咳嗽。
症状重时,会发生肺水肿,使循环作用困难而致死亡。
由食道进入人体的氯气会使人恶心、呕吐、胸口疼痛和腹泻。
1L空气中最多可允许含氯气0.001mg,超过这个量就会引起人体中毒。
金属1、金属钠在氯气中燃烧生成氯化钠。
现象:钠在氯气里剧烈燃烧,产生大量的白烟,放热。
2、铜在足量氯气中燃烧生成氯化铜。
现象:红热的铜丝在氯气里剧烈燃烧,瓶里充满棕黄色的烟,加少量水后,溶液呈蓝绿色(绿色较明显),加足量水后,溶液完全显蓝色。
化学方程式及离子方程式(总结)
点燃 △电解 四.学测考试化学方程式和离子方程式(学测必备材料4)一、钠及其化合物1、钠与氧气(常温): 4Na+O 2=2Na 2O2、钠与氧气(燃烧): 2Na+O 2 Na 2O 23、钠与水反应: 2Na+2H 2O =2NaOH+H 2↑ 2Na + 2H 2O = 2Na + +2OH - + H 2↑4、氧化钠与水反应: Na 2O+H 2O==2NaOH5、碳酸氢钠与氢氧化钠溶液: NaHCO 3 + NaOH== Na 2CO 3+ H 2OHCO 3- + OH - == CO 32- + H 2O6、碳酸氢钠与盐酸: HCl +NaHCO 3=NaCl+H 2O+CO 2↑HCO 3- + H + == CO 2↑ + H 2O7、碳酸氢钠固体加热: 2NaHCO 3 Na 2CO 3 + CO 2↑+ H 2O8、碳酸钠溶液通入二氧化碳: Na 2CO 3+CO 2+H 2O==2NaHCO 3 CO 32- + CO 2+H 2O==2HCO 3-9、大理石与与盐酸反应: CaCO 3+2HCl =CaCl 2+H 2O+CO 2↑CaCO 3 + 2H + == Ca 2+ + CO 2↑+ H 2O二、镁及其化合物 10、镁在氧气中燃烧: 2Mg+O 2 2MgO11、氯化镁溶液与石灰水: MgCl 2 + Ca(OH)2 = CaCl 2+ Mg(OH)2↓ Mg 2+ + 2OH - = Mg(OH)2↓12、氢氧化镁与盐酸反应: Mg(OH)2 + 2HCl = MgCl 2 +2H 2OMg(OH)2 + 2H + = Mg 2+ + 2H 2O 13、电解熔融氯化镁: MgCl 2 Mg + Cl 2↑14、碳酸镁与盐酸: MgCO 3 +2HCl = MgCl 2 + CO 2↑+ H 2OMgCO 3 + 2H + == Mg 2+ + CO 2↑+ H 2O三、铝及其化合物 (Al 2O 3是两性氧化物Al(OH)3是两性氢氧化物15、铝热反应: Fe 2O 3 + 2Al Al 2O 3+2Fe16、铝与盐酸: 2Al + 6HCl = 2AlCl 3 + 3H 2↑2Al + 6H + == 2Al 3+ + 3H 2↑17、铝与氢氧化钠溶液: 2Al+2NaOH+2H 2O =2NaAlO 2+3H 2↑ 2Al + 2OH - + 2H 2O =2AlO 2- + 3H 2↑18、氧化铝与盐酸: Al 2O 3+6HCl=2AlCl 3+3H 2O Al 2O 3 + 6H + = 2Al 3+ + 3H 2O19、氧化铝与氢氧化钠溶液: Al 2O 3+2NaOH =2NaAlO 2+H 2OAl 2O 3 + 2OH - =2AlO 2- + H 2O20、氢氧化铝与盐酸: Al(OH)3+3HCl=AlCl 3+3H 2OAl(OH)3 + 3H + =Al 3+ + 3H 2O21、氢氧化铝与氢氧化钠溶液: Al(OH)3+NaOH =NaAlO 2+2H 2OAl(OH)3 + OH - =AlO 2- + 2H 2O22、加热氢氧化铝: 2Al(OH)3 Al 2O 3+3H 2O 23、电解熔融氧化铝: 2Al 2O 3 4Al+3O 2↑ 点燃 △ 电解24、二氧化碳通入偏铝酸钠溶液中: NaAlO 2+CO 2+2H 2O =Al(OH)3↓+NaHCO 3CO 2 + AlO 2- + 2H 2O == Al(OH)3↓+ HCO 3-25、氯化铝与少量氢氧化钠溶液: AlCl 3+3NaOH =Al(OH)3↓+3NaClAl 3+ + 3OH - == Al(OH)3↓26、氯化铝与过量氢氧化钠溶液反应:AlCl 3 + 4NaOH = NaAlO 2+ 3NaCl + 2H 2OAl 3+ + 4OH - == AlO 2- + 2H 2O27、氯化铝与氨水: AlCl 3+3NH 3·H 2O =Al(OH)3↓+3NH 4Cl Al 3+ + 3NH 3.H 2O == Al(OH)3↓+ 3NH 4+28.明矾净水原理: Al 3++3 H 2O Al(OH)3(胶体) + 3H +四、铁及其化合物29、铁在与氯气中燃烧: 2Fe + 3Cl 2 2FeCl 330、铁在氧气中燃烧: 3Fe + 2O 2 点燃Fe 3O 431、铁与盐酸反应: Fe+2HCl =FeCl 2+H 2↑Fe + 2H + = Fe 2+ + H 2↑32、铁与氯化铁溶液: 2FeCl 3+Fe =3FeCl 2Fe + 2Fe 3+ == 3Fe 2+33、铜与氯化铁溶液: 2FeCl 3+Cu =2FeCl 2+CuCl 2Cu + 2Fe 3+ == 2Fe 2+ + Cu 2+34、氯化铁溶液与氢氧化钠溶液: FeCl 3+3NaOH == Fe(OH)3↓+ 3NaCl Fe 3+ + 3OH - == Fe(OH)3↓35、氯化铁溶液与硫氰化钾溶液: FeCl 3 + 3KSCN == Fe(SCN)3 + 3KClFe 3+ + 3SCN - == Fe(SCN)3(血红色)36、氯水(或氯气)与氯化亚铁溶液: Cl 2 +2FeCl 2 =2FeCl 3Cl 2 + 2Fe 2+ == 2Fe 3+ + 2Cl - 37、氧化铁与一氧化碳: Fe 2O 3 + 3CO △2Fe+3CO 238、氢氧化亚铁与氧气反应: 4Fe(OH)2 + O 2 + 2H 2O == 4 Fe(OH)339、氢氧化铁固体加热: 2F e(OH)3△Fe 2O 3 + 3H 2O (Al 、Fe 在冷、浓的H 2SO 4、HNO 3中钝化)五、铜及其化合物40、铜与氧气反应: 2Cu +O 2△2CuO 41、氢氧化铜固体加热: Cu(OH)2 △ CuO + H 2O42、氢氧化铜与硫酸反应: Cu(OH)2+H 2SO 4=CuSO 4+2H 2OCu(OH)2+ 2H + == Cu 2+ +2 H 2O六、硅及其化合物43、二氧化硅与氢氧化钠溶液: SiO 2+2NaOH =Na 2SiO 3+H 2O SiO 2 + 2OH - = SiO 32-+ H 2O44、二氧化硅与氢氟酸: 4HF+SiO 2=SiF 4↑+2H 2O45、工业上生产普通玻璃的反应: SiO 2+Na 2CO 3 高温Na 2SiO 3+CO 2↑点燃七、硫及其化合物46、硫与氧气:S+O2点燃SO247、二氧化硫被氧气氧化:2SO2+O2△2SO348、二氧化硫与水:SO2+H2O H2SO349、稀硫酸与氢氧化钡溶液:Ba(OH)2+ H2SO4= BaSO4↓ + 2H2OBa2+ + 2OH- + 2H+ + SO42- == BaSO4↓+ 2H2O50、浓硫酸与碳共热:2H2SO4(浓)+C △CO2↑+2SO2↑+2H2O(浓H2SO4只作氧化剂)51、浓硫酸与铜共热:Cu+2H2SO4(浓)△CuSO4+SO2↑+2H2O(H2SO4既表现氧化性又表现酸性)52、工业上接触法制硫酸(1)、以黄铁矿为原料:4FeS2+11O2催化剂△2Fe2O3+8SO22SO2+O2催化剂高温高压2SO3SO3+H2O==H2SO4八、氮气及其化合物53、工业氮气与氢气合成氨气:N2+3H2催化剂高温高压2NH354、氮气与氧气在放电条件下反应:N2+O22NO55、一氧化氮与氧气:2NO+O2=2NO256、二氧化氮与水:3NO2+H2O=2HNO3+NO57、实验室制NH3:2NH4Cl(固)+Ca(OH)2(固)△CaCl2+2NH3↑+2H2O58、氨与氯化氢:NH3+HCl=NH4Cl(白烟)59、氨气与水反应:NH3 + H2O NH3·H2O一水合氨电离NH3·H2O NH4+ + OH-(氨水呈碱性)或:NH3 + H2O NH3·H2O NH4+ + OH60、硝酸的见光、受热分解:4HNO3△4NO2↑+O2↑+2H2O61、稀硝酸与铜:3Cu+ 8HNO3=3Cu (NO3)2+2NO↑+4H2O3Cu +2NO3- + 8H+ == 3Cu2++ 2NO↑+ 4H2O 62、浓硝酸与铜:Cu+4HNO3(浓)==Cu(NO3)2+2NO2↑+2H2OCu +2NO3- + 4H+ == Cu2+ + 2NO2↑+ 2H2O63、浓硝酸与碳共热: 4HNO3(浓)+C △CO2↑+4NO2↑+2H2O64、工业氨的催化氧化制硝酸:(1). 4NH3+5O24NO +6H2O(2)2NO+O2==2NO2(3) 3NO2+H2O=2HNO3+NO九、氯、溴、碘及其化合物65、二氧化锰与浓盐酸共热(实验室制取氯气):4HCl(浓)+MnO 2△MnCl2+Cl2+2H2OMnO2 + 4H++ 2Cl-△Mn2+ + Cl2↑+ 2H2O66、氢气在氯气中燃烧:Cl2 +H22HCl (光照或点燃)67、氯气溶于水:Cl2+H2O HCl +HClOCl2+H2O H++Cl—+HClO68、氯水与碘化钾溶液反应:Cl2 +2KI= 2 KCl+ I2Cl2 + 2I- == 2Cl- + I269、氯气与氢氧化钠溶液反应:Cl2+2NaOH=NaCl+NaClO+H2OCl2 + 2OH- == Cl- + ClO- + H2O70、氯气与石灰乳反应(工业制取漂白粉):2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O71、漂白粉的漂白原理:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO十、原电池和电解池72、由铜、锌、稀硫酸构成的铜锌原电池(写出两极现象)电极反应式:正极:2H+ + 2e- == H2↑(有气泡放出)负极:Zn - 2e- == Zn2+(锌片溶解)电池总反应的化学方程式:Zn +H2SO4=ZnSO4+H2↑离子方程式:Zn + 2H+ == Zn2+ + H 2↑73、钢铁在潮湿的空气中发生电化学腐蚀电极材料:正极:碳,负极:铁正极:O2 + 2H2O + 4e - == 4OH-负极:2Fe - 4e- == 2Fe2+总反应式:2Fe + O2 + 2H2O == 2Fe(OH)2十一、烃74、甲烷与氯气混合光照:(取代反应)CH4 + Cl 2CH3Cl + HCl 等75、乙烯通入溴的四氯化碳溶液中:(加成反应)CH2=CH2 + Br2 CH2BrCH2Br(褪色)76、乙烯与氯化氢在催化剂作用下反应(加成反应):CH2=CH2 +HCl CH3CH2Cl77、乙烯与水在催化剂作用下反应生成乙醇(加成反应):CH2=CH2 + H2O CH3CH2OH78、乙烯在催化剂作用下生成聚乙烯(加聚反应):n CH2=CH279、苯与浓硝酸和浓硫酸的混酸共热(取代反应):+HO-NO2+ H2O十三、食品中的有机化合物80、乙醇的催化氧化(氧化反应):2CH3CH2OH+O2 2CH3COOH+2H2O81、乙醛的催化氧化:2CH3CHO + O 22CH3COOH82、.乙酸与乙醇发生酯化反应:CH3COOH + CH3CH2OH CH3COOCH2CH3 + H2O83、淀粉的水解:(C6H10O5)n (淀粉) + nH2O n C6H12O6(葡萄糖)Cu。
Cl的方程式
一、氯气(黄绿色气体,有毒)的化学性质1.与金属反应:因为氯气具有强氧化性,所以与金属反应生成高价的盐,写出氯气与钠、铜、铁反应的化学方程式:2Na +Cl 2 点燃 2NaCl Cu +Cl 2 点燃 CuCl 2 2Fe +3Cl 2 点燃 2FeCl 32.与非金属的反应:氯气可以在氢气中安静的燃烧,发出苍白色的火焰,瓶口有大量白雾,写出该反应的化学方程式:H 2+Cl 2 2HCl(任何发光、发热的剧烈的化学反应,都叫燃烧,不一定要有氧气参加)3.与水反应:1体积的水可溶解约2体积的氯气,氯气的水溶液被成为氯水。
写出常温下,溶于水中的部分氯气与水发生反应的化学方程式和离子方程式:Cl 2+H 2O=HCl+HClO Cl 2+H 2O=H ++Cl -+HClO (次氯酸)次氯酸具有强氧化性,因此次氯酸能杀死水中的病菌,起到消毒的作用。
氯水也因为含有次氯酸而具有漂白作用,干燥的氯气没有漂白性。
次氯酸是很弱的酸(比碳酸还要弱),不稳定,在光照或加热的条件下易分解放出氧气,写出该反应的化学方程式:2HClO +O 2↑ 4.与碱反应:(1)制漂白液:在常温下,将氯气通入氢氧化钠溶液中可以得到以次氯酸钠为有效成分.........的漂白液,写出该反应的化学方程式和离子方程式:Cl 2+2NaOH=NaCl +NaClO +H 2O Cl 2+2OH -=Cl -+ClO -+H 2O(2)制漂白粉:将氯气通入冷的消石灰中制得以次氯酸钙为有效成分.........的漂白粉,写出该反应的化学方程式:2Cl 2+2Ca(OH)2=Ca(ClO)2+CaCl 2+2H 2O漂白粉溶于水后,受空气中的二氧化碳的作用,即产生有漂白、杀菌作用的物质,这一反应的化学方程式为:Ca(ClO)2+H 2O +CO 2=CaCO 3↓+2HClO (此反应说明碳酸酸性比次氯酸强)5.与还原性物质反应:(1)将氯气通入到氯化亚铁溶液中,溶液由浅绿色变为黄色,写出该反应的化学方程式和离子方程式:2FeCl 2+Cl 2=2FeCl 3 2Fe 2++Cl 2=2Fe 3++2Cl -(2)氧化性Cl 2 >Br 2>I 2 ,氯气能把溴、碘从他们的盐溶液中置换出来,写出氯气通入溴化钾、碘化钾溶液的化学方程式和离子方程式:Cl 2 + 2KBr = Br 2 + 2KCl Cl 2 + 2Br -= Br 2 + 2Cl -Cl 2 + 2KI = I 2 + 2KCl Cl 2 + 2I - = I 2 + 2Cl -依此类推,写出溴水滴入碘化钾溶液中的化学方程式和离子方程式:Br 2+ 2KI = I 2 + 2KBr Br 2+ 2I - = I 2 + 2Br - 二、氯气的实验室制法1.实验室里通常用二氧化锰与浓盐酸加热反应制氯气,写出该反应的化学方程式和离子方程式:MnO 2+4HCl(浓)△2+2H 2O +Cl 2↑ MnO 2+4H ++2Cl- △ 2++2H 2O +Cl 2↑ 2.用上述方法制备的氯气,含有杂质氯化氢和水,通常用饱和食盐水和浓硫酸除杂。
高中化学必修二 第二章 钠及氯的化学方程式
高中化学无机反应★1、钠露置于空气中生成白色固体:4Na+O2= 2Na2O★2、钠在空气中燃烧(黄色的火焰):2Na+O2Na2O2(淡黄色固体)★3、钠在氯气中燃烧(白烟现象):2Na+Cl22NaCl★4、铜丝在氯气中剧烈燃烧(棕黄色的烟):Cu+Cl2CuCl2★5、铁在氯气中剧烈燃烧(棕褐色的烟):2Fe + 3Cl22FeCl36、铁在氧气中剧烈燃烧(火星四射,放出大量的热):3Fe +2O2点燃Fe3O4点燃2HCl★7、氢气在氯气中燃烧(苍白色火焰,瓶口有白雾):H2 + Cl2★8、钠与水反应(浮、熔、游、响、红):2Na + 2H2O =2NaOH + H2↑2Na + 2H2O = 2Na+ + 2OH - +H2 ↑9、氧化钠与氧气反应:2Na2O+ O2△2Na2O210、氧化钠与稀盐酸反应:Na2O+2HCl= 2NaCl + H2O(Na2O+2H+=2Na++ H2O)★11、钠与硫酸铜aq反应:2Na+2H2O+CuSO4=Cu(OH)2↓+Na2SO4+H2↑2Na+2H2O+Cu2+=Cu(OH)2↓+2Na++H2↑9、钠与氯化铁溶液反应:6Na+6H2O+2FeCl3=2Fe(OH)3↓+6NaCl+3H2↑6Na+6H2O+2Fe3+=Fe(OH)3↓+6Na++3H2↑★12、过氧化钠与水的反应(放热反应、Na2O2是强氧化剂,用于漂白。
)2Na2O2 + 2H2O = 4NaOH + O2↑2Na2O2 + 2H2O = 4Na+ + 4OH - +O2↑(Na2O2既是氧化剂又是还原剂)13、氧化钙与水的反应:CaO + H2O = Ca(OH)2★14、过氧化钠可用在呼吸面具和潜水艇中作为氧气来源,原因是:2Na2O2 + 2CO2 = 2Na2CO3 + O2 (Na2O2既是氧化剂又是还原剂)15、过氧化钠与稀盐酸的反应:2Na2O2 +4HCl= 4NaCl + 2H2O + O2↑2Na2O2 +4H+= 4Na+ + 2H2O + O2↑★16、苏打(纯碱)与盐酸反应:①盐酸中滴加纯碱溶液(有气泡):Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑CO32- + 2H+ = H2O + CO2↑②纯碱溶液中滴加少量盐酸(无气泡):Na2CO3 + HCl = NaHCO3 + NaCl CO32- + H+ = HCO3-★17、小苏打受热分解:2NaHCO3△Na2CO3 + H2O +CO2 ↑18、固体氢氧化钠和碳酸氢钠混合物在密闭容器中加热NaHCO3 + NaOH △Na2CO3 + H2O(若是溶液中反应有离子方程式):HCO3-+ OH - = H2O + CO32-★19、小苏打(碳酸氢钠)与盐酸反应:NaHCO3+ HCl=NaCl + H2O + CO2↑HCO3-+H+=H2O+CO2 ↑★20、饱和碳酸钠溶液通入CO2气体(晶体析出):Na2CO3+H2O+CO2=2NaHCO3↓★21、少量NaHCO3和Ca(OH)2的反应:NaHCO3+Ca(OH)2=CaCO3↓+H2O+NaOHHCO3-+OH-+Ca2+=CaCO3↓+H2O★22、足量NaHCO3和Ca(OH)2的反应:2NaHCO3+Ca(OH)2=CaCO3↓+2H2O+Na2CO32HCO3-+2OH-+Ca2+=CaCO3↓+2H2O+CO32-★23、氯气溶于水(新制氯水中含H+、Cl -、ClO -、OH-(少量)、Cl2、HClO、H2O):Cl2 + H2O = HCl + HClO Cl2 + H2O = H+ + Cl - + HClO★24、次氯酸见光分解(强氧化剂、杀菌消毒,漂白剂)2HClO2HCl + O2↑★25、氯气尾气的吸收原理:Cl2+2NaOH NaCl+NaClO+H2OCl 2+2OH-Cl-+ClO-+H2O★26、工业制漂白粉的原理(石灰乳与氯气反应)及漂白粉的失效:2Ca(OH)2 + 2Cl2 =Ca(ClO)2 + CaCl2 + 2H2O 2Ca(OH)2 + 2Cl2=2Ca2++2ClO- + 2Cl -+ 2H2O Ca(ClO)2 + CO2 + H2O=CaCO3↓+ 2HClO 2HClO2HCl + O2↑(此反应若在溶液中进行时有离子反应方程式):Ca2++2ClO- + CO2 + H2O=CaCO3↓+ 2HClO★27、氯气的实验室制法(仪器:分液漏斗,圆底烧瓶):MnO2 + 4HCl(浓) MnCl2 +Cl2↑+ 2H2OMnO2 + 4H+ +2Cl-Mn2+ + Cl2↑+ 2H2O★28、氯气通常用湿润的淀粉KI试纸检测:Cl2+ 2I-= I2+2Cl-29、溴水能使湿润的淀粉KI溶液变蓝:Br2+ 2I-= I2+2Br-(单质碘遇淀粉溶液变蓝色)★30、氯酸钾与浓盐酸反应:KClO3+6HCl(浓)=KCl+ 3Cl2↑+3H2O (ClO3-+6H++5Cl-=3Cl2↑+3H2O) ★31、高锰酸钾溶液与浓盐酸反应:2KMnO4+16HCl(浓)=2KCl+2MnCl2 +5Cl2↑+8H2O2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O32、次氯酸钙溶液与浓盐酸反应:Ca(ClO)2 +4HCl(浓)=CaCl2+2Cl2↑+2H2O2ClO-+4H++2Cl-=2Cl2↑+2H2O33、酸性高锰酸钾溶液中加入双氧水:2KMnO4+5H2O2+3H2SO4=K2SO4+2MnSO4+5O2↑+8H2O2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
氯气溶于水化学方程式
氯气在水中的溶解是一种化学反应,主要反应式如下:
1、氯气溶解在水中:
Cl2 (g)+H2O (l)→H+ (aq) + Cl- (aq)
2、氯气水解:
Cl2 (g) + H2O (l) →HOCl (aq) + H+ (aq)
3、氯气无水水解:
Cl2 (g) + e- → 2Cl- (aq)
这种反应不仅可以在化学实验中观察到,也可以在自然环境中发生。
它的物理性质表明,氯气在水中极易溶解,而且它的溶解度大于在空
气中的氯气溶解度。
在实验条件下,当氯气溶解在水中时,氯的活化
能降低,从而使氯能够更好地与水分子发生反应以形成氯离子。
因此,氯气在水中极易溶解,当氯气溶解在水中时,氯离子会极其清晰地分
离出来,使水中的细胞受到毒害。
此外,氯气水解反应可以产生苯磺酸,它可以作为抗菌剂和消毒剂使用。
氯气通过水解可以分解形成的苯磺酸对于对抗细菌感染和病毒有
较好的抑制效果,由此可以发现氯气水解紧贴人类生活,具有实际意
义。
最后,如果氯气接触到湿地、河流、湖泊和浅海,氯气可能会发生无
水水解。
当氯气接触水,氯气分子会接触电子媒介物质,形成氯离子,从而产生无水水解。
这使得水中的有害物质变得比浓度较低的水中更
活跃,更有害。
所以,含氯气的水不能直接排放到湿地,河流,湖泊
和浅海中,否则会破坏水的本质,从而使水污染加剧。
更多的是,氯气溶解在水中是一个复杂的反应过程,反应不但受到含
氯气物质的浓度、酸碱度、水温、光照强度等因素的影响,而且还受
到氯气分子相互作用的影响,还受到环境条件的影响,因此,在研究
氯气溶解在水中的过程时,必须考虑到这些因素,才可以得到有效的
反应结果。
总之,氯气溶于水是一个化学反应,它的化学方程式可以通过氯气溶
解在水中的反应、氯气水解的反应和氯气无水水解的反应过程来表示。
氯气溶解在水中结果受多种因素影响,如浓度、酸碱度、水温、光照
强度、氯气分子之间的作用以及环境条件等,因此,在研究其反应过
程时必须充分考虑这些因素。
