阿片受体与麻醉镇痛药
23麻醉性镇痛药及其拮抗药

第23章麻醉性镇痛药及其拮抗药所谓麻醉性镇痛药(narcotic analgesics, 或narcotics),通常是指作用于中枢神经系统能解除或减轻疼痛并改变对疼痛的情绪反应,剂量过大时则可产生昏睡的药物。
麻醉性镇痛药有时也称为阿片类药(opiates)。
按严格的定义,阿片类药是专指天然的阿片生物碱及其半合成的衍生物;而将能与阿片受体结合并产生不同程度激动效应的天然的或合成的物质则统称为阿片样物质(opioids)。
实际工作中往往将阿片类药和阿片样物质这两个名词混用。
麻醉性镇痛药的经典代表是吗啡。
这是阿片(opium)的天然生物碱,1803年由Serturner首次从阿片中分离出来,1925年由Gulland和Robinson 确定其化学结构。
Eisleb和Schauman于1939年合成的哌替啶是第一个合成的麻醉性镇痛药。
1942年合成的烯丙吗啡,首次发现有拮抗吗啡的作用。
近些年来,许多新的麻醉性镇痛药及其拮抗药相继合成,为临床麻醉提供了一系列可供选用的药物。
麻醉性镇痛药在临床麻醉中应用很广,可作为术前用药、麻醉辅助用药、复合全麻的主药,以及用于术后镇痛和其他疼痛治疗。
由于麻醉性镇痛药基本都可产生依赖性,必须按国家颁发的《麻醉药品管理条例》严加管理。
近年的研究发现,除阿片受体外,中枢神经系统还可通过其他机制产生镇痛效应,从而开发出一些非阿片类中枢性镇痛药,其中已在临床广泛应用的是曲马多,也在本章一并介绍。
第1节概述一、构效关系吗啡及其他有镇痛作用的阿片生物碱都具有Ⅰ、Ⅱ、Ⅲ三个环构成的氢化菲核(phenanthrene)作为基本骨架(图23-1a)。
吗啡的环Ⅰ的3位和环Ⅲ的6位分别有一个羟基,具有重要的药理作用。
3位羟基被甲氧基取代,成为可待因;3位和6位羟基均被甲氧基取代,成为蒂巴因,就改变了药物的性能。
环Ⅰ与环Ⅲ之间有氧桥相连。
此氧桥如被破坏,就形成阿朴吗啡,失去其镇痛效能而产生很强的催吐作用。
麻醉学-概述(疼痛、镇痛药的分类)

第一节 概述
一、疼痛(pain )
是多种原因(疾病、伤害刺激)所致的常见症状 使患者产生痛苦的感觉,影响病人情绪, 尤其是剧痛,还可引起生理功能紊乱, 甚至休克。适当选用镇痛药是必要的
疼痛的产生
外周
中枢
二、镇痛药分类
1、外周性镇痛药
解热镇痛药——作用外周(镇痛弱) 甾体类镇痛药(激素类)磷脂酶2抑制剂,减少花生四烯酸的产生 非甾体类镇痛药(nsaids) 主要的药理作用是抑制脂氧合酶(COX1-2)的活性 减少前列腺素的产生
在脑内、丘脑内侧、脑室及导水管周围灰质阿片受体密度高 这些结构与痛觉的整合及感受有关。 其他部位则与情绪、呼吸、胃肠活动等相关
早年认为,CNS内才有阿 片受体 近来的 研究还表明,中 枢神经系统以外也存在阿 片受体
2、阿片受体的分型
μ1受体:激动后产生脊髓以上水平的镇痛 μ2受体:激动以后产生呼吸抑制作用,心 率减慢,欣快感、依耐性 к受体: 激动后产生脊髓水平的镇痛,镇 静、缩瞳,轻度呼吸抑制 δ受体:激动后可调控μ受体的活性 σ受体:激动后产生烦躁不安,瞳孔散大, 幻觉、兴奋、呼吸频率增快、血压升高
使Mg2+的抑制膜去极化效应 保持,向超极化发展
3、内源性阿片样肽
正常机体内存在有内源性的阿片受体的激动剂: β-内啡肽( β-endorphin); 亮啡肽(leu-enkephin); 强啡肽(dynorphin)等
阿片受体和内源性阿片样物质的发现, 为解释麻醉性镇痛药的作用机理提供了十分重要的理论依据
内源性阿片样肽除来源于神经ቤተ መጻሕፍቲ ባይዱ统外, 免疫细胞(T、B淋巴细胞,单核细胞,巨细胞)也释放
甾体类
非甾体类
功能损害 损害
膜损害
阿片类镇痛药

(一)药理作用
曲马多
• 曲马多可与阿片受体结合,但其亲和力很
弱。
• 曲马多主要是克制神经元突触对去甲肾上
腺素旳再摄取,并增长神经元外5-羟色胺
浓度,从而影响痛觉传递而产生镇痛作用 。
(一)药理作用
曲马多
• 此药旳镇痛强度约为吗啡旳1/10。大剂量
可引起呼吸频率减慢,但程度较吗啡轻。
• 对心血管系统基本无影响。不引起缩瞳,也
• 目前临床上应用旳阿片受体拮抗药,主要
是纳洛酮,还有纳曲酮和纳美芬。
纳洛酮
• 该药拮抗麻醉性镇痛药旳强度大,拮抗谱广
静脉注射后 2~3min即产生最大效应,作用 连续时间约 45min;肌内注射10min产生最大 效应,作用连续时间约2.5~3h。
• 此药旳亲脂性很强,约为吗啡旳30倍,易于
透过血-脑脊液屏障,静脉注射后脑内药物 浓度可达血浆中浓度旳 4.6倍,而吗啡脑内 浓度仅为血浆中浓度旳 1/10。
吗啡因为对迷走神经旳兴奋作用和 对平滑肌旳直接作用,增长胃肠道平滑肌 和括约肌旳张力,减弱消化道旳推动性蠕 动,从而可引起便秘。吗啡可增长胆道平 滑肌张力,使奥狄括约肌收缩,造成胆道 内压力增长。
药理作用
吗啡
5.对泌尿系统作用
吗啡可增长输尿管平滑肌张力,并使膀胱 括约肌处于收缩状态从而引起尿储留。动 物试验中,吗啡可增长下丘脑一垂体系统 释放抗利尿激素(ADH),使尿量降低。
脉注射后5~10min呼吸频率减慢至最大程度,
连续约10min后逐渐恢复。剂量较大时潮气
量也降低,甚至呼吸停止.
药理作用
芬太尼
• 对心血管系统旳影响:不克制心肌收缩力,
一般不影响血压。芬太尼和舒芬太尼可引起 心动过缓。
去阿片化麻醉与镇痛的研究进展

㊃综述㊃去阿片化麻醉与镇痛的研究进展夏明㊀徐建国㊀㊀DOI:10.12089/jca.2020.09.018作者单位:200011㊀上海交通大学医学院附属第九人民医院麻醉科(夏明);东部战区总医院麻醉科(徐建国)通信作者:夏明,Email:xiaming1980@xzhmu.edu.cn㊀㊀研究表明阿片类药物滥用㊁误用产生系列严重问题,权衡其利弊,在麻醉与疼痛管理中阿片类镇痛药的合理使用引起广大国内外学者的重视[1]㊂尽管目前我国手术患者阿片类药物用量较低,但上升趋势明显,因此麻醉科医师应积极面对阿片类药物不良反应及滥用㊁成瘾问题㊂去阿片化麻醉(opioid⁃freeanesthesia,OFA)与镇痛技术是一种全新的麻醉理念,然而国内国际麻醉学界对其评价尚存在争议,本综述对OFA的优缺点及面临的问题挑战等研究的最新进展作一阐述㊂去阿片化麻醉技术概述阿片类药物用于缓解疼痛可追溯至17世纪,随着医疗的发展以及对阿片类药物的研究与研发,阿片类药物已经广泛应用于临床治疗中,尤其强效阿片类药物凭借其强大的镇痛作用,成为治疗术后疼痛㊁癌痛和慢性疼痛的主要药物㊂然而,阿片类药物是一把双刃剑,在带来有效镇痛作用的同时,也不可避免地带来其他不良反应,如呼吸抑制㊁恶心呕吐㊁痛觉过敏㊁免疫抑制㊁皮肤瘙痒㊁肌阵挛等㊂针对围手术期使用阿片类镇痛药带来的不良反应,Oderda等[2]回顾性研究319898例手术患者,其中12 2%的患者发生了上述不良反应,与未发生不良反应的患者比较,病情转归差㊁住院时间长㊁再住院率高,导致医疗费用增加,从而使患者满意度降低㊂近年来对阿片类药物的研究表明,围术期阿片类药物的应用可能与术后不良事件发病率与死亡率增加有关,也可能导致肿瘤患者的术后复发或转移㊂随着 舒适化医疗 概念的提出,医学界对疼痛管理也更加重视,希望可以在有效镇痛下,尽量避免或降低不良反应的发生㊂在这种背景下,OFA与镇痛技术应运而生㊂OFA是一种结合多种非阿片类药物和(或)技术的多模式麻醉策略,在不使用阿片类药物的情况下获得高质量麻醉[3]㊂阿片类镇痛药的作用机制是作用于阿片受体从而产生阻断痛觉神经的传导㊁传递㊂研究表明,这种抗伤害性感觉传导可以通过干扰各种神经介质来获得,并非只通过阿片类药物来实现,如静脉注射利多卡因可阻断钠通道和伤害性刺激引起的外周神经元放电,抑制NMDA受体,发挥镇痛㊁催眠作用和抑制自主神经系统(autonomicnervessystem,ANS)对手术应激的反应;非甾体抗炎药(NSAIDs)可减少50%吗啡的使用,NSAIDs与地塞米松均可产生镇痛作用;NMDA受体拮抗剂,氯胺酮能产生镇痛和催眠作用,并且可以防止术后痛觉过敏;α2受体激动剂(可乐定㊁右美托咪啶)刺激位于中枢神经系统的α2肾上腺素能受体,产生镇静㊁催眠㊁解焦虑㊁解交感和镇痛作用,是OFA的良好佐剂㊂此外,神经阻滞㊁针刺㊁局麻药局部浸润等技术都可提供镇痛作用㊂并且OFA完全契合加速康复外科(ERAS)理念,采用多模式麻醉与疼痛管理,能显著改善患者预后,降低患者术后不良反应的发生,促进患者康复[4]㊂去阿片化技术的优点在一项80例妇科腔镜手术的随机对照研究中,患者被随机分成两组:使用阿片类药物为O组,无阿片类药物组为OF组㊂主要预后指标为术后24h的QOR⁃40,次要预后指标为术后数字评分量表(NRS),首次抢救镇痛时间㊁抢救镇痛次数㊁术后恶心呕吐的发生率等㊂结果表明,OF组在不良事件方面明显优于O组,如改善第2天的生活质量㊁延长术后镇痛时间㊁降低术后恶心呕吐(postoperativenauseaandvomiting,PONV)发生率㊂此外,减少了对丙泊酚的需求,并保持了术中血流动力学稳定,减少PACU中阿片类药物的消耗[5]㊂在48例接受改良乳腺癌根治术的乳腺癌患者队列中,将OFA方案(包括利多卡因㊁布比卡因和右美托咪定以及丙泊酚诱导和异氟醚维持)与OA方案(包括注射吗啡和维库溴铵以及丙泊酚诱导和异氟醚维持)进行了比较,包括PONV发生率㊁在PACU中的停留时间㊁术后镇痛需求㊁VAS疼痛评分量表和欧洲生活质量Qol-5D问卷的生活质量评分,结果表明OFA方案优势明显,可显著提高患者满意度,缩短住院时间[6]㊂不仅在患者各类手术中,OFA可明显减少阿片类相关不良反应,对患儿的研究中也显示类似的结果㊂有学者对接受手部手术和扁桃体切除术的患儿进行研究,在OFA组中,PONV的发病率㊁术后镇痛药物的使用和达到出院标准的时间都较OA组有所减少[7-8]㊂除了在前瞻性研究中进行评估之外,去阿片化手术疼痛管理方法,对出现并发症的患者或不能使用阿片类药物方案的患者有益㊂例如,易患呼吸抑制的病态肥胖患者,阿片样物质诱发PONV的高风险患者㊁产后患者或阿片类物质诱发的谵妄患者均受益于此项技术[9]㊂对MarketScan数据库(包括急诊或住院期间使用阿片类药物的患者)的分析表明,处方中含有阿片类药物的患者较处方中无阿片类药物的患者产生的整体医疗资源利用成本高(49766美元vs19875美元)[10]㊂近年来研究表明,OFA可减少呼吸抑制㊁恶心呕吐等不良反应的发生率㊁减少术后阿片类镇痛药的使用㊁降低阿片类药物滥用和成瘾风险,还可改善患者预后,促进患者康复和功能恢复㊁缩短住院时间,从而减轻患者经济负担,提高医疗满意度,提高医疗资源利用率,降低医疗保健成本等㊂阿片类镇痛药可能促肿瘤转移与复发㊂晚期癌痛患者治疗的主要目的是镇痛,减轻患者不良体验,提高生活质量,延长生存期㊂吗啡作为经典和 金标准 的药物,一直是治疗癌痛和慢性痛的主要药物,同时也具有免疫抑制㊁便秘和成瘾等不良反应㊂这意味着长期应用吗啡等阿片类药物的癌痛患者,可能有尊严地摆脱癌痛打击,却难避免肿瘤扩散和转移的危险㊂研究表明,阿片类药物可能通过抑制细胞免疫㊁刺激血管生成等作用促进肿瘤细胞生长㊂因此,围术期阿片类药物的使用可能会影响癌症手术患者的长期转归㊂Cassinello等[11]研究表明,围术期使用阿片类药物能通过抑制巨噬细胞和B细胞等免疫细胞,产生细胞和体液的免疫抑制㊂一项动物实验研究表明,吗啡可通过激活MOR(μ阿片受体)和VEGF受体产生免疫抑制和促血管生成作用[11]㊂不仅如此,Neeman等[12]研究表明,无论在体内还是体外实验,吗啡均会促进雌激素受体(ER)阴性乳腺癌组织的血管生成和癌细胞生长㊂而曲马多虽也作用于μ受体,但没有免疫抑制作用㊂2005 2010年乳腺癌患者的回顾性分析的结果表明,乳腺癌患者术后用曲马多控制疼痛可明显降低术后复发和死亡率[13],且体外实验表明曲马多通过肾上腺素能受体途径抑制增殖㊁诱导凋亡以及对5⁃HT受体和TRPV1的作用等而发挥抗肿瘤作用㊂非阿片类镇痛药或技术可能对肿瘤转移与复发具有负向调节作用㊂OFA通过使用氯胺酮㊁右美托咪定㊁局麻药㊁神经阻滞等药物或技术代替阿片类药物的作用,通过节阿片作用实现负向调节肿瘤转移效应㊂Biki等[14]对患有侵袭性前列腺癌的手术患者的回顾分析,结果表明,通过硬膜外镇痛联合全身麻醉较阿片类药物联合全身麻醉的患者前列腺癌的复发率减少57%㊂研究分析,多数酰胺类局麻药不仅可减少阿片类镇痛药的使用,而且可通过抑制各种细胞因子生成或阻滞神经传导等多种途径,抑制肿瘤细胞增殖和转移,诱导其凋亡,从而产生抗肿瘤效应[15]㊂有学者对比了椎旁阻滞联合丙泊酚和基于阿片类药物全麻的乳腺癌切除术患者的血浆,结果表明,前者可明显抑制肿瘤细胞的进展[16]㊂但近期也有研究表明区域麻醉镇痛(椎旁阻滞和丙泊酚)与挥发性麻醉药(七氟醚)和阿片类药物比较,根治手术后乳腺癌复发并未减少,乳房切口持续疼痛比例和严重程度相似㊂临床医师既可以选择区域麻醉镇痛,也可以选择全身麻醉镇痛,并不影响乳腺癌复发和切口持续疼痛[17]㊂因此阿片类潜在促进肿瘤转移复发的作用仍需进一步深入研究㊂去阿片化技术的缺点阿片类药物在麻醉过程中,除了产生有效的镇痛作用外,还通过抑制交感神经系统来稳定血液动力学㊂一项胸部手术的临床对照试验表明,OFA组高血压事件发生率比阿片类药物麻醉组显著增多[18]㊂另一项OFA对心脏手术术后影响的回顾性研究中结果则表明,OFA可能与某些不良反应有关,如不良血流动力学事件发生率较高或有毒血浆水平引起的不良反应㊂去甲肾上腺素和抗高血压药的使用有增加的趋势,可能与丙泊酚用量的增加㊁乌拉地尔/尼卡地平的半衰期以及利多卡因的血管活性作用等因素有关[4]㊂最新研究表明,OFA在全膝或全髋关节置换术等骨科手术中不易维持血流动学稳定[19]㊂OFA的观点是避免术中使用阿片类药物将会带来更好的预后效果㊂在全身麻醉期间减少阿片类药物㊁伍用多种镇痛药可能会导致患者发生预料之外的特异性不良事件㊁药物相互作用和协同药物特异性不良事件[20]㊂不同镇痛药在作用机制㊁药效㊁疗效㊁不良反应及药物-药物相互作用等方面存在差异㊂如区域神经阻滞技术可能有局麻药过量中毒㊁出血等不良反应;非阿片类药物如非甾体抗炎药(NSAIDs)药物有镇痛封顶剂量,且可能与血小板功能异常㊁胃肠道功能减弱及出血以及肾功能异常有关;对乙酰氨基酚没有抑制血小板聚集㊁胃肠道蠕动㊁心血管活性及引发出血等一些NSAIDs相关的不良反应,但镇痛作用轻微,无抗炎作用[3]㊂目前缺乏准确的生物学监测指标来监测术中伤害感受㊂交感神经/副交感神经的平衡用于解决术中伤害刺激带来的不良事件㊂从阿片类药物麻醉向OFA麻醉的转变提出了伤害感受性监测的问题,即监测对麻醉和手术压力的病理生理反应[21]㊂目前 伤害感受 仍然经常被误解为 疼痛 ,但两者却有实质性差异,疼痛是一种令人不快的主观感受,伴或不伴有实质性组织损伤㊂伤害感受输入到达中枢神经系统会引起中枢敏感化,而中枢敏感化又会导致急性和持续性术后疼痛,麻醉科医师需要对术中伤害感受进行直接评估㊂因此,研发准确的术中伤害感受监测仪器是OFA面临的一大挑战[22]㊂小㊀㊀结OFA基于多模式麻醉和镇痛来避免使用阿片类镇痛药,不仅能避免产生阿片类药物相关不良反应,还能带来更多附加益处㊂从生理学上,术中使用阿片类药物虽可显著抑制患者疼痛体验,但伤害刺激已经形成,使用OFA可在伤害刺激传导通路中阻断伤害刺激上传,不仅能发挥镇痛作用,还可避免伤害刺激带来的一系列不良反应㊂因此,原理上OFA是利大于弊,切实可行的,但尚缺乏循证学依据来证实OFA的益处㊂基于现有研究表明OFA在患有肥胖㊁阻塞性睡眠呼吸暂停综合征或阿片依赖等患者手术中,可明显减少术后不良反应的发生,已证实其可行性㊂虽然已有研究表明OFA在胃食管癌㊁乳腺癌㊁前列腺癌等肿瘤患者麻醉与术后疼痛治疗中可降低肿瘤复发与死亡率,但OFA是否能减少肿瘤患者术后复发与转移,降低死亡率,以及其对肿瘤细胞负性调节的机制尚待完善,还需进一步研究[23]㊂随着近年来广大学者对阿片类药物与肿瘤关系的关注,大量研究数据提示阿片类药物通过不同的作用机制来促进肿瘤细胞的发生发展㊂因此,OFA在肿瘤患者手术的临床麻醉与镇痛中可能具有潜在的巨大优势,甚至在无法完全去除阿片类药物的临床路径中使用弱阿片化策略也可部分发挥去阿片化技术的优势作用㊂去/弱阿片化技术与肿瘤预后关系仍须进一步深入探讨和研究㊂参考文献[1]㊀BlancoC,VolkowND.ManagementofopioidusedisorderintheUSA:presentstatusandfuturedirections.Lancet,2019,393(10182):1760⁃1772.[2]㊀OderdaGM,GanTJ,JohnsonBH,etal.Effectofopioid⁃relatedadverseeventsonoutcomesinselectedsurgicalpatients.JPainPalliatCarePharmacother,2013,27(1):62⁃70.[3]㊀BeloeilH.Opioid⁃freeanesthesia.BestPractResClinAnaesthe⁃siology,2019,33(3):353⁃360.[4]㊀GuinotPG,SpitzA,BerthoudV,etal.Effectofopioid⁃freean⁃aesthesiaonpost⁃operativeperiodincardiacsurgery:aretrospec⁃tivematchedcase⁃controlstudy.BMCAnesthesiol,2019,19(1):136.[5]㊀KYKH,WZBW.Opioid⁃freetotalIntravenousanesthesiaim⁃provespostoperativequalityofrecoveryafterambulatorygyneco⁃logiclaparoscopy.AnesthEssaysRes,2019,13(2):199⁃203.[6]㊀TripathyS,RathS,AgrawalS,etal.Opioid⁃freeanesthesiaforbreastcancersurgery:anobservationalstudy.JAnaesthesiolClinPharmacol,2018,34(1):35⁃40.[7]㊀DeWindtAC,AsehnouneK,RoquillyA,etal.Anopioid⁃freeanaestheticusingnerveblocksenhancesrapidrecoveryafterminorhandsurgeryinchildren.EurJAnaesthesiol,2010,27(6):521⁃525.[8]㊀PestieauSR,QuezadoZM,JohnsonYJ,etal.High⁃dosedexme⁃detomidineincreasestheopioid⁃freeintervalanddecreasesopioidrequirementaftertonsillectomyinchildren.CanJAnaesth,2011,58(6):540⁃550.[9]㊀NassifGJ,MillerTE.Evolvingthemanagementofacuteperioper⁃ativepaintowardsopioidfreeprotocols:anarrativereview.CurrMedResOpin,2019,35(12):2129⁃2136.[10]㊀XieL,JoshiAV.,SchaafD,etal.Differencesinhealthcareutili⁃zationandassociatedcostsbetweenpatientsprescribedvs.non⁃prescribedopioidsduringaninpatientoremergencydepartmentvisit.PainPract,2014,14(5):466⁃256.[11]㊀CassinelloF,PrietoI,delolmoM,etal.Cancersurgery:howmayanesthesiainfluenceoutcome?JClinAnesth,2015,27(3):262⁃272.[12]㊀NeemanE,Ben⁃EliyahuS.Surgeryandstresspromotecancermetastasis:newoutlooksonperioperativemediatingmechanismsandimmuneinvolvement.BrainBehavImmun,2013,30(Sup⁃pl):S32⁃40.[13]㊀KimMH,OhJE,ParkS,etal.Tramadoluseisassociatedwithenhancedpostoperativeoutcomesinbreastcancerpatients:aret⁃rospectiveclinicalstudywithinvitroconfirmation.BrJAnaesth,2019,123(6):865⁃876.[14]㊀BikiB,MaschaE,MoriartyDC,etal.Anesthetictechniqueforradicalprostatectomysurgeryaffectscancerrecurrence:aretro⁃spectiveanalysis.Anesthesiology,2008,109(2):180⁃187.[15]㊀夏明,徐建国.麻醉药物与肿瘤转移.临床麻醉学杂志,2019,35(5):515⁃517.[16]㊀夏明,张咏梅,段满林,等.麻醉药物对乳腺癌细胞生长和转移的作用研究进展.临床麻醉学杂志,2017,33(8):816⁃818.[17]㊀SesslerDI,PeiL,HuangY,etal.Recurrenceofbreastcancerafterregionalorgeneralanaesthesia:arandomisedcontrolledtrial.Lancet,2019,394(10211):1807⁃1815.[18]㊀BelloM,OgerS,Bedon⁃CarteS,etal.Effectofopioid⁃freean⁃aesthesiaonpostoperativeepiduralropivacainerequirementafterthoracicsurgery:aretrospectiveunmatchedcase⁃controlstudy.AnaesthCritCarePainMed,2019,38(5):499⁃505.[19]㊀吴朋,冉小利,黄炳强,等.多学科合作疼痛管理对全髋关节和全膝关节置换术患者快速康复的影响.中华麻醉学杂志,2019,39(8):935⁃938.[20]㊀SteyaertA,Lavand hommeP.Preventionandtreatmentofchronicpostsurgicalpain:anarrativereview.Drugs,2018,78(3):339⁃354.[21]㊀Pogatzki⁃ZahnEM,SegelckeD,SchugSA.Postoperativepain⁃frommechanismstotreatment.PainRep,2017,2(2):e588.[22]㊀Lavand'hommeP.Opioid⁃freeanaesthesia:Pro:damnedifyoudon'tuseopioidsduringsurgery.EurJAnaesthesiol,2019,36(4):247⁃249.[23]㊀deOliveiraGS,AhmadS,SchinkJC,etal.Intraoperativeneuraxialanesthesiabutnotpostoperativeneuraxialanalgesiaisassociatedwithincreasedrelapse⁃freesurvivalinovariancancerpatientsafterprimarycytoreductivesurgery.RegAnesthPainMed,2011,36(3):271⁃277.(收稿日期:20190821)。
治疗疼痛的药物——阿片受体拮抗剂

阿片受体拮抗剂阿片受体拮抗剂本身对阿片受体并无激动效应,但对四受体有很强的亲和力,对K受体、8受体和。
受体也有一定的亲和力,可移除与这些受体结合的阿片类镇痛药物,从而产生拮抗效应。
目前的研究表明,阿片受体不仅存在于中枢神经系统,包括脑和脊髓,而且广泛存在于外周神经等部位。
一般的阿片受体拮抗剂全身应用对中枢和外周阿片受体均有作用,在拮抗阿片药物外周作用的同时,也减弱了中枢镇痛作用,主要包括纳洛酮、纳曲酮和纳美芬;而新型的外周阿片受体拮抗剂仅与外周阿片受体结合,与中枢阿片受体几乎不结合,可以拮抗阿片药物的外周作用,但不减弱阿片药物的中枢镇痛效应,主要包括甲基纳曲酮和Alvimopan。
一、纳洛酮(naloxone)纳洛酮又名N-烯丙去甲羟基吗啡酮(N-allyl-noroxymorphone)。
结构式为:H0分子式:C19H21NO4分子量:327.21纳洛酮拮抗阿片类药物的强度是烯丙吗啡的30倍,对中枢和外周阿片受体均有效,不仅可拮抗吗啡等纯阿片受体激动药,而且可拮抗喷他佐辛等阿片受体激动-拮抗药,但对丁丙诺啡的拮抗作用稍弱。
纳洛酮的亲脂性很强,约为吗啡的30倍,易于透过血-脑脊液屏障。
静脉注射后脑内药物浓度可达血浆浓度的4.6倍,而吗啡脑内浓度仅为血浆浓度的1/10。
纳洛酮的分布容积为1.81 L/kg,与血浆蛋白结合率为46%,主要在肝内与葡萄糖醛酸结合后随尿排出,清除率14〜30 ml/(kg-min)。
消除半衰期30〜78分钟。
由于在脑内的浓度下降迅速,故药效维持时间短。
静脉注射后2〜3分钟即可产生最大效应,作用持续时间约45分钟;肌内注射后10分钟产生最大效应,作用持续时间约2.5〜3小时。
纳洛酮主要应用于主要用于:①拮抗阿片药物急性中毒的呼吸抑制;②全麻的手术结束后,用以拮抗阿片药物的残余作用;③娩出的新生儿因受其母体中阿片药物影响而致呼吸抑制,可用纳洛酮拮抗;④纳洛酮可激发阿片药物成瘾者的戒断症状,具有诊断价值。
第二节 阿片类镇痛药
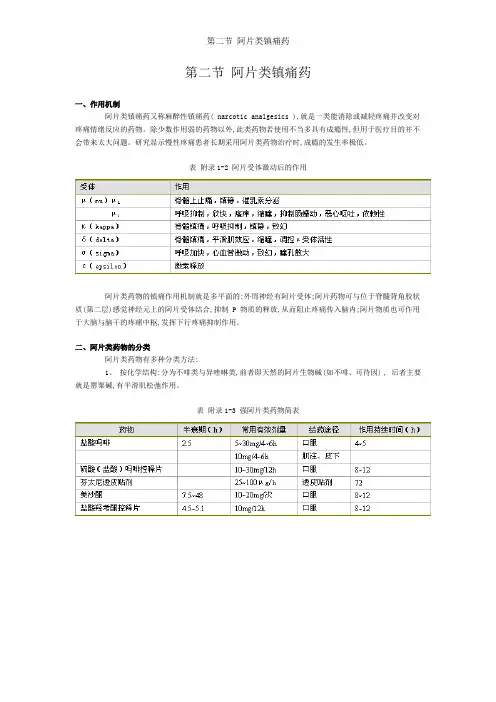
第二节阿片类镇痛药一、作用机制阿片类镇痛药又称麻醉性镇痛药( narcotic analgesics ),就是一类能消除或减轻疼痛并改变对疼痛情绪反应的药物。
除少数作用弱的药物以外,此类药物若使用不当多具有成瘾性,但用于医疗目的并不会带来太大问题。
研究显示慢性疼痛患者长期采用阿片类药物治疗时,成瘾的发生率极低。
表附录1-2 阿片受体激动后的作用阿片类药物的镇痛作用机制就是多平面的:外周神经有阿片受体;阿片药物可与位于脊髓背角胶状质(第二层)感觉神经元上的阿片受体结合,抑制 P 物质的释放,从而阻止疼痛传入脑内;阿片物质也可作用于大脑与脑干的疼痛中枢,发挥下行疼痛抑制作用。
二、阿片类药物的分类阿片类药物有多种分类方法:1、按化学结构:分为不啡类与异喹啉类,前者即天然的阿片生物碱(如不啡、可待因) , 后者主要就是罂粟碱,有平滑肌松弛作用。
表附录1-3 强阿片类药物简表表附录1-4 弱阿片类药物简表2、按来源该类药物可分为天然阿片类、半合成衍生物 ( 如双氢可待因,二乙酰不啡 ) 与合成的阿片类镇痛药。
合成药物又分为四类:①苯丙不啡烷类 (phenylpiperidine derivatives) ,如哌替啶、芬太尼等;②不啡喃类 (morphinenans) ,如左不喃;③苯异不啡烷类 (bengmorphans) ,如喷她佐辛;④二苯甲烷类 (diphenylmethanes) ,如美散酮。
3、按受体类型可分为μ、κ、δ受体,该三种受体的分子结构已被确定,并被成功克隆。
从功能上还可能存在ε与δ受体,并可能进一步分为μ 1 、μ 2 、κ 1 、κ 2 、κ 3 与δ 1 、δ 2 等亚型。
表 3-2 为受体激动后的药理作用。
4、按药理作用分,阿片类镇痛药又可分为激动药 ( 不啡、芬太尼、哌替啶等 ) ,激动一拮抗药( 喷她佐辛、纳布啡等 ) ,部分激动药(丁丙诺啡)与拮抗药 (纳洛酮等) 。
激动—拮抗药又称部分激动药,主要激动κ受体,对δ受体也有一定激动作用,而对μ受体则有不同程度的拮抗作用。
第二节 阿片类镇痛药
第二节阿片类镇痛药一、作用机制ﻫ阿片类镇痛药又称麻醉性镇痛药( narcotic analgesics ),就是一类能消除或减轻疼痛并改变对疼痛情绪反应得药物。
除少数作用弱得药物以外,此类药物若使用不当多具有成瘾性,但用于医疗目得并不会带来太大问题。
研究显示慢性疼痛患者长期采用阿片类药物治疗时,成瘾得发生率极低。
表附录1-2 阿片受体激动后得作用阿片类药物得镇痛作用机制就是多平面得:外周神经有阿片受体;阿片药物可与位于脊髓背角胶状质(第二层)感觉神经元上得阿片受体结合,抑制 P 物质得释放,从而阻止疼痛传入脑内;阿片物质也可作用于大脑与脑干得疼痛中枢,发挥下行疼痛抑制作用。
二、阿片类药物得分类1。
按化学结构:分为不啡类与异喹啉类,前者即天然得阿阿片类药物有多种分类方法: ﻫ片生物碱(如不啡、可待因) , 后者主要就是罂粟碱,有平滑肌松弛作用。
表附录1—3 强阿片类药物简表ﻫ表附录1-4 弱阿片类药物简表ﻫ2。
按来源该类药物可分为天然阿片类、半合成衍生物 ( 如双氢可待因,二乙酰不啡) 与合成得阿片类镇痛药。
合成药物又分为四类:①苯丙不啡烷类 (phenylpiperidinederivatives) ,如哌替啶、芬太尼等;②不啡喃类 (morphinenans) ,如左不喃;③苯异不啡烷类 (bengmorphans) ,如3。
按受体类型可分为μ、κ、喷她佐辛;④二苯甲烷类(diphenylmethanes) ,如美散酮。
ﻫδ受体,该三种受体得分子结构已被确定,并被成功克隆、从功能上还可能存在ε与δ受体,并可能进一步分为μ 1、μ 2 、κ 1 、κ 2 、κ 3与δ 1 、δ 2等亚型。
表 3-2 为受体激动后得药理作用。
4. 按药理作用分,阿片类镇痛药又可分为激动药 ( 不啡、芬太尼、哌替啶等) ,激动一拮抗药( 喷她佐辛、纳布啡等 ) ,部分激动药(丁丙诺啡)与拮抗药 (纳洛酮等) 。
ﻫ激动—拮抗药又称部分激动药,主要激动κ受体,对δ受体也有一定激动作用,而对μ受体则有不同程度得拮抗作用。
麻醉性镇痛药
常用阿片受体激动药
吗啡(morphine)
▪ 药理作用
呼吸系统
▪ 释放组胺和对平滑肌的直接作用 支气管痉挛 激发哮喘发作 肺血管阻力增加
▪ 抑制咳嗽反射 耐受清醒气管插管
•11
常用阿片受体激动药
吗啡(morphine)
▪ 药理作用
心血管系统
▪ 不影响心肌收缩力 ▪ 迷走神经兴奋-心率减慢 ▪ 外周血管扩张
•2
麻醉性镇痛药分类
▪ 按药物的来源
天然的阿片生物碱-吗啡,可待因。 半合成的衍生物-二乙酰吗啡(海洛因),双氢
可待因。 合成的麻醉性镇痛药
▪ 苯基哌啶-哌替啶,苯哌立啶,芬太尼族。 ▪ 吗啡南类-羟甲左吗南 ▪ 苯并吗啡烷类-喷他佐辛 ▪ 二苯甲烷类-美沙酮
•3
阿片类药物分类
▪ 按药物结合阿片受体
简介
▪ 麻醉性镇痛药(narcotic)
narcotic来源于希腊语,意为麻木或失活 泛指阿片类药吗啡或强效吗啡类镇痛药 目前最有效的镇痛药 消除或减轻疼痛并能改变对疼痛的情绪反应
•1
简介
▪ 麻醉性镇痛药主要指阿片受体激动剂 ▪ 阿片从草本植物罂粟未成熟的果实中提取的。 ▪ 阿片含20多种生物碱。 ▪ 阿片(opium)希腊语“浆汁”
与其他麻醉药合用
•21
常用阿片受体激动药
芬太尼(fentanyl)
▪ 临床应用
术前药 麻醉诱导
▪ 芬太尼最大效应给药后3-5分钟 ▪ 合用其他药物减轻插管反应 ▪ 药物组合技巧
麻醉维持
▪ 单次用药,选定时机。 ▪ 静注后持续时间30分钟
•22
常用阿片受体激动药
芬太尼(fentanyl)
▪ Байду номын сангаас床应用
药物化学4 镇痛药
吗啡6位醇羟基
异可待因 R = Me 5倍 6-乙酰吗啡 R = Ac 4倍
吗啡6位醇羟基
其他部位的修饰
将吗啡结构中7、8位双键氢化还原,6位醇羟 基氧化成酮称为氢吗啡酮 (Hydromorphinone),镇痛作用为吗啡 8~10倍;将氢吗啡酮的3位羟基甲基化得到氢 可酮(Hydrocodone)。
COH3H
CH2CH2CH3
HO
O
OMe
H3C N
COH3H
CH2CH2CH3
HO
O
OMe
埃托啡作用比吗啡强1000倍, 常被兽医用作大象、犀牛等大型动物的镇静剂
三、吗啡结构的简化 和合成镇痛药
吗啡喃类化合物
吗啡分子中去掉E环(呋喃环)后的衍 生物
吗啡喃类化合物比吗啡活性更强、作用 时间更长,但也有较高的毒性和一定的 依赖性
甲基化得到可待因 (Codeine)
乙基化得到乙基吗啡 (Ethylmorphine)
可待因 乙基吗啡
R = CH3 R = C2H5
吗啡6位醇羟基
吗啡6位醇羟基醚化或酯化镇痛作用增强,成 瘾性加强。
甲基化后称为异可待因(Heterocodeine,5 倍)镇痛作用增强,但因惊厥和毒性作用强, 无药用价值。
联合国麻醉药品委员会将毒品分为六大类:①吗啡型药物, 包括鸦片、吗啡、可待因、海洛因和罂粟植物等最危险的毒 品;②可卡因和可卡叶;③大麻;④安非他明等人工合成兴 奋剂;⑤安眠镇静剂,包括巴比妥药物和安眠酮;⑥精神药 物,即安定类药物。
2021/10/10
27
即使是一次使用毒品,也会改变脑功能
第二节_阿片类镇痛药
第二节阿片类镇痛药一、作用机制阿片类镇痛药又称麻醉性镇痛药( narcotic analgesics ),是一类能消除或减轻疼痛并改变对疼痛情绪反应的药物。
除少数作用弱的药物以外,此类药物若使用不当多具有成瘾性,但用于医疗目的并不会带来太大问题。
研究显示慢性疼痛患者长期采用阿片类药物治疗时,成瘾的发生率极低。
表附录1-2 阿片受体激动后的作用阿片类药物的镇痛作用机制是多平面的:外周神经有阿片受体;阿片药物可与位于脊髓背角胶状质(第二层)感觉神经元上的阿片受体结合,抑制 P 物质的释放,从而阻止疼痛传入脑内;阿片物质也可作用于大脑和脑干的疼痛中枢,发挥下行疼痛抑制作用。
二、阿片类药物的分类阿片类药物有多种分类方法:1. 按化学结构:分为吗啡类和异喹啉类,前者即天然的阿片生物碱(如吗啡、可待因) , 后者主要是罂粟碱,有平滑肌松弛作用。
表附录1-3 强阿片类药物简表表附录1-4 弱阿片类药物简表2. 按来源该类药物可分为天然阿片类、半合成衍生物 ( 如双氢可待因,二乙酰吗啡 ) 和合成的阿片类镇痛药。
合成药物又分为四类:①苯丙吗啡烷类 (phenylpiperidine derivatives) ,如哌替啶、芬太尼等;②吗啡喃类 (morphinenans) ,如左吗喃;③苯异吗啡烷类 (bengmorphans) ,如喷他佐辛;④二苯甲烷类 (diphenylmethanes) ,如美散酮。
3. 按受体类型可分为μ、κ、δ受体,该三种受体的分子结构已被确定,并被成功克隆。
从功能上还可能存在ε和δ受体,并可能进一步分为μ 1 、μ 2 、κ 1 、κ 2 、κ 3 和δ 1 、δ 2 等亚型。
表 3-2 为受体激动后的药理作用。
4. 按药理作用分,阿片类镇痛药又可分为激动药 ( 吗啡、芬太尼、哌替啶等 ) ,激动一拮抗药 ( 喷他佐辛、纳布啡等 ) ,部分激动药(丁丙诺啡)和拮抗药 (纳洛酮等) 。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
? 脂肪代谢:
– 糖皮质激素能加速脂肪组织中脂肪的分解,抑制其合
成。 – 分泌过多时,可使四肢皮下脂肪减少,还使脂肪重新分
布在面、颈、上胸部、背、腹及臀部,形成向心性肥胖。
? 对水盐代谢的影响:
内 分 泌 腺
第一节 肾上腺皮质激素类药物
肾 上 腺
髓质——肾上腺素 adrenaline 肾上腺
肾上腺皮质激素类药物
皮质
球状带——盐皮质激素 mineralocorticoids 束状带——糖皮质激素 glucocorticoids 网状带——性激素 sex hormones
[构效关系]
2
(Lip素ocortin
LC) 脂氧化
脂调素 胞) 巨皮素 肾皮素
Lipomodulin(中性粒细
macrocortin (巨噬细胞) renocortin (肾脏细胞)
酶
PG HPETE
PG LTs s
2.免疫抑制作用
感应期——抑制巨噬细胞对抗原的吞噬处理 增殖分化期——减少血液循环中的细胞因子、淋巴细胞 效应期——抑制细胞免疫、体液免疫、排斥反应、炎症 反应
[ 临床应用 ]
1. 替代疗法 肾上腺皮质功能不全症(如addison's disease)
2. 严重感染
3. 超敏反应性疾病(变态反应性疾病) 4. 抗休克 5. 血液系统疾病 6.局部用药
[ 不良反应 ] 1.长期大量用药 1)医源性肾上腺皮质功能亢进
2)诱发加重感染 3)诱发加重溃疡病 4)其它
– 对水的排除有影响,缺乏时会出现排水困难
? 对血细胞生成与破坏的影响:
– 增强骨髓对红细胞和血小板的造血功能。
? 对血管反应的影响:
– 提高血管平滑肌对去甲肾上腺素的敏感性,降低毛 细血管的通透性。
? 在应激反应中的作用:
– 环境中一切有害刺激,如感染、中毒、创伤等因素 作用于机体,可引起应激反应。此时,糖皮质激素 分泌相应增加,能增强机体的应激能力。
心肌抑 制
网状内 皮系统 抑制
内脏血 管持续 收缩
休克时MDF形成及糖皮质激素抗休克机制
4. 其它作用
血液系统:刺激骨髓造血 中枢神经系统:GABA减少,中枢兴奋
[ 体内过程 ]
1. 药物吸收途径多 2. 有特异性的血浆结合蛋白——皮质激素转运蛋白 CBG 3. GCS经肝脏代谢,代谢产物经肾脏排出
超生理剂量时, 影响物质的代谢,还可产生抗炎、免疫抑 制等药理作用。
?糖代谢:
正常量:对抗胰岛素,使血糖升高,维持血糖的正常水 平和肝脏与肌肉的糖原含量。
过量时:糖皮质激素可引起血糖明显升高,有加重或诱 发糖尿病的倾向。
?蛋白质代谢:
– 促进蛋白质分解,使氨基酸在肝中转变为糖原;加速 肌肉、皮肤、骨、淋巴腺、胸腺 等肝外组织的蛋白质 分解,抑制其合成。
诱导炎症抑制蛋白合成 nGRE途径 抑制细胞因子的产生与释放 抑制NOS活性 抑制活化蛋白1 (active protein-1, AP-1) 抑制中性粒细胞产生的纤溶酶原激活因子
2) 抑制肉芽组织形成 3) 诱导炎症细胞凋亡
致炎因子
糖皮质激素类药物
细胞膜磷脂
aspirin A 环氧酶A
PLA (-) 脂皮
骨自 质发 疏性 松骨
折
肌合影 肉响 萎创 缩口
愈
糖 胖向 男 尿心性
性化 肥
[ 用法及疗程 ]
1. 小剂量替代疗法 2. 大剂量冲击疗法 3. 一般剂量长程疗法 4. 隔日疗法
泼尼松
20mg/日 (按给剂量的10%减量)
第一阶段: 每2-4周减少2mg,经过10-20周 10mg/日;
第二阶段: 每月减少1mg,经过5个月 5mg/日;
第三阶段: 每月减少0.5mg,经过 5个月 停药。
强的 松
二、促皮质素、皮质激素抑制药 三、盐皮质激素 自学
第二节 胰岛素及口服降血糖药
胰腺
糖尿病分类 I型糖尿病 胰岛素依赖性糖尿病( insulin-dependent diabetes mellitus ), 自身 免疫机制引起?细胞破坏, 胰岛素分泌缺乏。 胰岛素(注射、埋植、口服) 基因工程细胞移植
甾核
肾上腺皮质激素基本结构
hydrocotiso ne
肾上腺皮质激素类药物 (1)
hydrocotiso ne
肾上腺皮质激素类药物 (2)
肾上腺皮质激素类药物 (3)
F F
一、糖皮质激素类药物 glucocorticoids, GCS
(一)糖皮质激素的生理功能
在生理情况下所分泌的糖皮质激素主要影响正常物质代 谢过程,是维持其自身稳定的重要物质;
3. 抗休克
改善微循环,加强心肌收缩力 抑制某些炎性因子的产生
提高机体对细菌内毒素的耐受力 稳定溶酶体酶,减少MDF形成
休克 BP
内脏血管代偿性 收缩 内脏血管灌注 降低
酸中 毒
低氧
溶酶体破 裂
缺血 糖皮质激素 类药物
蛋白水解
酶 组织蛋白酶 D
血浆蛋白(激肽
心肌抑制因子(MDF)
原)
心输出量降 低
2. 停药反应 1)医源性肾上腺皮质功能不全 2)反跳现象
下丘脑
用代 谢 作 不 良 反 应
腺垂
外源性糖皮质激
体
素
肾上腺皮
质
盐皮质激
糖皮质激
素 留水 排 排
钠 潴 钾钙
素 蛋白
糖 常脂 用雄
ห้องสมุดไป่ตู้
加 分质少 加合异 少 利 解 成生 用 增 减增 减
肪 分 离 异
激 素 作
压水 涨肌 肿无 高力 血腹
甾体类激素——基因表达学说 反应区
(二)糖皮质激素的药理作用
[作用机制] GCS与靶组织细胞内特异性受体结合,进而与核内
GRE或nGRE相互作用,使基因转录增加(诱导)或减少 (阻遏),改变靶组织蛋白质合成水平,从而产生抗炎、 抗免疫等效应。
[药理作用] 1. 抗炎作用 1) 抑制炎性介质、炎性细胞的产生与释放 GRE途径 增加脂皮素的合成与释放 诱导产生血管紧张素转化酶,降解缓激肽
第六章 激素类药物
教学目的:掌握糖皮质激素、胰岛素及口服降糖药 的药理作用、作用机制、临床应用、不良反应;了 解盐皮质激素及促肾上腺皮质激素的临床作用。 课时数:4 课时。
? 内分泌药理回顾
– 替代疗法 – 类固醇类似物研究的高潮 – 避孕药( 改变激素化构,防止肝脏破坏) – 内分泌抑制药( 硫脲类化合物) – 口服降糖药 – 激素对抗药( 三苯氧胺、米菲司酮)
