元素及其化合物的性质归纳整
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
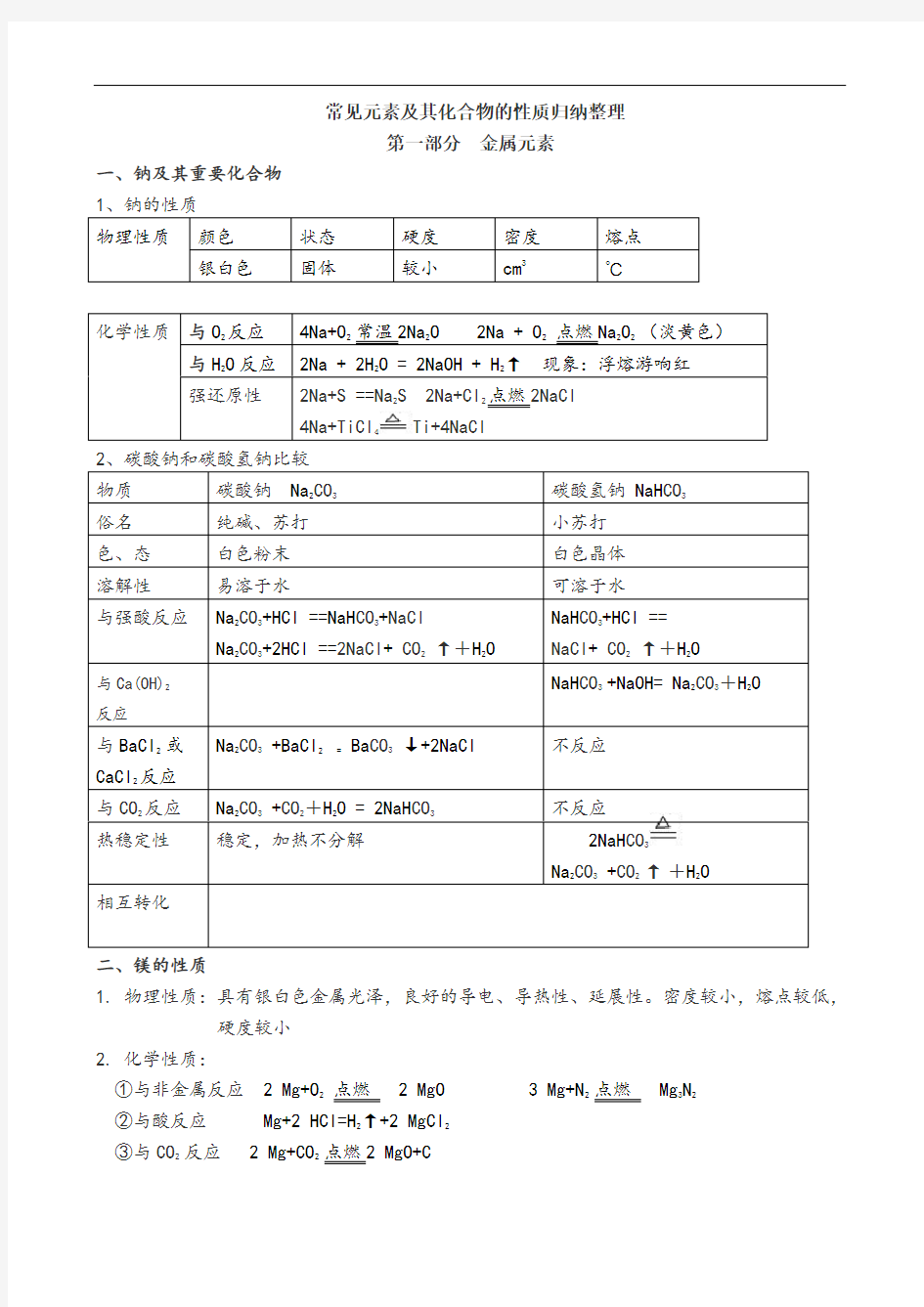
常见元素及其化合物的性质归纳整理
第一部分金属元素
一、钠及其重要化合物
1、钠的性质
物理性质颜色状态硬度密度熔点银白色固体较小cm3℃
化学性质与O
2反应4Na+O
2
常温2Na
2
O 2Na + O
2
点燃Na
2
O
2
(淡黄色)
与H
2O反应2Na + 2H
2
O = 2NaOH + H
2
↑现象:浮熔游响红
强还原性2Na+S ==Na
2S 2Na+Cl
2
点燃2NaCl
4Na+TiCl
4
Ti+4NaCl
物质碳酸钠Na
2CO
3
碳酸氢钠NaH CO
3
俗名纯碱、苏打小苏打色、态白色粉末白色晶体溶解性易溶于水可溶于水
与强酸反应Na
2CO
3
+HCl ==NaH CO
3
+NaCl
Na
2CO
3
+2HCl ==2NaCl+ CO
2
↑+H
2
O
NaH CO
3
+HCl ==
NaCl+ CO
2
↑+H
2
O
与Ca(OH)2
反应
NaH CO3 +NaOH= Na2CO3+H2O
与BaCl
2
或
CaCl
2反应
Na
2
CO
3
+BaCl
2 =
Ba CO
3
↓+2NaCl不反应
与CO
2反应Na
2
CO
3
+CO
2
+H
2
O = 2NaH CO
3
不反应
热稳定性稳定,加热不分解2NaH CO
3
Na
2CO
3
+CO
2
↑+H
2
O
相互转化
二、镁的性质
1. 物理性质:具有银白色金属光泽,良好的导电、导热性、延展性。密度较小,熔点较低,
硬度较小
2. 化学性质:
①与非金属反应 2 Mg+O
2 点燃 2 MgO
3 Mg+N
2
点燃Mg
3
N
2
②与酸反应Mg+2 HCl=H
2↑+2 MgCl
2
③与CO
2 反应 2 Mg+CO
2
点燃2 MgO+C
三、铝及其化合物的性质 1、铝的性质
①与非金属反应 4Al+3O 2 点燃 2 Al 2O 3 ②铝热反应 2Al+Fe 2O 3 高温 Al 2O 3+2Fe (焊接铁轨) ③与酸反应 2Al+6HCl == 2AlCl 3+3H 2 ↑ ④与碱反应 2Al+2NaOH+2H 2O == 2NaAlO 2+3H 2↑ 2、Al2O3(两性氧化物)
①与酸反应 Al 2O 3 +6HCl == 2AlCl 3 + 3H 2O Al 2O 3 + 6H + ==2Al 3+ + 3H 2O ②与碱溶液反应 Al 2O 3 + 2NaOH === 2NaAlO 2 + H 2O
Al 2O 3+ 2OH - === 2AlO 2-+ H 2O
3、Al(OH)3(两性氢氧化物)
①与酸反应 Al(OH)3 +3HCl ==AlCl 3 + 3H 2O ②与碱反应 Al(OH)3 + NaOH ===NaAlO 2 + 2H 2O ③受热分解 2Al(OH)3 Al 2O 3+ 3H 2O
④ 电离方程式 H + + AlO 2-+ H 2O Al(OH)3 Al 3+ + 3 OH -
4、Al(OH)3 制备
AlCl 3 +3NH 3·H 2O=Al(OH)3 ↓+3NH 4Cl NaAlO 2 +CO 2+ 2H 2O =Al(OH)3 ↓+ NaH CO 3 5、从铝土矿提取铝(优化32页) 酸溶法 碱溶法
四、铁及其化合物的性质 1、铁的性质
物理性质:纯净的铁是光亮的银白色金属,密度大,熔沸点高,有延展性、导热性和导电
性。
化学性质:
①与氧化性不太强的氧化剂反应,生成+2价化合物 如S .I 2.H +.Fe 3+.Cu 2+
Fe +CuSO 4 = Cu + FeSO 4 Fe +S 点燃FeS Fe +2Fe 3+ ===3 Fe 2+
Fe +2HCl == FeCl 2 + H 2↑
②与强氧化剂反应,生成+3价化合物 如Cl 2.Br 2.HNO 3.浓H 2SO 4(△)等氧化为Fe 3+。(若在溶液中反应,若铁过量还有可能生成Fe 2+)
2Fe +3Cl
2点燃 2FeCl
3
2、 Fe3+ 、 Fe2+相互转化
3、Fe3+ 、 Fe2+的检验方法
五、铜的化学性质
①与非金属单质反应
2Cu+O
2 2CuO Cu+Cl
2
CuCl
2
2Cu + S Cu
2
S
②与强氧化性酸反应
3Cu+8HNO
3 (稀) =3Cu(NO
3
)
2
+2NO↑+4H
2
O
Cu+4HNO
3(浓) = Cu(NO
3
)
2
+2NO
2
↑+2H
2
O
Cu + 2H
2SO
4
(浓) CuSO
4
+SO
2
↑+2H
2
O
③与非氧化性酸不反应,如盐酸、稀硫酸
第二部分非金属元素
一、C、H、O元素
氧气的性质
1. 氧气的物理性质:无色无味的气体,不易溶于水,密度比空气略大。
2. 氧气的化学性质:支持燃烧,有助燃性。可供呼吸用,是常用的氧化剂。
3 Fe + 2 O
2点燃 Fe
3
O
4
3. 制法①用双氧水制氧气:2 H
2O
2
MnO
2
2 H
2
O+ O
2
↑
②加热高锰酸钾 2 KMnO
4K
2
MnO
4
+MnO
2
+O
2
↑
③加热氯酸钾和二氧化锰的混合物 2 KClO
32 KCl +3 O
2
↑
④过氧化钠与水的反应2Na
2O
2
+2H
2
O=4NaOH+O2↑
氢气的性质
1.氢气的物理性质:无色无味的气体,极难溶于水,密度最小的气体
2. 氢气的化学性质
①可燃性: 2 H
2+ O
2
2 H
2
O
②还原性: H
2+CuO Cu+H
2
O
