常见缓冲溶液配制方法
最全 常见缓冲溶液配制办法

常见缓冲溶液配制方法乙醇-醋酸铵缓冲液(pH3.7):取5mol/L醋酸溶液15.0ml,加乙醇60ml和水20ml,用10mol/L 氢氧化铵溶液调节pH值至3.7,用水稀释至1000ml。
三羟甲基氨基甲烷缓冲液(pH8.0):取三羟甲基氨基甲烷12.14g,加水800ml,搅拌溶解,并稀释至1000ml,用6mol/L盐酸溶液调节pH值至8.0。
三羟甲基氨基甲烷缓冲液(pH8.1):?取氯化钙0.294g,加0.2mol/L三羟甲基氨基甲烷溶液40ml使溶解,用1mol/L盐酸溶液调节pH值至8.1,加水稀释至100ml。
三羟甲基氨基甲烷缓冲液(pH9.0):?取三羟甲基氨基甲烷6.06g,加盐酸赖氨酸3.65g,氯化钠5.8g,乙二胺四醋酸二钠0.37g,再加水溶解使成1000ml,调节pH值至9.0。
乌洛托品缓冲液:取乌洛托品75g,加水溶解后,加浓氨溶液4.2ml,再用水稀释至250ml。
巴比妥缓冲液(pH7.4):取巴比妥钠4.42g,加水使溶解并稀释至400ml,用2mol/L盐酸溶液调节pH值至7.4,滤过。
巴比妥缓冲液(pH8.6):取巴比妥5.52g与巴比妥钠30.9g,加水使溶解成2000ml。
巴比妥-氯化钠缓冲液(pH7.8):取巴比妥钠5.05g,加氯化钠3.7g及水适量使溶解,另取明胶0.5g加水适量,加热溶解后并入上述溶液中。
然后用0.2mol/L盐酸溶液调节pH值至7.8,再用水稀释至500ml。
甲酸钠缓冲液(pH3.3):取2mol/L甲酸溶液25ml,加酚酞指示液1滴,用2mol/L氢氧化钠溶液中和,再加入2mol/L甲酸溶液75ml,用水稀释至200ml,调节pH值至3.25~3.30。
邻苯二甲酸盐缓冲液(pH5.6):?取邻苯二甲酸氢钾10g,加水900ml,搅拌使溶解,用氢氧化钠试液(必要时用稀盐酸)调节pH值至5.6,加水稀释至1000ml,混匀。
枸橼酸盐缓冲液:取枸橼酸4.2g,加1mol/L的20%乙醇制氢氧化钠溶液40ml使溶解,再用20%乙醇稀释至100ml。
磷酸缓冲溶液的配制

磷酸缓冲溶液的配制
磷酸缓冲溶液的配制可根据所需的 pH 值和缓冲范围来决定。
以下是两种常见的配制方法:
1. 磷酸二氢盐-磷酸二氧化磷缓冲溶液(pH 5.8-7.4):
此缓冲溶液可在生物实验中常用。
首先配制0.1 M的磷酸二氢盐溶液(称为溶液 A),然后配制0.1 M的磷酸二氧化磷溶液(称为溶液 B)。
最后,根据所需的 pH 值用溶液 A 和溶液B 混合合适体积的两者来配制磷酸缓冲溶液。
- 溶液 A 的配制:将 13.6 g 磷酸二氢盐(H₂PO₄)溶解在 1 L 的去离子水中,将溶液调至 pH 7.4。
- 溶液 B 的配制:将 27.6 g 磷酸二氧化磷(Na₂HPO₄)溶解在 1 L 的去离子水中,将溶液调至 pH 7.4。
2. 磷酸二氢盐-磷酸一氢二钾缓冲溶液(pH 6.0-8.0):
此缓冲溶液常用于蛋白质电泳和酶反应等实验中。
首先配制0.1 M的磷酸二氢盐溶液(A 溶液),然后配制0.2 M的磷酸一氢二钾溶液(B 溶液)。
最后,根据所需的 pH 值用 A 溶液和 B 溶液混合合适体积的两者来配制磷酸缓冲溶液。
- A 溶液的配制:将 13.6 g 磷酸二氢盐(H₂PO₄)溶解在800 mL 的去离子水中,将溶液调至 pH 6.0。
- B 溶液的配制:将 44 g 磷酸一氢二钾(KH₂PO₄)溶解在200 mL 的去离子水中,将溶液调至 pH 8.0。
以上配制方法可根据具体需要进行调整,为了使pH 值更精确,还可以使用 pH 电极测量和调整。
另外,注意在配制缓冲溶液
时要使用高纯度的试剂和去离子水,以避免任何杂质对实验结果的影响。
常用缓冲溶液配制方法

附录二常用缓冲液的配制方法6.Na2HPO4-NaH2PO4缓冲液,pH5.8~8.0(25℃)pH,25℃Xml 0.2mol/L Na2HPO4Yml 0.2mol/L NaH2PO45.8 4.046.06.0 6.1543.856.29.2540.756.413.2536.756.618.7531.256.824.525.57.030.519.57.236.014.07.440.59.57.643.5 6.57.845.75 4.258.047.35 2.65Na2HPO4·2H2O,分子量178.05;0.2mol/L溶液含35.61g/LNa2HPO4·12H2O,分子量358.22;0.2mol/L溶液含71.64g/LNa2HPO4·H2O,分子量138.01;0.2mol/L溶液含72.6g/LNaH2PO4·2H2O,分子量156.03;0.2mol/L溶液含31.21g/L将Xml 0.2mol/L Na2HPO4·2H2O,与Yml 0.2mol/L NaH2PO4,用H2O稀释至100ml。
1.广范围的缓冲液(pH)pH混合液*0.2N NaOH pH混合液*0.2N NaOH(18℃)(ml)(ml)(18℃)(ml)(ml)2.6100 2.07.410055.82.8100 4.37.610058.63.0100 6.47.810061.73.21008.38.010063.73.410010.18.210065.63.610011.88.410067.53.810013.78.610069.34.010015.58.810071.04.210017.69.010072.74.410019.99.210074.24.610022.49.410075.94.810024.89.610077.65.010027.19.810079.35.210029.510.010080.85.410031.810.210082.05.610034.410.410082.95.810036.510.610083.96.010038.910.810084.96.210041.211.010086.06.410043.511.210087.76.610046.011.410088.76.810048.311.610092.07.010050.611.810095.07.210052.912.010099.6*混合液的配制:6.008克柠檬酸,3.893克磷酸二氢钾,1.769克硼酸和5.266克巴比妥酸混合溶于1000毫升蒸馏水中,上述四种成份在混合液中的浓度均为0.02875mol/L。
缓冲液配制方法
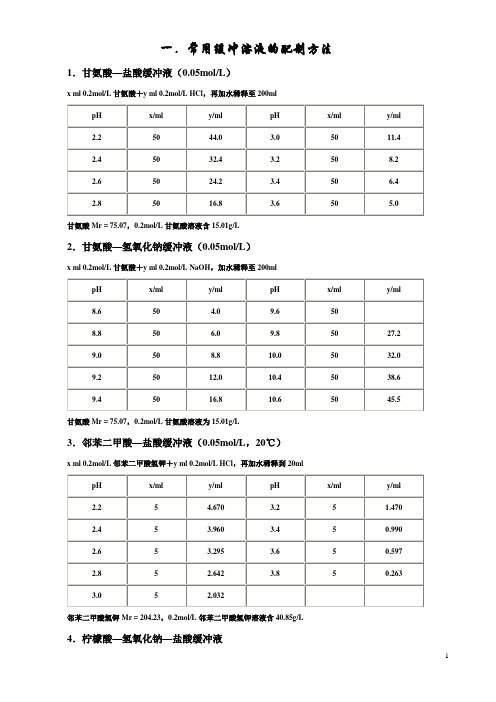
25.5
5.8
42.3
4.5
8.7
5.2
28.8
5.9
43.7
4.6
11.1
5.3
31.6
4.7
13.6
5.4
34.1
邻苯二甲酸氢钾Mr = 204.23,0.1mol/L溶液为20.42g/L
9.磷酸盐缓冲液
(1)磷酸氢二钠—磷酸二氢钠缓冲液(0.2mol/L)
pH
0.2mol/L
Na2HPO4/ml
pH
Na+浓度
/mol/L
柠檬酸/g
C6H8O7·H2O
氢氧化钠/g
NaOH(97%)
盐酸/ml
HCl(浓)
最终体积/L*
2.2
0.20
210
84
160
10
3.1
0.20
210
83
116
10
3.3
0.20
210
83
106
10
4.3
0.20
210
83
45
10
5.3
0.35
245
144
68
10
5.8
0.45
50
11.0
10.0
50
43.0
9.6
50
23.0
10.1
50
46.0
硼砂Na2B4O7·10H2O,Mr = 381.43,0.05mol/L溶液为19.07g/L
硼砂/ml
0.2mol/L
硼酸/ml
7.4
1.0
9.0
8.2
3.5
6.5
7.6
1.5
常用缓冲溶液的配置方法
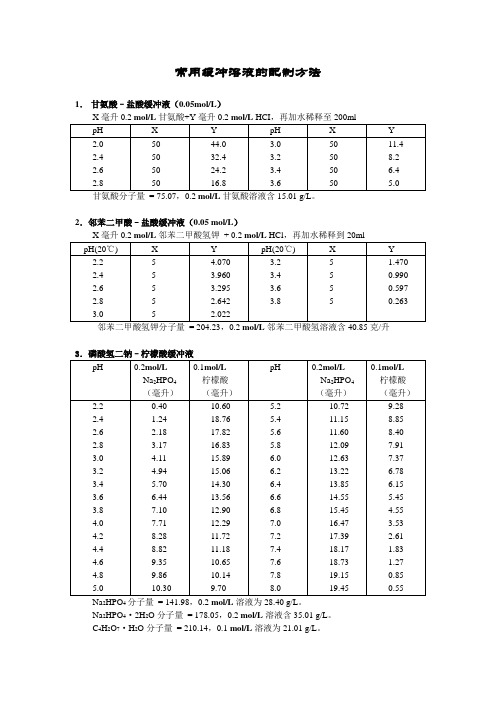
常用缓冲溶液的配制方法1.甘氨酸–盐酸缓冲液(0.05mol/L)2.邻苯二甲酸–盐酸缓冲液(0.05 mol/L)邻苯二甲酸氢钾分子量= 204.23,0.2 mol/L邻苯二甲酸氢溶液含40.85克/升3.磷酸氢二钠–柠檬酸缓冲液24Na2HPO4·2H2O分子量= 178.05,0.2 mol/L溶液含35.01 g/L。
C4H2O7·H2O分子量= 210.14,0.1 mol/L溶液为21.01 g/L。
① 使用时可以每升中加入1g 酚,若最后pH 值有变化,再用少量50% 氢氧化钠溶液或浓盐酸调节,冰箱保存。
6872柠檬酸钠Na 3 C 6H 5O7·2H 2O :分子量294.12,0.1 mol/L 溶液为29.41 g/L 。
227.磷酸盐缓冲液(1)磷酸氢二钠–磷酸二氢钠缓冲液(0.2 mol/L )Na2HPO4·2H2O分子量= 178.05,0.2 mol/L溶液为85.61克/升。
Na2HPO4·12H2O分子量= 358.22,0.2 mol/L溶液为71.64克/升。
Na2HPO4·2H2O分子量= 156.03,0.2 mol/L溶液为31.21克/升。
Na2HPO4·2H2O分子量= 178.05,1/15M溶液为11.876克/升。
KH2PO4分子量= 136.09,1/15M溶液为9.078克/升。
8.磷酸二氢钾–氢氧化钠缓冲液(0.05 mol/L)巴比妥钠盐分子量=206.18;0.04M 溶液为8.25克/升10.Tris –盐酸缓冲液(0.05M ,25℃)50毫升0.1M 三羟甲基氨基甲烷(Tris )溶液与X 毫升0.1N 盐酸混匀后,加水稀释至100吸收二氧化碳,使用时注意将瓶盖严。
11.硼酸–硼砂缓冲液(0.2M 硼酸根)硼砂Na 2B 4O 7·H 2O,分子量=381.43;0.05M 溶液(=0.2M 硼酸根)含19.07克/升。
常用缓冲溶液配制方法

常用缓冲溶液的配制方法1.甘氨酸–盐酸缓冲液(0.05mol/L)甘氨酸分子量= 75.07,0.2 mol/L甘氨酸溶液含15.01克/升。
2.邻苯二甲酸–盐酸缓冲液(0.05 mol/L)邻苯二甲酸氢钾分子量= 204.23,0.2 mol/L邻苯二甲酸氢溶液含40.85克/升3.磷酸氢二钠–柠檬酸缓冲液Na2HPO4分子量= 14.98,0.2 mol/L溶液为28.40克/升。
Na2HPO4·2H2O分子量= 178.05,0.2 mol/L溶液含35.01克/升。
C4H2O7·H2O分子量= 210.14,0.1 mol/L溶液为21.01克/升。
4.柠檬酸–氢氧化钠-盐酸缓冲液①使用时可以每升中加入1克克酚,若最后pH值有变化,再用少量50% 氢氧化钠溶液或浓盐酸调节,冰箱保存。
5.柠檬酸–柠檬酸钠缓冲液(0.1 mol/L)柠檬酸C6H8O7·H2O:分子量210.14,0.1 mol/L溶液为21.01克/升。
柠檬酸钠Na3 C6H5O7·2H2O:分子量294.12,0.1mol/L溶液为29.41克/毫升。
7.磷酸盐缓冲液242Na 2HPO 4·12H 2O 分子量 = 358.14,0.2 mol/L 溶液为71.628克/升。
NaH 2PO 4·2H 2O 分子量 = 156.01,0.2 mol/L 溶液为31.202克/升。
磷酸盐是生物化学研究中使用最广泛的一种缓冲剂,由于它们是二级解离,有二个pKa 值,所以用它们配制的缓冲液,pH 范围最宽:NaH 2PO 4: pKa1=2.12,pKa2=7.21; Na 2HPO 4:pKa1=7.21,pKa2=12.32配酸性缓冲液:用NaH 2PO 4,pH =1~4,配中性缓冲液:用混合的两种磷酸盐,pH =6~8, 配碱性缓冲液:用Na 2HPO 4,pH =10~12。
各种缓冲液的配制方法
各种缓冲液的配制方法缓冲液是一种用于调节溶液酸碱度(pH值)的溶液,它可以稳定溶液的pH值,满足实验的需要。
不同实验需要使用不同pH值的缓冲液,因此配制方法也会有所不同。
下面将介绍常见的几种缓冲液的配制方法。
1.磷酸盐缓冲液:磷酸盐缓冲液是最常用的一种缓冲液,在生物化学和分子生物学实验中广泛应用。
配制方法:-0.2M磷酸盐酸(pH2.5):用稀磷酸(H3PO4)溶液调节酸度至所需pH值。
-0.2M磷酸盐盐(pH2.5):用0.2M磷酸钠(Na2HPO4)溶液调节碱度至所需pH值。
-混合上述两种液体,按体积比例混合即可配制所需pH值的磷酸盐缓冲液。
2.乙酸缓冲液:乙酸缓冲液常用于酶催化反应的研究和生物制剂的稳定。
配制方法:-0.1M乙酸酸(pH3.6):用浓烧碱(CH3COOH)溶液调节酸度至所需pH值。
-0.1M乙酸盐(pH3.6):用0.1M乙酸钠(CH3COONa)溶液调节碱度至所需pH值。
-混合上述两种液体,按体积比例混合即可配制所需pH值的乙酸缓冲液。
3.碳酸氢盐缓冲液:碳酸氢盐缓冲液常用于生命科学实验中。
配制方法:-0.1M碳酸酸(pH6.0):用稀碳酸(H2CO3)溶液调节酸度至所需pH 值。
-0.1M碳酸盐(pH6.0):用0.1M碳酸氢钠(NaHCO3)溶液调节碱度至所需pH值。
-混合上述两种液体,按体积比例混合即可配制所需pH值的碳酸氢盐缓冲液。
4. Tris缓冲液:Tris缓冲液是一种多用途的缓冲液,在生物化学和分子生物学研究中广泛应用。
配制方法:- 0.1 M Tris酸(pH 8.0):用三羟甲基氨基甲烷(Tris)溶液调节酸度至所需pH值。
- 0.1 M Tris盐(pH 8.0):用0.1 M Tris盐溶液调节碱度至所需pH值。
- 混合上述两种液体,按体积比例混合即可配制所需pH值的Tris缓冲液。
配制缓冲液时需要准备所需浓度的酸液和盐液,然后根据所需pH值逐渐调整酸度和碱度至目标值。
常用缓冲溶液的配制方法
常用缓冲溶液的配制方法11.甘氨酸–盐酸缓冲液(0.05mol/L)2.邻苯二甲酸–盐酸缓冲液(0.05 mol/L)24Na2HPO4-2H2O分子量= 178.05,0.2 mol/L溶液含35.61克/升。
柠檬酸C4H2O7·H2O分子量= 210.14,0.1 mol/L溶液为21.01克/升。
浓盐酸调节,冰箱保存。
6872柠檬酸钠Na 3 C 6H 5O 7·2H2O :分子量294.12,0.1 mol/L 溶液为29.41克/毫升。
227.磷酸盐缓冲液242Na 2HPO 4·12H 2O 分子量 = 358.22,0.2 mol/L 溶液为71.64克/升。
Na 2HPO 4·H 2O 分子量 = 138.01,0.2 mol/L 溶液为27.6克/升 Na 2HPO 4·2H 2O 分子量 = 156.03,0.2 mol/L 溶液为31.21克/升。
242KH 2PO 4分子量= 136.09,1/15M 溶液为9.078克/升。
8.磷酸二氢钾–氢氧化钠缓冲液(0.05M )10.Tris –盐酸缓冲液(0.05M ,25℃)CHOCH2 NH2分子量=121.14;0.1M溶液为12.114克/升。
Tris溶液可从空气中吸收二氧化碳,使用时注意将瓶盖严。
2472硼酸H2BO3,分子量=61.84,0.2M溶液为12.37克/升。
硼砂易失去结晶水,必须在带塞的瓶中保存。
12.甘氨酸–氢氧化钠缓冲液(0.05M)13.硼砂-氢氧化钠缓冲液(0.05M硼酸根)247214.碳酸钠-碳酸氢钠缓冲液(0.1M)2+2+22N a HCO3分子量=84.01;0.1M溶液为8.40克/升。
元素的原子量表。
常用缓冲溶液的配制方法
常用缓冲溶液的配制方法1.甘氨酸–盐酸缓冲液(0.05mol/L)甘氨酸分子量= 75.07,0.2 mol/L甘氨酸溶液含15.01克/升。
2.邻苯二甲酸–盐酸缓冲液(0.05 mol/L)邻苯二甲酸氢钾分子量= 204.23,0.2 mol/L邻苯二甲酸氢溶液含40.85克/升3.磷酸氢二钠–柠檬酸缓冲液Na2HPO4分子量= 14.98,0.2 mol/L溶液为28.40克/升。
Na2HPO4·2H2O分子量= 178.05,0.2 mol/L溶液含35.01克/升。
C4H2O7·H2O分子量= 210.14,0.1 mol/L溶液为21.01克/升。
4.柠檬酸–氢氧化钠-盐酸缓冲液液或浓盐酸调节,冰箱保存。
柠檬酸C 6H 8O 7·H 2O :分子量210.14,0.1 mol/L 溶液为21.01克/升。
柠檬酸钠Na 3 C 6H 5O 7·2H 2O :分子量294.12,0.1 mol/L 溶液为29.41克/毫升。
6.乙酸–乙酸钠缓冲液(0.2 mol/L )Na 2Ac·3H 2O 分子量 = 136.09,0.2 mol/L 溶液为27.22克/升。
7.磷酸盐缓冲液Na 2HPO 4·2H 2O 分子量 = 178.05,0.2 mol/L 溶液为85.61克/升。
Na 2HPO 4·12H 2O 分子量= 358.22,0.2 mol/L 溶液为71.64克/升。
Na 2HPO 4·2H 2O 分子量 = 156.03,0.2 mol/L 溶液为31.21克/升。
Na 2HPO 4·2H 2O 分子量 = 178.05,1/15M 溶液为11.876克/升。
KH 2PO 4分子量 = 136.09,1/15M 溶液为9.078克/升。
8.磷酸二氢钾–氢氧化钠缓冲液(0.05M )9.巴比妥钠-盐酸缓冲液(18℃)巴比妥钠盐分子量=206.18;0.04M 溶液为8.25克/升10.T ris–盐酸缓冲液(0.05M ,25℃)50毫升0.1M 三羟甲基氨基甲烷(Tris )溶液与X 毫升0.1M 盐酸混匀后,加水稀释至100毫升。
常见缓冲溶液配制方法
常见缓冲溶液配制方法 Revised as of 23 November 2020常见缓冲溶液配制方法乙醇-醋酸铵缓冲液:取5mol/L醋酸溶液,加乙醇60ml和水20ml,用10mol/L 氢氧化铵溶液调节pH值至,用水稀释至1000ml。
三羟甲基氨基甲烷缓冲液:取三羟甲基氨基甲烷12.14g,加水800ml,搅拌溶解,并稀释至1000ml,用6mol/L盐酸溶液调节pH值至。
三羟甲基氨基甲烷缓冲液:取氯化钙0.294g,加L三羟甲基氨基甲烷溶液40ml 使溶解,用1mol/L盐酸溶液调节pH值至,加水稀释至100ml。
三羟甲基氨基甲烷缓冲液:取三羟甲基氨基甲烷6.06g,加盐酸赖氨酸3.65g,氯化钠5.8g,乙二胺四醋酸二钠0.37g,再加水溶解使成1000ml,调节pH值至。
乌洛托品缓冲液:取乌洛托品75g,加水溶解后,加浓氨溶液,再用水稀释至250ml。
巴比妥缓冲液:取巴比妥钠4.42g,加水使溶解并稀释至400ml,用2mol/L盐酸溶液调节pH值至,滤过。
巴比妥缓冲液:取巴比妥5.52g与巴比妥钠30.9g,加水使溶解成2000ml。
巴比妥-氯化钠缓冲液:取巴比妥钠5.05g,加氯化钠3.7g及水适量使溶解,另取明胶0.5g加水适量,加热溶解后并入上述溶液中。
然后用L盐酸溶液调节pH值至,再用水稀释至500ml。
甲酸钠缓冲液:取2mol/L甲酸溶液25ml,加酚酞指示液1滴,用2mol/L氢氧化钠溶液中和,再加入2mol/L甲酸溶液75ml,用水稀释至200ml,调节pH值至~。
邻苯二甲酸盐缓冲液:取邻苯二甲酸氢钾10g,加水900ml,搅拌使溶解,用氢氧化钠试液(必要时用稀盐酸)调节pH值至,加水稀释至1000ml,混匀。
枸橼酸盐缓冲液:取枸橼酸4.2g,加1mol/L的20%乙醇制氢氧化钠溶液40ml使溶解,再用20%乙醇稀释至100ml。
枸橼酸盐缓冲液:取%枸橼酸水溶液,用50%氢氧化钠溶液调节pH值至。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
常见缓冲溶液配制方法
1.醋酸/醋酸钠缓冲溶液:
醋酸/醋酸钠缓冲溶液具有较宽的酸碱度范围,在生物化学以及分析
化学实验中得到广泛应用。
其配制方法如下:
(1)准备一定浓度的醋酸溶液,可以采用浓缩醋酸与适量的水混合而成。
(2)根据所需的缓冲溶液pH值,计算所需浓度的醋酸钠。
(3)将计算所需的醋酸钠溶解在适量的去离子水中,得到所需的缓冲
溶液。
2.磷酸盐缓冲溶液:
磷酸盐缓冲溶液在生物化学以及分子生物学实验中常用于维持pH值。
以下介绍两种常见的磷酸盐缓冲溶液的配制方法:
(1)磷酸盐酸性缓冲液:
-准备所需的酸性磷酸盐缓冲液,将一定量的二氢磷酸钠溶解在适量
的去离子水中。
-根据所需的pH值,使用盐酸调节溶液的酸度,直至达到所需的pH 值。
(2)磷酸盐碱性缓冲液:
-准备所需的碱性磷酸盐缓冲液,将一定量的氢磷酸二钠溶解在适量
的去离子水中。
-根据所需的pH值,使用氢氧化钠调节溶液的碱性,直至达到所需的pH值。
3.碳酸盐缓冲溶液:
碳酸盐缓冲溶液在一些生物化学实验中用于控制pH值。
以下介绍两种常见的碳酸盐缓冲溶液的配制方法:
(1)酸性碳酸盐缓冲液:
-准备所需的酸性碳酸盐缓冲液,将一定量的二氧化碳通过气体输注器向含有一定浓度的NaHCO3溶液中通入,直至溶液中的二氧化碳饱和。
(2)碱性碳酸盐缓冲液:
-准备所需的碱性碳酸盐缓冲液,将一定量的Na2CO3溶解在适量的去离子水中。
4.三氯乙酸/氯化钾缓冲溶液:
三氯乙酸/氯化钾缓冲溶液在DNA和RNA等生物大分子的提取和纯化过程中常用作酶及细胞的裂解缓冲液。
以下是常见的三氯乙酸/氯化钾缓冲溶液的配制方法:
(1)将一定量的三氯乙酸和氯化钾溶解在适量的去离子水中,混合均匀。
(2)根据所需的缓冲溶液pH值,使用醋酸或氢氧化钾调节溶液的pH 值,直至达到所需的pH值。
5.甘氨酸缓冲溶液:
甘氨酸缓冲溶液在生物化学实验中常用于维持pH值,并在一些药物的制剂和生物制品的稳定性中得到应用。
以下是甘氨酸缓冲溶液的配制方法:
(1)准备一定浓度的甘氨酸溶液,将甘氨酸与适量的去离子水溶解。
(2)根据所需的缓冲溶液pH值,使用盐酸或氢氧化钠调节溶液的pH 值,直至达到所需的pH值。
需要注意的是,以上介绍的缓冲溶液配制方法仅作为参考,实际操作时应根据具体情况进行调整和优化。
此外,配制缓冲溶液时应注意使用优质的实验室试剂和去离子水,以确保配制的缓冲溶液质量的稳定性和可靠性。
