急性白血病的诊断分型和预后
2021年急性髓系白血病的规范化诊断和预后分层(全文)

2021年急性髓系白血病的规范化诊断和预后分层(全文)急性髓系白血病(AML)是一类严重危害人们健康的恶性血液病,其发病率随着年龄增加而增高,欧美国家AML发病率约为5.06/10万。
过去20年中,年龄<65岁的AML患者的预后得到极大改善,这得益于诊断和预后分层的进展、支持治疗的改进以及异基因造血干细胞移植(Allo-HSCT)供者来源缺乏这一世界性难题的解决。
越来越多的证据表明,规范化诊断和预后分层认识是实现AML患者的精准治疗或复发干预的前提和基础,本文重点讨论除急性早幼粒细胞白血病以外的AML诊断和预后分层。
一、AML诊断的规范化对于初诊的AML患者的检验和检查项目不仅包括确定诊断所需的项目,而且还包括其他项目,如生化、凝血分析和脑脊液检查等。
本文我们仅从形态学、免疫表型和分子遗传学等角度讨论AML规范化诊断(表1)。
表1 急性髓细胞白血病及相关肿瘤分类(WHO 2016)注:a表中的预后因素与治疗方法密切相关,随着治疗新方法的引入,预后因素也会随着变化1.形态学诊断:AML形态学诊断基于骨髓涂片计数500个有核细胞,其中髓系来源的原始细胞≥20%;这些细胞应包括原始粒细胞、原始单核细胞和/或幼稚单核细胞及原始巨核细胞,但不包括形态异常的成熟单核细胞。
按照世界卫生组织(WHO)的最新分类标准,计算原始细胞占有核细胞的比例时应该以骨髓全部有核细胞作分母。
骨髓涂片的细胞组化染色应包括苏丹黑B、髓过氧化物酶和酯酶染色等。
AML 初诊时还应人工分类计数外周血涂片200个有核细胞。
对于具有t (15;17)、t(8;21)、inv(16)或t(16;16)细胞遗传学异常的初诊患者而言,即使原始细胞的比例不足20%,仍可确定AML 的诊断。
此外,对于骨髓穿刺出现“干抽”的疑诊AML患者,骨髓活检是必需项目。
2.免疫表型分析:用于诊断AML的抗原标记如下:(1)髓系祖细胞表达CD34、CD117、CD33、CD13和HLA-DR;近年的研究提示可用CD38和CD123、CD133等来确定白血病干细胞,但白血病干细胞确定并未常规用于表型分析。
急性白血病的诊断与分型3

图81-4 单核细胞成熟过程中抗原的表达骨髓单核细胞的成熟可分为三个阶段。
第一个阶段与粒细胞基本相同。
第二阶段则不同于粒细胞,其HLA-DR抗原持续存在,CD11b迅速出现并很快达到高峰,CD45呈中等水平的表达,CD13和CD33逐渐升高而CD15仅呈低水平的表达。
第三阶段的单核细胞CD45和CD14的表达强度增强。
⒋巨核细胞标记巨核细胞在分化发育过程中主要表达血小板膜糖蛋白Ⅱb/Ⅲa,即CD41a(Ⅱb/Ⅲa)、CD41b(Ⅱb)和CD61(Ⅲa),CD42b(Ⅰb)出现,但血小板黏附于细胞上可造成假阳性。
另较晚。
CD41+和CD61+见于FAB-M7外一些标记如CD9、CD31、CD32、CD36也可有表达,但它与其它白细胞有交叉,所以不能作诊断标记。
正常⒌红细胞标记CD71、CD36和血型糖蛋白是红系标志,见于M6骨髓红系的抗原表达见图81-4。
图81-5 骨髓红系统成熟过程中抗原的表达骨髓红系统的成熟可分为三个阶段。
第一阶段的骨髓红系统CD45消失,CD71表达增强并达到高峰。
第二阶段的骨髓红系统CD71持续存在,并出现血型糖蛋白和血红蛋白的标记。
骨髓红系统的最后发展阶段表现为细胞核消失,CD71表达下降和网织红细胞中的RNA 片段的丢失,但血型糖蛋白持续存在。
需要说明的是,由于白血病细胞分化的高度异质性,各型之间及每一个亚型之间,以及亚型的不同病例其白血病细胞分化表达十分复杂,差异很大。
单克隆抗体并没有严格的系列性,以往认为是淋巴细胞的特异抗原,如CD7可与CD34共表达。
CD4亦可表达于单核细胞,因此CD4+见于M 4/M 5。
CD 2+见于M 4EO ,往往伴16号染色体异常。
M3时亦可有CD56+。
正常粒细胞可表达CD10。
㈥细胞遗传学检查近几年来,由于染色体分带技术的提高,尤其是高分辨技术的发展,对染色体异常(核型异常、数目异常)与某些急性白血病类型之间的关系已越来越密切,而且明确了某些亚型的标志性染色体异常。
白血病who分型诊断标准

白血病who分型诊断标准白血病是一种严重的血液病,多数白血病患者需要接受化疗、放疗、骨髓移植等治疗方案才能够生存。
白血病WHO分型诊断标准是一种反映白血病分类、病情评估以及治疗方案设计的标准,但这个标准究竟是什么呢?下面我们就来具体了解一下。
一、白血病WHO分型诊断标准的概述白血病WHO分型诊断标准是一个国际公认的白血病分类系统,其分类标准根据病变细胞的来源、分化程度以及生物学特征来确定。
它可以将白血病分为急性和慢性两大类,同时还包括淋巴细胞系和骨髓或淋巴系等多种分型。
不同类型的白血病不仅在临床表现、病理特征和预后上有所不同,同时也应该采用不同的治疗方案,对患者进行个体化的治疗。
二、白血病WHO分型诊断标准的分类白血病WHO分型诊断标准的分类主要依据白血病细胞来源、分类学及遗传学特征等因素而确定,其主要的分类包括下面几种。
1、急性淋巴细胞白血病(ALL)急性淋巴细胞白血病(ALL)是一种有较高发病率的急性白血病,约占所有儿童白血病的80%,同时还有成人发病率为25%。
ALL的分类主要依据白血病原细胞的不同来源,包括B细胞系和T细胞系。
2、慢性淋巴细胞白血病(CLL)慢性淋巴细胞白血病(CLL)是一种常见的老年人恶性疾病,通常发生在40岁以上的老年人中。
其分类的主要依据是从B淋巴细胞系中发生的肿瘤。
3、急性髓细胞白血病(AML)急性髓细胞白血病(AML)是一种急性的白血病,其病情会迅速加重,约占所有成人白血病发病率的80%。
其分类方法则是根据骨髓内非淋巴系统细胞分化成熟状态的不同决定的。
4、慢性髓细胞白血病(CML)慢性髓细胞白血病(CML) 是一种少见的白血病,通常发生在中年人和老年人中。
它的分类依据是在骨髓和外周血中都能发现一种特殊的白血病细胞——Philadelphia 染色体。
三、白血病WHO分型诊断标准的意义白血病WHO分型诊断标准在白血病的分类中起到非常重要的作用,不仅有助于更准确地进行白血病的诊断和治疗,还有利于对患者的生存期、预后等方面进行评估。
急性白血病的诊断与分型5

---------------------------------------------------------------最新资料推荐------------------------------------------------------急性白血病的诊断与分型4急性白血病的诊断与分型 4 ㈩病理形态学骨髓病理活检可较全面地了解骨髓造血的情况,可弥补骨髓穿刺局限性的不足,尤其是对骨髓增生极度活跃或增生减低,骨髓脂肪化、纤维化或合并骨髓坏死等情况下更适合做病理检查。
骨髓活检病理检查已作为急性白血病诊断中的一个重要指标。
三.急性白血病的分型 1975~1976 年,法国、美国、英国的 7 位血液学者在伦敦、巴黎先后观察了大量的血及骨髓标本,讨论并制订了急性白血病分型方案,称为 FAB分型。
他们将急性白血病分为淋巴细胞型和非淋巴细胞型(髓细胞白血病),前者可分为 L1、L2、L3,后者可分为 M1~M6。
后又经多次修改及补充,1985 年又将急性巨核细胞白血病划为M7,1991 年又提出急性髓细胞白血病未分化型(M0)。
FAB 分型方法已被国外广泛采用。
我国在 1978 年南宁的全国血液学会议上提出了关于白血病分型的建议,同年 12 月在广州召开的中华内科学会会议上又进行了修改。
1986年 9 月在天津会议上又对 ANLL 的分型进行了认真的修改补充,以使国内的诊断标准尽可能地与国外的 FAB 分型相吻合。
目前,急性白血病的 FAB 分型还在不断补充、修改、完善。
分型新的发展会对急性白血病的治疗、预后和生物学特性的研究1/ 20有更大的推动。
⒈按白血病细胞系可分为淋巴细胞型及非淋巴细胞型(髓细胞型)。
⒉急性白血病的亚型急性淋巴细胞白血病可分 L1、L2、L3 3 型。
急性非淋巴细胞白血病可分为 8 个亚型:即急性粒细胞白血病未分化型(M0)、急性粒细胞白血病未成熟型(M1)、急性粒细胞白血病部分成熟型(M2a、M2b)、急性颗粒增多的早幼粒细胞白血病(M3a、M3b)、急性粒-单核细胞白血病(M4a、M4b、M4c、M4E0)、急性单核细胞白血病(M5a、M5b)、急性红白血病(M6)、急性巨核细胞白血病(M7)。
急性白血病(临床医学概要)

易出血和淤血
减少血小板和凝血因子导致患者 容易出现淤血和淤血斑点。
急性白血病的实验室检查和诊断依据
血液检查
包括血常规、骨髓涂片、骨髓 穿刺和活检,可以确定白血病 的类型和程度。
遗传学检查
检查染色体异常、基因突变和 表达,提供诊断和治疗依据。
免疫学检查
通过检测白血病细胞的表面标 记物和抗原来辅助诊断。
急性白血病(临床医学概 要)
欢迎参加本次关于急性白血病的临床医学概要的演讲。我们将探讨急性白血 病的定义、分类、病因和发病机制,以及典型症状和体征。我们还将介绍实 验室检查、诊断依据,不同的治疗方法,以及预后评估。
急性白血病的定义
1 白血病病状复发
通过异常增殖和累积未成熟的白细胞,导致血液功能丧失,恶化患者的健康状况。
急性白血病的病因和发病机制
病因 基因突Байду номын сангаас 环境暴露
遗传因素
发病机制 异常基因表达导致血细胞分化和增殖异常。 暴露于致癌物质或高剂量放射线可导致白血病发 生。 某些遗传突变可增加患白血病的风险。
急性白血病的典型症状和体征
疲劳和虚弱
患者常感到疲劳和虚弱,无法恢 复精神和体力。
贫血
由于骨髓功能受损,造成红细胞 减少,导致贫血症状。
复发
白血病细胞再次增生,治疗失败,预后较差。
2 血液恶性肿瘤
一种血液系统中的恶性肿瘤,起源于造血干细胞,并累积在骨髓和外周血中。
急性白血病的分类
AM L
急性髓系白血病,最常见的类 型。由于骨髓干细胞的异常增 殖和成熟障碍而引起。
A LL
急性淋巴细胞白血病,主要发 生在淋巴细胞前体。发病年龄 多在儿童和年轻成年人。
其他亚型
白血病分型及诊断标准

白血病分型及诊断标准白血病是一种由于骨髓中某些白细胞异常增生而导致的恶性血液疾病。
它是一种高度复杂的疾病,分为多种不同的类型和亚型。
对于正确诊断和治疗白血病,准确分型是非常重要的。
本文将深入探讨白血病的分型及其诊断标准,并提供相关观点和理解。
为了更好地了解白血病的分型和诊断标准,我们首先需要了解白血病的基本概念。
白血病是一种造血系统的恶性疾病,主要表现为骨髓中异常增生的白细胞,这些白细胞数量过多,发育不成熟或功能异常。
根据白细胞的分化程度和特征,白血病可以分为急性白血病和慢性白血病两大类。
急性白血病是一类进展迅速的白血病,骨髓中存在大量未成熟的白细胞,这些白细胞无法正常发挥其功能,并且会抑制正常造血细胞的产生。
急性白血病通常分为急性淋巴细胞白血病(ALL)和急性髓系白血病(AML)两大类。
急性淋巴细胞白血病(ALL)是一种由淋巴细胞前体异常增生导致的白血病。
它可发生在儿童和成人身上,儿童ALL占所有儿童肿瘤的25%,成人ALL则较为罕见。
ALL的诊断标准主要基于骨髓和外周血液中异常淋巴细胞比例的检测及免疫分型。
根据世界卫生组织(WHO)的分类标准,ALL通常被分为B细胞型和T细胞型。
B细胞型ALL占所有ALL患者的大部分,而T细胞型ALL较为罕见。
急性髓系白血病(AML)是一种由骨髓中异常增生的髓系细胞引起的白血病。
与ALL不同的是,AML主要发生在成年人身上,尤其是中老年人。
AML的诊断主要依据骨髓中异常细胞的形态学特征和免疫分型。
根据WHO的分类标准,AML根据细胞学分类、分子遗传学和临床表现可分为多个亚型。
慢性白血病是一类进展缓慢的白血病,相对于急性白血病而言,慢性白血病的白细胞增生相对成熟,功能也相对正常。
慢性白血病一般分为慢性淋巴细胞白血病(CLL)和慢性髓细胞白血病(CML)两大类。
慢性淋巴细胞白血病(CLL)是一种由成熟淋巴细胞异常增生导致的白血病。
CLL通常发生在中老年人身上,很少影响年轻人和儿童。
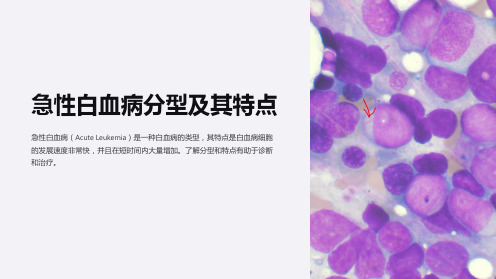
急性白血病分型及其特点
预后因素
一些预后因素包括年龄、白血病细胞的遗传异常和 治疗反应等,它们会对患者的预后产生影响。
急性白血病分型及其特点
急性白血病(Acute Leukemia)是一种白血病的类型,其特点是白血病细胞 的发展速度非常快,并且在短时间内大量增加。了解分型和特点有助于诊断 和治疗。
急性白血病的定义和背景
急性白血病是一种骨髓中恶性白血病细胞异常增生的疾病。它会影响造血系统,导致正常细胞的数量减少,而 白血病细胞的数量迅速增加。
克隆异常
淋巴细胞发生了遗传异常,导致其无法正常发育,从而形成了白血病细胞。
增殖速度快
淋巴母细胞迅速增殖,使其在骨髓中的比例迅速增加,抑制了正常造血细胞的产生。
急性髓系细胞白血病的特点
骨髓受侵
急性髓系细胞白血病以骨髓为中 心,造血系统中的干细胞出现恶 性增殖。
早幼粒细胞
髓系细胞白细胞特别是早幼粒细 胞的增生,使正常的造血细胞无 法充分发育和成熟。
染色体异常
急性髓系细胞白血病患者的染色 体有一些异常,这可能有助于诊 断和指导治疗。
其他非常见类型的急性白血病
1 急性单核细胞白血病
源于骨髓或外周血单核细胞的增殖异常,发病率较低。
2 急性浆细胞白血病
浆细胞白血病细胞异常形成,此类型白血病非常罕见。
3 急性轴突性髓细胞白血病
髓细胞白血病的一种亚型,以特定细胞的异常增生为特征。
不同类型急性白血病的诊断和治疗方法
1
诊断
通过骨髓穿刺、病理分析和染色体检查等
治疗
2
方法确定急性白血病的类型。
常见方法包括化疗、骨髓移植和靶向治疗
等,根据个体情况制定最佳治疗方案。
急性白血病的诊断分型及预后判断

急性白血病的诊断分型及预后判断唐亚辉;马葵;李次芬;殷宗建;袁淑雯;杨平地;向丹【期刊名称】《海军总医院学报》【年(卷),期】2002(015)002【摘要】目的采用形态学、免疫学、细胞遗传学和分子生物学分型体系对102例急性白血病进行综合分型.方法按照FAB标准进行形态学分型;运用间接免疫荧光法标记活细胞膜表面分化抗原确定细胞属性;采用24 h培养法或直接法制备染色体标本;用PCR方法检测融合基因.结果形态学分型、免疫学分型与形态学、免疫学、细胞遗传学和分子生物学体系分型符合率分别为91.2%和98.0%;16/67型急性髓细胞白血病表达淋系抗原,预后好;6/26例急性淋巴细胞白血病表达髓系抗原,预后差.染色体异常(62/80例)检出率为77.5%;其中(44/62例)71.0%为特异性异常.融合基因的检查也具有特异性的分子标志.结论形态学、免疫学、细胞遗传学和分子生物学体系分型可提高急性白血病的分型准确性,具有指导临床,提示预后的意义.【总页数】4页(P81-84)【作者】唐亚辉;马葵;李次芬;殷宗建;袁淑雯;杨平地;向丹【作者单位】海军总医院血液实验室,北京,100037;海军总医院血液实验室,北京,100037;解放军总医院血液科,北京,100073;解放军总医院血液科,北京,100073;航天部中心医院血液科,北京,100039;海军总医院血液实验室,北京,100037;海军总医院血液实验室,北京,100037【正文语种】中文【中图分类】R733.7【相关文献】1.MRI在急性白血病骨髓浸润诊断与CAG化疗预后判断中的价值 [J], 孙和顺;王毅捷;薄金勇;马亚震;廖云杰;周辉2.血清VEGF-C、VEGFR-2、3表达水平在急性白血病疗效监测及预后判断中的应用 [J], 沈秀芬;薛丽;番寿蕊;何晓娟;王雪娇;余景星;夏梅花;尹列芬3.血清VEGF-C、VEGFR-2、3表达水平在急性白血病疗效监测及预后判断中的应用 [J], 沈秀芬;薛丽;番寿蕊;何晓娟;王雪娇;余景星;夏梅花;尹列芬;4.介绍国际血液学标准化委员会推荐的急性白血病诊断分型法 [J], 骈淮媛5.髓过氧化物酶抗体在急性白血病诊断分型中的应用 [J], 戴海滨;李璐璐;刘芳;赵仁杰;张桂杰因版权原因,仅展示原文概要,查看原文内容请购买。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
•B •T
AML危险分层指标
高危险: • 染色体单体异常、 Inv(3)/t(3;3)、≥3个的复杂染色体异 常、-5、5q-、-7、 7q-、T(9;22)(BCR-ABL)、-17、伴 其它改变的17p异常、除t(9;11)MLL-AF9以外的累及 11q23/MLL基因的异常、 t(1;22)(p13;q13) RBM15MKL1、 t(6;9)(p23;q34)DEK-NUP214
• 快速、简便、重复性好
缺点:
•不能确定组织结构,一些罕见的大细胞不能分析到,一些细胞粘 附性高,难以抽出。因此对HL等难以确诊。
•判断恶性细胞的比例不如形态准确,对M6、MDS的诊断不如形态
•预后价值不如染色体和基因
诊断误区举例
原始细胞增多是诊断前体恶性血液病尤其AL的重要指 标,但原始细胞应根据免疫学标志/基因/染色体证 实为恶性造血前体细胞
• 血WBC >100109/L
• FLT3-ITD基因突变同时合并以下指标至少一种:TET2、 DNMT3A、MLL-PTD突变或+8染色体异常,3年总生存率 为14.5%
• 无FLT3-ITD突变,但有TET2、ASXL1、PHF6和/或 MLL-PTD突变 • 混合型
AML危险分层指标
• 低危险AML : • 染色体正常且无FLT3-ITD基因突变,但有NPM1+及 IDH1或IDH2突变者 • 无c-KIT基因突变及-Y的 t(8;21)(q22;q22)/AML1RUNX1(AML1-ETO)AML、inv(16)(p13q22)/ t(16;16)(p13;q22)/CBFβ-MYH11 AML
如有2 系或以上的特异性标志,可诊断为急性混合性白血病
流式I
AML(病例1)
流式I
ALL (病例2)
流式I
FCM 的优缺点
优点:
•一次可检测数万至数十万个细胞上的数十种标记,可同时检测每 个细胞的六个以上参数,敏感性高,分析全面
• 更容易区分良恶性,恶性细胞的系列及成熟度
• 可帮助确定免疫治疗的靶点并监测疗效,如CD20、CD19是监测 MRD覆盖面最广的方法。
细胞遗传学C
单体核型(monosomal karyotype,MK)
--AML,MDS 中的预后价值
定义:有两条以上的常染色体为单体;
或一条常染色体为单体,另一条染色 体是结构异常
细胞遗传学C
日本两个移植中心进行异基因造血干细胞移植的AML 和MDS共183例患者,显示MK组患者4年的OS最短 为0%
流式I
流式细胞术判断急性白血病:
➢20%或者25%以上细胞表达早期标志 (CD34、HLA-DR、 TdT)或者不表达成 熟标志 ➢系别标志: ✓ 髓系 ✓ B系 ✓ T系
流式I
白血病细胞的系列特异性标志
髓系 MPO+(用FCM,免疫组织化学染色,细胞化学染色证实) 或单核细胞(至少有以下标志中的2项阳性:NSE、CD11c、CD14、 CD64、CD36*、溶酶体 T细胞系 cCD3+(用抗CD3ε链的单抗及FCM分析,不能用免疫组化的抗CD3ζ链 多克隆来检测,因为后者不是T细胞特异性抗原) 或sCD3+ B细胞系 CD19强阳性并同时有以下标志中的至少1项阳性:CD79a、cCD22、 CD10 或CD19弱阳性并同时有以下标志中的至少2项阳性:CD79a、cCD22、 CD10
细胞遗传学C
白血病染色体分析存在的问题:
•有丝分裂相少或缺如 •染色体质量低劣,显带不佳 •染色体异常复杂
• 如果恶性细胞不分裂,其结果是假阴性
• 由于分析的细胞少,有部分白血病患者无染色体异常, 监测残留白血病不敏感
细胞遗传学C
荧光原位杂交(FISH)
利用已知核酸序列作为探针,以荧光素直 接标记后与靶DNA进行杂交,最后在荧光 显微镜下观察杂交信号,从而对标本中待 测核酸进行定性、定位和定量分析
▪ 一些形态上的原始细胞可以是正常造血细胞(尤其 见于儿童感染后,G-CSF,GM-CSF等刺激或化疗 后或移植后)
病例3 儿童B-ALL,化疗3年后停药,来我院复查,骨 髓涂片8%的幼稚细胞
流式幼稚B淋巴细胞增生,未见异常表型
病例4 NK细胞白血病移植后40天,骨髓涂片 8%的幼稚细胞
流式: 未见表型异常细胞,CD34阳性细胞 为幼稚B淋巴细胞
急性白血病的诊断、分型和 预后
白血病的概念
•白血病是造血干/祖细胞 发生恶变
白血病的概念
▪ 分化障碍 ▪ 增殖失控 原始和幼稚细胞增生累积 ▪ 凋亡受阻 ▪ 浸润其它器官和组织
原始和幼稚细胞 (白血病细胞)
白血病的概念
临床表现: ▪ 正常造血受到抑制:乏力、面色苍白、发热、
出血 ▪ 浸润:肝脾淋巴结肿大、皮肤、中枢神经系
流式I
FCM的工作原理
摘自 Flow Cytometry: First Principle
流式I
FCM检测的参数
• FSC: 细胞大小 • SSC:细胞内颗粒多少及细胞内构造的复杂性 • FL:3-10多种(荧光素耦联的单克隆抗体)
流式I
正常BM细胞的图形(CD45/SSC)
R8:幼稚细胞群,正常骨髓中此群细胞数量极低或空缺
形态M
病理及免疫组织化学的优缺点
• 标本直接固定,不容易损失信息,恶性细胞比例更客观,对一些 抽不出或少见细胞,仍可诊断。如伴骨髓纤维化、MM、淋巴瘤、 转移癌、组织细胞、巨噬细胞、树突细胞、何杰金细胞等 • 可以直接观察到组织结构,容易确定恶性细胞的组织部位 • 诊断慢、受诊断者个人经验及知识水平影响大 • 对一些组织结构无破坏、细胞形态改变不大的细胞,难以鉴定良 恶性及成熟度 • 有些恶性细胞在液体中,难以获取组织标本,难以判断组织结构
分子生物学M
31种白血病融合基因 (122种变异体) 筛查
1. AML1/EAP(1) 5. CBFβ/MYH11(8) 9. E2A/PBX1(2) 13. MLL/AF1p(4) 17. MLL/AF9(8) 21. NPM/ALK(1) 25. PML/RARα(5) 29. TEL/AML1(2)
细胞遗传学C ▪ 中期分裂相的染色体分析
细胞遗传学C
▪ AML:50%~90%的患者细胞遗传学可检出 异常克隆
▪ ALL:大约60%~85%的患者可检出克隆性 染色体畸变
细胞遗传学C
染色体的诊断价值
• 一些染色体有诊断价值: 如重现性染色体异常,如t(8;21), inv(16)、t(16;16)、 t(15;17)(q22;q12), t(5;14)(q31;q32) ,t(3;3),t(4;11)可直接诊断急性白血病; • 一些染色体和/或基因有辅助诊断价值,如5q31、CEP7、 7q31、CEP8、20q、CEPY、P53 高度疑似MDS等; • 有-7、5q-、 t(3;3)、t(4;11)、t(9;22)、复杂染色体等的 急性白血病预后不好
白血病的诊断与分类步骤
• 增加的血液细胞是良性还是恶性
• 细胞形态:急性白血病原始细胞明显增加, 一些白血病有明显的特征,如auer’s小体; APL的异常早幼粒细胞有外浆、大量的颗粒等
• 免疫标志异常表达:跨系表达、早晚期同时 表达、罕见细胞大量存在等
• 单克隆轻链表达、克隆性TCR基因重排、 DNA异常
细胞遗传学C
EBMT登记的在CR1进行异基因造血干细胞移 植的初发AML4119例
MK-的 2yrOS:61.1~63.3 %
MK+物学M
基因检测的优缺点
• 有独立的诊断及预后价值 • 可以检测出染色体或FISH不能检测出的异常,联合染色体和 FISH,增加了对疾病预后的判断能力。 • 诊断时间比染色体及FISH短 • 与染色体及FISH分析比较,对检测人员的经验依赖程度低 • 是最敏感的监测残留白血病的指标 • 对试验设计、试验质控要求高 • 对无基因异常的疾病难以诊断 • 疾病是复杂的,仅有基因异常未必完全决定预后
• 可以对既往的骨髓片回顾分析,进一步明确或排除诊断
• 探针昂贵,每次只能分析1-2种异常,只能分析已知的染色体或 基因异常
急性白血病按照细胞遗传学亚型的预后分级
预后 低危
中危
高危
AML
inv(16)或t(16;16) t (8;21) t (15;17)
ALL
>50 超二倍体 t (12;21)
• 急性白血病特有的染色体和/或基因
恶性前体与外周(成熟) 淋巴细胞疾病的鉴别
• 前体细胞型: ALL,淋巴母细胞淋巴瘤 • B: 除了B细胞标志外,CD45dim/-、
CD34+、TdT+、CD10+
• T: 除了T细胞标志外,CD45dim/-、CD34+、 TdT+、cCD3+、sCD3-、CD1a
4. BCR/ABL(4) 8. E2A/HLF(3) 12. MLL/AF17(1) 16. MLL/AF6(4) 20. MLL/ENL(4) 24. PLZF/RARα(2) 28. TEL/ABL(2)
白血病的诊断与分类步骤
• 增加的血液细胞是良性还是恶性 • 前体与外周(成熟)恶性淋巴瘤/白血病的区别, 也就是急性和慢性白血病的区别 • 恶性细胞的系列来源 • 预后评估
▪ MICM整合诊断对恶性血液病进行诊断和分 型重复性更好、更客观
▪ 并且能更好地帮助判断预后
▪ 指导制定治疗方案及策略,监测疗效
形态M
细胞形态及细胞化学分析的优缺点
优点: 直观:镜下直接观察细胞形态,对MDS的诊断、一些少见
的、大的恶性细胞的确定优于流式细胞分析 恶性细胞的比例更准确: 简单快速,有显微镜即可完成报告 缺点: 人为因素影响大 难以鉴别细胞的成熟阶段,B、T等系列的恶性细胞 细胞较成熟时,难以鉴别良恶性 不能提供太多的预后信息
