2018届二轮复习 常见元素及其化合物 课件(17张)(全国通用)
2018高考化学二轮复习课件:铜及其化合物专题复习 (共27张PPT)
原料: Mg2B2O5·H2O
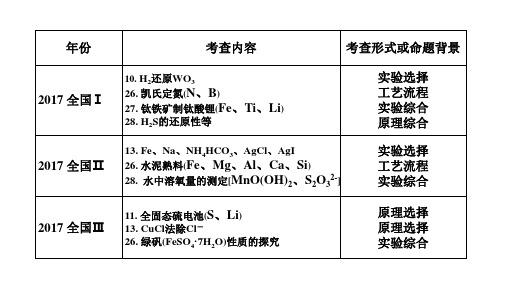
(1)写出Mg2B2O5·H2O与硫酸反应的化学方程式 ____M__g2_B_2_O_5_·H_2_O_+_2_H__2S_O_4__=_2_M_g_S_O__4+_2_H_3_B_O_3_____。
可行的实验方案:
方案一:取绿色溶液于试管中,加热,溶液颜色变为蓝色,则
可证明假设2 方案二:取绿色溶液于试管中,向其中通入足量的空气,溶液
颜色变为蓝色,则可证明假设2 方案三:取蓝色溶液少许于试管中,向其中通入NO2气体,溶 液颜色变成绿色,则可证明假设2
3、探究型实验解题策略
控制变量法:确定需变量,控制不变量
已知:Cu2O+2H+═Cu+Cu2++H2O
从流程图看——
规律: 主线主产品、分支副产品、回头为循环。
流程题突破:
原料
原料循环利用
物质转化线:核心反应
环保
目标 产物
实验操作线
原料的 预处理
反应条件的 控制
产品的分离 提纯
【演练3】(2015全国卷1)以铁硼矿(主要成分为Mg2B2O5·H2O和Fe3O4,还有少量
则Fe3+完全沉淀[c(Fe3+)≤1×10-5 mol·L-1 ]时溶液pH 3.3 ,开始 生成Cu(OH)2沉淀时溶液pH 5
(2)分析[Cu(OH)2(s) Cu2+(aq)+2OH-(aq)]平衡移动
改变条件
实验现象
加适量Na2S(s) 蓝色沉淀变黑色
通入适量 HCl(g)
蓝色沉淀溶解, 溶液变蓝
2018届二轮复习 物质结构与性质 课件(97张)(全国通用)

答案:(1)①4NA
(2)①> ②< ③< ④< ⑤> ⑥>
考点突破
原子结构与性质
精华聚焦 1.基态原子的核外电子排布规律 (1)能量最低原理 基态原子核外的电子先占有能量最低的原子轨道,电子才依次进入能量较高的轨 道,以使原子处于能量最低的稳定状态。如Ge是32号元素,其核外电子的排布式为 1s22s22p63s23p63d104s24p2。 (2)泡利原理 在每个原子轨道上最多只能容纳2个自旋状态相反的电子。
(3)洪特规则 在同一能级的不同轨道中,电子尽可能分占不同的轨道。且自旋状态相同,这样有 利于降低体系的能量。 洪特规则特例:能量相同的轨道处于全充满、半充满或全空的状态时原子是比较稳 定的。
2 2 6 2 6 4 2 Cr:1s 2s 2p 3s 3p 3d 4s × 如 2 2 6 2 6 5 1 Cr:1s 2s 2p 3s 3p 3d 4s √ 2 2 6 2 6 9 2 Cu:1s 2s 2p 3s 3p 3d 4s × 2 2 6 2 6 10 1 Cu : 1s 2s 2p 3s 3p 3d 4s √
(5)在KIO3晶胞结构的另一种表示中,I处于各顶角位置,则K处于________位置,O 处于________位置。
【解析】 (1)紫色波长为400 nm~435 nm,因此选项A正确;(2)K位于第四周期 ⅠA族,电子占据最高能层是第四层,即N层,最后一个电子填充在s能级上,电子云轮 廓图为球形;K的原子半径大于Cr的半径,且价电子数较少,金属键较弱,因此K的熔 点、沸点比Cr低;(3)I 3 与OF2互为等电子体,OF2属于V形,因此I 3 的几何构型为V形, 其中心原子的杂化类型为sp3;(4)根据晶胞结构,K与O间的最短距离是面对角线的一 2 半,即为 ×0.446nm=0.315nm,根据晶胞的结构,距离K最近的O的个数为12个;(5) 2 根据KIO3的化学式,以及晶胞结构,可知K处于体心,O处于棱心。
2018届高考化学第二轮专题复习课件常见非金属元素及其化合物
[限时规范训练] 单独成册A 组 对点强化练1.常温下,下列各组物质中,Y 既能与X 反应又能与Z 反应的是( )A.①③ C .②④D .②③解析:①中,Al(OH)3是两性氢氧化物,既能与强碱NaOH 反应又能与强酸H 2SO 4反应;②中,SiO 2与浓盐酸不反应;③中,N 2与O 2、H 2在常温下均不能反应;④中,Cu 和FeCl 3反应生成FeCl 2和CuCl 2,Cu 与浓HNO 3反应生成Cu(NO 3)2、NO 2和水。
其中①、④与题意吻合,故选B 。
答案:B2.下表各组物质中,物质之间不可能实现如图所示转化的是( )X ――→M Y ――→MZ解析:Fe 与Cl 232Na 2CO 3,Na 2CO 3与CO 2和H 2O 反应可生成NaHCO 3,B 项正确;NH 3催化氧化生成NO ,NO 与O 2反应生成NO 2,C 项正确;S 与O 2反应生成SO 2,SO 2在催化剂作用下能被O 2氧化成SO 3,D 项正确。
答案:A3.(2017·福建质检)X 、Y 、Z 三种物质存在如图所示的转化关系(图中“→”表示一步转化)。
下列各组物质中,不能满足此转化关系的是( )解析:NaAlO 22Fe +3Cl 2=====点燃2FeCl 3、2FeCl 3+Fe===3FeCl 2、FeCl 2+Zn===Fe +ZnCl 2、Fe +CuCl 2===FeCl 2+Cu(或Fe +2HCl===FeCl 2+H 2↑),B 项不符合题意;C 项转化关系可以为:2C +O 2=====点燃2CO 、2CO +O 2=====点燃2CO 2、C +O 2=====点燃CO 2、2Mg +CO 2=====点燃2MgO +C ,C 项不符合题意;D 项转化关系可以为:Cl 2+H 2=====点燃2HCl 、HCl +NaOH===NaCl +H 2O 、2NaCl(熔融)=====通电2Na +Cl 2↑、Cl 2+2Na=====点燃2NaCl(或Cl 2+2NaOH===NaCl +NaClO +H 2O),D 项不符合题意。
2018年高考化学二轮专题复习课件:《钠及其重要化合物》 (共82张PPT)

固体质量增加a g
解析:选D。A项,Na2O2与H2O反应
产生NaOH使石蕊试液变蓝,但Na2O2
具有强氧化性,过量的Na2O2又会使
蓝色褪去,A项错误;B项,Na2O2与
水反应时,既作氧化剂,又作还原
剂,1 mol Na2O2转移1 mol电子;C项,
在计算时可处理成先让CO2与Na2O2
全都反应,若剩余Na2O2,则再与
1.过氧化钠的强氧化性
2.Na2O2与CO2、H2O反应的重要关
系
(1)气体体积差的关系 2Na2O2+2CO2===2Na2CO3+O2 2 气体体积差 ΔV=1 ① 1
2Na2O2+2H2O(g)===4NaOH+O2 2 1
气体体积差②
ΔV=1
由此可见,若CO2和水蒸气的混合气 体(或单一气体)通过足量Na2O2,气体
2.钠的化学性质——还原性 (1)与非金属单质(如O2、Cl2)的反应
(2)与水反应 ①离子方程式: 2Na+2H2O===
2Na++2OH-+H2↑ __________________ _____________________。 ②钠与含有酚酞的水反应的实验现象 及解释:
(3)与酸反应 离子方程式:2Na+2H+===2Na++ H2↑。 钠与酸的反应比与水的反应更剧烈。
化学式 氧元素 的化合 价 所含离 子 与H2O 反应
Na2O -2
Na2O2 -1
- Na+、 存在 Na+、O2 2 存在 ______ 2 - O ________ _____离子 离子 2Na2O2+ Na2O+ 2H2O=== H2O=== 4NaOH+ 2NaOH O2↑
化学式2 ,
即为生成氧气的量。
2018届高考化学二轮复习 化学常用计量 课件(全国通用) (共36张PPT)

件
状况
熟记在标准状况下是液体或固体的物
物质的聚集
状态
质,如 CCl4、H2O、SO3、己烷、苯、
酒精、CHCl3 等
考查方向
注意问题
①某些物质分子中的原子个数,如
物质的微观 结构
Hale Waihona Puke Ne、O3、P4 等;②特殊物质的摩尔质 量或分子中的中子数,如 D2O、T2O、 18O2、H37Cl 等;③一些物质中的化学 键数目,如 SiO2、Si、CH4、P4、CO2、 C60、烃中碳碳键数目等;④最简式相 同或摩尔质量相同物质的粒子数。如
考向二 有关物质的量浓度的计算 [名校备考]
专题二 化学常用计量
命题分析——对考向把握要准 (清晰备考方向)
考向一 阿伏加德罗常数及定律的综合应用 [名校备考]
1.NA 试题“一算、二定、三判断”的解题思路 一算:利用基本公式 n=Mm=VVm=c·V,用已知的物理量计 算物质的量。注意公式的使用范围 n=VVm(标准状况的下气体)。 n=cV(V 是指溶液体积),若不能计算物质的量则此选项错误。
解析:只要在相同条件下气体分子数相同,其物质的量、气 体体积必相等,设 A、B 的相对分子质量为 MA 和 MB,气体密 度为 ρA 和 ρB,分子数为 NA 和 NB,其质量为 WA 和 WB。对各选 项进行分析:A 项,MmA=MnB,则 MA∶MB=m∶n,正确;B 项, 两气体的体积相等,则 ρA∶ρB=MA∶MB=m∶n,错误;C 项, 摩尔质量越大,单位质量的分子数目越少,等质量的 A、B 气体 的分子数与其摩尔质量成反比,即 NA∶NB=MB∶MA=n∶m, 正确;D 项,同温同压下,同体积的气体分子数相同,故 A 和 B 等体积时,WA∶WB=MA∶MB=m∶n,正确。
2018年高考化学二轮专题复习课件:氮及其化合物 (共122张PPT)

H 2O、 氨气溶于水得氨水,氨水中含有的粒子有: NH3·
- + NH3、H2O、NH+ 、 OH 、 H 4 。NH3· H2O为可溶性一元 △ NH · H O===== NH3↑+H2O 。 3 2 弱碱,不稳定,易分解:
②与酸反应 a.蘸有浓盐酸的玻璃棒与蘸有浓氨水的玻璃棒靠近,其现 象为 有白烟生成 ,将浓盐酸改为 浓硝酸 ,也会出现 相同的现象。化学方程式为: HCl+NH3===NH4Cl, NH3+HNO3===NH4NO3 。 b . 与 CO2 等 酸 性 氧 化 物 反 应 : NH3 + CO2 + H2O===NH4HCO3或2NH3+CO2+H2O===(NH4)2CO3
高能 固氮约占10% 自然固氮 生物 固氮约占90% (2)方法 合成氨 人工固氮 仿生 固氮
2.氮气
(1)物理性质
纯净的N2是一种无色无味的气体,难溶于水,在空气中约 4 占总体积的 5 。
(2)化学性质 通常情况下,N2化学性质很稳定,在高温、高压、放电、催
具有更强的氧化性,能使Au、Pt溶解。
久置的硝酸呈黄色,如何除去?怎样保存硝 酸? 提示 硝酸分解产生的NO2溶解于浓硝酸显黄色,除去的 方法是通入足量的氧气。 硝酸通常用棕色细口瓶密封保存,置于冷暗处。
三种理解 1.对N2性质的理解 N2的稳定性是相对的,物质的性质不是一成不变的,当外 界条件发生变化时物质的性质也可能改变。
③还原性
催化剂 4NH3+5O2 ===== 4NO+6H2O △ 氨的催化氧化化学方程式为: 。
(3)实验室制法
△ 2NH Cl + Ca(OH) ===== CaCl2 4 2 化学方程式为: +2NH3↑+2H2O 。
2018届全国卷高考化学二轮复习课件专题一 基本概念第1讲物质的组成、性质、分类和化学用语
2.熟记物理变化、化学变化中的“三馏”“四解”“十一
化”
物理变化
化学变化
三馏 蒸馏、分馏
干馏
四解
潮解
电解、水解、裂解
熔化、汽化、钝化、裂化、酯化、煤的气化、 十一化
液化 煤的液化、碳化、硝化、老化
3.“1 图”“6 式”的规范使用和书写
结构示
意图 S2-:
;Al3+:
电子式
Na2O2:Na+[··O······O······]2-Na+; H2O:H··O······H
A.将该材料分散到液体分散剂中,所得混合物具有丁达尔 效应
B.该材料的基本微粒既能透过滤纸,也能透过半透膜 C.该材料在 2000℃的高温下,还可以保持结构完整,可正 常使用 D.该材料在航空航天高温热防护、有毒化学物质吸附和清 除等领域有重要的应用前景
[解析] 该材料的基本微粒的直径为 1~100 nm,将该材料 分散到液体分散剂中,形成的分散系属于胶体,具有丁达尔效应, A 项不符合题意,该材料的基本微粒不能透过半透膜,B 项符合 题意;氮化硼晶体属于原子晶体,可耐高温,结构稳定,C 项不 符合题意;该材料具有很强的吸附性,D 项不符合题意。
专
题
基本概念
一
第1讲
物质的组成、性质和分类、化学用语
[把脉考向] 一、考纲要求 1.了解分子、原子、离子等概念的含义。了解原子团的定 义。 2.理解物理变化与化学变化的区别与联系。 3.理解混合物和纯净物、单质和化合物、金属和非金属的 概念。 4.理解酸、碱、盐、氧化物的概念及其相互联系。 5.熟记并正确书写常见元素的名称、符号、离子符号。
2018精准高考大二轮化学课件第1部分 第10讲常见金属元素
b.洗涤
d.分馏
Ⅲ填“Ⅰ”“Ⅱ” “Ⅲ”或 ③若白色固体X的质量为7.0 g,则X的组成为_______(
“Ⅳ”)。
返回导航
第一部分 专题三 常见元素及其化合物
3.(2017· 晋中模拟)某无色稀溶液 X 中,可能含有如表所列离子中的某几种。 导学号 43864331
阴离子
- - - 2- CO2 、 SiO 、 AlO 、 Cl 3 3 2
化 学
低温下蒸干得到白色固体X,X的组成可能有四种情况,按出现的先后顺序分别 Na2CO3 是 Ⅰ.NaOH 、 Na CO , Ⅱ.____________ , Ⅲ.Na CO 、 NaHCO ,
2 3 2 3 3
NaHCO3 。 Ⅳ.____________ ①常温下,将得到的固体 X重新溶于水,在所得溶液中加入盐酸,使溶液 5.85 的pH=7,再将溶液蒸干,得到固体的质量为____________ g。
返回导航
第一部分 专题三 常见元素及其化合物
② 若 其 他 操 作 不 变 , 将 A与 C 连 接 , 可 观 察 到 的 现 象 是
广口瓶中的长导管口有气泡产生 。 ________________________________ (2)向100 mL 1 mol·L-1烧碱溶液中通入一定量CO2充分反应后,将溶液在
返回导航
第一部分 专题三 常见元素及其化合物
c、b 填字母 ②若要验证白色固体 X是第Ⅰ种组成,依次加入的试剂为 ________( 序号)。 a.盐酸 c.BaCl2溶液 b.MgCl2溶液 d.Ba(OH)2溶液
化 学
c 在验证的过程中,一定需要进行的操作是______( 填字母序号)。
a.萃取
2018届高考化学二轮复习 非金属单质及其化合物(硫、氮) 课件(62张)(全国通用)
答案
(1)抑制氯化铁水解
(2)溶液由棕黄色变为浅绿色
- + 2+ (3)①2Fe3++SO2+2H2O===SO2 + 4H + 2Fe 4
②取C中反应后的溶液少许,向其中滴入KSCN溶液,不变 红,再加入新制的氯水,溶液变红 溶解的SO2氧化为H2SO4,干扰实验 止溶液倒吸 (5)bc ③不合理 硝酸可以将
第二轮复习 非金属单质及其化合物
(硫、氮)
考点三 硫及其重要化合物
高考定位 硫及其化合物的性质和转化关系是高考考查的 重点,高考命题通常围绕 SO2 、 H2SO3 、亚硫 酸盐、硫酸盐和浓 H2SO4 的性质,以工农业生 产、环境保护、化学实验为背景对物质性质进 推断、实验探究,并渗透有关计算和氧化还原 反应方程式的书写进行考查是高考的热点题型, 二轮复习应重点关注。
Na2S溶液变浑浊 酸性KMnO4溶液褪色 品红溶液褪色
SO2与Na2S溶液反应产
生了S单质 SO2具有还原性 SO2具有漂白性
解析 SO2与水反应生成H2SO3,H2SO3不能 与BaCl2溶液反应。 答案 A
2.某研究小组用下图装置进行SO2与FeCl3 溶液反应的相关实验(夹持装置已略去)。
[题组训练·] 1.如图,利用培养皿探究SO2的性质。实验时 向Na2SO3固体上滴几滴浓硫酸,立即用另一表 面皿扣在上面。
下表中对实验现象的描述或所做的解释不 正确的是 ( )。
选项 A
实验现象 BaCl2溶液变浑浊
解释 SO2与BaCl2溶液反应产 生了BaSO3沉淀
B C D
- 2+ SO2 4 ,还原产物是 Fe ,先根据得失电子守恒可得
2018年高考化学大二轮复习课件:专题三 元素及其化合物 第13讲
2
• (4)同一元素的气态氢化物和最高价氧化物 氮 NH 对应的水化物发生化合反应,生成盐的元 NO 素一定是_____。 SiO • (5)溶于水显碱性的气体只有_________ 。 Si 浓硫酸 浓硝酸 • (6)在空气中迅速由无色变为红棕色的气体 只有_______。 • (7)可溶于氢氟酸的酸性氧化物只有
+ + - +
N3-核电荷数大;Cl-有 3 个电子层。核外电子层数越多,离子半径越大,电子层 数相同时,核电荷数越大的离子半径越小,故离子半径由小到大的顺序为 r(H+) <r(Mg2 )<r(N3 )<r(Cl )。
ห้องสมุดไป่ตู้+ - -
Mg 原子核外有 3 个电子层,最外层有 2 个电子,故 Mg 位于周期表中第三 周期ⅡA 族。 Mg(OH)2 是 由 Mg2 。 (2)根据质量守恒定律,A2B 的化学式是 Mg2Si。电解熔融的 MgCl2 生成 Mg 和 Cl2。NH3 和 NH4Cl 既是副产物又是起始原料。
第一部分
专题整合突破
专题三 元素及其化合物
第13讲 非金属及其化合物
1 2 3
高 考 点 击
高 频 考 点
课后热点强化
高 考 点 击
最新考纲 1.了解碳、硅单质及其重要化合物的主要性质及应用。 2.了解碳、硅单质及其重要化合物对环境质量的影 响。 3.了解氯单质及其重要化合物的主要性质及应用。 4.了解氯单质及其重要化合物对环境质量的影响。 5.掌握氯气的实验室制法(包括所用试剂、仪器,反 应原理和收集方法) 6.了解硫单质及其重要化合物的主要性质及应用。 7.了解硫单质及其重要化合物对环境质量的影响。 8.了解氮元素单质及其重要化合物的主要性质和应 用。 9.了解氮元素单质及其重要化合物对环境质量的影 响。
