化学室试题库
有机化学试题库及答案

有机化学试题库及答案一、填空题1. 分子式为C3H6O的物质结构式为_____________。
2. 以下化合物中,不属于酯的是_____________。
3. 由n-丁烷制备1,2-二溴丁烷的试剂是_____________。
4. 甲醛与乙醇加热反应,生成的主要产物是_____________。
5. 砒霜是一种有机物,其化学名称为_____________。
二、选择题1. 下列化合物中,具有香气的是:A. 丁酸B. 甲基丙酮C. 丙酮D. 乙酸乙酯2. 下面哪一个官能团在石蜡烯中不存在?A. 烯烃B. 炔烃C. 醇D. 酮3. 在氢化反应中,通常使用以下哪一种催化剂?A. CuB. AgC. PdD. Pt4. 以下哪种有机反应不属于取代反应?A. 酯化反应B. 醚化反应C. 氯代反应D. 氢化反应5. 下列哪个化学式表示的有机物属于脂肪烃?A. C6H12O6B. C6H12O2C. C6H14D. C6H10O三、解答题1. 请给出正丁醇(1-丁醇)、异丁醇(2-丁醇)和叔丁醇(2-甲基-2-丁醇)的结构式,并写出它们的系统命名。
2. 某有机化合物的分子式为C4H8O2,经元素分析后得知该化合物中含有6个氢原子,试推测该有机化合物的结构式。
4. 某有机物的IR光谱图中显示有一个吸收峰出现在1710 cm^-1附近,请解释该峰对应的官能团是什么。
4. 1,3-戊二烯(C5H8)与Br2反应后得到了一种溴代产物,该产物的分子式为C5H8Br2,试写出该溴代产物的结构式并给出其命名。
5. 请结合水蒸气特性,解释为什么三氯甲烷(CHCl3)的沸点较甲醇(CH3OH)更高。
参考答案:一、填空题1. CH3CHO2. 甲酸甲酯3. Br24. 乙醇5. 砷化氢二、选择题1. D2. C3. C4. A5. C三、解答题1. 正丁醇(1-丁醇): CH3CH2CH2OH异丁醇(2-丁醇): CH3CH(OH)CH3叔丁醇(2-甲基-2-丁醇): (CH3)3COH2. 该有机化合物的结构式为CH3COOCH2CH3。
高一化学试题题库及答案

高一化学试题题库及答案 一、选择题(每题3分,共30分) 1. 下列物质中,属于混合物的是( ) A. 氧气 B. 空气 C. 二氧化碳 D. 氮气
答案:B 2. 根据质量守恒定律,下列反应中水的质量增加的是( ) A. 2H2 + O2 → 2H2O B. 2H2O → 2H2 + O2 C. 2CO + O2 → 2CO2 D. 2H2O + 2CO2 → 2H2CO3 答案:D 3. 金属钠与水反应的化学方程式是( ) A. 2Na + 2H2O → 2NaOH + H2 B. Na + H2O → NaOH + H2 C. 2Na + H2O → 2NaOH + H2 D. Na + 2H2O → 2NaOH + H2
答案:C 4. 下列物质中,属于电解质的是( ) A. 蔗糖 B. 酒精 C. 硫酸铜 D. 石墨
答案:C 5. 根据元素周期表,下列元素中属于非金属元素的是( ) A. Na B. Cl C. Fe D. Cu
答案:B 6. 根据化学方程式,下列反应中生成物中水的质量分数最大的是( )
A. 2H2 + O2 → 2H2O B. 2H2O → 2H2 + O2 C. 2CO + O2 → 2CO2 D. 2H2O + 2CO2 → 2H2CO3
答案:A 7. 根据化学方程式,下列反应中生成物中二氧化碳的质量分数最大的是( ) A. 2H2 + O2 → 2H2O B. 2H2O → 2H2 + O2 C. 2CO + O2 → 2CO2 D. 2H2O + 2CO2 → 2H2CO3
答案:C 8. 下列物质中,属于酸的是( ) A. HCl B. NaOH C. H2O D. NH3
答案:A 9. 下列物质中,属于碱的是( ) A. HCl B. NaOH C. H2O D. NH3
有机化学试题库(命名和写结构)知识分享
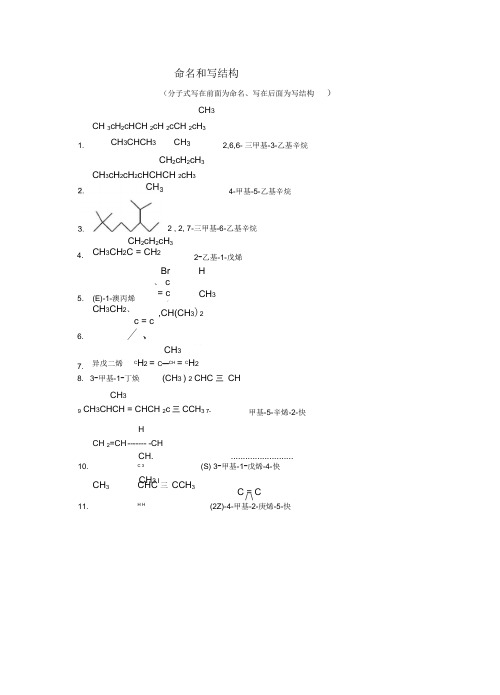
命名和写结构(分子式写在前面为命名、写在后面为写结构)CH 3CH 3cH 2cHCH 2cH 2cCH 2cH 3CH 2cH 2cH 3CH 3cH 2cH 2cHCHCH 2cH 3CH 2cH 2cH 3CH 38. 3-甲基-1-丁焕(CH 3 ) 2 CHC 三 CHCH 39 CH 3CHCH = CHCH 2c三CCH 3 7-HCH 2=CH ------- -CHCH...........................10.C 3(S) 3-甲基-1-戊烯-4-快CH 3 ICH 3CHC 三 CCH 3C = C / \11.H H(2Z)-4-甲基-2-庚烯-5-快7.异戊二烯 C H 2 = C —CH = CH 2 1.CH 3CHCH 3CH 32,6,6- 三甲基-3-乙基辛烷4-甲基-5-乙基辛烷2 , 2, 7-三甲基-6-乙基辛烷4. CH 3CH 2C = CH 25. (E)-1-澳丙烯CH 3CH 2、 Br 、 c = c/2-乙基-1-戊烯H CH 3,CH(CH 3)26.c = c/ 、()甲基-5-辛烯-2-快CH 3 CH 3HH反式十氢奈的构象式21. CH 3CH 3 COOH (CH 3)2CHCH H H (2E,4Z) 12. 3\C = C.H 、 ..CH 2CH 3C = CH -2,4-庚二烯13. 4-甲基环己烯H Cl HCl CH 315. 2-甲基丁烷的最稳定 Newma 微影式CH 3H HCH 3 HCH 316. (R,S) -2,3-二羟基丁二酸的最稳定 Newma©影式H OH HOH 17. COOH投影式(R,S) -2,3-二羟基丁二酸(内消旋酒石酸)的 Fischer18.顺-1 , 2-二甲基环己烷的优势构象14. (2S,3R) -2,3-二氯丁烷的 Fischer 投影式COOHH :^°HCOOH19.反-1-乙基-3-异丙基环己烷的优势构象20.顺-1-甲基-4-叔丁基环己烷的优势构象CH 2CH 3:C(CH 3)3CH 3CH 3CH 3cH 2cHe H 2cH e H 2cH 33-甲基-5-澳庚烷CH=CH 2CCH3CH2,/ HHOBrC 2H 5CH 323. 24. 1,8-二甲基-螺[3.5]-5- 辛烯庚烯30. 31. 烯丙基氯5-澳-1,3- Cl32. 4-氯-2-戊烯CH 3CHCH = CHCH 3Br22.29.(S)-3-羟基-1-戊烯33. 对二甲苯34.35.36.37.38.39. CH 3 CH 3CH 3cH2cHCH 2CHCH 2CH3CH3CH 3c = CHCH 2CH2CH34-硝基芳基澳苯磺酸3-甲基-5- 2-苯基-2-己烯CH2BrNO2SO3HSO2NH2苯基庚烷又寸-氨基苯磺酰胺COOHCH5- NH2甲基-1-蔡甲酸Cl40.NO2 41. 9-硝基菲CH20H ICHOH42.甘油CH20HOHQ44. 0cH3对-甲氧基苯酚OHO2N NO2V45. 2,4,6-三硝基苯酚NO2CH 3cH^CH 346. HO CH 2cH 33-甲基-2-戊醇47. 叔丁醇(CH3)3c0HCH348. CH3cH= CHCH2cH0H4-己烯』-醇—O —CH349 .苯甲醛\=/50 .乙基叔丁基醒(CH3)3 C0cH2cH351 .苯甲硫醇C6H5cH2s H52 .二甲亚碉(C H3)2S O义CH3-C-CH-CH353 . CH3 2-甲基-2,3-环氧丁烷54 .四氢吠喃OIICHCCH 2cH 3O OII IICH 3CCH 2CCH 3对苯醍COOH、55. 18-冠-6 56. 3 -蔡酚 OH57. 2- 丁烯醛 CH 3CH = CHCHO58. 苯甲醛CHO60. CH 3 2-苯基-3- 戊酮61.COCHOCH 3又^•-甲氧基苯乙酮 63. NHNH 2苯肿65.COOH邻苯二甲酸59. 62. 2,5-戊二酮64.32-甲基环己酮HOOCC = C产、66 .反-丁烯二酸HCOOHCH 3(CH 2)4\CH2C = C ,C 67 .顺式亚油酸 HH H68 .硬脂酸 CH3(CH 2)16COOH69 .软脂酸 CH 3(CH 2)14COOHCH 3(CH 2)7cH = CH(CH 2)7COOH71.3-苯基丙烯酸C 6H 5cH=CHC00H73.乙酸酎(CH 3c 0)2。
初三化学用语化学式决赛试题

XX学校--用心用情服务教育!精品试卷,请参考使用,祝老师、同学们取得好成绩!化学用语竞赛试题班级:姓名:得分:一、写出下列物质的化学式(每空1分,满分30分)汞银甲烷氨气氧化钙氧化镁氧化铜氧化铁氧化亚铁硫酸硝酸氢氧化钠氢氧化钾氢氧化铁氢氧化铜硝酸铵硫酸铝碘化钾五氧化二氮氯化钾氯化钡氯化银碳酸氢钠碳酸钠碘化银锰酸钾碳酸氢铵氯化镁硝酸钠硝酸钡二、用化学元素或化学式填空(每空1分,满分30分)9个钠原子 6个氮原子 5个镁原子4个钙原子 2个铁原子 N个铝原子2个五氧化二磷分子 4个二氧化碳分子7个一氧化氮分子 2个氯化钙分子1个镁离子 3个钠离子 4个铁离子2个亚铁离子 10个铝离子 5个钙离子2个氯离子 3个氢氧根离子 6个碳酸根离子3个硫酸根离子 4个硝酸根离子氨水2个铵根离子 2个乙醇(酒精)分子请标出Fe2O3中Fe的化合价请标出Na2O中的Na的化合价请标出CH4中C的化合价请标出NaNO2中N的化合价请写出地壳中含量最多的金属元素请写出地壳中含量最多的非金属元素三、请说明下列化学式中数字的含义(每空1分,满分10分)3NaCl MnO2 KIO3 SO3NaNO2 10MgOCO32-中3表示:,2表示:Fe3O4中的3代表,4代表三、请根据下列提示写出对应的化学方程式(每空2分,满分30分)1.硫与氧气发生反应,生成一种带有刺激性气味的气体并放出热XX学校--用心用情服务教育!量,该反应方程式为2.铁丝在氧气中点燃后生成一种黑色的固体物质,火星四射,该反应为3.高锰酸钾是一种暗紫色固体,受热时,分解出氧气,同时还有其他物质生成,该反应为4.实验室常用大理石和稀盐酸制取二氧化碳,该反应方程式为。
5.氢气和氧气在点燃的条件下生成水6.学校运动会上,短跑项目“发令枪”里的火药成分为KClO3、MnO2和红磷,当扣动扳机时,撞针撞击火药产生的热量使KClO3分解产生O2,进而引燃红磷产生白烟。
高考化学试题题库大全及答案

高考化学试题题库大全及答案一、选择题1. 下列化合物中,属于共价化合物的是:A. NaClB. H2OC. MgOD. CO22. 根据题目中的选项,可以判断出B和D选项中的H2O和CO2都是由共价键结合的化合物,因此它们属于共价化合物。
而A选项中的NaCl 和C选项中的MgO都是由离子键结合的化合物,属于离子化合物。
因此,正确答案为B和D。
3. 根据题目分析,我们可以得出以下结论:共价化合物是由共价键结合的化合物,而离子化合物是由离子键结合的化合物。
在本题中,H2O 和CO2都是由共价键结合的化合物,因此它们属于共价化合物。
二、填空题4. 请写出水的化学式:______。
5. 水的化学式为H2O,其中H代表氢元素,O代表氧元素,数字2表示氢元素的数量。
因此,正确答案是H2O。
三、简答题6. 请简述什么是氧化还原反应?7. 氧化还原反应是指在化学反应中,原子或离子之间发生电子转移的过程。
在这类反应中,一个物质失去电子(被氧化),而另一个物质获得电子(被还原)。
氧化还原反应是化学反应中非常重要的一类反应,广泛应用于工业生产和科学研究中。
四、计算题8. 已知某化学反应的平衡常数Kc = 1.2 × 10^-3,反应物A的初始浓度为0.1 mol/L,求反应达到平衡时,生成物B的浓度。
9. 根据平衡常数的定义,我们有:Kc = [B] / [A]设平衡时B的浓度为x mol/L,A的浓度为(0.1 - x) mol/L,代入平衡常数表达式得:1.2 × 10^-3 = x / (0.1 - x)解这个方程,我们可以得到x的值,即B的平衡浓度。
五、实验题10. 请描述如何通过实验确定一个化合物是酸性还是碱性。
11. 可以通过酸碱指示剂法来确定化合物的酸碱性。
首先,取少量待测化合物溶液,然后滴加几滴酚酞指示剂。
如果溶液变红,说明该化合物是碱性的;如果溶液颜色不变或变蓝,说明该化合物是酸性的。
(化学)初三化学化学方程式的计算模拟试题及解析 (2)

(化学)初三化学化学方程式的计算模拟试题及解析一、中考化学方程式的计算1.在盛有24.3g 硫酸钠和氯化钠组成的固体混合物的烧杯中,加入100g 水使硫酸钠和氯化钠全部溶解。
向其中逐渐滴加溶质质量分数为20%的氯化钡溶液。
生成沉淀的总质量与所滴入氯化钡溶液的质量关系曲线如图Z7-6所示,请根据题意回答问题。
(1)过程中观察到的现象_____。
(2)滴加到B 点时,溶液中的溶质是_____(填化学式)。
(3)当滴加氯化钡溶液至图中A 点时,所得溶液中溶质的质量分数。
_____(结果保留一位小数)【答案】生成白色沉淀,溶液变浑浊; NaCl 和BaCl 2 10.6% 【解析】 【分析】 【详解】(1)硫酸钠和氯化钡生成硫酸钡沉淀和氯化钠,所以会看到有白色沉淀生成,故填:生成白色沉淀,溶液变浑浊;(2)硫酸钠和氯化钡生成硫酸钡沉淀和氯化钠,A 点表示恰好完全反应,此时溶质为氯化钠,B 点表示氯化钡过量,此时溶质为氯化钡和氯化钠,故填:NaCl 和BaCl 2; (3)当滴加氯化钡溶液至图中A 点时,所得溶液中溶质为氯化钠 设生成氯化钠质量为x 反应硫酸钠质量为y ,生成沉淀质量为z 。
2244BaCl Na SO BaSO 2NaCl208142233117104g 20%yzx208104g 20%208104g 20%208104g 20%===117x 142y 233z x=11.7gy=14.2g z=23.3g+=↓+⨯⨯⨯⨯,,,,反应后氯化钠质量为:11.7g+(24.3g-14.2g)=21.8g ,反应后溶液质量为:24.3g+100g+104g-23.3g=205g,反应后溶液质量分数为;21.8g100%10.6%205g⨯≈ 答:溶质质量分数为10.6%2.为测定某石灰石矿中碳酸钙的含量,进行了如下实验:称取10g石灰石样品,高温煅烧至质量不再改变,称得剩余固体质量为6.7g(假设杂质不参与反应)。
高三化学试题题库及答案
高三化学试题题库及答案一、选择题1. 下列物质中,属于混合物的是()A. 空气B. 蒸馏水C. 纯碱D. 碳酸钙答案:A解析:混合物是由两种或两种以上物质组成的物质,空气中含有氮气、氧气等多种气体,因此属于混合物。
蒸馏水、纯碱和碳酸钙都是纯净物。
2. 根据元素周期表,下列元素中原子序数最大的是()A. 氧B. 硫C. 氯D. 氩答案:D解析:元素周期表中,原子序数越大,元素在周期表中的位置越靠后。
氧的原子序数为8,硫为16,氯为17,氩为18,因此氩的原子序数最大。
3. 下列化学反应中,属于氧化还原反应的是()A. CO2 + H2O → H2CO3B. 2H2 + O2 → 2H2OC. 2NaOH + H2SO4 → Na2SO4 + 2H2OD. 2HCl + CaCO3 → CaCl2 + H2O + CO2答案:B解析:氧化还原反应是指在化学反应中,元素的氧化态发生变化的反应。
在选项B中,氢气中的氢元素氧化态从0变为+1,氧气中的氧元素氧化态从0变为-2,因此属于氧化还原反应。
二、填空题4. 写出下列物质的化学式:(1)氧化镁(2)硫酸铜(3)硝酸钾答案:(1)MgO(2)CuSO4(3)KNO3解析:根据化合物化学式的书写规则,先写阳离子,再写阴离子,阴阳离子的电荷数相等。
5. 写出下列离子的名称:(1)Fe3+(2)SO42-(3)OH-答案:(1)铁离子(2)硫酸根离子(3)氢氧根离子解析:根据离子的命名规则,金属离子直接用元素名称加离子,非金属离子则用元素名称加根字,再根据电荷数确定名称。
三、简答题6. 简述如何鉴别硫酸铵和氯化铵。
答案:可以通过加入氢氧化钠溶液并加热的方法鉴别硫酸铵和氯化铵。
硫酸铵与氢氧化钠反应会生成氨气,而氯化铵则不会。
解析:硫酸铵与氢氧化钠反应生成氨气,氨气具有刺激性气味,可以通过闻气味来鉴别。
氯化铵与氢氧化钠反应生成氯化钠和水,没有明显的现象。
7. 描述实验室制取氧气的两种方法,并简述其原理。
无机化学试题库及答案
无机化学试题库及答案一、选择题(每题2分,共20分)1. 下列元素中,属于碱土金属的是()。
A. NaB. MgC. AlD. Si答案:B2. 化学式H2O表示的是()。
A. 氢气B. 氧气C. 水D. 过氧化氢答案:C3. 以下化合物中,属于共价化合物的是()。
A. NaClB. MgOC. HClD. Fe答案:C4. 元素周期表中,第ⅠA族元素具有的价电子数为()。
A. 1B. 2C. 3D. 4答案:A5. 以下化合物中,属于离子化合物的是()。
A. H2OC. NaClD. CH4答案:C6. 以下元素中,原子序数最小的是()。
A. HB. HeC. LiD. Be答案:A7. 以下化合物中,属于酸的是()。
A. HClB. NaOHC. H2SO4答案:C8. 以下化合物中,属于碱的是()。
A. HClB. NaOHC. H2SO4D. NH3答案:B9. 以下化合物中,属于盐的是()。
A. HClB. NaOHC. NaClD. H2O答案:C10. 以下化合物中,属于氧化物的是()。
A. HClB. NaOHC. Na2OD. H2O答案:C二、填空题(每题2分,共20分)11. 元素周期表中,第ⅤA族元素具有的价电子数为_________。
答案:512. 元素的原子序数等于其原子核中的_________数。
答案:质子13. 化学式CO2表示的是_________。
答案:二氧化碳14. 元素周期表中,第ⅦA族元素具有的价电子数为_________。
答案:715. 元素周期表中,第ⅥA族元素具有的价电子数为_________。
答案:616. 元素周期表中,第ⅢA族元素具有的价电子数为_________。
答案:317. 元素周期表中,第ⅡA族元素具有的价电子数为_________。
答案:218. 元素周期表中,第ⅠB族元素具有的价电子数为_________。
答案:1119. 元素周期表中,第ⅡB族元素具有的价电子数为_________。
高中化学试题题库及答案
高中化学试题题库及答案一、选择题1. 以下哪种元素属于碱金属?A. 钠(Na)B. 镁(Mg)C. 铝(Al)D. 钾(K)答案:A2. 根据化学式H2O,水分子中氢原子和氧原子的个数比是多少?A. 1:1B. 1:2C. 2:1D. 2:3答案:C3. 以下哪个反应是氧化还原反应?A. CaO + H2O → Ca(OH)2B. 2H2 + O2 → 2H2OC. Na2CO3 + 2HCl → 2NaCl + H2O + CO2D. 2Na + 2H2O → 2NaOH + H2答案:D二、填空题4. 化学方程式书写时,需要遵循的两个基本原则是________和________。
答案:质量守恒定律;客观事实5. 根据题目3的化学方程式,如果生成2mol氢气,反应中消耗的钠的质量是多少克?答案:46克三、简答题6. 什么是化学键?请简述离子键和共价键的区别。
答案:化学键是指原子之间通过电子的相互作用而形成的连接。
离子键是由正负离子之间的静电吸引力形成的,通常存在于金属和非金属之间。
共价键则是由两个原子共享电子对形成的,通常存在于非金属元素之间。
四、计算题7. 某化学反应中,1mol氮气(N2)与3mol氢气(H2)反应生成2mol氨气(NH3)。
请写出该反应的化学方程式,并计算反应的平衡常数K。
答案:化学方程式为:N2 + 3H2 ⇌ 2NH3。
平衡常数K的计算需要具体的浓度值或温度条件,这里无法给出具体数值。
五、实验题8. 描述如何使用滴定法测定溶液中盐酸的浓度。
答案:首先,取一定体积的待测盐酸溶液放入滴定瓶中。
然后,使用已知浓度的标准碱溶液进行滴定,记录滴定过程中消耗的碱溶液体积。
根据滴定反应的化学方程式,可以计算出盐酸溶液的浓度。
结束语:本试题涵盖了高中化学的基础知识和应用,旨在帮助学生巩固化学概念,提高解题能力。
希望同学们通过练习,能够更好地理解和掌握化学知识。
高中常见化学方程式填空练习试题
钾和硫酸的反应
47
钾和硫酸铜的反应
48
锂在氮气中燃烧
镁、铝及其化合物有关的化学方程式
序号
反应条件
化学反应方程式或离子方程式
1
镁在氧气中燃烧
2
镁在氮气中燃烧
3
镁在二氧化碳中燃烧
4
镁在氯气中燃烧
5
镁与硫粉共热
6
镁与硫酸反应
7
镁与氯化亚铁反应
8
工业制备镁
9
铝在氧气中燃烧
10
铝在氯气中燃烧
11
铝与硫粉共热
12
铝与稀硫酸反应
13
铝与氢氧化钠反应
14
铝与硫酸铜溶液反应
15
铝与氧化铁反应(铝热反应)
铝与二氧化锰反应
铝与五氧化二钒反应
铝与三氧化二铬反应
16
工业制备铝
17
氧化铝与盐酸反应
18
氧化铝与氢氧化钠反应
19
氢氧化铝受热分解
20
氢氧化铝酸式电离
21
氢氧化铝碱式电离
22
氢氧化铝与硫酸反应
23
氢氧化铝与氢氧化钠反应
10
氯气通入氢氧化钠溶液
11
氯气通入热的氢氧化钠溶液
12
向次氯酸钙溶液通入少量二氧化碳
52
铜生锈原理
53
铜与浓硫酸共热
54
铜与浓硝酸反应
55
铜与稀硝酸反应
56
铜与硝酸银溶液反应
57
氧化铁与稀硫酸反应
58
氧化铜与氢气加热
59
氧化亚铜与稀硫酸(歧化反应)
60
氧化亚铜与氢气共热
61
氧化亚铜与稀硝酸反应
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一.填空题 1.检查项包括 有效性 、 均一性 、 纯度要求 、与 安全性 四个方面。 2.物理常数包括相对密度、馏程、熔点、凝点、比旋度、折光率、黏度、吸收系数、碘值、皂化值和酸值等。 3.标准品、对照品系指用于鉴别、检查、含量测定的标准物质。 4.标准品与对照品均应附有使用说明书、质量要求(包括水分)、使用效期和装量等。 5.盛装药品的各种容器(包括塞子等)均应无毒、洁净,与内容药品应不发生化学反应,并不影响药品质量。 6.气相色谱法中的顶空进样适用于固体和液体供试品中挥发性组分的分离和测定。 7.紫外-可见分光光度常用的波长范围为200~400nm的紫外光区和400~760nm的可见光区。 8.紫外-可见分光光度法含量测定采用的方法一般有(1)对照品比较法(2)吸收系数法(3)计算分光光度法(4)比色法。药品检验中最常用的是对照品比较法和吸收系数法。 9.2005年版中国药典规定,标示装量为50ml以上的注射液及注射用浓溶液照最低装量检查法检查。 10.糖浆剂系指含有药物的浓蔗糖水溶液,含蔗糖量应不低于45%(g/ml) 11.在氧化还原反应SO2+2H2S=3S+2H2O中,氧化剂是 SO2 ,还原剂是 H2S 。 12.已知在0.5LNaCl溶液中含有0.5molNaCl,则1LNaCl溶液中含NaCl mol。在2LNaOH溶液中含有4molNaOH,则1LNaOH溶液中含NaOH mol。 13.高效液相色谱法的系统适用性试验通常包括理论板数,分离度,重复性和拖尾因子等四个指标。 14.气相色谱法的进样方式一般可采用溶液直接进样或顶空进样。 顶空进样适作于固体和液体供试品中挥发性组分的分离和测定。 15.2005年版中国药典中规定,薄层色谱法应对检测方法进行系统适用性试验,使斑点的检测灵敏度、比移值(Rf)和分离效能符合规定。 二.名词解释 1.片剂:系指药物与适宜的辅料均匀混合,通过制剂技术压制而成的圆片状或异形片状的固体制剂。 2.注射剂:系指药物与适宜的溶剂或分散介质制成的供注入体内的溶液、乳状液或混悬液及供临用前配制或稀释成溶液或混悬液的粉末或浓溶液的无菌制剂。 3.不良反应:指合格药品在正常用法和用量下,出现与药品作用无关的或意外的有害反应。 4.重金属:指在实验条件下能与硫代乙酰胺或硫化物作和显色的金属杂质。 5.药品:用于预防、治疗、诊断人的疾病,有目的的调节人的生理机能并规定有适应症或功能主治、用法用量的物质。 三.选择题 1.下列反应中不属于氧化还原反应的是( C ) A.2KClO3=3KCl+3O2↑ B. 2Na+Cl2=2NaCl C.NH4Cl=NH3↑+HCl↑ D. Fe2O3+3CO=2Fe+3CO2 2.下列物质中,能导电的是(E、F、G) A.干燥的氯化钠晶体 B. 干燥的氢氧化钠晶体 C. 蔗糖晶体 D. 酒精 E. 氯化钠溶液 F. 氢氧化钠溶液 G. 稀盐酸 H. 蒸馏水 3.下列各项中的物质能导电且属于强电解质的是( B ) A.固态氯化镁 B. 液态氯化镁 C. 氨水 D. 液态磷酸 4.下列各组中的离子能在溶液中大量共存的是( B ) A.Fe3+、Na+、NO3-、OH- B. NH4+、Fe3+、SO42-、NO3- C.SO42-、Cl-、Ca2+、Mg2+ D. Ba2+、K+、CO32-、Cl- 5.下列说法正确的是( A、C) A.物质发生化学反应都伴随着能量变化 B.伴随能量变化的物质变化都是化学变化 C.在一个确定的化学反应关系中,反应物的总能量与生成物的总能量一定不同 D.在一个确定的化学反应关系中,反应物的总能量一定高于生成物的总能量 6.下列过程中属于吸热反应的是( C ) A.烧碱固体溶于水中 B. 水与浓硫酸混合 C.硝酸铵固体溶于水中 C. 氯化钠固体溶于水中 7.下列关于NaHCO3性质的说法中,正确的是( A、C ) A.和盐酸反应放出等量CO2所消耗的酸比NaCO3少 B.相同温度下溶解质比NaCO3要在 C.和同浓度盐酸反应比NaCO3产气快 D.NaCO3只能和酸作用不能和碱作用 8.碳酸氢钠受热容易分解为碳酸钠。现加热5.00g的碳酸钠和碳酸氢钠的温合物,使碳酸氢钠完全分解,混合物质量减少了0.31g,则原混合物中碳酸钠的质量为( C ) A.3.38g B. 4.58g C. 4.16g D.4.41g 9.在一定温度下将500ml2mol/LNaCl分为300ml(记为A)和200ml(记为B)两份,判断下列说法是否正确。正确的在括号内打“√”,错误的在括号内打“×” (1)( √ )A、B中物质的摩尔浓度相同 (2)( × )A中NaCl物质的摩尔浓度较大 (3)( × )A中NaCl的物质的量较小 (4)( √ )B中NaCl的物质的量较小 (5)( √ )A、B的密度相同 (6)( √ )A中H2O的物质的量较大 10.用氢氧化钠固体配制一定摩尔浓度的NaOH溶液,下列情况使NaOH溶液浓度偏高的是(A、C) A.所用的氢氧化钠中混有Na2O B.用托盘天平称取一定质量的NaOH时,所用的小烧杯内壁不太干燥 C.NaOH在烧杯中预溶后立即将溶液转移到容量瓶内,正确的完成了以后的操作 D.最后确定NaOH溶液的体积(定容)时,用仰视式观察液面与容量瓶刻度线之间的关系 11.使用胆矾配制1L0.1mol/L的CuSO4溶液,正确的做法是(C、D) A.将胆矾加热除去结晶水后,称取16g溶于1L水中 B.称取胆矾25g溶于1L水中 C.将25g胆矾溶于少量水,然后将溶液稀释至1L D.将16g无水硫酸酮溶于水,然后将此溶液稀释至1L 12.300mlNaOH溶液中含NaOH30g,用这种溶液配制NaOH摩尔浓度为2mol/L的溶液,下列说法中正确的是(B、C) A.原溶液与水的体积比约为1:4 B.原溶液与水的体积比约为4:1 C.原溶液与新溶液的体积比为4:5 D.原溶液与新溶液的体积比为5:4 13.现将x%的H2SO4溶液和3%的H2SO4溶液等体积混合,所得混合溶液的质量分数为n%,则n与x的关系是( C ) A.n=2x B. n<2x C. n>2x D. 无法判断 14.溶质质量分数分别为a%和5a%的H2SO4溶液按等体积混合均匀后,混合液中H2SO4的质量分数为( C ) A.3a% B. 6a C. >3a% D. <3a% 15.有两种气体X、Y,均易溶于水,但不与水反应,且Y的相对分子量是X相对分子量的两倍,则下列说法正确的是( B、C ) A.同温同压下,同体积的X、Y两气体,其质量之比为2:1 B.同温同压下,同质量的X、Y两气体,其体积比为2:1 C.同温同压下,同质量的X、Y两气体,分别溶于水配制成同体积的X的溶液、Y的溶液,其摩尔浓度之比为2:1 D.同温同压、同体积X、Y两气体分子数目比为2:1 16.要配制浓度约为2mol/L的氢氧化钠溶液100ml,下面的操作正确的是( A、D ) A.称取8gNaOH固体,放入250ml烧杯中,用100ml量筒取100ml纯化水,加入烧杯中,同时不断搅拌至固体溶解。 B.称取8gNaOH固体,放入100ml量筒中,边搅拌,边慢慢加入纯化水,待固体完全溶解后用纯化水稀释至100ml C.称取8gNaOH固体,放入100ml容量瓶中,加入适量纯化水,振荡容量瓶使固体溶解,再加入到刻度,盖好瓶塞,反复摇匀 D.用100ml量筒量取40ml5mol/LNaOH溶液,倒入250ml烧杯中,再用同一量筒取60ml纯化水,不断搅拌,慢慢倒入烧杯中 17.“84”消毒液在日常生活中被广泛使用,该消毒液无色,pH大于7,对某些有色物质有漂白作用。它可能的有效成分是( D ) A.SO2 B. Na2CO3 C. KMnO4 D. NaClO 18.下列试剂保存方法中不正确的是( D ) A.AgNO3溶液保存在棕色细口瓶中 B.氢氟酸保存在特制塑料瓶中 C.澄清石灰水保存在带胶塞的无色细口玻璃瓶中 D.AgBr保存在无色试剂瓶中 19.下列物质不会因见光而分解的是( A ) A.NaHCO3 B. HNO3 C. AgI D.HClO 20.向碘化钾溶液中加入硝酸银溶液,直到沉淀完全为止。已知反应后生成硝酸盐溶液的质量恰好等于反应前原碘化钾溶液的质量。则加入的硝酸银溶中溶质的质量分数为( C ) A.69% B. 75% C. 72.3% D. 48.3% 四.综合题 1.用化学方程式表示下列反应,并注明反应属于那种类型 ①三氧化硫与水反应 ②加热高锰酸钾制氧气 ③氧化铁与盐酸反应 ④氧化铜跟铝在高温下生成氧化铝和铜 答案:①化合反应SO2+H2O=H2SO4 ②分解反应2KMnO4=K2MnO4+MnO2+O2↑ ③复分解反应FeO3+6HCl=2FeCl3+3H2O ④置换反应3CuO+2Al=Al2O3+3Cu 2.某元素R和氧元素形成的原子团为RO4—,其中R元素的化合价为 +7 ;某元素M与氢元素形成的原子团为MH4+,其中M元素的化合价为 —3 。
