工程热力学重点内容

绪论+基本概念
研究对象:研究热能与机械能相互转换规律。目的:提高热能利用率。研究内容:热力学两大基本性质,工质的热力性质和热力过程,以及理论在热力过程和循环装置中的应用。方法:宏观,唯象。
工质:实现能量相互转换的媒介物质。热力系统:被人为分割出来作为热力学分析对象的有限物质系统。外界:热力系统周围物体。边界:热力系与外界的交界面。闭口系统:只有能量交换而无物质交换CM。开口系统:有能量交换和物质交换CV。绝热系:与外界无热量交换。孤立系:无能量无物质交换。热源:与外界仅有热量交换,且有限热量交换不引起系统温度变化。平衡状态:平衡状态:在没有外界影响(重力场除外)的条件下,系统的宏观性质不随时间变化的状态。充要条件:系统内部及系统与外界之间各种不平衡势差(力差、温差、化学势差)
的消失。平衡状态具有确定的状态参数。强度量:与系统内所含工质的数量无关的状态参数。广延量:广延参数具有可加性。单位质量的广延参数具有强度参数的性质,称为比参数。温度:是物系间达到热平衡的判据物质分子热运动的激烈程度。习惯上:物体冷热程度的度量。是确定一个系统是否与其他系统处于热平衡的状态函数。温度是热平衡的唯一判据。热力学第零定律:若两个热力系中的每一个都与第三个系统处于热平衡,那么它们彼此也处于热平衡。温标:温度的定量表示法。压力:单位面积上承受的垂直作用力。对于气体,实质上是气体分子运动撞击容器壁面,在单位面积的容器壁面上所呈现的平均作用力。单位:Pa,kPa,MPa 。压力表测量的压力-表压力p g,真空表测量力-真空度p v,工质的真实压力-绝对压力p,大气压力p b。p〉p b,p=pg+pb,p〈pb,p=pb-pv。比体积:单位质量工质所占有的体积。m3/kg。热力过程:热力系从一个状态向另一个状态变化时所经历的全部状态的总和。准平衡过程(准静态过程):由一系列无限接近于平衡态的状态所组成的过程.(着眼于系统)/偏离平衡态无穷小,随时恢复平衡的状态变化过程。实现条件:推动过程进行的势差无限小。这样保证系统在任意时刻皆无限接近于平衡态。建立准平衡过程概念的好处:①可以用确定的状态参数变化描述过程;②可以在参数坐标图上用一条连续曲线表示过程。可逆过程:如果系统完成某一热力过程后,再沿原来路径逆向进行时,能使系统和外界都返回原来状态而不留下任何变化。实现条件:准平衡过程过程中无任何耗散效应(通过摩擦、电阻、磁阻等使功变成热的效应)无耗散的准平衡过程为可逆过程。功(可逆过程)
w>0膨胀功(对外作功)w<0压缩功(消耗功)热量:热力系和外界之间仅仅由
于温度不同而通过边界传递的能量。吸热为正,放热为负。功和热均由边界传递能量,均为过程两,压差,温差为各自推动力,功宏观,热微观。热力循环:工质由某一初态出发,经历一系列热力状态变化后,又回到原来初态的封闭热力过程。目的:为了实现预期连续的能量转换。按照性质分:可逆循环(全部由可逆过程组成的循环)和不可逆循环(含有不可逆过程的循环)按照目的分:正向循环(即动力循环)热效率ηt =Wnet/Qh对外做的功,从高温热源取得的热量。和逆向循环(即制冷循环制冷系数从低温热源取出的热,取这些热做的功。热泵循环供热系数)给高温热源提供的热,提供热耗费的功。难点诠释。平衡状态:参数不随时间改变只是现象,不能作为判断系统是否平衡的条件,只有系统内部及系统与外界之间的一切不平衡势差的消失,才是实现平衡的本质,也是实现平衡的充要条件。平衡必稳定,稳定未必平衡。平衡是相对时间而言,而均匀是相对空间而言。平衡不一定均匀。特点:平衡状态具有确定的状态参数。建立可逆过程概念的目的①使得系统与外界功量和热量的交换能用系统的参数来计算,而无需考虑往往不知道情况的外界参数②由于可逆过程进行的结果不会产生任何能量损失,因而可逆过程可以作为实际过程中能量转换效果比较的标准和极限;③因实际过程或多或少地存在着各种不可逆因素(如摩擦、温差、力差或化学势差),所以实际过程都是不可逆的。为简便起见,通常把实际过程当作可逆过程进行分析计算,然后再用一些经验加以修正。
热力学第一定律实质:能量转换与守恒定律在热现象中的应用。表述:当热能与其他形式的能量相互转换时,能的总量保持不变。第一类永动机是不可能制造成功的。内部储存能—热力学能:储存于系统内部的能量,物质内部粒子热运动具有的能量的总和。⑴内动能T ⑵内位能p ⑶电磁能等。外部储存能总储存能
体积变化功W。轴功W s:系统通过轴与外界交换的功量。推动功和流动功:开口系因工质流
动而传递的功称为推动功--pV 进出pV的推动功之差称为流动功:
焓物理意义:表示了工质流动而携带的取决于热力状态的能量。状态参数,与是否流动无关。H=U+PV
热力学第一定律能量方程闭口系:(适用任何工质))若是可逆过程:。循环
开口系:稳定流动:开口系内任意一点工质的状态参数及运动参数不随时间变化
可逆过程:
理想气体热力性质及热力过程定义:是一种实际上并不存在的假想气体,其分子间没有作用力,分子本身是不占
体积的弹性质点。理想气体状态方程:pa m3 J/(kg.k) K Rg=R/M R=8.314J/(mol.k) kg/mol
P V m=RT m3/mol Vm0=0.0224m3/mol PV=nRT气体常数R g与气体所处状态无关,随气体种类而异。P0=0.1013MP
理想气体比热容热容:物体温度升高1K所需的热量。质量热容(比热容) :单位质量的物体升高1K所需的热量。c=C/m J/(kg.k)摩尔热容C m=C/n, J/(mol?K)容积热容C’=C/V0, J/(m 3?K) 比定压热容比定容热
容比热容比:平均比热容
定值比热容c
v单原子分子
3/2Rg 双原子分子5/2Rg 多原子7/2 c p单5/2 双7/2 多9/2 理想气体的
热力学能、焓和熵
理想气体混合物
由理想气体组成的混合物。组元(组分) :组成混合物的各种气体。分压力定律与分容积定律。分压力:混和气体中第i种组元气体单独占有与混和气体相同的体积,并处于混和气体相同的温度时,所呈现的压力。V T均相同,压力,物质的量为各组分之和。分容积:混合气体中第i种组元气体在混合气体温度和压力下单独存在时占有的容积.V,n 不同,PT相同。混合物成分:各组元的含量占总量的百分比。质量分数wi=mi/m wi总=1 摩尔分数xi=ni/n xi和=1 体积分数:φi=Vi/V 三者关系折合摩尔质量:
折合气体常数:分压力计算:
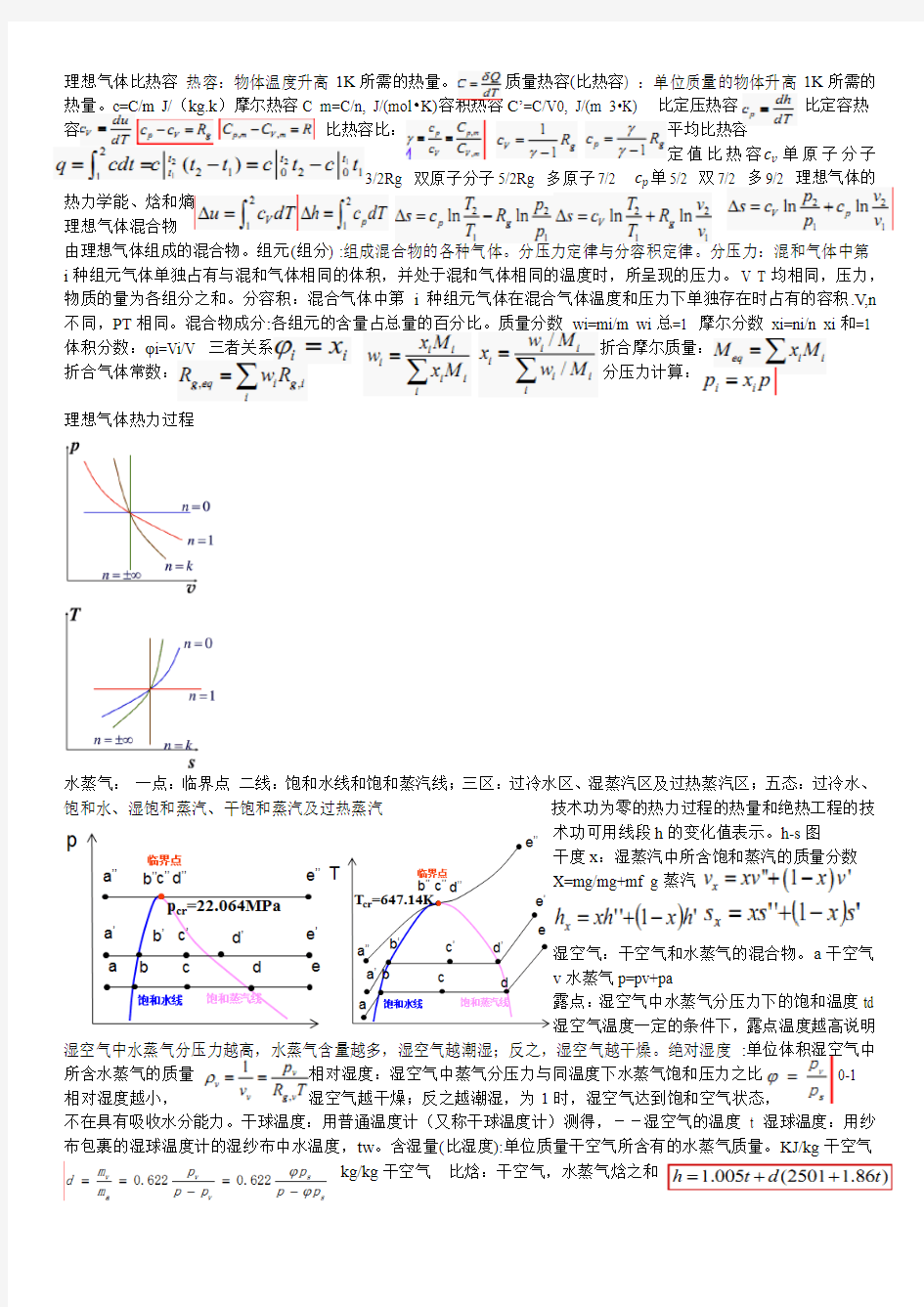
理想气体热力过程
水蒸气:一点:临界点二线:饱和水线和饱和蒸汽线;三区:过冷水区、湿蒸汽区及过热蒸汽区;五态:过冷水、饱和水、湿饱和蒸汽、干饱和蒸汽及过热蒸汽技术功为零的热力过程的热量和绝热工程的技
术功可用线段h的变化值表示。h-s图
干度x:湿蒸汽中所含饱和蒸汽的质量分数
X=mg/mg+mf g蒸汽
湿空气:干空气和水蒸气的混合物。a干空气
v水蒸气p=pv+pa
露点:湿空气中水蒸气分压力下的饱和温度td
湿空气温度一定的条件下,露点温度越高说明湿空气中水蒸气分压力越高,水蒸气含量越多,湿空气越潮湿;反之,湿空气越干燥。绝对湿度:单位体积湿空气中所含水蒸气的质量相对湿度:湿空气中蒸气分压力与同温度下水蒸气饱和压力之比0-1
相对湿度越小,湿空气越干燥;反之越潮湿,为1时,湿空气达到饱和空气状态,
不在具有吸收水分能力。干球温度:用普通温度计(又称干球温度计)测得,--湿空气的温度t 湿球温度:用纱布包裹的湿球温度计的湿纱布中水温度,tw。含湿量(比湿度):单位质量干空气所含有的水蒸气质量。KJ/kg干空气
kg/kg干空气比焓:干空气,水蒸气焓之和
热力学第二定律:克劳修斯:不可能把热从低温物体传到高温物体而不引起其他变化。开尔文:不可能制造出从单一热源吸热,使之全部转化为功而不留下其他任何变化的热机。第二类永动机(以环境为单一热源吸热对外做功)是不可以制造成功的。
动力循环:顺时针 逆向循环(逆时针):制冷机 热泵 卡诺循环:理想气体 四个可逆过程
概括性卡诺循环:
卡诺定理:卡诺定理一:在相同温度的高温热源和相同温度的低温热源之间工作的一切可逆循环,其热效率都相等,与工质以及循环形式无关. 卡诺定理二:在相同温度的高温热源和相同温度的低温热源之间工作的一切不可逆循环,其热效率必小于可逆循环的热效率.<1> 在两个热源间工作的一切可逆循环,它们的热效率相同,与工质的性质无关,只决定于热源和冷源的温度,且都等于卡诺循环的热效率 t ;<2> 温度界限相同,但具有多于两个热源的可逆循环,其热效率低于卡诺循环;<3> 不可逆循环的热效率小于同样条件下的可逆循环。
克劳修斯积分式 循环过程: 克劳修斯不等式=0,可逆循环,<0不可逆循环 >0,不可能。(针对工质) 孤立系熵增原理: (热机,A 是高温热源)若为制冷
则符号相反
火用:在环境条件下,能量中可转化为有用功的最高份额;热力系只与环境相互作用,从任意状态可逆地变化到与环境相平衡状态时,作出的最大有用功。 (孤立系) 火无:在环境条件下不可能转化为有用功的那部分能量
喷管:设计与校核 已知进口处参数p1,T1,C1,qm,背压pb 1.比较背压与进口压的比值和临界圧比Vcr 的关系,大于选渐缩,小于选缩放。渐缩p2=pb,缩放p2=pcr 。2。根据定熵过程状态参数之间的关系计算重要界面参数,临界,出口。Pcr 由临界压比关系计算,体积和温度由定熵过程的公式和理想气体状态方程计算。出口压已确定,T,V 在利用1-2的定熵计算。3.计算主要气体流速:c 2=√2(?1??2)=√2c p (T 1?T 2) 4.计算截面参数qm=Ac/v,得截面积。 注意,这里是忽略c1,Ma<1,渐缩,Ma>1,渐扩,Ma<1-Ma>1缩放
滞止过程:对于任意速度不为零的气体,被固体壁面所滞止,或经扩压管后其
速度较低为零的过程。与外界无热交换叫绝热滞止。此时的状态参数称为滞止
参数。T0=T1+C 122C P P0=P1(T0T1)K K?1 在计算时利用滞止参数计算即可。
压气机的热力过程:消耗外功使气体压缩升压的设备。单级活塞式压缩机工作过程,吸气,压缩,排气。增压比π
=p2/p1 可逆 开口系Q=△H+Wt,
压缩过程分为三种,绝热,多变,定温。三种功和温度特点读图
多级压缩:T2’=T1
叶轮式压缩机为绝热压缩
热力循环及装置
内燃机:直接在机内的气缸或燃烧室中进行燃烧液体燃料内燃机(汽油机、柴油机)气体燃料内燃机(煤气机)四冲程内燃机(进气、压缩、燃烧和膨胀、排气)二冲程内燃机压燃式(柴油机)点燃式(汽油机、煤气机)
活塞式压缩机混合加热吸气压缩喷油、燃烧燃烧膨胀作功排气
压缩比ε=v1
定容增压比入=p3/p2
v2
定容预胀比ρ=v4
v3
定容加热定压加热
制冷压缩
南京师范大学《工程热力学》考试重点笔记.doc
南京师范大学《工程热力学》考试重点笔记专业课复习资料(最新版)封面 南京师范大学工程热力学第第 1 章基本概念本章基本要求:深刻理解热力系统、外界、热力平衡状态、准静态过程、可逆过程、热力循环的概念,掌握温度、压力、比容的物理意义,掌握状态参数的特点。本章重点:取热力系统,对工质状态的描述,状态与状态参数的关系,状态参数,平衡状态,状态方程,可逆过程。1. 1 热力系统一、热力系统热力系统一、热力系统系统:用界面从周围的环境中分割出来的研究对象,或空间内物体的总和。外界:与系统相互作用的环境。界面:假想的、实际的、固定的、运动的、变形的。依据:系统与外界的关系,系统与外界的作用:热交换、功交换、质交换。二、闭口系统和开口系统(按系统与外界有无物质交换)闭口系统:系统内外无物质交换,称控制质量。开口系统:系统内外有物质交换,称控制体积。三、绝热系统与孤立系统绝热系统:系统内外无热量交换 (系统传递的热量可忽略不计时,可认为绝热)孤立系统:系统与外界既无能量传递也无物质交换=系统+相关外界=各相互作用的子系统之和= 一切热力系统连同相互作用的外界 四、根据系统内部状况划分可压缩系统:由可压缩流体组成的系统。简单可压缩系统:与外界只有热量及准静态容积变化均匀系统:内部各部分化学成分和物理'性质都均匀一致的系统,是由单相组成的。非均匀系统:由两个或两个以上的相所组成的系统。单元系统:一种均匀的和化学成分不变的物质组成的系统。多元系统:由两种或两种以上物质组成的系统。单相系:系统中工质的物理、化学性质都均匀一致的系统称为单相系。复相系:由两个相以上组成的系统称为复相系,如固、液、气组成的三相系统。注意:系统的选取方法仅影响解决问题的繁复程度,与研究问题的结果无关。思考题:孤立系统一定是闭口系统吗。反之怎样。孤立系统一定不是开口的吗。孤立系统是否一定绝热。1 .2 工质的热力状态与状态参数一、状态与状态参数状态:工质的热力状态与状态参数一、状态与状态参数状态:热力系统中某瞬间表现的工质热力性质的总状况。状态参数:描述工质状态特性的各种状态的宏观物理量。如:温度(T)、压力(P)、比容()或密度()、内能(u)、焓(h)、熵(s)、自由能(f)、自由焓(g)等。状态参数的数学特性:1.1212x x dx 有关,而与状态变化的途径无关。2. dx =0 表明:状态参数的循环积分为零基本状态参数:可直接或间接地用仪表测量出来的状态参数。如:温度、压力、比容或密度1 .温度:宏观上,是描述系统热力平衡状况时冷热程度的物理量。微观上,是大量分子热运动强烈程度的量度BTw m22式中22w m分子平移运动的动能,其中 m 是一...
工程热力学知识点总结
工程热力学大总结 '
… 第一章基本概念 1.基本概念 热力系统:用界面将所要研究的对象与周围环境分隔开来,这种人为分隔的研究对象,称为热力系统,简称系统。 边界:分隔系统与外界的分界面,称为边界。 外界:边界以外与系统相互作用的物体,称为外界或环境。 闭口系统:没有物质穿过边界的系统称为闭口系统,也称控制质量。 ) 开口系统:有物质流穿过边界的系统称为开口系统,又称控制体积,简称控制体,其界面称为控制界面。 绝热系统:系统与外界之间没有热量传递,称为绝热系统。 孤立系统:系统与外界之间不发生任何能量传递和物质交换,称为孤立系统。 单相系:系统中工质的物理、化学性质都均匀一致的系统称为单相系。 复相系:由两个相以上组成的系统称为复相系,如固、液、气组成的三相系统。 单元系:由一种化学成分组成的系统称为单元系。 多元系:由两种以上不同化学成分组成的系统称为多元系。 } 均匀系:成分和相在整个系统空间呈均匀分布的为均匀系。 非均匀系:成分和相在整个系统空间呈非均匀分布,称非均匀系。 热力状态:系统中某瞬间表现的工质热力性质的总状况,称为工质的热力状态,简称为状态。 平衡状态:系统在不受外界影响的条件下,如果宏观热力性质不随时间而变化,系统内外同时建立了热的和力的平衡,这时系统的状态称为热力平衡状态,简称为平衡状态。 状态参数:描述工质状态特性的各种物理量称为工质的状态参数。如温度(T)、压力(P)、比容(υ)或密度(ρ)、内能(u)、焓(h)、熵(s)、自由能(f)、自由焓(g)等。 基本状态参数:在工质的状态参数中,其中温度、压力、比容或密度可以直接或间接地用仪表测量出来,称为基本状态参数。
工程热力学(1)考试复习重点总结
第一章 基本概念及定义 一、填空题 1、热量与膨胀功都是 量,热量通过 差而传递热能,膨胀功通过 差传递机械能。 2、使系统实现可逆过程的条件是:(1) ,(2) 。 3、工质的基本状态参数有 、 、 。 4、热力过程中工质比热力学能的变化量只取决于过程的___________而与过程的路经无关。 5、热力过程中热力系与外界交换的热量,不但与过程的初终状态有关,而且与_______有关。 6、温度计测温的基本原理是 。 二、判断题 1、容器中气体的压力不变则压力表的读数也绝对不会改变。( ) 2、无论过程是否可逆,闭口绝热系统的膨胀功总是等于初、终态的内能差。( ) 3、膨胀功的计算式?= 2 1 pdv w ,只能适用于可逆过程。 ( ) 4、系统的平衡状态是指系统在无外界影响的条件下(不考虑外力场作用),宏观热力性质不随时间而变化的状态。( ) 5、循环功越大,热效率越高。( ) 6、可逆过程必是准静态过程,准静态过程不一定是可逆过程。( ) 7、系统内质量保持不变,则一定是闭口系统。( ) 8、系统的状态参数保持不变,则系统一定处于平衡状态。( ) 9、孤立系统的热力状态不能发生变化。( ) 10、经历一个不可逆过程后,系统和外界的整个系统都能恢复原来状态。( ) 三、选择题 1、闭口系统功的计算式21u u w -=( )。 (A )适用于可逆与不可逆的绝热过程 (B )只适用于绝热自由膨胀过程 (C )只适用于理想气体绝热过程 (D )只适用于可逆的绝热过程 2、孤立系统是指系统与外界( )。 (A )没有物质交换 (B )没有热量交换 (C )没有任何能量交换 (D )没有任何能量传递与质交换 3、绝热系统与外界没有( )。 (A )没有物质交换 (B )没有热量交换 (C )没有任何能量交换 (D )没有功量交换
工程热力学复习重点
工程热力学复习重点 -标准化文件发布号:(9456-EUATWK-MWUB-WUNN-INNUL-DDQTY-KII
工程热力学复习重点2012 工程热力学复习重点 绪论 [1] [2] [3] 理解和掌握工程热力学的研究对象、主要研究基本概念及定义 1. 1 热力系统 一、热力系统 系统:用界面从周围的环境中分割出来的研究对象,或空间内物体的总和。 外界:与系统相互作用的环境。 界面:假想的、实际的、固定的、运动的、变形的。 依据:系统与外界的关系 系统与外界的作用:热交换、功交换、质交换。 二、闭口系统和开口系统 闭口系统:系统内外无物质交换,称控制质量。 开口系统:系统内外有物质交换,称控制体积。 三、绝热系统与孤立系统 绝热系统:系统内外无热量交换 (系统传递的热量可忽略不计时,可认为绝热) 孤立系统:系统与外界既无能量传递也无物质交换 =系统+相关外界=各相互作用的子系统之和= 一切热力系统连同相互作用的外界 四、根据系统工质的热力状态与状态参数 一、状态与状态参数 状态:热力系统中某瞬间表现的工质热力性质的总状况。状态参数:描述工质状态特性的各种状态的宏观物理量。 如:温度(T)、压力(P)、比容(υ)或密度(ρ)、内能(u)、焓(h)、熵(s)、自由能(f)、自由焓(g)等。 状态参数的数学特性: 1. 2
1dx x2x1 表明:状态的路径积分仅与初、终状态有关,而与状态变化的途径无关。2.dx=0 表明:状态参数的循环积分为零 基本状态参数:可直接或间接地用仪表测量出来的状态参数:温度、压力、比容或密度 温度:宏观上,是描述系统热力平衡状况时冷热程度的物理量。微观上,是大量分子热运动强烈程度的量度 2.压力: 垂直作用于器壁单位面积上的力,称为压力,也称压强。 F; p式中:F—整个容器壁受到的力,单位为牛顿(N)f f—容器壁的总面积(m2)。 微观上:分子热运动产生的垂直作用于容器壁上单位面积的力。压力测量依据:力平衡原理压力单位:MPa 相对压力:相对于大气环境所测得的压力。工程上常用测压仪表测定的压力。以大气压力为计算起点,也称表压力。 p B pg (P>B) p B H (P<B) 式中 B—当地大气压力 Pg—高于当地大气压力时的相对压力,称表压力; H —低于当地大气压力时的相对压力,称为真空值。注意:只有绝对压力才能代表工质的状态参数3.比容: 比容:单位质量工质所具有的容积。密度:单位容积的工质所具有的质量。 v V m m3/kg 关系:v 1 式中:—工质的密度 kg/m3 ,v—工质的比容 m3/kg 例:表压力或真空度为什么不能当作工质的压力工质的压力不变化,测量它的压力表或真空表的读数是否会变化? 解:作为工质状态参数的压力是绝对压力,测得的表压力或真空度都是工质的绝对压力与大气压力的相对值,因此不能作为工质的压力;因为测得的是工质绝对压力与大气压力的相对值,即使工质的压力不变,当大气压力改变时也会引起压力表或真空表读数的变化。 1.3准静态过程与可逆过程
工程热力学考研试题及答案
1.湿蒸汽的状态参数p,t,v,x 中,不相互独立的一对是(D )D .(p,t)2.在不可逆循环中(B )A . ??>?ds T q B . ??t w >t C .t DP =t w =t D .t w > t DP >t 6.如果孤系内发生的过程都是可逆过程,则系统的熵(C ) A .增大 B .减小 C .不变 D .可能增大,也可能减小21.理想气体的可逆过程方程式=n pv 常数,当n = ∞ 时,即为等体过程。 7.pdv dT c q v +=δ适用于(A )A .可逆过程,理想气体 B .不可逆过程,理想气体 C .可逆过程,实际气体 D .不可逆过程,实际气体 8.电厂蒸汽动力循环回热是为了(C )A .提高循环初参数 B .降低循环终参数C .提高平均吸热温度 D .提高汽轮机的相对内效率 9.活塞式压气机采取分级压缩( C )A .能省功 B .不能省功 C .不一定省功 D .增压比大时省功 10.理想情况下活塞式压气机余隙体积的增大,将使生产1kg 压缩空气的耗功量(C )A 增大 B .减小C .不变 D .的变化视具体压缩空气的耗功量 11.下列各项中,不影响燃烧过程热效应的是(C )A .反应物的种类 B .反应温度C .反应速度D .反应压力 12.欲使亚声速气流加速到超声速气流应采用(C )A .渐缩喷管B .渐扩喷管C .缩放喷管D .前后压差较大直管 13.水蒸汽h -s 图上定压线(C .在湿蒸汽区是直线,在过热蒸汽区是曲线 14.为提高空气压缩制冷循环的制冷系数,可以采取的措施是(D ) A .增大空气流量 B .提高增压比C .减小空气流量 D .降低增压比 15.在范德瓦尔方程中,常数b 为考虑气体 而引入的修 正项。(C )A 分子间内位能 B .分子运动动能C .分子本身体积D .分子间相互作用力 二、多项选择题16.理想气体可逆等温过程的体积变化功w 等于(AC )A .2 1 p p RT ln B .1 2p p RT ln C .1 2v v RT ln D .2 1v v RT ln E .(p 2v 2-p 1v 1) 17.vdp dh q -=δ适用于 AC A .可逆过程,理想气体 B .不可逆过程,理想气体 C .可逆过程,实际气体D .不可逆过程,实际气体 E .任意过程,任意气体 18.再热压力若选得合适,将使(BCDE ) A .汽耗率提高 B .热耗率提高 C .循环热效率提高 D .排汽干度提高 E .平均吸热温度提高 19.马赫数小于1的气流可逆绝热地流过缩放管时,如果把喷管的渐扩段尾部切去一段,在其他条件不变的情况下,其(BDE )A .流量变小B .流量不变 C .流量变大 D .出口压力变大E .出口速度变大 20.不可逆循环的热效率(BE ) A .低于可逆循环的热效率 B .在相同的高温热源和低温热源间低于可逆循环的热效率 C .高于可逆循环的热效率 D .在相同的高温热源和低温热源间高于可逆循环的热效率 E .可能高于,也可能低于可逆循环的热效率 三、填空题 22.在一定的压力下,当液体温度达到 饱和 时,继续加热,立即出现强烈的汽化现象。 23.湿空气的绝对温度是指lm 3湿空气中所含水蒸汽的 质 量 。 24.火电厂常用的加热器有表面式和 混合 式。 25.可逆绝热地压缩空气时,无论是活塞式压气机还是叶轮式压气机,气体在压气机内的 状态变化 规律是相同的。 26.理想气体的绝热节流效应是 零效应 。 27.利用平均比热表计算任意体积气体在定压过程中的吸热量时,应使用公式 Q =V 0 )t |c -t |(c 1t 0'p 2t 0'p 1 2?? 。 28.图示通用压缩子图上一状态点A ,其位置表明: 在该状态下气体分子之间的相互作用力 主要表现为 排斥 力。
工程热力学复习重点及简答题
工程热力学复习重点2012. 3 绪论 [1]理解和掌握工程热力学的研究对象、主要研究内容和研究方法 [2]理解热能利用的两种主要方式及其特点 [3]了解常用的热能动力转换装置的工作过程 1.什么是工程热力学 从工程技术观点出发,研究物质的热力学性质,热能转换为机械能的规律和方法,以及有效、合理地利用热能的途径。 2.能源的地位与作用及我国能源面临的主要问题 3. 热能及其利用 [1]热能:能量的一种形式 [2]来源:一次能源:以自然形式存在,可利用的能源。 如风能,水力能,太阳能、地热能、化学能和核能等。 二次能源:由一次能源转换而来的能源,如机械能、机械能等。 [3]利用形式: 直接利用:将热能利用来直接加热物体。如烘干、采暖、熔炼(能源消耗比例大) 间接利用:各种热能动力装置,将热能转换成机械能或者再转换成电能, 4..热能动力转换装置的工作过程 5.热能利用的方向性及能量的两种属性 [1]过程的方向性:如:由高温传向低温 [2]能量属性:数量属性、,质量属性(即做功能力) [3]数量守衡、质量不守衡 [4]提高热能利用率:能源消耗量与国民生产总值成正比。 第1章基本概念及定义 1. 1 热力系统 一、热力系统 系统:用界面从周围的环境中分割出来的研究对象,或空间内物体的总和。 外界:与系统相互作用的环境。 界面:假想的、实际的、固定的、运动的、变形的。 依据:系统与外界的关系 系统与外界的作用:热交换、功交换、质交换。 二、闭口系统和开口系统 闭口系统:系统内外无物质交换,称控制质量。 开口系统:系统内外有物质交换,称控制体积。 三、绝热系统与孤立系统 绝热系统:系统内外无热量交换(系统传递的热量可忽略不计时,可认为绝热) 孤立系统:系统与外界既无能量传递也无物质交换
工程热力学第二章整理知识点第三版
工程热力学第三版 沈维道蒋智敏童钧耕合编 第二章热力学第一定律 热力学第一定律(能量守恒与转换定律):自然界中的一切物质都具有能量, 能量不可能被创造, 也不可能被消灭;但能量可以从一种形态转变为另一种形态,且在能量的转化过程中能量的总量保持不变。它确定了热力 过程中热力系与外界进行能量交换时,各种形态能量数量上的守恒关系。 能量是物质运动的度量。分子运动学说阐明了热能是组成物质的分子、原子等微粒的杂乱运动———热运动的能量。 根据气体分子运动学说,热力学能是热力状态的单值函数。在一定的热 力状态下, 分子有一定的均方根速度和平均距离, 就有一定的热力学能, 而与达到这一热力状态的路径无关,因而热力学能是状态参数。由于气体的热力状态可由两个独立状态参数决定, 所以热力学能一定是两个独立状态参数的函数,如: u = f( T, v) 或 u = f( T, p) ; u = f( p, v)
能量传递方式:作功和传热。作功来传递能量总是和物体的宏观位移有关。 功的形式除了膨胀功或压缩功这类与系统的界面移动有关的功外, 还有因工质在开口系统中流动而传递的功, 这种功叫做推动功。对开口系统进行功的计算时需要考虑这种功。 开口系统和外界之间功的交换。 取燃气轮机为一开口系统,当1 kg工质从截面 1 - 1 流入该热力系时, 工质带入系统的 推动功为 p 1 v 1 , 工质在系统中进行膨胀, 由状态 1 膨胀到状态 2, 作膨胀功 w, 然后从截面 2 - 2 流出, 带出系统的推动功为 p 2 v 2 。推动功差 Δ( pv) = p 2 v 2 - p 1 v 1 是系统为维持工质流动所需的功,称为流动功(系统为维持工质流动所需的功)。在不考虑工质的动能及位能变化时,开口系与外界交换的功量是膨胀功与流动功之差w - ( p 2 v 2
工程热力学基本概念及重要公式
工程热力学基本概念及 重要公式 Company number:【WTUT-WT88Y-W8BBGB-BWYTT-19998】
第一章基本概念1.基本概念 热力系统:用界面将所要研究的对象与周围环境分隔开来,这种人为分隔的研究对象,称为热力系统,简称系统。 边界:分隔系统与外界的分界面,称为边界。 外界:边界以外与系统相互作用的物体,称为外界或环境。 闭口系统:没有物质穿过边界的系统称为闭口系统,也称控制质量。 开口系统:有物质流穿过边界的系统称为开口系统,又称控制体积,简称控制体,其界面称为控制界面。 绝热系统:系统与外界之间没有热量传递,称为绝热系统。 孤立系统:系统与外界之间不发生任何能量传递和物质交换,称为孤立系统。 单相系:系统中工质的物理、化学性质都均匀一致的系统称为单相系。 复相系:由两个相以上组成的系统称为复相系,如固、液、气组成的三相系统。 单元系:由一种化学成分组成的系统称为单元系。 多元系:由两种以上不同化学成分组成的系统称为多元系。 均匀系:成分和相在整个系统空间呈均匀分布的为均匀系。 非均匀系:成分和相在整个系统空间呈非均匀分布,称非均匀系。 热力状态:系统中某瞬间表现的工质热力性质的总状况,称为工质的热力状态,简称为状态。 平衡状态:系统在不受外界影响的条件下,如果宏观热力性质不随时间而变化,系统内外同时建立了热的和力的平衡,这时系统的状态称为热力平衡状态,简称为平衡状态。
状态参数:描述工质状态特性的各种物理量称为工质的状态参数。如温度(T)、压力(P)、比容(υ)或密度(ρ)、内能(u)、焓(h)、熵(s)、自由能(f)、自由焓(g)等。 基本状态参数:在工质的状态参数中,其中温度、压力、比容或密度可以直接或间接地用仪表测量出来,称为基本状态参数。 温度:是描述系统热力平衡状况时冷热程度的物理量,其物理实质是物质内部大量微观分子热运动的强弱程度的宏观反映。 热力学第零定律:如两个物体分别和第三个物体处于热平衡,则它们彼此之间也必然处于热平衡。 压力:垂直作用于器壁单位面积上的力,称为压力,也称压强。 相对压力:相对于大气环境所测得的压力。如工程上常用测压仪表测定系统中工质的压力即为相对压力。 比容:单位质量工质所具有的容积,称为工质的比容。 密度:单位容积的工质所具有的质量,称为工质的密度。 强度性参数:系统中单元体的参数值与整个系统的参数值相同,与质量多少无关,没有可加性,如温度、压力等。在热力过程中,强度性参数起着推动力作用,称为广义力或势。 广延性参数:整个系统的某广延性参数值等于系统中各单元体该广延性参数值之和,如系统的容积、内能、焓、熵等。在热力过程中,广延性参数的变化起着类似力学中位移的作用,称为广义位移。 准静态过程:过程进行得非常缓慢,使过程中系统内部被破坏了的平衡有足够的时间恢复到新的平衡态,从而使过程的每一瞬间系统内部的状态都非常接近平衡状态,整个过程可看作是由一系列非常接近平衡态的状态所组成,并称之为准静态过程。
工程热力学知识点
工程热力学复习知识点 一、知识点 基本概念的理解和应用(约占40%),基本原理的应用和热力学分析能力的考核(约占60%)。 1. 基本概念 掌握和理解:热力学系统(包括热力系,边界,工质的概念。热力系的分类:开口系,闭口系,孤立系统)。 掌握和理解:状态及平衡状态,实现平衡状态的充要条件。状态参数及其特性。制冷循环和热泵循环的概念区别。 理解并会简单计算:系统的能量,热量和功(与热力学两个定律结合)。 2. 热力学第一定律 掌握和理解:热力学第一定律的实质。 理解并会应用基本公式计算:热力学第一定律的基本表达式。闭口系能量方程。热力学第一定律应用于开口热力系的一般表达式。稳态稳流的能量方程。 理解并掌握:焓、技术功及几种功的关系(包括体积变化功、流动功、轴功、技术功)。 3. 热力学第二定律 掌握和理解:可逆过程与不可逆过程(包括可逆过程的热量和功的计算)。 掌握和理解:热力学第二定律及其表述(克劳修斯表述,开尔文
表述等)。卡诺循环和卡诺定理。 掌握和理解:熵(熵参数的引入,克劳修斯不等式,熵的状态参数特性)。 理解并会分析:熵产原理与孤立系熵增原理,以及它们的数学表达式。热力系的熵方程(闭口系熵方程,开口系熵方程)。温-熵图的分析及应用。 理解并会计算:学会应用热力学第二定律各类数学表达式来判定热力过程的不可逆性。 4. 理想气体的热力性质 熟悉和了解:理想气体模型。 理解并掌握:理想气体状态方程及通用气体常数。理想气体的比热。 理解并会计算:理想气体的内能、焓、熵及其计算。理想气体可逆过程中,定容过程,定压过程,定温过程和定熵过程的过程特点,过程功,技术功和热量计算。 5. 实际气体及蒸气的热力性质及流动问题 理解并掌握:蒸汽的热力性质(包括有关蒸汽的各种术语及其意义。例如:汽化、凝结、饱和状态、饱和蒸汽、饱和温度、饱和压力、三相点、临界点、汽化潜热等)。蒸汽的定压发生过程(包括其在p-v和T-s图上的一点、二线、三区和五态)。 理解并掌握:绝热节流的现象及特点 6. 蒸汽动力循环
华北电力大学工程热力学考研必做题5
表明比定容热容不随比体积变化,这与实际情况不符,说明范德瓦尔方程并不能准确的描述实际气体的这方面的性质。 第七章 水蒸气 例:用温度为500K 的恒温热源加热1atm 的饱和水,使之定压汽化为100oc 的饱和干蒸汽,求:1)该过程中工质的熵变如何计算?2)过程中熵流和熵产。
第八章 气体和蒸汽的流动 例:空气进入喷管时流速为300m/s ,压力为0.5MPa ,温度450K ,喷管背压pb=0.28MPa ,求:喷管的形状,最小截面积及出口流速。cp=1004J/kg·k ,Rg=287J/kg·k 解:由于cf1=300m/s ,所以应采用滞止参数 滞止过程绝热 所以采用缩放喷管 注:若不考虑cf1,则 pcr=νcr·p1=0.528?0.5=0.264MPa 内燃机原理复习资料 第二章、内燃机的工作循环 一、“理想循环”假定? 答:理想循环讨论中所采取的简化假定是:1.工质是一种理想的完全气体,在整个循环中保持物理及化学性质不变;2.不考虑实际存在的工质更换以及漏气损失,工质数量保持不变,循环是在定量工质下进行的;3.把汽缸内工质的压缩和膨胀看成是完全理想的绝热过程,工质与外界不进行热交换;4.用假想的定容放热和定容或定压加热来代替实际的换气和燃烧过程。 二、内燃机的实际循环与理论循环的区别 答:1、工质不同;2、气体流动阻力;3、传热损失;4、燃烧不及时、后燃及不完全燃烧损失;5、漏气损失。 三、压缩过程的作用? 1、压缩过程扩大了工作循环的温度范围; 2、压缩过程使循环的工质得到更大的膨胀比,对活塞做更多的功; 3、压缩过程提高的工质的温度和压力,为冷机启动及着火燃烧创造了条件。 四、四冲程工作原理 1、进气行程:排气门关闭,随着活塞下行汽缸内产生低压,重进气门吸入空气和汽油的混合气,柴油机中吸入的是新鲜空气。 2、压缩行程:进、排气门关闭,活塞上行压缩汽缸内的气体,在柴油机中,把空气压缩到燃料自然温度以上。 3、做功行程:当活塞快到上止点时,用火花塞点燃混合气使之燃烧,在柴油机中,此时燃料以雾化状态喷射到汽缸内,和高温空气接触而自行着火燃烧,燃烧所产生的高压气体,把活塞往下推而做功。 4、排气行程:当活塞到下止点稍前一些时,排气门开启,排气溢出,汽缸内压力下降,活塞上行把膨胀完了的燃气排除汽缸外。 五、示功图:把内燃机在1个工作循环中气缸内工质状态的变化,表示为压力与容积的关系,即压力与活塞行程的关系的图形。 六、标定转速:指在标定工况下,发出标定功率时内燃机相应的曲轴转速。 七、油耗率:在标定工况下,发出标定功率时内燃机所具有的有效油耗率。 八、升功率N :单位气缸工作容积内燃机所具有的标定功率。 九、活塞功率N :单位活塞总面积上内燃机所具有的标定功率。 十、指示效率:是评价内燃机工作循环的一个经济性参数,也是衡量气缸内燃料燃烧所应释放出的热能有效转换成指示功的程度的一个尺度。 十一、机械损失功率由以下组成:摩擦损失功率、泵气损失功率、压力机或扫气泵损失功率、辅助机械损失功率。 《工程热力学I》课程教学大纲 课程名称:工程热力学I 课程代码: 学分/学时:3学分/48学时 开课学期:春季学期 适用专业:机械工程及自动化、热能与动力工程、核工程、建筑环境与设备及相关专业先修课程:大学物理、高等数学 后续课程:工程热力学II 开课单位:机械与动力工程学院 一、课程性质和教学目标(需明确各教学环节对人才培养目标的贡献,专业人才培养目标中的知识、能力和素质见附表) 课程性质:工程热力学是机械工程、热能动力工程、工业工程、核科学与工程、航空航天工程等专业的一门重要技术基础课,是机械、能源动力类专业必修主干课。 教学目标:工程热力学是研究热能有效利用以及热能与其它能量转换规律的科学。本课程不仅为学生学习有关专业课程提供必要的基础理论知识,也为从事相关专业技术工作、科学研究工作及管理工作提供重要的理论基础。(A5.1, A5.2, B2, C2) 本课程由基本概念、热力学基本理论、纯物质热物理性质、基本热力过程及应用五部分组成。通过本课程教学,不仅使学生在能量转换和利用特别是热能与机械能的转换和合理利用方面树立正确的概念,同时培养学生科学抽象、逻辑思维能力,进一步强化实践是检验理论的唯一标准的认识观。具体来说: (1)掌握热能和机械能相互转换的基本规律,并能推广应用于其它能量的转换问题。(A5.1) (2)初步掌握热力过程和热力循环的分析方法,了解提高能量利用经济性的基本原则和主要途径。(A5.1) (3)能运用常用工质物性公式、图表(如水蒸气)和电子软件等进行一般热力过程计算。(A5.2) (4)初步具有从实际问题抽象为理论,并运用理论分析解决实际问题能力。(B2) (5)强化理论来源于实践,实践是检验理论的唯一标准的认识观。(A5.1, A5.2, C2) 工程热力学复习重点及 简答题 HUA system office room 【HUA16H-TTMS2A-HUAS8Q8-HUAH1688】 工程热力学复习重点2012. 3 绪论 [1]理解和掌握工程热力学的研究对象、主要研究内容和研究方法 [2]理解热能利用的两种主要方式及其特点 [3]了解常用的热能动力转换装置的工作过程 1.什么是工程热力学 从工程技术观点出发,研究物质的热力学性质,热能转换为机械能的规律和方法,以及有效、合理地利用热能的途径。 2.能源的地位与作用及我国能源面临的主要问题 3. 热能及其利用 [1]热能:能量的一种形式 [2]来源:一次能源:以自然形式存在,可利用的能源。 如风能,水力能,太阳能、地热能、化学能和核能等。 二次能源:由一次能源转换而来的能源,如机械能、机械能等。 [3]利用形式: 直接利用:将热能利用来直接加热物体。如烘干、采暖、熔炼(能源消耗比例大) 间接利用:各种热能动力装置,将热能转换成机械能或者再转换成电能, 4..热能动力转换装置的工作过程 5.热能利用的方向性及能量的两种属性 [1]过程的方向性:如:由高温传向低温 [2]能量属性:数量属性、,质量属性 (即做功能力) [3]数量守衡、质量不守衡 [4]提高热能利用率:能源消耗量与国民生产总值成正比。 第1章基本概念及定义 1. 1 热力系统 一、热力系统 系统:用界面从周围的环境中分割出来的研究对象,或空间内物体的总和。 外界:与系统相互作用的环境。 界面:假想的、实际的、固定的、运动的、变形的。 依据:系统与外界的关系 系统与外界的作用:热交换、功交换、质交换。 二、闭口系统和开口系统 闭口系统:系统内外无物质交换,称控制质量。 开口系统:系统内外有物质交换,称控制体积。 三、绝热系统与孤立系统 绝热系统:系统内外无热量交换 (系统传递的热量可忽略不计时,可认为绝热) 孤立系统:系统与外界既无能量传递也无物质交换 工程热力学考研大纲 一、参考书目: 工程热力学A《工程热力学》童钧耕主编,高等教育出版社,2007年 二、基本要求: 1.理解和掌握热力学的基本概念和热力学的宏观研究方法,能够运用基本概念,针对实际问题的特点选取热力系统,列出简化条件,并进行功和热量的计算; 2.掌握热力学第一定律、第二定律的实质,对闭口系和开口系统进行热力过程的分析和计算,并能用状态坐标图表示过程及能量转换的特点; 3.掌握运用理想气体、水蒸气、湿空气等常用工质的热力性质图表及公式进行热力过程的分析和计算; 4.掌握提高能量利用率的基本原则和主要途径。把实际热工设备的工作过程简化成理想热力循环或热力过程,应用第一、第二定律对循环或过程进行分析和计算。 三、主要知识点 第一章基本概念热力系统,状态及平衡状态,状态参数及其特性,参数坐标图,热力过程及准静态过程,热力循环 第二章热力学第一定律闭口系热力学第一定律解析式,热力学第一定律应用于开口系统,稳定流动能量方程式,焓,技术功,能量方程应用 第三章理想气体及其混合物理想气体状态方程及气体常数,理想气体的比热,理想气体的内能、焓和熵的计算,混合气体的概念,分压力和分容积,混合气体成分 表示方法及其核算,混合气体的比热、内能、焓和熵的计算 第四章气体的基本热力过程四个典型热力过程,多变过程及多变指数 第五章热力学第二定律过程的方向性,卡诺循环和卡诺定理,熵的导出,孤立系统熵增原理,熵方程,熵流与熵产,作功能力损失 第六章实际气体的性质实际气体的性质,范德瓦尔方程,对应态原理,通用压缩因子图 第七章蒸汽的性质蒸汽的性质,蒸汽图表及其应用, 第八章气体和蒸气流动稳定流动基本方程,流速和流量,临界压力比,临界流速和最大流量,喷管的计算,摩阻对流动的影响,绝热滞止,绝热节流,第九章气体的压缩气体的理想压缩功,压缩机的效率,活塞式压缩机余隙容积的影响,多级压缩和中间冷却 第十章动力循环分析分析循环的热效率法,分析循环中不可逆损失的熵方法第十一章蒸汽动力循环朗肯循环,蒸汽参数对循环热效率的影响,再热循环,回热循环, 第十二章气体动力循环活塞式内燃机循环,燃气轮机装置循环,提高循环热效率的各种途径, 第十三章制冷循环空气压缩制冷,蒸汽压缩制冷,提高制冷系数的各种途径,第十四章湿空气湿空气的概念,湿空气的热力过程,焓湿图,湿空气的应用, 第一章基本概念 1.基本概念 热力系统:用界面将所要研究的对象与周围环境分隔开来,这种人为分隔的研究对象,称为热力系统,简称系统。 边界:分隔系统与外界的分界面,称为边界。 外界:边界以外与系统相互作用的物体,称为外界或环境。 闭口系统:没有物质穿过边界的系统称为闭口系统,也称控制质量。 开口系统:有物质流穿过边界的系统称为开口系统,又称控制体积,简称控制体,其界面称为控制界面。绝热系统:系统与外界之间没有热量传递,称为绝热系统。 孤立系统:系统与外界之间不发生任何能量传递和物质交换,称为孤立系统。 单相系:系统中工质的物理、化学性质都均匀一致的系统称为单相系。 复相系:由两个相以上组成的系统称为复相系,如固、液、气组成的三相系统。 单元系:由一种化学成分组成的系统称为单元系。多元系:由两种以上不同化学成分组成的系统称为多元系。 均匀系:成分和相在整个系统空间呈均匀分布的为均匀系。 非均匀系:成分和相在整个系统空间呈非均匀分布,称非均匀系。 热力状态:系统中某瞬间表现的工质热力性质的总状况,称为工质的热力状态,简称为状态。 平衡状态:系统在不受外界影响的条件下,如果宏观热力性质不随时间而变化,系统内外同时建立了热的和力的平衡,这时系统的状态称为热力平衡状态,简称为平衡状态。 状态参数:描述工质状态特性的各种物理量称为工质的状态参数。如温度(T)、压力(P)、比容(υ)或密度(ρ)、内能(u)、焓(h)、熵(s)、自由能(f)、自由焓(g)等。 基本状态参数:在工质的状态参数中,其中温度、压力、比容或密度可以直接或间接地用仪表测量出来,称为基本状态参数。 温度:是描述系统热力平衡状况时冷热程度的物理量,其物理实质是物质内部大量微观分子热运动的强弱程度的宏观反映。 热力学第零定律:如两个物体分别和第三个物体处于热平衡,则它们彼此之间也必然处于热平衡。压力:垂直作用于器壁单位面积上的力,称为压力,也称压强。 相对压力:相对于大气环境所测得的压力。如工程上常用测压仪表测定系统中工质的压力即为相 对压力。 比容:单位质量工质所具有的容积,称为工质的比容。 密度:单位容积的工质所具有的质量,称为工质的密度。 强度性参数:系统中单元体的参数值与整个系统的参数值相同,与质量多少无关,没有可加性,如温度、压力等。在热力过程中,强度性参数起着推动力作用,称为广义力或势。 广延性参数:整个系统的某广延性参数值等于系统中各单元体该广延性参数值之和,如系统的容积、内能、焓、熵等。在热力过程中,广延性参数的变化起着类似力学中位移的作用,称为广义位移。 准静态过程:过程进行得非常缓慢,使过程中系统内部被破坏了的平衡有足够的时间恢复到新的 平衡态,从而使过程的每一瞬间系统内部的状态都非常接近平衡状态,整个过程可看作是由一系列非常接近平衡态的状态所组成,并称之为准静态过程。 可逆过程:当系统进行正、反两个过程后,系统与外界均能完全回复到初始状态,这样的过程称为可逆过程。 膨胀功:由于系统容积发生变化(增大或缩小)而通过界面向外界传递的机械功称为膨胀功,也称容积功。 热量:通过热力系边界所传递的除功之外的能量。热力循环:工质从某一初态开始,经历一系列状态变化,最后又回复到初始状态的全部过程称为热力循环,简称循环。 2.常用公式 状态参数:1 2 1 2 x x dx- = ? ?=0 dx 状态参数是状态的函数,对应一定的状态,状态参数都有唯一确定的数值,工质在热力过程中发生状态变化时,由初状态经过不同路径,最后到达 目录 Ⅰ序言 (3) Ⅱ考前必知 (5) 一、历年报录情况 (5) 二、学费与奖学金 (6) Ⅲ复习方略 (10) Ⅳ考试分析 (13) 一、考试难度 (13) 二、考试题型 (14) 三、考点分布 (15) 四、试题分析 (18) 五、考试展望 (19) Ⅴ复习指南 (21) Ⅵ核心考点解析 (34) 《工程热力学》 (34) 第一章基本概念及定义 (34) 第二章热力学第一定律 (37) 第三章气体和蒸汽的性质 (51) 第四章气体和蒸汽的基本的热力过程 (66) 第五章热力学第二定律 (80) 第六章实际气体的性质及热力学一般关系式 (102) 第七章气体和蒸汽的流动 (104) 第八章压气机的热力过程 (121) 第九章气体动力循环 (131) 第十章蒸汽动力装置循环 (146) 第十一章制冷循环 (154) 第十二章混合气体和湿空气 (161) Ⅶ往年真题试卷与答案解析 (170) 往年考研真题试卷 (170) 同济大学2005年招收攻读硕士研究生入学考试试卷 (170) 同济大学2006年招收攻读硕士研究生入学考试试卷 (172) 同济大学2007年招收攻读硕士研究生入学考试试卷 (174) 同济大学2008年招收攻读硕士研究生入学考试试卷 (178) 同济大学2011年招收攻读硕士研究生入学考试试卷 (179) 同济大学2012年招收攻读硕士研究生入学考试试卷 (181) 同济大学2013年招收攻读硕士研究生入学考试试卷 (183) 同济大学2014年招收攻读硕士研究生入学考试试卷 (185) 同济大学2017年招收攻读硕士研究生入学考试试卷(回忆版) (187) 往年考研真题试卷答案解析 (189) 同济大学2005年招收攻读硕士研究生入学考试试卷答案解析 (189) 同济大学2006年招收攻读硕士研究生入学考试试卷答案解析 (198) 同济大学2007年招收攻读硕士研究生入学考试试卷答案解析 (208) 同济大学2008年招收攻读硕士研究生入学考试试卷答案解析 (218) 同济大学2011年招收攻读硕士研究生入学考试试卷答案解析 (225) 同济大学2012年招收攻读硕士研究生入学考试试卷答案解析 (233) 同济大学2013年招收攻读硕士研究生入学考试试卷答案解析 (241) 同济大学2014年招收攻读硕士研究生入学考试试卷答案解析 (252) 工程热力学复习重点2012 工程热力学复习重点 绪论 [1] [2] [3] 理解和掌握工程热力学的研究对象、主要研究基本概念及定义 1. 1 热力系统 一、热力系统 系统:用界面从周围的环境中分割出来的研究对象,或空间内物体的总和。 外界:与系统相互作用的环境。 界面:假想的、实际的、固定的、运动的、变形的。 依据:系统与外界的关系 系统与外界的作用:热交换、功交换、质交换。 二、闭口系统和开口系统 闭口系统:系统内外无物质交换,称控制质量。 开口系统:系统内外有物质交换,称控制体积。 三、绝热系统与孤立系统 绝热系统:系统内外无热量交换(系统传递的热量可忽略不计时,可认为绝热) 孤立系统:系统与外界既无能量传递也无物质交换 =系统+相关外界=各相互作用的子系统之和= 一切热力系统连同相互作用的外界 四、根据系统工质的热力状态与状态参数 一、状态与状态参数 状态:热力系统中某瞬间表现的工质热力性质的总状况。状态参数:描述工质状态特性的各种状态的宏观物理量。 如:温度(T)、压力(P)、比容(υ)或密度(ρ)、内能(u)、焓(h)、熵(s)、自由能(f)、自由焓(g)等。 状态参数的数学特性: 1.2 1dx x2x1 表明:状态的路径积分仅与初、终状态有关,而与状态变化的途径无关。 2.dx=0 表明:状态参数的循环积分为零 基本状态参数:可直接或间接地用仪表测量出来的状态参数:温度、压力、比容或密度 温度:宏观上,是描述系统热力平衡状况时冷热程度的物理量。微观上,是大量分子热运动强烈程度的量度 2.压力: 垂直作用于器壁单位面积上的力,称为压力,也称压强。 F;p式中:F—整个容器壁受到的力,单位为牛顿(N)f f—容器壁的总面积(m2)。微观上:分子热运动产生的垂直作用于容器壁上单位面积的力。压力测量依据:力平衡原理压力单位:MPa 相对压力:相对于大气环境所测得的压力。工程上常用测压仪表测定的压力。 以大气压力为计算起点,也称表压力。 p B pg (P>B) p B H (P<B) 式中B—当地大气压力 Pg—高于当地大气压力时的相对压力,称表压力;H —低于当地大气压力时的相对压力,称为真空值。注意:只有绝对压力才能代表工质的状态参数 3.比容: 比容:单位质量工质所具有的容积。密度:单位容积的工质所具有的质量。 v V m m3/kg 关系:v 1 式中:—工质的密度kg/m3 ,v—工质的比容 m3/kg 例:表压力或真空度为什么不能当作工质的压力工质的压力不变化,测量它的压力表或真空表的读数是否会变化? 解:作为工质状态参数的压力是绝对压力,测得的表压力或真空度都是工质的绝对压力与大气压力的相对值,因此不能作为工质的压力;因为测得的是工质绝对压力与大气压力的相对值,即使工质的压力不变,当大气压力改变时也会引起压力表或真空表读数的变化。 1.3准静态过程与可逆过程 热力过程:系统状态的连续变化称系统经历了一个热力过程。 一、准静过程:如果造成系统状态改变的不平衡势差无限小,以致该系统在任意时刻均无限接近于某个平衡态,这样的过程称为准静态过程。 注意:准静态过程是一种理想化的过程,实际过程只能接近准静态过程。工程热力学及内燃机原理自考重点复习资料
上海交大《工程热力学》考研大纲
工程热力学复习重点及简答题定稿版
工程热力学A考研大纲
工程热力学 基本知识点
同济大学工程热力学考研考点精编(含历年真题解析)
工程热力学复习重点
