直接滴定法在聚维酮碘含量测定中的应用
滴定分析法在药物分析中的应用

滴定分析法在药物分析中的应用滴定分析法在药物分析中的应用滴定分析的主要方法有:①根据滴定分析的方式不同,滴定分析法可分为:(1)直接滴定法。
(2)间接滴定法。
(3)返滴定法,又称剩余量滴定法或回滴定法。
(4)置换滴定法。
②根据滴定反应类型的不同滴定分析法又可分为:(1)酸碱滴定法,又称中和法。
(2)配位滴定法,旧称络和滴定法。
(3)氧化还原滴定法。
(4)沉淀滴定法。
滴定分析法作为标准分析方法之一,被广泛应用在医药行业:进行简单,快速,具有重现性和准确性的有效成分,药品及其原料的分析(含量测定)。
滴定尤其适合于生产过程中的质量控制和常规分析。
以下为一些主要的应用:1.具有药物活性物质的纯度分析滴定主要用于测定药物活性成分的含量,如:阿斯匹林中的乙酰水杨酸或复合维他命片剂中的维生素C,以及用于药物合成的药物添加剂的含量测定和纯度控制。
酸碱中和反应等酸碱滴定是医药行业用得最多的滴定。
一个典型的例子就是盐酸麻黄碱的纯度控制[1]。
该成分通常出现在咳嗽糖浆中,用以治疗支气管哮喘。
其含量的测定是在含有无水醋酸和醋酸汞的有机溶剂中,用高氯酸作滴定剂进行滴定:2R-NH3+-Cl-+Hg(OAc)2 =2R-NH2+HgCl2+2HOAcR-NH2+HClO4 =R-NH3+-ClO4-2.用氧化还原滴定进行成分分析氧化还原滴定通常被用来检测原料、填充物和防腐剂的纯度。
例如,4-苯甲酸甲酯(一种对羟基苯甲酸酯)中溴值的测定。
这种化合物作为防腐剂被应用于眼药制剂和外用眼药膏中。
硫代硫酸钠被用作滴定剂。
整个分析由下述几个步骤组成:2.1 酯与氢氧化钠的皂化作用(水解)2.2 羟基氧化到酮基的过程2.3 苯环的(亲电)溴化2.4 过量的溴与碘离子反应,生成滴定过程中所需的游离碘2.5 碘经硫代硫酸盐滴定,还原成碘离子:I2+2S2O32-=2I-+S4O62-3.沉淀滴定某些药品由于其结构的关系,在滴定过程中会有沉淀析出。
直接滴定法的原理与应用

直接滴定法的原理与应用1. 原理介绍直接滴定法是一种常用的定量化学分析方法,用于确定溶液中特定化学物质的浓度。
它基于化学反应的滴定过程,通过添加已知浓度溶液(称为滴定试剂)到待测溶液中,直到达到一个化学终点指示器的转变点。
从滴定试剂的用量可以推算出待测溶液中特定物质的浓度。
直接滴定法的主要原理是酸碱滴定反应和氧化还原滴定反应。
在酸碱滴定反应中,通过滴定酸或碱溶液到碱性或酸性溶液中,使用指示剂(例如酚酞、溴酚蓝等)来标志酸碱滴定反应的中点。
在氧化还原滴定反应中,通常使用一种氧化剂(例如过氧化氢、高锰酸钾等)作为滴定试剂,滴定到待测溶液中的还原剂。
使用指示剂来指示还原剂被氧化的中点。
2. 应用领域直接滴定法广泛应用于分析化学、环境化学、食品工业、制药工业等领域。
以下是直接滴定法在不同领域中的一些常见应用:2.1 分析化学•硝酸银法:用于测定氯离子的含量。
•硝酸钡法:用于测定硫酸根离子的含量。
•亚硫酸钠法:用于测定二氧化碳的含量。
•高锰酸钾法:用于测定有机物的含量。
2.2 环境化学•高锰酸钾法:用于测定水中的化学需氧量(COD)。
•亚硫酸钠法:用于测定水中的氯离子含量。
•硝酸银法:用于测定水中的溶解性氯化物含量。
•硝酸铁法:用于测定水中的硫化物含量。
2.3 食品工业•酸度测定法:用于测定食品样品中的酸度。
•硝酸银法:用于测定食品样品中的氯化物含量。
•硫酸铜法:用于测定食品样品中的还原糖含量。
•高锰酸钾法:用于测定食品样品中的抗坏血酸含量。
2.4 制药工业•磺胺类药物含量测定法:用于测定制药样品中磺胺类药物的含量。
•高锰酸钾法:用于测定制药样品中的双氧水含量。
3. 实验步骤直接滴定法的实验步骤一般包括以下几个方面:1.准备滴定试剂:根据具体实验需要,制备所需的酸和碱溶液。
2.准备待测溶液:根据目标浓度和所需样品量等要求,准确称取样品,并将其溶解或稀释至适当的体积。
3.设置滴定仪及取样装置:根据实验需要,选择合适的滴定仪和取样装置,并对其进行适当的调整和设置。
直接碘量法测定维生素c含量课件

直接碘量法测定维生素c含量
(3)胡萝卜,称取41.215g,切成小块,加入20ml 2%的稀盐酸研磨 至糊状,加入250ml容量瓶中,加2%的稀盐酸定容250ml,然后用 真空泵抽滤,除去大颗粒和杂质,滤液密封备用。
测定
直接碘量法测定维生素c含量
维生素C的化学性质
• 又具有烯醇式结构 ,还原性强 • 水溶液中可解离成氧化型抗坏血酸
直接碘量法测定维生素c含量
维生素C的化学性质
• 在弱酸性条件下 ,可被碘氧化为脱氢抗坏血酸
可利用此性质滴定: 指示剂——淀粉溶液(
遇碘变蓝)
直接碘量法测定维生素c含量
1.直接碘量法
1、K2Cr2O7浓度
m
1 .2 4 1 g
C K 2 C r 2 O 7 M /V 2 9 4 .1 6 g /m o l 2 5 0 m l 1 0 0 0 m l/l 0 .0 1 6 9 m o l/L
2、Na2S2O3浓度
C N a 2S 2 O 36 C K 2 C V r2 O N 7 a 2 • S 2 V O 3K 2 C r2 O 70 .1 0 0 4 m o l/L
体KI1g和3g 浓盐酸,充分摇匀,放在暗处5min。 • 然后用50ml蒸馏水稀释,用Na2S2O3滴定到浅黄绿色,然后加入
5ml淀粉溶液,滴定至终点。记录消耗的体积。计算Na2S2O3溶液 浓度,平行滴定三次。
直接碘量法测定维生素c含量
• 5 I2 溶液的标定 • 移取Na2S2O3 溶液25ml三份于锥形瓶中,各加入25ml的水,5ml
实训x:直接碘量法测定维生素C片的含量

实训x :直接碘量法测定维生素C 片的含量一、目的要求:通过实训掌握直接碘量法测定Vc 片含量的原理及其操作。
熟悉片剂通过滴定分析测定含量时的处理方法。
二、原理:维生素C(C 6H 8O 6),分子结构中的烯二醇基具有还原性,能被I 2定量地氧化成二酮基,抗坏血酸分子中的二烯醇基被I 2完全氧化后,则I 2与淀粉指示剂作用而使溶液变蓝,因此当滴定到溶液出现蓝色时即为终点。
维生素C 在空气中极易被氧化,尤其在碱性介质中更甚,故该滴定反应在稀HAc 中进行,以减少维生素C 的副反应。
该反应产物HI 为酸性,醋酸酸性条件下不利于反应向右进行,但由于维生素C 的还原性很强,即使在弱酸性条件下,上述反应也进行得相当完全。
三、操作步骤:直接碘量法:取本品10片,精密称定,研细,精密称取适量(约相当于维生素C0.2g ),置100ml 锥形瓶中,加新沸过的冷水100ml 与稀醋酸10ml 的混合液适量,振摇使维生素C溶解并稀释至刻度,迅速滤过,精密量取续滤液50ml ,加淀粉指示液1ml ,立即用碘滴定液(0.05mol ·L -1)滴定,至溶液显蓝色并持续30秒钟不褪。
每1ml 碘 滴定液(0.05mol ·L -1)相当于8.806mg 的C 6H 8C 6。
平行测定3份,计算含量。
四、计算:维生素C 含量以标示量来计算,按下式计算: F (I 2)×V (I 2)×T (C 6H 8O 6)×W 平%(C 6H 8O 6)=—————————————————×100% m ×规格F-----滴定液浓度有效因数V-----供试品消耗碘滴定液的体积 T-----滴定度W 平-----平均片重g m------供试品取用量g 五、注意点:1、在稀醋酸酸性介质中,维生素C 受空气中氧的氧化速度减慢,但供试品溶于稀醋酸后仍应立即进行滴定。
2、溶剂使用新沸过的冷水以减少水中溶解氧对测定的影响。
维生素C的含量测定(直接碘量法)
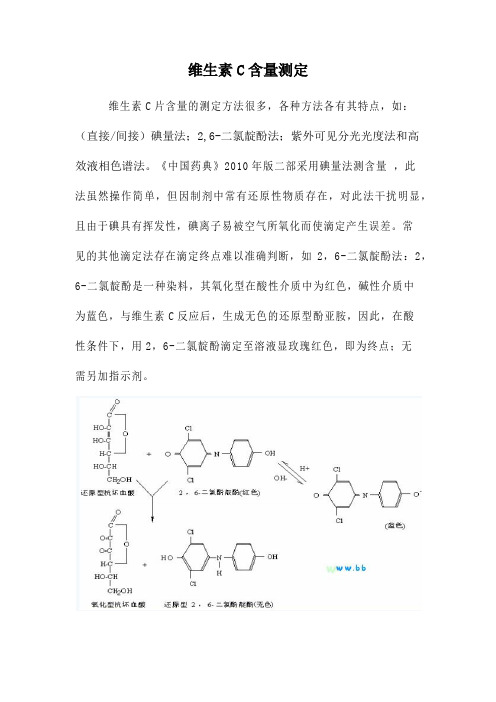
维生素C含量测定维生素C片含量的测定方法很多,各种方法各有其特点,如:(直接/间接)碘量法;2,6-二氯靛酚法;紫外可见分光光度法和高效液相色谱法。
《中国药典》2010年版二部采用碘量法测含量,此法虽然操作简单,但因制剂中常有还原性物质存在,对此法干扰明显,且由于碘具有挥发性,碘离子易被空气所氧化而使滴定产生误差。
常见的其他滴定法存在滴定终点难以准确判断,如2,6-二氯靛酚法:2,6-二氯靛酚是一种染料,其氧化型在酸性介质中为红色,碱性介质中为蓝色,与维生素C反应后,生成无色的还原型酚亚胺,因此,在酸性条件下,用2,6-二氯靛酚滴定至溶液显玫瑰红色,即为终点;无需另加指示剂。
分光光度法运用维生素C的旋光性能进行含量测定,但操作费时,而高效液相色谱法是目前发展较为迅速的一种方法,灵敏度高,选择性好,是一个准确高效的测定维生素C含量的方法。
我们主要介绍的是直接碘量法。
直接碘量法一.实验原理维生素C是人体重要的维生素之一,它影响胶元蛋白的形成,参与人体多种氧化-还原反应,并且有解毒作用。
人体不能自身制造维生素C,所以人体必须不断地从食物中摄入维生素C,通常还需储藏能维持一个月左右的维生素C。
缺乏时会产生坏血病,故又称抗坏血酸。
维生素C属水溶性维生素,分子式C6H8O6。
分子中的烯二醇基具有还原性,能被I2定量地氧化成二酮基,因而可用I2标准溶液直接测定。
简写为:C6H8O6+I2= C6H6O6+2HI使用淀粉作为指示剂,用直接碘量法可测定药片、注射液、饮料、蔬菜、水果中维生素C的含量。
由于维生素C的还原性很强,较容易被溶液和空气中的氧氧化,在碱性介质中这种氧化作用更强,因此滴定宜在酸性介质中进行,以减少副反应的发生。
考虑到I - 在强酸性中也易被氧化,故一般选在pH为3~4的弱酸性溶液中进行滴定。
由于碘具有挥发性,碘离子易被空气所氧化而使滴定产生误差;又由于碘的挥发性和腐蚀性,使碘标准滴定溶液的配制及标定比较麻烦。
直接碘量法测定维生素C(1)

药品试剂及仪器
药品:0.04mol/L的Na2S2O3; 0.02mol/LI2标 准溶液;0.2%(质量分数)淀粉溶液; 2mol/L醋酸溶液;重铬酸钾溶液 仪器:烧杯、容量瓶 、量筒、酸式滴定 管、碱式滴定管、移液管、胶头滴管、锥 形瓶、玻璃棒、电子天平等
实验步骤
维生素C试样的准备: 取2~4片维生素C药片称重,小心研成粉末,计算平 均片重。准确称量适量药粉,以醋酸溶解,于100mL 容量瓶中定容,摇匀后干过滤,弃去10mL左右的初 滤液,收集续滤液备用。 0.04mol/LNa2S2O3溶液的配制: 称5.0gNa2S2O3· 2O于烧杯中,加入约200mL新煮 5H 沸后冷却的蒸馏水溶解,加入约0.1gNa2CO3固体, 然后用新煮沸且冷却的蒸馏水稀释至500mL,贮于棕 色试剂瓶中,在暗处放置1~2周后再标定。
2
3
实验数据记录及处理
维生素C含量的测定 1 2 3
V维生素C制备液(mL) V淀粉(mL) 起始 VI (mL) 结束 消耗 P(维生素C含量)(mg/片)
2
P平均(维生素C含量)( mg/片)
注意事项
由于维生素C的还原能力强而易被空气氧化,特别 是在碱性溶液中更易被氧化,所以,在测定中须加 入稀HAc,使溶液保持足够的酸度,以减少副反应 的发生。 溶解I2时,应加入过量的KI及少量水研磨成糊状, 使I2完全生成I3ˉ后再稀释。否则,加水后I2不再溶 解。 称样前将Vc片研成粉末,称样后应立即溶解测定, 以免Vc被空气中的氧氧化而损失。必须用新煮沸过 并冷却的蒸馏水溶解样品,目的是为了减少蒸馏水 中的溶解氧。
分析讨论
I2-KI溶液呈深棕色,在滴定管中较难分辨凹液面, 但液面最高点较清楚,所以常读取液面最高点,读时 应调节眼睛的位置,使之与液面最高点前后在同一水 平位置上 使用碘量法时,应该用碘量瓶,防止Vc被氧化,影响 实验结果的准确性。 由于实验中不能避免地摇动锥形瓶,因此空气中的氧 会将Vc氧化,使结果偏低。
直接碘量法测定维生素C的含量

实验四直接碘量法测定维生素C的含量一、实验目的1.掌握碘标准溶液的配制与标定方法。
2.了解直接碘量法的操作步骤及注意事项。
3.掌握直接碘量法的基本操作。
二、实验原理电对电位低的较强还原性物质,可用碘标准溶液直接滴定,这种滴定方法,称为直接碘量法。
维生素C(C6H8O6)又称抗坏血酸,其分子中的烯二醇基具有较强的还原性,能被I2定量氧化成二酮基,所以可用直接碘量法测定其含量。
其反应式如下:从反应式可知,在碱性条件下,有利于反应向右进行。
但由于维生素C的还原性很强,即使在弱酸性条件下,此反应也能进行得相当完全。
在中性或碱性条件下,维生素C易被空气中的O2氧化而产生误差,尤其在碱性条件下,误差更大。
故该滴定反应在酸性溶液中进行,以减慢副反应的速度。
三、实验器材、药品器材:分析天平,酸式滴定管(25mL,棕色),吸量管(2mL),量筒(15mL、5mL),锥形瓶(250m1)。
药品:维生素C注射液(20mL 2.5g),I2标准溶液(0.05mol·L-1),稀醋酸,丙酮,淀粉指示剂。
四、实验操作步骤1、I2标准溶液(0.05mol·L-1)的配制取KI 10.8g于小烧杯中,加水约15mL,搅拌使其溶解。
再取I2 3.9g,加入上述KI溶液中,搅拌至I2完全溶解后,加盐酸1滴,转移至棕色瓶中,用蒸馏水稀释至300mL,摇匀,用垂熔玻璃滤器过滤。
2、I2标准溶液(0.05mol·L-1)的标定精密称取在105℃干燥至恒重的基准物质As2O33份,每份在0.1080~0.1320g之间,置于3个锥形瓶中,各加NaOH溶液(1mol·L-1)4.00mL使溶解,加蒸馏水20.00mL与酚酞指示剂1滴,滴加H2SO4溶液(1mol·L-1)至粉红色褪去,再加NaHCO3 2g,蒸馏水30.00mL及淀粉指示剂2mL,用待标定的I2标准溶液滴定至溶液显浅蓝紫色,即为终点,记录所消耗碘标准溶液的体积。
定量化学分析:碘量法

8I- + 2SO42-+5H2O
(3)指示剂的选择-淀粉指示剂
✓ 要求:室温;弱酸性;新鲜配制
✓ 加入时间:近终点时加入(与直接碘量法不同)
✓ 终点变化:蓝色→无色(与直接碘量法相反)
✓ 变色原理:I2(过量)+ I-
I3-
(与淀粉形成深蓝色配合物)
✓注:间接碘量法中淀粉指示剂过早加入,强烈吸附I2,造成终点拖后
2、间接碘量法
间接碘量法——氧化性比I2 高的物质在一定的条 件下,用I―还原生成I2 ,然后用Na2S2O3标准溶液 滴定I2,又称滴定碘法。 (1)可测定物:具有氧化性物质
如:MnO4-,Cr2O7-,CrO4-,AsO43-,BrO3-, IO3-,H2O2,ClO-,Cu2+
加入KI KI
四、碘量法的滴定误差
(1)碘量法的误差来源
I2易挥发 在酸性溶液中I-易被空气中的O2氧化
(2)减小误差的方法
➢ 为了防止I2挥发和空气中氧氧化I-,测定时要加入过量的KI,使I2生成I3- 离子 ➢ 使用碘瓶,滴定时不要剧烈摇动,以减少I2的挥发。 ➢ 由于I-被空气氧化的反应,随光照及酸度增高而加快,因此在反应时,应将碘
3、直接碘量法、间接碘量法的比较
三、碘量法指示剂
碘量法用淀粉指示剂来指示滴定终点。 淀粉指示剂——显色指示剂:能与滴定剂或被测定物质发生显色 反应且可逆,从而指示滴定终点。
使用淀粉指示液指示终点时要注意以下几点; (1)所用的淀粉必须是可溶性淀粉; (2)I3-与淀粉的蓝色在热溶液中会消失,因此不能在热溶液中进行滴定; (3)要注意反应介质的条件,淀粉在弱酸性溶液中灵敏度很高,显蓝色;当 pH<2时,淀粉会水解成糊精,与I2作用显红色;若pH>9时,I2转变为IO-离 子与淀粉不显色。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
直接滴定法在聚维酮碘含量测定中的应用
【摘要】 目的 对比直接滴定法与电位滴定法在聚维酮碘含量测定中的结
果,建立聚维酮碘的简便可靠的测定方法。方法 利用Na2S2O3直接滴定法和
ZD-2A自动电位滴定仪的电位滴定法对不同产地的聚维酮碘原料及聚维酮碘溶
液进行滴定,并将滴定结果进行分析。结果 直接滴定法与电位滴定法在聚维酮
碘及溶液中的含量测定结果无显著差异。结论 直接滴定法仪器要求简单、操作
方便、结果准确,适合于聚维酮碘原料药及溶液的含量测定。
【关键词】聚维酮碘 ;电位滴定法;直接滴定法;含量测定
聚维酮碘是碘与聚乙烯批咯烷酮(PVP)的结合物,由于它具有成膜、粘合、
解毒、慢性释放、水溶性强以及广谱杀菌作用等优点[1],聚维酮碘已被越来越
广泛地应用于皮肤黏膜、手术以及器械等的杀菌、消毒工作。《中国药典》2000、
2005年版对聚维酮碘的含量测定方法为电位滴定法,此方法准确度高,但是操
作以及计算麻烦且必须借助一定仪器(电位滴定仪)。笔者在日常工作中发现聚
维酮碘与硫代硫酸钠滴定液反应灵敏、结果指示准确,因此对不同产地的聚维酮
碘原料药及不同厂家的聚维酮碘溶液分别用电位滴定法和直接滴定法进行含量
测定,并对测定结果进行比较,结果,直接滴定法与电位滴定法在聚维酮碘原料
及溶液中的含量测定结果差异不显著,因此,可以用直接滴定法进行聚维酮碘原
料药及聚维酮碘溶液的含量测定。
1 仪器与试药
1.1 仪器 ZD-2A自动电位滴定仪,参比电极(Ag-AgCl电极),铂电极,
吸量管,滴定管等。
1.2 试药 聚潍酮碘原料1(产地:广东庆发药业有限公司 批号:20080122),
聚潍酮碘原料2(产地:焦作化学工业有限公司批号:20080412),聚潍酮碘溶
液1(商品名:肤阴泰,产地:海南南台海神国药有限公司,批号:070903),
聚潍酮碘溶液2(商品名:贝诺贝美,产地:潍坊贝诺贝美科技有限公司,批号:
20080425),0.1%硫代硫酸钠滴定液(f=1.085),淀粉指示液。
2 测定方法
2.1 聚维酮碘原料的测定方法 电位滴定法:取本品约1 g,精密称定,置
烧杯中,加水120 ml,搅拌使溶解,照电位滴定法(附录ⅦA),用硫代硫酸钠
滴定液(0.1mol/L)滴定,每1 ml硫代硫酸钠滴定液(0.1mol/L)相当于12.69
mg的I。
直接滴定法:取本品约1 g,精密称定,置烧杯中,加水120 ml,搅拌使溶
解,用硫代硫酸钠滴定液(0.1mol/L)滴定,至近终点时,加淀粉指示液2 ml,
继续滴定至蓝色消失,每1 ml硫代硫酸钠滴定液(0.1mol/L)相当于12.69 mg
的I。
2.2 聚维酮碘溶液的测定方法 电位滴定法:精密量取本品适量(约相当于
聚维酮碘1.25 g),置烧杯中,加水至125 ml, 照电位滴定法(附录ⅦA),用硫
代硫酸钠滴定液(0.1mol/L)滴定,每1 ml硫代硫酸钠滴定液(0.1mol/L)
相当于12.69 mg的I。
直接滴定法:精密量取本品适量(约相当于聚维酮碘1.25 g),置烧杯中,
加水至125 ml,用硫代硫酸钠滴定液(0.1 mol/L)滴定,至近终点时,加淀粉
指示液2 ml,继续滴定至蓝色消失,每1 ml硫代硫酸钠滴定液(0.1 mol/L)相
当于12.69 mg的I。
3 测量结果及分析
3.1 按照2.1的两种滴定方法对不同产地的聚维酮碘原料进行含量测定,
测定结果如表1。两种方法对聚维酮碘原料1和聚维酮碘原料2的含量测定结果
差异变化不大,原料1与原料2的P值都大于0.05,两种测量结果差异无统计学
意义。
3.2 按照2.2的两种滴定方法对不同产地的聚维酮碘溶液进行含量测定,
测定结果如表2。两种方法对聚维酮碘溶液1和聚维酮碘溶液2的含量测定结果
差异变化不大,聚维酮碘溶液1与聚维酮碘溶液2的P值都大于0.05,两种测
量结果差异无统计学意义。
4 讨论
聚维酮碘是碘与聚乙烯批咯烷酮(PVP)的结合物,由于它具有成膜、粘合、
解毒、慢性释放、水溶性强以及广谱杀菌作用等优点,聚维酮碘已被越来越广泛
地应用于皮肤黏膜、手术以及器械等的杀菌、消毒工作。对于聚维酮碘的含量测
定,《中国药典》2000年版、2005年版对聚维酮碘的含量测定方法为电位滴定法,
此方法准确度高,但是操作以及计算麻烦(见表3)且必须借助一定仪器(电位滴
定仪), 直接滴定法仪滴定结果与电位滴定法相比无显著差异且仪器要求简单,
操作方便,计算简单快捷,比电位法有明显的优点,完全适合于日常工作中聚维
酮碘原料和溶液的含量测定。
根据表2的数据做V-E曲线或ΔE/ΔV-V曲线(做图略)得消耗硫代硫酸
钠滴定液9.9 ml,计算得聚维酮碘的量按有效碘计算为标示量的10.3%。
参考文献
[1] 国家药典委员会.中国药典.临床用药须知.化学工业出版社,2001:
911.
[2] 国家药典委员会.中国药典二部.化学工业出版社,2000:910.
