物化问答题 付献彩 高教版
物理化学思考题及参考答案傅献彩

第八章可逆电池的电动势及其应用 ………………………25
第九章电解与极化作用……………………………………29
第十章化学动力学基础…………………………………… 32
第十一章界面现象…………………………………………… 36
第十二章胶体分散体系与大分子溶液……………………… 38
18、体系中有100克N2,完全转化成NH3,如按计量方程式N2+3H2→2NH3,Δξ=?,如按计量方程式N2+H2—→NH3,Δξ=?,如反应前体系中N2的物质的量n(N2)=10mol,分别按上述二计量方程式所得的Δξ计算反应后的n'(N2)=?
恒容过程ΔU1=CV,mdT两者终态的温度相同
恒压过程ΔU2=ΔU1+ΔU3∴ΔU3=0∴ΔU2=ΔU1=CV,mdp
即1mol理想气体不论什么过程,只要变到相同温度的终态其ΔU总是等于CV,mdT
17、为什么理想气体常数R在数值上等于1mol理想气体升高1K时所作的等压体积功?
答:W=-p外ΔV=-p(V2-V1)=-nR(T2-T1)当n=1molT2-T1=1K时W=R
答:不一定。因为Δ(PV)可以为零、正数和负数。
3、ΔH = Qp , ΔU = Qv两式的适用条件是什么?
答:ΔH = Qp此式适用条件是:封闭系等压非体积功为零的体系。
ΔU = 态确定后,状态函数的值即被确定。
答:对。
(2)状态改变后,状态函数值一定要改变。
证明:ΔU=Q+W等容时ΔV=0,又无其它功,W=0∴ΔU=QV
16、为什么对于理想气体,公式ΔU=nCV,mdT可用来计算任一过程的ΔU,并不受定容条件的限制?
答:因为对理想气体,U=f(T),内能仅是温度的函数,从始态出发,不论经什么过程,达到不同的终态,只要始终态温度分别相同,ΔU就一定相同。所以公式ΔU=CV,mdT并不受定容条件的限制。
傅献彩物理化学选择题———第六章化学平衡物化试卷(二)

傅献彩物理化学选择题———第六章化学平衡物化试卷(二)目录(试卷均已上传至“百度文库”,请自己搜索)第一章热力学第一定律及其应用物化试卷(一)第一章热力学第一定律及其应用物化试卷(二)第二章热力学第二定律物化试卷(一)第二章热力学第二定律物化试卷(二)第三章统计热力学基础第四章溶液物化试卷(一)第四章溶液物化试卷(二)第五章相平衡物化试卷(一)第五章相平衡物化试卷(二)第六章化学平衡物化试卷(一)第六章化学平衡物化试卷(二)第七章电解质溶液物化试卷(一)第七章电解质溶液物化试卷(二)第八章可逆电池的电动势及其应用物化试卷(一)第八章可逆电池的电动势及其应用物化试卷(二)第九章电解与极化作用第十章化学动力学基础(一)物化试卷(一)第十章化学动力学基础(一)物化试卷(二)第十一章化学动力学基础(二) 物化试卷(一)第十一章化学动力学基础(二) 物化试卷(二)第十二章界面现象物化试卷(一)第十二章界面现象物化试卷(二)第十三章胶体与大分子溶液物化试卷(一)第十三章胶体与大分子溶液物化试卷(二)参考答案1. 对反应CO(g)+H2O(g)=H2(g)+CO2(g) ( )(A) K pθ=1 (B) K pθ=K c(C) K pθ>K c(D) K pθ<K c2. 一定温度下, (1) K m, (2) (αG/αξ)T,p, (3)Δr Gθ, (4) K f四个量中,不随化学反应体系压力及组成而改变的量是: ( )(A)1,3 (B)3,4 (C)2,4 (D)2,33. 化学反应等温式Δr G m=Δr G mθ + RTlnQ a,当选取不同标准态时,反应的Δr G mθ将改变,该反应的Δr G m和Q a将:( )(A) 都随之改变(B) 都不改变(C) Q a变,Δr G m不变(D) Q a不变,Δr G m改变4. 已知反应2NH3= N2+ 3H2在等温条件下,标准平衡常数为0.25,那么,在此条件下,氨的合成反应(1/2) N2+(3/2) H2= NH3的标准平衡常数为:( )(A) 4 (B) 0.5 (C) 2 (D) 15. Ag2O 分解可用下列两个反应方程之一表示,其相应的平衡常数也一并列出I. Ag2O(s) === 2Ag(s) + (1/2)O2 (g)K p(Ⅰ)II. 2Ag2O(s) === 4Ag(s) + O2(g)K p(Ⅱ)设气相为理想气体,而且已知反应是吸热的,试问下列结论是正确的是:( )(A) K p(Ⅱ) = K p(Ⅱ) (B) K p(Ⅰ) = K p2(Ⅱ)(C) O2气的平衡压力与计量方程的写法无关(D) K p(Ⅰ) 随温度降低而减小6. 某化学反应在298 K时的标准吉布斯自由能变化为负值,则该温度时反应的K值将: ( )(A) K= 0 (B) K< 0 (C) K> 1 (D) 0 < K< 17. 在一定温度和压力下,对于一个化学反应,能用以判断其反应方向的是:( )(A) Δr G mθ(B) K p(C) Δr G m(D) Δr H m8. 对理想气体反应CO(g) + H2O(g) = H2(g) + CO2(g) ,下述关系正确的是:( )(A) K x< K p (B) K p= K x(C) K x= K c (D) K p< K c9. 下列平衡常数中,量纲为1的是: ( )(A) K f,K p, K (B) K x, K p(C) K c, K a, K x(D) K pθ, K a, K x10. 已知分解反应NH2COONH4(s) = 2NH3(g) + CO2(g) 在30℃时的平衡常数K=0.000655,则此时NH2COONH4(s)的分解压力为:( )(A)16630Pa (B)594000Pa (C)5542Pa (D)2928Pa11. 在温度为T,压力为p时,反应3O2(g)=2O3(g) 的K p与K x的比值为( )(A) RT (B) p (C) 1/(RT) (D) 1/p12. 已知445℃时, Ag2O(s) 的分解压力为20 974 kPa,则此时分解反应Ag2O(s)=2Ag(s)+(1/2)O2(g) 的Δr G mθ为:( )(A) 14.387 J/mol (B) 15.92 kJ/mol(C) -15.92 kJ/mol (D) -31.83 kJ/mol13. 反应2HgO(s) =2Hg(g) + O2(g) 在101 325 Pa、分解温度时的分压p Hg等于:( )(A) 101.325 kPa (B) (101.325 /2) kPa(C) (101.325 /3) kPa (D) (2/3)×101.325 kPa14. 对一个理想气体化学反应的平衡常数与其标准吉布斯自由能变化(Δr G mθ ) 的关系有:( )(1) K pθ= exp(=-Δr G mθ/RT)(2) K cθ= exp(-Δr G mθ/RT)(3) K x= exp(-Δr G mθ/RT) 其中关系正确的是:(A) (1)、(2) 和(3) 式均正确(B) (1) 式正确(C) (2) 式正确(D) (3) 式正确15. 理想气体化学反应平衡时,应用下列哪个关系式?(A) Δr G m= -RTln K pθ(B) Δr G mθ= -RTln K pθ(C) Δr G mθ= -RTlnK x(D) Δr G mθ= -RTln K cθ16. 在S,H,C V,G,F 几个热力学函数中,其数值与最低能级能量数值的选取无关的是: ( )(A) S,H,C V,G,F (B) C V(C) C V,S (D)A,G,H17. 300 K 时,某分子的基态能量是6.21×10-21J,其玻耳兹曼因子为:( )(A) 1.5 (B) -1.5 (C) 0.223 (D) 4.4818. 在一定的温度下,一定量的PCl5(g) 在一密闭容器中达到分解平衡。
物理化学第5-6章课后答案傅献彩_第五版(南京大学化学化工学院)

第五章相平衡I- ⅛,□(s)分解的反应方程为⅛O(s)-Ξ⅛(s) + γ<λ<gλ当用⅛O(s)进行分無达平衡时•系统的组分数、自由度数和可能平衡共存的最大相数各为多少?解:S=31C=S-R=2Φ-3t f~ C÷2-Φ=l/=0时4最大为4-2.搭出如下各系统的组分数、相数和自曲度数各为多少?(1)NH4CKs)在抽空容器中,部分分解为NH^⅛),HCKg)达平衡:(2)NKCiCS)在含有一定量NHNE的容器中,部分分解为NH√g)τHCKgJ达平衡;(3)NH i HS(S)与任竜量的NH3(g}和H J SCg)^合,达分解平衡;(4)在900K 时Cx叮与CO(g),CO⅛Cg) ∕λ (G达平翫解:NHKnNHa Cg) + HCKg)门)呂=3* C=S-R-R, {R=l f R f = ∖) [NH s]=[HCl]-C=I TΦ=2∙t /=C-Φ+2 = lC2)S=3t C=S-R-R'=2 Φ=2,f=C~Φ~∖~2=2C3)S=3, C=S-R-R, =3-1-0=2. Φ=2f=OM2=2(同2)C<s)+yQCg)-COCg)①<4)9t>0K 时’CXXg)+⅛ (g)-α⅛ (g)②$=4, C^R-R f(◎中KxxI 的慑不定龙=0、C=S-R-R f = 4-2-0=2Φ=2 Γ ^C+i-φ^l.玉在制水煤气的过稈中,有五种物质,CCs)τCX)(g),CC⅛Cg}Λ⅛⅛)和H2OCgJ建立如下三牛平衡,试求该系统的独立组分数.CCs> + H- 0(g)^=⅛(g)÷CO(g)(1>C0⅛(g) + H? ⅛)-H3 0(fi) +CO(g) ¢2)Ce⅛(g)+CCs>-2Co(g> <3)解:建立3个平衡,(3)式可⅛¢1)+(2)得到RT S= 5C^S-R-R f=^二已知T‰CαS和H2O(I)可以生成如下三种水合物:Na a CQ ∙ H S O(S) ,N¾C0⅛・7H2OCs)和Na2CC⅛ * IOH2 O(s)试求门)在大气压下•与Na S CQ J水溶液和冰平衡共存的忒合盐的最大值;<2)在298K时,与水蒸气平衡共存的水合盐的最大值.解:(1〉S=5.R=3IJ R Z^O C=S-R~R f^=2每生咸一种含水盐+ R增加1.S增加1:匚、值不变.在∕⅛∙τ√* =C+1-Φ Γ =0时血绘大为3.已知有NamEQ水陪揪和H2O(≡)两相•则还能生成一种含水盐.(2)同样地τ∕* =C+I^Φei⅛大为3故还可最多有两种含水盐主成-5∙在不同温度下•测得Ag2O(S)分解时氧气的分压如下:T/K 401 417 443 463 486P(Co2)∕kPa10 20 51 101 203试问(1)分别于413K和423K时,在空气中加热银粉,是否有Ag2O(S)生成?(2)如何才能使Ag2O(S)加热到443K时而不分解?△ 1解:⑴ Ag2O(s)^=i2Ag(s)÷-∣-θ2(g)空气中O2的分压为0. 21 ×po=0. 21X101. 325kPa=21. 3Pa当空气中Q的分压大于或等于Ag2O的分解压力时,能生成Ag2O,否则不能,作PJ -T图,可以看出413K时P OZ的压力V空气中O Z的分压,能生成Ag"),而在423K时如=25kPa>O. 21Pa不能生成Ag2O.(图略)(2)从所给数据可知,在443K时,如解的平衡压力为5IkPa故当O2的分压大于51kPa时Ag2O不分钟.6・通常在大气压力为101. 3kPa时,水的沸点为373K,而在海拔很高的高原上,当大气压力降为66. 9kPa时,这时水的沸点为多少?已知水的标准摩尔气化焙为40. 67kJ・moΓ1,并设其与温度无关.解:根据ClaUniUS-CIaPeyrOn 方程式—H lf与温度无关时•%=鬻G卡66.9 _40. 67 × IO3z 1 1、Iln10L3(丽飞)T2=361. 56K.7.某种溜冰鞋下面冰刀与冰的接触面为:长7. 62cm,宽2. 45X 10~3cm.若某运动员的体重为60kg,试求<1)⅛动员施加于冰面的总压力.(2)在该压力下冰的熔点.已知冰的摩尔熔化熔为6∙ OIkJ ∙ moΓ1•冰的正常熔点为273K,冰和水的密度分别为920和IOOOkg •解:PA = P e÷P⅛P运=Gs = τng∕S= 2X7. ^×2.4^<10^3= 1.58×109PaP运》护 * P总=P远=1∙ 58 × IO R Pa 根据克拉贝龙方程•CIft . _ △汕Hm臥L T ∙ Δfu9V m皿Vm=I8X10-3(誌δ-禽)= -1.556×10^6m3∙ kg~1L58X10«Pa-l. OlXlO5Pa≡占诰労君r⅞, InT加-0∙ 04114≡lnτ^73κE =262. 2K.8.已知在1013kPa时.正已烷的正常沸点为342K,假事实上它符合TrOUton规则,即Δv.p‰ZT b¾ 88J ・KT・moΓ,,试求298K时正已烷的蒸气压.解:根据TrOUtOn规则Δvv H n∕Tb≈88J ・ K-】・moΓ1ΔvH>H m=88×342=116. 964kJ ・moΓ1根据克拉贝龙方程Δrtt>Hm与温度无关时•叱刖譬(*~⅜I 4 _ ]血964kJ ∙ rpoL( __________ 1 X I-I rl lnI 2VP QInA -8. 314J ∙ K^l∙ moΓ1( 342K 298K)+ lnl°1* 3kPp2=0∙ 41kPa.9.从实验测得乙烯的蒸气压与温度的关系为In 瓷=-号竖+1. 75In-^-1. 928×10~2-^ + 12. 26试求乙烯在正常沸点169. 5K时的摩尔蒸发熔变.解:根据克拉贝龙方程•当V e»Vi从乙烤蒸气压与温度关系式得•dln%p= 1921 K/ Γ5 +1. 75/ 丁一1. 928 X10一2在乙烤的正常沸点T=I69. 5K时d∣n%τ=0∙C胡=伶学πXPH In=8. 314×0. O58X169.5X=81.73J ・moΓ,.10・已知液态碑AS(I)的蒸气压与温度的关系为In 育=-等^+20. 30固态碑AS(S)的蒸气压与温度的关系为In 盘=-翌泮+ 29. 76试料的三相鮒温度和氐丸.解:在三相点上,固态与液态碑的F相等.(ln%a=-3^K+20. 30jln^p a=~15^9κ+29.76解得:T=IO92. 4K, p=3664. 38kPa.11.在298K时,纯水的饱和蒸气压为3167. 4Pa,若在外压为101. 3kPa的空气中,求水的饱和蒸气压为多少?空气在水中溶解的影响可忽略不计.解:外压与蒸气压的关系,空气不溶解于水,可看成是不活泼气体,lnP%∙=呂*(以_九)p;是无惰性气依时的蒸气压,久是当外压为P t时•有惰性气体存在时的蒸气压依题意得等温∖"P fξ∕p;=漲# (P ・_P ;)⅛67.4 = 8⅛⅜98(IOI ∙3×1°3~3167M)V W (I) = Ig£ *I mPrI ⅞1 m °1 ≈ 18cm 3 = 1. 8 × 10~5 m 3%=3169. 66Pa可以看出影响很小,因为V(g)»V(l).12. 在36OK 时,水(A)与异丁醇(B)部分互溶,异丁醇在水相中的摩尔分数为刘=0. 021.已知水相中 的异丁醇符合Henry 定律,Henry 系数HB=I ・58X 疔Pa.试计算在与之平衡的气相中,水与异丁醇的分 压•已知水的摩尔蒸发熔为40. 66kJ ・mol~1 ,且不随温度而变化.设气体为理想气体.解:水相中的异丁醇符合Henry 定律有 PB=It 小・ X B = I. 58× 106Pa×0. 021=≡33180Pa 水的分压 AA=Z —如= (IOl300—33180>Pa=68120Pa. 13. 根据所示碳的相图(图5-4),回答如下问题: ⑴曲线OA,OB,OC 分别代表什么意思? (2) 指出O 点的含义,(3) 碳在常温、常压下的稳定状态是什么?(4) 在2000K 时•增加压力,使石墨转变为金刚石是一个放热 反应,试从相图判断两者的摩尔体积哪个大?(5) 试从相图上估计,在2000K 时,将石墨转变为金刚石至少 夏加多大压力?解:(1)OA'代表,金刚石与石墨的两相平衡线,OB 表示液态 C 与石蜃的两相平衡线,OC 代表金刚石与液相C 的两相平衡线.(2) 0点代表液态C,金刚石和石墨的三相点是QA,OB,OC 的交点・此点2=3,/=0,三相点的温度 压力皆由系统确定.(3) 碳任常温,常压下稳定状态是石墨. (4) 根据克拉贝龙方程. d%τ= 邈;・石墨(s)" 金刚石(S)d%τ即为OA 线的斜率为正. 龛卷 >0 ∆H ra <0,7>0Λ∆⅛1<0即由石墨变成金刚石体积滅小,石墨的摩尔体积较大. (5) 估汁53XlO 8Pa 时可以将石最转变为金刚石.14. 在外压为101.3kPa 的空气中,将水蒸气通入固体碘I 2 (s)与水的混合物中,进行蒸汽蒸倔.在 371. 6K 时收集谐出蒸汽冷凝,分析他岀物的组成得知,生IOog 水中含碘81. 9g.试计算在371. 6K 时碘的 蒸气压.而R 2 ∕Z P H 2O =叫 /∏H 2O P I 2 + P H 2O = P解出汐S =5556. 87PaP H 2O =5556. 9Pa图5-4 解:1,-Z ∏H 2OTAQ 3K15. 水(A)与氯苯(B)互溶度极小,故对氯苯进行蒸汽蒸谓.在101. 3kPa 的空气中,系统的共沸点为 365K,这时氯苯的蒸气分压为29kPa.试求(1) 气相中氯苯的含凰加(2) 欲蒸出IoOO kg 纯氯苯,需消耗多少水蒸气?已知氯苯的摩尔质量为112. 5g ・moΓ1. 解:⑴在“°空气中•氯苯的蒸气压为29kPa,则水的蒸气压为,P H 2OOQ刃=伽/P 总=PC 6H S C ∣∕P e=JQ2~2=O- 286Hn Wy/MB = 29 卩:町/M 厂(IoI ・3-29)IOoOKg/112・ 5g ∙ mo 「= 39kPaVV A Z18g ∙ moΓl ^7Γ3id⅛ 叭=WH 2o =398. 9kg 希消耗水,398. 9kg.16. 在273K 和292K 时,固体苯的蒸气压分别为3. 27kPa 和12. 30kPa,液体苯在293K 时的蒸气压为 10. 02kPa.液体苯的摩尔蒸发熔为34.14 kJ ・moΓ1.试求(D303K 时液体苯的蒸气压; (2) 固体苯的摩尔升华焙; (3) 固体苯的摩尔熔化焙. 解:(1)克拉贝龙方程式: InA/»=爷(*-*)I、ZIA AOl n _ 34・ 17kJ ∙ / 1 1 、“化 / °∙ 02kl a一 & 314J ・ KT ・ moiτ( 293K _ 303K )∕>2≡15. 92kPa.⑵同理 Jn√2∕√ι=^=(γr~γr) I n 30 = A⅛L X ( —1 -------- 1— \ n3.27 & 314 k 273K 393K 7 ∆H m =44.05kJ ∙ moL∙ (3) Δ⅛ H nl =ΔΛ H rn -» H m= 44∙ 05-34. 17≡9. 88kJ ∙ moΓ1.17. 在298K 时,水(A)与丙醇(B)的二组分液相系统的蒸气压与组成的关系如下页表所示,总蒸气压 在X B =O. 4时出现极大值:(1) 请画岀p-χ~y 图•并指岀各点、线和面的含义和自由度;(2〉将x tt =0. 56的丙醇水溶液进行精協•精懈塔的顶部和底部分别得到什么产品? (3)若以298K 时的纯丙醇为标准态,求X B =O. 2的水溶液中,丙醇的相对活度和活度因子•(2)nc 6H 5αX ∏H 2O =吋5。
物理化学傅献彩习题课-第二、三、四章
21.偏摩尔量是容量性质的状态函数。 22. 化学势是容量性质的状态函数。 23.理想稀溶液中的溶剂遵从亨利定律,溶质遵从拉乌尔定律。 24.理想混合气体中任意组分B的逸度fB就等于其分压pB。 25.任何一个偏摩尔量(化学势)都是温度、压力和组成的函数。 26.对于非理想气体,Z<1表示实际气体极容易压缩。 27.对于纯组分,化学势等于Gibbs自由能。 28.热力学的不可逆过程就是不能向相反方向进行的过程。此 话对吗? 29.一个爆炸反应体系应看作是绝热系统。 30.一个隔离系统的熵永不减少。 31.理想稀溶液Raoult定律与Henry定律没有区别。 32.溶质在气相和在溶液中的分子状态不相同,Henry定律也 能适用。
(b)
∆vapS总,∆vapA,∆vapG是否均可用来判别这
一过程的方向?并叙述理由,其判断结果如何?
9
解:通过可逆过程进行计算
∆vapG = 0;∆vapS = n∆vapHm/T = 41.85 J· −1 K
∆vapA= ∆vapG − ∆vap(pV) = −nRT = −3325.6 J
椐,因 W = 0 ∴ −W ≤ − ∆vapA ∴ ∆vapA < 0,过程不可逆 ∵ 过程不恒压,不能用 ∆vapG 来判别
10
判断题 1.1摩尔100℃101325Pa下的水变成同温同压下的水蒸气,该过 程的ΔU=0。 2.ΔfHθm (C,金刚石,298K)=0。 3.298.15K时,H2(g)的标准摩尔燃烧焓与H2O(l)的标准摩尔生成 焓数值上相等。 4.绝热过程都是等熵过程。 5.体系经历一个不可逆循环过程,ΔS>0。 6.一定量理想气体的熵只是温度的函数。 7.dU=nCv,mdT, dH=nCp,mdT这两个公式对一定量的理想气体的任 何pVT过程均适用。 8.一个系统从始态到终态,只有可逆过程才有熵变。 9.系统从同一始态出发,经绝热不可逆到达的终态,若经过绝 热可逆过程,则一定达不到此终态。 10.对气态物质,其Cp-Cv=nR
物理化学傅献彩第五版复习题答案

物理化学傅献彩第五版复习题答案物理化学是化学学科中的一个重要分支,它结合了物理学的原理来研究物质的性质和变化。
傅献彩教授的《物理化学》第五版是许多高校化学专业学生的必修教材。
以下是根据该教材复习题的一些参考答案,供同学们复习参考:第一章热力学基础1. 描述热力学第一定律和第二定律的物理意义。
- 第一定律,即能量守恒定律,表明能量不能被创造或消灭,只能从一种形式转换为另一种形式,或从一个系统转移到另一个系统。
- 第二定律,表明在自发过程中,系统的熵总是增加,这意味着自然界倾向于向更加无序的状态发展。
2. 解释什么是熵,并给出熵变的计算方法。
- 熵是系统无序程度的度量,通常用于描述系统的热力学状态。
熵变可以通过等压或等容过程的积分来计算,例如:\(\Delta S = \int \frac{dQ}{T}\)。
第二章化学平衡1. 简述勒夏特列原理。
- 勒夏特列原理指出,如果一个处于平衡状态的系统受到外部条件的改变(如压力、温度或浓度的改变),系统会自发调整以抵消这种改变,从而重新达到平衡。
2. 描述化学平衡常数及其表达式。
- 化学平衡常数是一个衡量反应在平衡状态下各组分浓度的比值的常数,表达式通常为:\(K = \frac{[C]^c[D]^d}{[A]^a[B]^b}\),其中\(a, b, c, d\)是各组分的系数。
第三章相平衡1. 解释拉乌尔定律及其适用范围。
- 拉乌尔定律指出,在理想溶液中,溶剂的蒸汽压力与其摩尔分数成正比。
该定律适用于理想溶液,即溶质和溶剂之间没有相互作用力的溶液。
2. 描述相图的基本概念及其在物理化学中的应用。
- 相图是表示不同相态(如固体、液体、气体)在不同条件下的共存关系的图形。
在物理化学中,相图用于描述和预测物质在不同温度和压力下的相变行为。
第四章电化学1. 定义法拉第定律及其在电化学中的应用。
- 法拉第定律描述了在电解过程中,通过电极的物质量与通过电极的电荷量成正比的关系。
物理化学傅献彩上册习题答案

第二章 热力学第一定律思考题.:1. 一封闭系统,当始终态确定后:(a )当经历一个绝热过程,则功为定值;(b )若经历一个等容过程,则Q 有定值:(c )若经历一个等温过程,则热力学能有定值:(d )若经历一个多方过程,则热和功的和有定值。
解释:始终态确定时,则状态函数的变化值可以确定,非状态函数则不是确定的。
但是热力学能U 和焓没有绝对值,只有相对值,比较的主要是变化量。
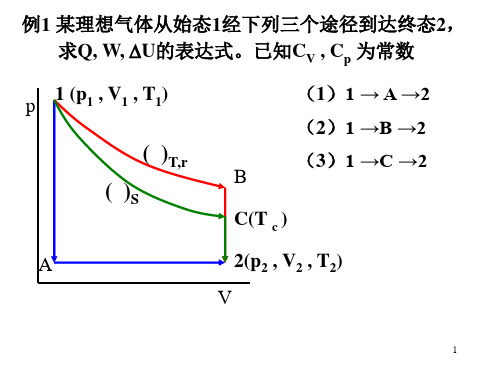
2. 从同一始态A 出发,经历三种不同途径到达不同的终态:(1)经等温可逆过程从A →B ;(2)经绝热可逆过程从A →C ;(3)经绝热不可逆过程从A →D 。
试问:(a )若使终态的体积相同,D 点应位于BC 虚线的什么位置,为什么? (b )若使终态的压力相同,D 点应位于BC 虚线的什么位置,为什么,参见图12p p (a)(b)图 2.16解释: 从同一始态出发经一绝热可逆膨胀过程和一经绝热不可逆膨胀过程,当到达相同的终态体积V 2或相同的终态压力p 2时,绝热可逆过程比绝热不可逆过程作功大,又因为W (绝热)=C V (T 2-T 1),所以T 2(绝热不可逆)大于T 2(绝热可逆),在V 2相同时,p=nRT/V,则p 2(绝热不可逆)大于 p 2(绝热可逆)。
在终态p 2相同时,V =nRT/p ,V 2(绝热不可逆)大于 V 2(绝热可逆)。
不可逆过程与等温可逆过程相比较:由于等温可逆过程温度不变,绝热膨胀温度下降,所以T 2(等温可逆)大于T 2(绝热不可逆);在V 2相同时, p 2(等温可逆)大于 p 2(绝热不可逆)。
在p 2相同时,V 2(等温可逆)大于 V 2(绝热不可逆)。
综上所述,从同一始态出发经三种不同过程,当V 2相同时,D 点在B 、C 之间,p 2(等温可逆)>p 2(绝热不可逆)> p 2(绝热可逆)当p 2相同时,D 点在B 、C 之间,V 2(等温可逆)> V 2(绝热不可逆)>V 2(绝热可逆)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第一定律部分 1、为什么第一定律数学表示式dU=δQ-δW 中内能前面用微分号d,而热量和功的前面用δ符号? 答:因为内能是状态函数,具有全微分性质。而热量和功不是状态函数,其微小改变值用δ表示。 2、公式H=U+PV中H > U,发生一状态变化后有ΔH =ΔU +Δ(PV), 此时ΔH >ΔU吗?为什么? 答:不一定。因为Δ(PV)可以为零、正数和负数。 3、ΔH = Qp , ΔU = Qv两式的适用条件是什么? 答:ΔH = Qp此式适用条件是:封闭系等压非体积功为零的体系。 ΔU = Qv此式适用条件是:封闭系等容非体积功为零的体系。
4、ΔU=dTCTTv21,ΔH=dTCpTT21两式的适用条件是什么? 答:ΔU=dTCTTv21此式适用条件是:封闭系等容非体积功为零的简单状态变化体系。
ΔH=dTCpTT21此式适用条件是:封闭系等压非体积功为零的简单状态变化体系。 5、判断下列说法是否正确 (1)状态确定后,状态函数的值即被确定。 答:对。 (2)状态改变后,状态函数值一定要改变。 答:不对。如:理想气体等温膨胀过程,U和H的值就不变化。 (3)有一个状态函数值发生了变化,状态一定要发生变化。 答:对。 6、理想气体绝热向真空膨胀,ΔU=0,ΔH=0对吗? 答:对。因理想气体绝热向真空膨胀过程是一等温过程。 7、恒压、无相变的单组分封闭体系的焓值当温度升高时是增加、减少还是不变? 答:增加。
8、在PØ下,C(石墨)+O2(g)——>CO2(g)的反应热为ΔrHm,对于下列几种说法,哪种不正确?
(A)ΔrHm是CO2的标准生成热, (B)ΔrHm是石墨的燃烧热, (C)ΔrHm=ΔrUm, (D)ΔrHm>ΔrUm 答:D不正确。 9、当体系将热量传递给环境后,体系的焓值是增加、不变还是不一定改变? 答:不一定改变。 10、孤立体系中发生的过程,体系的内能改变值ΔU=0对吗? 答:对。 11、实际气体节流膨胀过程,体系的焓变ΔH=0对吗? 答:对。 12、当一个化学反应的ΔCp=0时,反应的热效应与温度无关,此结论对否,为什么?
答:对。因:()p = ΔCp 13、1mol理想气体,经历一个循环后,W=400J,因ΔU的值没有给出,所以该过程的热量值也无法确定,此结论对吗,为什么? 答:不对。经过一循环过程后,ΔU=0,所以Q=400J 14、等压热效应与等容热效应关系式,Qp=Qv+ΔnRT中的Δn为生成物与反应物
中气相物质摩尔数的差值,此结论对吗? 答:对。 15、等温等压进行的某化学反应,实验测得T1和T2时的热效应分别为ΔrH1和ΔrH2,用基尔霍夫公式验证时,发现数据不相等。为什么?
解:用基尔霍夫公式计算的ΔrHm,1和ΔrHm,2是反应物完全变成产物时的值。而ΔrH1和ΔrH2是该化学反应达到平衡时实验测得的值。
第二定律部分
1、有人说,根据热力学第二定律可以断定下两句话是正确的 Ⅰ、从单一热源吸热不可能完全变成功, Ⅱ、热量从低温物体向高温物体扩散是不可能的。 你对上两句话是如何理解的。 答:这两句话是不正确的。热力学第二定律的正确说法是:在不引起其它变化的条件下,从单一热源吸热不可能完全变成功。及在不引起其它变化的条件下,热量从低温物体向高温物体扩散是不可能的。 2、计算绝热不可逆过程的ΔS时,能否设计一个始终态相同的绝热可逆过程去计算,为什么? 答:不能。因为从ΔS≥0判据式的条件是绝热过程和孤立体系,可以看出,从同一始态出发,绝热可逆过程和绝热不可逆过程达不到同一终态。 3、理想气体等温过程的ΔG=ΔF,此结论对否?为什么? 答:对。∵ΔG=ΔH-Δ(TS)、ΔF=ΔU-Δ(TS),而理想气体等温过程的ΔH=0,ΔU=0。 4、100℃、1Pø水向真空中蒸发为100℃、1Pø水蒸气,经计算此相变过程的ΔG=0,说明此相变过程是可逆的,此结论对吗?为什么? 答:不对。因为100℃、1Pø水向真空中蒸发为100℃、1Pø水蒸气不是等温等压过程,因此不能用ΔG做判据。 5、理想气体绝热向真空膨胀Q=0,ΔS=0,此结论对吗?为什么? 答:不对。因理想气体绝热向真空膨胀是一不可逆过程,所以ΔS≠0。 6、 7、下列两种说法是否正确,说明原因。 (1)不可逆过程一定是自发过程。 (2)自发过程一定是不可逆过程。 答(1)不对,如:气体的不可逆压缩过程是非自发过程。 (2)对。 8、理想气体在等温条件下,经恒外压压缩至稳定,此变化过程中 ΔS体<0,ΔS环>0,此结论对否?为什么? 答:对。因此过程ΔS体<0,又因此过程是不可逆过程,ΔS孤立>0, 所以ΔS环>0。 9、理想气体在绝热条件下,经恒外压压缩至稳定,此变化过程中 ΔS体>0、ΔS体=0还是不确定,为什么? 答:ΔS体>0。因为此过程是绝热不可逆过程。 10、公式dG=-SdT+VdP可适用于下列哪一过程 A、298K,1Pø的水蒸发过程 B、理想气体向真空膨胀 C、电解水制取氢 D、N2(g)+3H2(g)=2NH3(g)未达平衡 答:适用于B过程。 11、(1)等温等压的可逆相变过程中,体系的熵变ΔS=ΔH/T (2)体系经历一自发过程总有ΔS>0, 上两种表述正确吗?为什么? 答:不正确。对于(1)缺少非体积功等于零的条件。对于(2)应该是绝热体系或者是孤立体系经历一自发过程总有ΔS>0。 12、在α、β两相中,均含有A、B两种物质,当达到平衡时,下列哪种情况是正确的?
A、μA=μB,B、μA= μA,C、μA= μB,D、μA=μB 答:B正确。 13、在浓度一定的溶液中,若采用不同的标准态,溶质的化学势也将不同,这句话对吗? 答:不对,应该是相同。 14、323K、1Pø的N2的化学势比298K、1Pø的N2的化学势要大,此结论对吗?为什么?
答:不对。∵PTG=-S ∴温度增加化学势下降。 15、298K、0.1Pø、1mol N2(g)的化学势与298K、0.1Pø、1mol O2(g)的化学势相同,此结论对吗?为什么? 答:不对。不同物质的化学势不能相互比较。 16、有个学生对理想气体的某个公式记得不太准确了,他只模糊地记得(xS)y=VnR,按你的看法,这个公式的正确表达式中x和y应该是什么? 答:x为v, y为T。∵TVS=VTP 又因理想气体的VTP=VnR。 17、(1)因为可逆热机的效率最高,可逆热机的效率可以大于等于1吗? 答:不能。如果ηR>1,则违背热力学第一定律。如果ηR=1,则违背热力学第二定律。 (2)可逆热机的效率最高,在其它条件相同的情况下,可逆热机带动的机车速度最快吗? 答:不对,热力学不讨论速度问题。可逆过程的特点之一就是变化过程无限缓慢,因此在其它条件相同的情况下,可逆热机带动的机车速度最慢。但它所带动的机车所运行的距离应是最长的。 18、等温等压下,在A和B组成的均相体系中,若A的偏摩尔体积随温度的改变而增加时,则B的偏摩尔体积将减小。此结论对吗? 答:对。由吉布斯—杜亥姆nAdvA + nBdvB = 0很容易证明。
溶液部分
1、理想溶液有何特点? 答:在全部浓度范围内,各组分都严格遵拉乌尔定律;对理想溶液遵拉乌尔定律和亨利定律等同;理想溶液中组分B的化学势的表达式为:PTBB,RTlnXB ;当各组分混合构成理想溶液时,
△ △ mixV=0, △mixU=0, △mixH=0。 2、何为正偏差溶液?何为负偏差溶液? 答:形成溶液时,不同分子间的引力弱于同类分子间的引力,使得分子逸出的倾向增加,实际蒸汽压比用拉乌尔定律计算的结果要大。△H>0,△V>0。此称正偏差溶液。负偏差溶液情况则正相反。 3、固体糖可顺利溶解在水中,请说明固体糖的化学势与糖水中的化学 势比较,高低如何? 答:高。 4、重结晶制取纯盐的过程中,析出NaCl固体的化学势与母液中NaCl的化学势比较,高低如何? 答:相等。 5、马拉松运动员沿途准备的饮料应该是那一种 A 白开水 B 含适量的维生素的等渗饮料 C 20%葡萄糖饮料 D 高脂肪、高蛋白、高能量饮料 答:B 6、298K,0.01m糖水的渗透压为Л1, 0.01m食盐水的渗透压为Л2,则Л1与Л2
的关系如何?
答:Л1<Л2 7、恒压下,将分子量为50的二元电解质5克溶于250克水中,测得凝固点为-0.744℃,该电解质在水中的解离度是多少?(水的冰点降低常数kf=1.86) A 100% B 76% C 27% D 0 答: D 8、0.450克化合物溶于30克水中,(水的冰点降低常数kf=1.86),凝固点降低了0.150℃,该化合物的分子量是多少? 答:ΔT=kfmB 解得M=186 9、在一恒温抽空得玻璃罩中,封入两杯液面相同的糖水(A)和纯水(B),经历若干时间后,两杯液面的高度将如何变化? 答:(A)杯高于(B)杯
10、在温度T时纯液体A的饱和蒸汽压为AP,化学势为A,并且已知在P压力下的凝固点为fT,当A中溶入少量与A 不形成固态溶液的溶质而形成稀溶液时,上述三个分别为AP,A,fT,则下述结论何者正确? (A) AP<AP A<A fT<fT (B) AP>AP A<A fT<fT
