高中化学第二节影响化学反应速率的因素同步练习新人教版选.
2.1化学反应速率 第2课时 同步练习 2021-2022学年高二化学人教版(2019)选择性必修1

第二章化学反应速率与化学平衡第一节化学反应速率第二课时影响化学反应速率的因素课后练习2021-2022学年高中化学人教版(2019)选择性必修一一、单选题(共16题)1.催化剂在化学反应里A .只能加快反应速率B .一定能改变反应速率C .只能减慢反应速率D .不一定影响反应速率2.少量铁粉与100mL0.01mol·L -1的稀盐酸反应,反应速率太慢,为了加快此反应速率而不改变H 2的量,可以使用如下方法中的①由铁粉换铁块②加NaNO 3固体③将0.01mol·L -1的稀盐酸换成98%的硫酸溶液④加CH 3COONa 固体⑤加NaCl 溶液⑥滴入几滴硫酸铜溶液⑦升高温度(不考虑盐酸挥发)⑧改用100mL0.1mol·L -1盐酸A .③⑤B .①③C .⑥⑦D .⑦⑧3.下列有关化学反应速率的说法正确的是A .用铁片与稀硫酸反应制取氢气时,改用浓硫酸可以加快产生氢气的速率B .1100mL 2mol L -⋅的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变C .2SO 的催化氧化是一个放热反应,所以升高温度,反应速率减慢D .催化剂能降低分子活化时所需能量,使单位体积内活化分子数目大大增加4.对于100 mL1 mol·L -1盐酸与铁片的反应,采取下列措施:①升高温度;②改用100 mL3 mol·L -1盐酸;③多用300 mL1 mol·L -1盐酸;④用等量铁粉代替铁片;⑤改用98%的硫酸。
其中能使反应速率加快的是 A .①③④ B .①②④ C .①②③④ D .①②③⑤5.下列措施不是为了改变化学反应速率的是A .加工馒头时添加膨松剂B .将食物存放在冰箱中C .糕点包装袋内放置除氧剂D .冶铁时将铁矿石粉碎6.在下列影响化学反应速率的外界因素中,肯定能使化学反应速率加快的方法是①加入正催化剂②增大反应物浓度③将固体块状反应物磨成粉末A .①②B .②③C .①③D .①②③7.下列做法的目的与改变化学反应速率无关的是A .在糕点包装内放置小包除氧剂B .在糖果制作过程中添加着色剂C .牛奶在冰箱里保存D .未成熟的猕猴桃与成熟苹果一起密封放置8.室温下,将一根镀锡铜线置于稀硫酸中,数十分钟内,未观察到气泡冒出,铜线表面的锡层也未见脱落,其可能的原因是A .锡是一种很稳定的金属B .硫酸的浓度太小C .稀硫酸与锡的作用很缓慢D .室温太低9.已知分解221molH O ,放出热量98 kJ ,在含少量I -的溶液中,22H O 分解的机理为222H O I H O IO --+→+(慢)、2222H O IO H O O I --+→+↑+(快)。
2021新教材人教版高中化学选择性必修第一册对应练习--第二章化学反应速率与化学平衡第一~二节拔高练

第一~二节综合拔高练五年选考练考点1 化学反应速率及其影响因素1.(高考组编,)下列叙述不正确的是( )A.(2019课标Ⅲ,12B)在过氧化氢溶液中加入少量MnO2加快氧气的生成速率B.(2018课标Ⅱ,13D改编)向2支盛有5 mL不同浓度NaHSO3溶液的试管中同时加入2 mL 5% H2O2溶液,观察实验现象,不能达到探究浓度对反应速率的影响的目的C.(2018江苏单科,10D)在酶催化淀粉水解反应中,温度越高淀粉水解速率越快D.(2018江苏单科,13B)下图是室温下H2O2催化分解放出氧气的反应中c(H2O2)随反应时间变化的曲线,说明随着反应的进行H2O2分解速率逐渐减小2.(2016浙江4月选考,18,2分,)X(g)+3Y(g)2Z(g) ΔH=-a kJ·mol-1。
一定条件下,将1 mol X和3 mol Y通入2 L的恒容密闭容器中,反应10 min,测得Y的物质的量为2.4 mol。
下列说法正确的是( )A.10 min内,Y的平均反应速率为0.03 mol·L-1·s-1B.第10 min时,X的反应速率为0.01 mol·L-1·min-1C.10 min内,消耗0.2 mol X,生成0.4 mol ZD.10 min内,X和Y反应放出的热量为a kJ3.(2015福建理综,12,6分,)在不同浓度(c)、温度(T)条件下,蔗糖水解的瞬时速率(v)如下表。
下列判断不正确...的是( )c/mol·L-1v/mmol·L-1·min-1T/K0.600 0.500 0.400 0.300318.2 3.60 3.00 2.40 1.80328.2 9.00 7.50 a 4.50b 2.16 1.80 1.44 1.08A.a=6.00B.同时改变反应温度和蔗糖的浓度,v可能不变C.b<318.2D.不同温度时,蔗糖浓度减少一半所需的时间相同4.(2018北京理综,27节选,)(3)I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下。
高中化学选择性必修1 第二章 化学反应速率与化学平衡 第二节 化学平衡(3)同步练习含详解答案

化学反应平衡图像同步练习 (答题时间:40分钟)一、选择题1. 汽车尾气中NO 产生的反应为:N 2(g )+O 2(g )⇌2NO (g )。
一定条件下,等物质的量的N 2(g )和O 2(g )在恒容密闭容器中反应,如图曲线a 表示该反应在温度T 下N 2的浓度随时间的变化,曲线b 表示该反应在某一起始反应条件改变时N 2的浓度随时间的变化。
下列叙述正确的是( )A. 温度T 下,该反应的平衡常数K =21210)(4c c c - B. 温度T 下,随着反应的进行,混合气体的密度减小 C. 曲线b 对应的条件改变可能是加入了催化剂D. 若曲线b 对应的条件改变是温度,可判断该反应的ΔH <02. 在恒容密闭容器中通入X 并发生反应:2X (g )⇌Y (g ),温度T 1、T 2下X 的物质的量浓度c (X )随时间t 变化的曲线如图所示,下列叙述正确的是( )A. 该反应进行到M 点放出的热量大于进行到W 点放出的热量B. T 2下,在0~t 1时间内,v (Y )=1t ba -mol·L -1·min -1 C. M 点的正反应速率v 正大于N 点的逆反应速率v 逆 D. M 点时再加入一定量X ,平衡后X 的转化率减小3. 已知:CO 2(g )+3H 2(g )⇌CH 3OH (g )+H 2O (g ) ΔH =-49. 0 kJ·mol -1。
一定条件下,向体积为1 L 的恒容密闭容器中充入1 mol CO 2和3 mol H 2,测得CO 2和CH 3OH (g )的浓度随时间变化曲线如图所示。
下列叙述中正确的是( )A. 3 min时,用CO2的浓度表示的正反应速率等于用CH3OH的浓度表示的逆反应速率B. 从反应开始到平衡,用H2表示的平均反应速率v(H2)=0. 225 mol·L-1·min-1C. 13 min时,向容器中充入2 mol氦气,该反应的化学反应速率增加D. 13 min时,向容器中充入2 mol氦气,CO2的转化率增加4. 有如下可逆反应:A(g)+B(s)⇌C(s)+D(g)ΔH>0。
高中化学《影响化学反应速率的因素》基础练习题(含解析)

高中化学《影响化学反应速率的因素》基础练习题学校:___________姓名:___________班级:______________一、单选题1.一定条件下的可逆反应:N2(g)+3H2(g)=2NH3(g) △H=-92.4kJ·mol-1,下列说法正确的是()A.将氨气液化分离或升高温度,都有利于提高反应物的转化率B.保持容积不变时充入少量Ar气体,压强增大,平衡不移动C.将1molN2(g)和3molH2(g)充入一密闭容器中反应,放出92.4kJ的热量D.加入催化剂,改变了反应的路径,反应的△H也随之改变2.对于在一定条件下进行的化学反应 2SO2(g)+O2(g) 2SO3(g),改变下列条件,能提高反应物中活化分子百分数的是()A.增大压强B.升高温度C.降低温度 D.增大反应物浓度3.为探究Fe3+和Cu2+对H2O2分解反应的催化效果,甲、乙两组同学分别设计了如图1、图2所示的实验。
下列叙述中不正确的是()A.图1实验可通过观察产生气泡的快慢来比较反应速率的大小B.若图1所示的实验中反应速率为①>②,则一定说明Fe3+比Cu2+对H2O2分解反应的催化效果好C.用图2装置比较反应速率,可测定在相同状况下反应产生的气体体积及反应时间D.若比较Fe3+和Cu2+对H2O2分解的催化作用,应选用Fe2(SO4)3(aq)和CuSO4(aq)或FeCl3(aq)和CuCl2(aq)。
如果选用FeCl3(aq)和CuSO4(aq),虽然加入FeCl3(aq)的反应速率快,但两溶液的阴离子不同,不能得出结论。
4.298.15K时,N2、H2与NH3的平均能量与合成氨反应的活化能的曲线如图所示,下列说法正确的是( )A .合成氨反应的热化学方程式为N 2+3H 2=2NH 3△H =﹣92kJ/molB .在图中曲线a 表示加入催化剂时的能量变化曲线C .升高反应温度,活化分子数增多D .催化活性很强的新型催化剂可以提高N 2的转化率5.反应C(s)+H 2O(g)CO(g)+H 2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )A .保持压强不变,充入N 2使容器的体积增大B .将容器的体积缩小一半C .保持体积不变,充入H 2O(g)D .增加C 的量 6.下列说法错误的是( )A .水玻璃常用于制备硅胶和木材防火剂B .在现代化学工业中催化剂的应用十分普遍,对于给定条件下反应物之间能够同时发生多个反应时,理想催化剂还可以大幅度提高目标产物在最终产物中的比率C .煤经过气化和液化两个物理变化过程,可变为清洁能源D .PM2.5是指大气中直径小于或等于2.5微米的颗粒物,也称为“细颗粒物”, PM2.5分散在空气中可能形成胶体或浊液7.如图为PCl 5(g)PCl 3(g)+Cl 2(g)(正反应为吸热反应)从平衡状态Ⅰ移动到平衡状态Ⅱ的反应速率(v)与时间(t)的曲线,此图表示的变化是 ( )A .降温B .降压C .增加PCl 5的量D .增加PCl 3的量8.氯气与水反应的化学方程式为22Cl H OHCl HClO ++,可用于自来水消毒。
高中化学选择性必修1 第二章 化学反应速率与化学平衡 第二节 化学平衡(1)同步练习含详解答案

探究影响化学平衡移动的因素(上)同步练习(答题时间:40分钟)一、选择题1. 对处于化学平衡的体系,由化学平衡与化学反应速率的关系可知()A. 化学反应速率变化时,化学平衡一定发生移动B. 化学平衡发生移动时,化学反应速率一定变化C. 正反应进行的程度大,正反应速率一定大D. 改变压强,化学反应速率一定改变,平衡一定移动2. 将C(s)和H2O(g)以物质的量之比1∶2置于恒容容器中,一定条件下发生反应:C(s)+H2O(g)H2(g)+CO(g)ΔH>0。
下列能说明反应达到平衡状态的是A. v(H2O)=v(CO)B. H2和CO的体积比保持不变C. 形成2 mol H-O键,同时生成1 mol CD. 混合气体密度和平均相对分子质量都保持不变3. 对于可逆反应4 NH3(g)+5O2(g)4NO(g)+6H2O(g),下列叙述正确的是A. 达到化学平衡时,4v正(O2)=5v逆(NO)B. 若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态C. 达到化学平衡时,若增加容器体积时,则正反应速率减小,逆反应速率增大D. 化学反应速率关系是2v正(NH3)=3v正(H2O)4. 温度不变时,在恒压容器a与恒容容器b中,分别充入体积比为1∶3的N2和H2。
若开始时两容器的体积相等,则在相同条件下达到平衡时,两容器中N2的转化率应当是()A. a中大B. b中大C. a、b一样大D. 无法判断*5. 可逆反应mA(s)+nB(g)pC(g)在一定条件下达到平衡后,改变压强,B的体积分数φ(B)与压强的关系如图所示,有关叙述正确的是()A. m+n<pB. n>pC. X点时v(正)>v(逆)D. X点比Y点的正反应速率大6. 下列叙述中说明某化学平衡一定发生移动的是()A. 混合体系中气体密度发生变化B. 正、逆反应速率改变C. 混合物中各组分的浓度改变D. 反应物的转化率改变二、填空题*7. 对于反应A(?)+2B(g)nC(g)在一定条件下达到平衡后,改变下列条件,请回答:(1)改变A的量,平衡不移动,则A为_____________________。
2021人教版高中化学选修4第二章同步课时(导)学案2.2 影响化学反应速率的因素
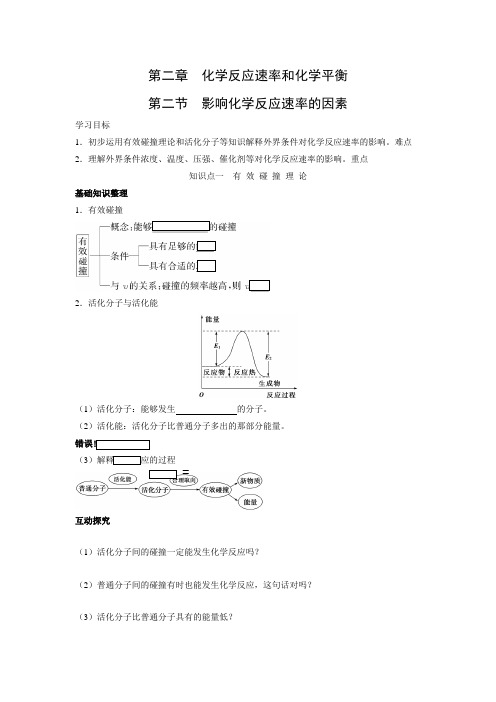
第二章化学反应速率和化学平衡第二节影响化学反应速率的因素学习目标1.初步运用有效碰撞理论和活化分子等知识解释外界条件对化学反应速率的影响。
难点2.理解外界条件浓度、温度、压强、催化剂等对化学反应速率的影响。
重点知识点一有效碰撞理论基础知识整理1.有效碰撞2.活化分子与活化能(1)活化分子:能够发生的分子。
(2)活化能:活化分子比普通分子多出的那部分能量。
错误!(3)解释化学反应的过程=互动探究(1)活化分子间的碰撞一定能发生化学反应吗?(2)普通分子间的碰撞有时也能发生化学反应,这句话对吗?(3)活化分子比普通分子具有的能量低?(4)化学反应的实质是分子的重新组合?归纳总结1.活化分子与有效碰撞的关系能够发生有效碰撞的一定是活化分子,但是活化分子不一定发生有效碰撞。
并不是反应物分子之间的任何一次直接碰撞都能发生反应,只有那些能量相当高的分子之间的直接碰撞才能发生反应。
2.单位体积内的活化分子数与活化分子百分数单位体积内的活化分子数就是指单位体积内能量达到一定要求的活化分子的总数;而活化分子百分数是活化分子数与总分子数的比值,总分子数包含:活化分子数以及普通分子的个数。
3.活化能与化学反应速率的关系活化能大小主要是由反应物自身的性质决定的改变外界条件也可以改变反应的活化能,如加入催化剂,即反应物自身的性质影响着化学反应所需的活化能,从而影响化学反应速率的大小。
例如:活化能小→普通分子容易变成活化分子→活化分子百分数大→单位体积内活化分子数多→单位时间、单位体积内有效碰撞次数多→化学反应速率大内因对化学反应速率的影响。
即时训练1.有效碰撞是指A.反应物分子间的碰撞B.反应物活化分子间的碰撞C.反应物分子发生合适取向的碰撞D.活化分子之间发生合适取向的碰撞2.下列说法正确的是①活化分子间的碰撞一定能发生化学反应;②普通分子间的碰撞有时也能发生化学反应;③反应物活化能越大,反应越快;④化学反应的实质是原子的重新组合;⑤化学反应的实质是旧化学键的断裂和新化学键的形成过程;⑥化学反应的实质是活化分子有合适取向时的有效碰撞。
高中化学影响化学反应速率的因素练习题
高中化学影响化学反应速率的因素练习题高中化学影响化学反应速率的因素练习题双基练习1.当增大压强时,下列化学反应速率不会变大的是( )A.碘蒸气和氢气化合生成碘化氢B.稀硫酸和氢氧化钡溶液反应C.二氧化碳通入澄清石灰水D.氨的催化氧化反应解析:改变压强只能影响有气体参与的化学反应速率;而B项中没有气体参与反应,故增加压强,化学反应速率不会变大。
答案:B2.(2011如东高二检测)下列表格中的各种情况,可以用下面对应选项中的曲线表示的是( )选项反应纵坐标甲乙A 外形、大小相近的金属和水反应反应速率 K NaB 4 mL 0.01 mol/L的KMnO4溶液,分别和不同浓度的H2C2O4(草酸)溶液各2 mL反应0.1 mol/L的H2C2O4溶液0.2 mol/L的H2C2O4溶液C 5 mL 0.1 mol/L Na2S2O3溶液和5 mL 0.1 mol/L H2SO4溶液反应热水冷水D 5 mL 4%的过氧化氢溶液分解放出O2 无MnO2粉末加MnO2粉末A. B. C. D.解析:反应速率与物质本身的性质有关。
由于K比Na活泼,故相同大小的K和Na,K的反应速率快,又由于Na、K与H2O反应均为放热反应,随反应进行,放出大量热,反应速率逐渐加快,故A正确;由于起始时乙中H2C2O4浓度大,故其反应速率比甲中快,B错误;由于甲反应是在热水中反应,温度高,故甲的反应速率高于乙的。
随反应进行,反应物浓度逐渐减小,故甲、乙中反应速率逐渐减小,故C正确;MnO2在H2O2分解过程中起催化作用,故乙中反应速率就大于甲中,D错误。
新课标第一网答案:AC3.20℃时装0.10 mol/L Na2S2O3溶液10 mL和0.10 mol/L的H2SO4 10 mL混合2 min后溶液中明显出现浑浊。
已知温度每升高10℃,反应速率增大到原来的2倍,那么50℃时,同样的反应要明显出现浑浊所需的时间是( )A.40 s B.15 s C.48 s D.20 s解析:设原来的反应速率为v,温度从20℃升高到50℃,共升高了3个10℃,所以50℃时的反应速率为23v。
人教版高中化学选择性必修1第二章化学反应速率与化学平衡第二节化学平衡第2课时化学平衡常数练习含答案
第二章化学反应速率与化学平衡第二节化学平衡第2课时化学平衡常数基础过关练题组一化学平衡常数的概念理解与表达式1.(2024浙江台州八校联盟期中联考)下列关于化学平衡常数的叙述正确的是() A.当反应中有关物质的浓度商等于平衡常数时,该反应达到化学平衡状态B.平衡常数的大小与物质起始浓度有关C.K值越大,反应物的平衡转化率越小D.温度一定,对于给定的化学反应,正、逆反应的平衡常数互为相反数2.(2024辽宁锦州联考)一定条件下,某可逆反应的平衡常数表达式K=√c(M)×c3(N)c2(Q)×c(R),则该反应的化学方程式为()A.M(g)+3N(g) 2Q(g)+R(g)B.2Q(g)+R(g) M(g)+3N(g)C.Q(g)+12R(g)12M(g)+32N(g)D.12M(g)+32N(g) Q(g)+12R(g)题组二化学平衡常数的相关计算3.(2024山东德州第一中学月考)已知:2CO2(g) 2CO(g)+O2(g)ΔH1=+566.0 kJ·mol-1;S(s)+O2(g) SO2(g)ΔH2=-296.0 kJ·mol-1。
已知某反应的平衡常数K=c 2(CO2)c(SO2)·c2(CO),则该反应的焓变为() A.-540.0 kJ·mol-1 B.+540.0 kJ·mol-1C.-270.0 kJ·mol-1D.+270.0 kJ·mol-14.(2024黑龙江大庆实验中学月考)加热N2O5依次发生的分解反应为①N2O5(g) N2O3(g)+O2(g),②N2O3(g) N2O(g)+O2(g)。
在容积为2 L的密闭容器中充入8 mol N2O5,加热到t℃,达到平衡状态后O2为9 mol,N2O3为3.4 mol。
则t℃时反应①的平衡常数的值为()A.8.5B.9.6C.10.2D.17.05.(2023天津南开中学期中)在800 ℃时,体积为1 L的密闭容器中,可逆反应CO(g)+H2O(g) CO2(g)+H2(g)达到化学平衡状态。
新人教版选修4高中化学影响化学反应速率的因素 同步练习3
影响化学反应速率的因素同步练习1.升高温度时,化学反应速率加快,主要是由于( )A.分子运动速率加快,使反应物分子间的碰撞机会增多B.反应物分子的能量增加,活化分子百分数增大,有效碰撞次数增多,化学反应速率加快C.该化学反应的过程是放热的D.该化学反应的过程是吸热的2.对于在一定条件下进行的化学反应:2SO2+O22SO3,改变下列条件,可以提高反应物中的活化分子百分数的是( )A.升高温度B.增大压强C.使用催化剂D.增大反应物浓度3.用3克块状大理石与30毫升3摩/升盐酸反应制取CO2气体,若要增大反应速率,可采取的措施是①再加入30毫升3摩/升盐酸②改用30毫升6摩/升盐酸③改用3克粉末状大理石④适当升高温度( )A.①②④B.②③④C.①③④D. ①②③4.对于反应:A + B = C ,下列条件的改变一定能使化学反应速率加快的是( )A.增加A的物质的量B.升高体系的温度C.增加体系的压强D.减少c的物质的量5.下列各组实验中溶液最先变浑浊的是 ( )参加反应的物质组号反应温度Na2S2O3H2SO4H2O(℃) V c V c V(mL) (mol/L) (mL) (mol/L) (mL)A 10 5 0.1 5 0.1 5B 10 5 0.1 5 0.1 10C 30 5 0.1 5 0.1 10D 30 5 0.2 5 0.2 10为速率常数。
c (A)= c (B) = 1mol/L时,反应速率在数值上等于速率常数。
下列说法正确的是( )A.只增大c (A)时,v也增大B.只增大c (A)时,v值不变C.只升高温度时,k值不变D.只升高温度时,k值变小7.能使碳酸钙的分解速率显著增大的措施是量 ( )A. 增加少量的CaCO3固体 B. 升高温度 C. 加入MnO2D. 增大压强8.将5.6g铁粉投入足量的100mL 2mol/L稀硫酸中,反应进行2 min后铁刚好完全溶解,下列有关这个反应的速率表示正确的是( ) A.硫酸的反应速率=0.5mol/(L·min) B.硫酸亚铁的反应速率=0.5mol/(L·min)C.铁的反应速率=0.5mol/(L·min)D.氢气的反应速率=0.5mol/(L·min)9.已知氯酸钾和亚硫酸氢钠发生氧化还原反应,生成-1价的氯 和+6价的硫的化合物,反应速率v 和反应时间t 的关系如右边图 所示。
人教版高中化学选择性必修1第二章化学反应速率与化学平衡综合拔高练含答案
第二章化学反应速率与化学平衡综合拔高练五年高考练考点1化学反应速率及其影响因素1.(2023辽宁,12)一定条件下,酸性KMnO4溶液与H2C2O4发生反应,Mn(Ⅱ)起催化作用,过程中不同价态含Mn粒子的浓度随时间变化如图所示。
下列说法正确的是()A.Mn(Ⅲ)不能氧化H2C2O4B.随着反应物浓度的减小,反应速率逐渐减小C.该条件下,Mn(Ⅱ)和Mn(Ⅶ)不能大量共存D.总反应为2Mn O4−+5C2O42−+16H+ 2Mn2++10CO2↑+8H2O2.(2022浙江6月选考,20)恒温恒容的密闭容器中,在某催化剂表面上发生氨的分解反应:2NH3(g) N2(g)+3H2(g),测得不同起始浓度和催化剂表面积下氨浓度随时间的变化,如下表所示,下列说法不正确...的是()A.实验①,0~20 min,v(N2)=1.00×10-5 mol·L-1·min-1B.实验②,60 min时处于平衡状态,x≠0.40C.相同条件下,增加氨气的浓度,反应速率增大D.相同条件下,增加催化剂的表面积,反应速率增大3.(2022广东,15)在相同条件下研究催化剂Ⅰ、Ⅱ对反应X 2Y的影响,各物质浓度c随反应时间t的部分变化曲线如图,则()A.无催化剂时,反应不能进行B.与催化剂Ⅰ相比,Ⅱ使反应活化能更低C.a曲线表示使用催化剂Ⅱ时X的浓度随t的变化D.使用催化剂Ⅰ时,0~2 min内,v(X)=1.0 mol·L-1·min-1考点2化学平衡及其移动4.(2023北京,4)下列事实能用平衡移动原理解释的是()A.H2O2溶液中加入少量MnO2固体,促进H2O2分解B.密闭烧瓶内的NO2和N2O4的混合气体,受热后颜色加深C.铁钉放入浓HNO3中,待不再变化后,加热能产生大量红棕色气体D.锌片与稀H2SO4反应过程中,加入少量CuSO4固体,促进H2的产生5.(2020北京,10改编)一定温度下,反应I2(g)+H2(g) 2HI(g)在密闭容器中达到平衡时,测得c(I2)=0.11 mmol·L-1、c(H2)=0.11 mmol·L-1、c(HI)=0.78 mmol·L-1。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第二节影响化学反应速率的因素同步测试
一、选择题
1、在一个密闭、恒容的容器中进行下列反应:4NH3(g+ 5O2(g4NO(g+6H2O(g
在一定的条件下达到平衡,现向反应容器中通入少量的氯化氢气体,产生的结果是(
A.容器内压强增大
B.原平衡不受影响
C.正反应速率增大
D.NO 浓度降低
2、对于在一定条件下进行的化学反应:2SO2+O22SO3,改变下列条件,可以提高
反应物中活化分子百分数的是(
A、增大压强
B、升高温度
C、加入催化剂
D、减小反应物浓度
3、在锌与某浓度的盐酸起反应的实验中,一个学生得到下面的结果:
50
则下列说法正确的是(
①t1=75s ②t2>200>t3③单位时间内消耗的锌的质量m G>m F>m B
A、①
B、①②
C、只有②
D、全部正确
4、将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如
下反应:
2A(g+B(g2C(g。若经2 s后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
①用物质A表示的反应平均速率为0.3 mol·L-1·s-1
②用物质B表示的反应的平均速率为0.6 mol·L-1·s-1
③2 s时物质A的转化率为70%
④2 s时物质B的浓度为0.7 mol·L-1
其中正确的是(
A.①③
B.①④
C.②③
D.③④
5、从下列实验事实所引出的相应结论正确的是(
A
C
g 6、在一体积不变的密闭容器中发生如下化学反应:2A(g B B(g+C(g。当物质
A 的起
始浓度为1.0 mol ·L -
1、物质B 、C 的起始浓度为0时,物质A 的浓度、转化率以及物质B 的浓度
随反应时间的变化如下列各图所示:
则下列有关说法中正确的是(
A .条件I 、条件II 时的反应温度不同,压强相同
B .条件I 时可能未使用催化剂,条件II 时可能使用了催化剂
C .条件III 时的平衡混合物中,物质C 的浓度等于0.6 mol ·L -
1 D .条件IV 和条件II 相比较,条件IV 时可能缩小了容器体积
7、合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反
应:N 2(g+3H 2(g2NH 3(g △H <0,673 K ,30 M Pa 下n(NH 3和n(H 2随时间变化的关
系如
A .点a 的正反应速率比点b 的大
B .点c 处反应达到平衡
C .点d(t 1时刻和点e(t 2时刻处n(N 2不一样
图I :在条件I 时
的反应情况 图Ⅱ:在条件Ⅱ时的反应情况 图III :在条件III 时的反应情况 图Ⅵ:
在条件Ⅵ时的反应情况 H n
a
b
c
d
e
NH 32
t 1t
2
t
D.其他条件不变,773 K下反应至t1时刻,n(H2比上图中d点的值大
8、把石灰石浸入盐酸中,下列措施能使反应速率增大的是(
A、加大盐酸用量
B、增大盐酸浓度
C、粉碎石灰石
D、增大体系压强
9、用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加快的是(
A、加热
B、将稀硫酸改为98%的浓硫酸
C、滴加少量硫酸铜溶液
D、不用铁片,改用铁粉
10、NO和CO都是汽车尾气里的有毒气体,他们之间能缓慢反应生成N2和
CO2,,对于该反应的下列说法中正确的时(
A、降低压强能增大反应速率
B、使用适当催化剂增大反应速率
C、升高温度能增大反应速率
D、增大压强对该反应速率无影响
二、填空题
1、二氧化氮在加热条件下能够分解成一氧化氮和氧气。该反应进行到45s时,
达到平衡(NO2浓度约为0.0125mol·L-1。右图中的曲线表示二氧化氮分解反应
在前20s内的反应进程。
(1请计算前25s内氧气的平均生成速度。
(2若反应延续至70s,请在右图中用实线画出25s至70s的反
应进程曲线。
(3若反应开始时加入催化剂(其他条件都不变请在图上用虚线画出加入催化剂
后的反应进程曲线。
2、.在溶液中进行某化学反应2A B + D 在四种不同条件下进行,B、D 起始浓
度为零,反应物A 的浓度(mol/L随反应时间(min的变化情况如下表:
根据上述数据,完成下列填空:
(1在实验1,反应在10至20分钟时间内平均速率(V A为mol/(L·min。
(2在实验2,A 的初始浓度C2= mol/L,反应经20分钟就达到平衡,可推测实验2
中还隐含的条件是。
反应过程
能量
( 总能量(E 总能量(E (3设实验 3的反应速率为 v 3,实验 1的反应速率为 v 1,则
v 3 v 1(填“ > ”、“ = ”、“ < ”,且 C 3 1.0mol/L (填“ > ”、“ = ”、“ < ”
(4比较实验 4和实验 1,可推测该反应是 反应(选填吸热、放热。理由是 。 3、
在化学反应中,只有极少数能量比平均能量高得多的反
应物分子发生碰撞时才可能发生化学反应,这些分子被称为活
化分子。使普通分子变成活化分子所需提供的最 低限度的能量叫活化能,其单
位通常用kJ·mol -1
表示。请认真观察右图,然后回答问题。
(1图中所示反应是________(填“吸热”或“放热”反应, 该反应_______(填“需要”
或“不需要”加热,
该反应的△H =____ ____ (用含E 1、E 2的代数式表示。 (2已知热化学方程
式:H 2(g +
1
2
O 2(g = H 2O (g △H = - 241.8 kJ·mol -1,该反应的活化能为167.2 kJ·mol -1,则其
逆反应的活化能为____________________。
(3对于同一反应,图中虚线(Ⅱ与实线(Ⅰ相比,活化能大大降低,活化分子百分数
增多,反应速率加快,你认为最可能的原因是_________________________。
第二节影响化学反应速率的因素同步测试答案
一、选择题
1、A
2、BC
3、C
4、B
5、AC
6、B
7、AD
8、B C
9、
B 10、B C
二、填空题
1、(15.5×10-4mol·L-1·s-1;(2图中实线;(3图中虚线;
2、(10.013;(21.0,使用催化剂;(3> ,> ;(4吸热,温度升高时,平衡向右移动。本题有
关化学反应速率、化学平衡的图表分析,主要是考查对表中所隐含信息的观察能
力。对于问题(1只要从化学速率的定义出发,从表中找出反应在10至20分时间内
的A 浓度变化值,即可求出 A 的平均速率为(0.80mol·L-1- 0.67mol·L-1/10min=
0.013mol·L-1·min-1。对于问题(2的解答,首先要从计算800℃该反应的平衡常
数(K =
1入手,查出实验2中A 的平衡浓度,代入有关平衡表达式即可求出B、C 的平
衡浓度,进而得出 A 的初始浓度。比较实验(1、(2的条件,温度、浓度相同,达到平衡
的时间不相同,从中推测出实验 2 中还存在着催化剂这一隐含条件。对于问题(3的
解答,也要以K = 1入手,求算出40min后B、C 的平衡浓度为0.6mol·L-1,进而求出
A 的初始浓度为1.3mol·L-1;然后根据浓度越大,反应速率也越大,得出υ3大于υ1的
结论。对于问题(4的解答,亦是根据观察表格中的数据入手,实验1到实验4属温度
升高,A 的平衡浓度减小,说明平衡向着正反应方向移动,该方向为吸热反应。
3、(1放热;需要; -(E1- E2 kJ·mol-1
(2409 kJ·mol-1;(3使用了催化剂。
