人教版初中化学九下11.1 生活中常见的盐 第一课时 课件 ppt
合集下载
11.1生活中常见的盐人教版九年级化学下册课件(共46张PPT)

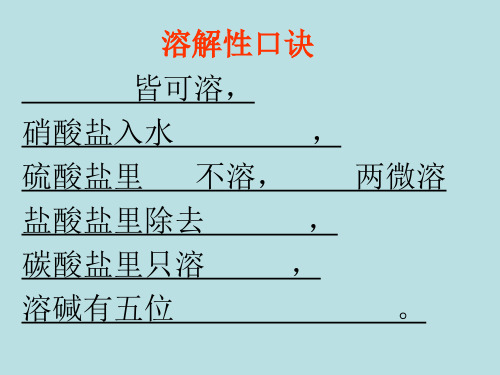
判断下列盐,哪些不溶?
(1)KCl Na2CO3 Na2SO4 NH4Cl (2) Ag2SO4 BaCl2 Ba(NO3)2
(3) AgNO3 AgCl FeCl2 BaSO4
(4) Fe2(SO4)3 Cu(NO3)2 MgSO4
(1)组都溶 (2)组都溶
(4)组都溶
(3)组 AgCl 不溶 BaSO4不溶
石灰石也是建筑上常用的石料。 碳酸钙还可用作补钙剂。
【回顾】 请书写出实验室制取CO2的方程式。
碳酸钙可以与盐酸反应: CaCO3+2HCl=CaCl2+H2CO3
CO2↑+H2O
碳酸钠和碳酸氢钠是否也发生类似的反应?
碳酸钠+盐酸
碳酸氢钠+盐酸
现象
分析
【演示实验11-1】
碳酸钠+ 碳酸氢钠+盐
盐酸
物质 颜色 状态 溶水性
Na2CO3 白色 固体
易溶于水
NaHCO3 白色 固体 易溶于水
CaCO3 白色 固体
难溶于水
碳酸钠、碳酸氢钠和碳酸钙的用途 (阅读P70倒数第3行- -P71顺数第3行)
衣 物
玻璃、纸、纺织品这些物质看起来不相 关,它们的生产都要用到一种盐——碳酸 钠(Na2CO3)。
(3)能与某些盐反应 Na2CO3+ CaCl2==CaCO3 ↓+ 2NaCl
【讨论】1.酸和碱作用生成盐和水的反 应是否也属于复分解反应?为什么?
2.分析、归纳上述几个酸、碱、盐之间 的复分解反应,它们的生成物有什么特 点?
二、复分解反应
两种化合物互相交换成分,生成另外两 种化合物的反应
CaCO3+2HCI=CaCI2+H2O+CO2
人教九下化学11.1 生活中常见的盐—— 复分解反应实质 课件(共42张PPT)
NO3-
NO3-
K+
K+
NO3-
K+
NaCl+KNO3 ——
K+ NO3-
Cl-
Na+
Na+ Cl-
K+
NO3-
NO3-
NO3K+
K+
NaCl+KNO3 ——
Cl-
Na+
K+ NO3-
NO3-
Na+
Cl-
NO3K+
K+
NO3-
K+
NaCl+KNO3——
K+ NO3-
ClNa+
NO3-
K+
Na+
Ca2+
HO-
HO-
HO-
Ca2+
HO-
Ca(OH)2+CuCO3 ——
Ca2+
CO3C2u- 2+CuC2O+ 32C-O3C2u- 2+ CuC2O+ 32C-O3C2u- 2+CuC2O+ 32-
HO-
Ca2+ HO-
HOHO-
Ca(OH)2+CuCO3 ——
HOCa2+
HO-
CO3C2u- 2+CuC2O+ 32C-O3C2u- 2+
⑹HCl + ⑺H2SO4 ⑻CaO +
NaOH == NaCl +CuO==CuSO4 H2O =Ca(OH)2
+ H2O +H2O
⑼BaCl2 + Na2SO4 == BaSO4↓+ 2NaCl
人教版初中化学九下11.1 生活中常见的盐-复分解反应条件探究 课件ppt

ClH2O
Na+ OH-
Cl- Na+
氢离子和氢氧根离子结合成水分子
Na2CO3 + H2SO4 =
H+ H+
SO42-
CO2
H2O SO42-
CO32-
Na+ Na+Na+ Na+
氢离子和碳酸根离子结合成
水分子和二氧化碳分子
CaCl2 + Na2CO3 =
CO32- Na+ Na+
ClNa+
Na+ Cl-
Ca2+
Cl-
Cl-
CaCO3
溶液中的钙离子和 碳酸根离子大量减少
H2SO4 + NaCl =
H+ SO42H+
Na+ Cl-
H+ Cl-
SO42-
H+
Na+
溶液中的离子未发生变化, 即各离子的浓度不变
我总结
复 分
宏观 有沉淀、气体或水生成
解
反
离子交换的反应,反应物中
应 微观 某些离子浓度减小了
15、经过漫长的旅程,我遇到了很多人,无意中发现人生中最优美的风景是内心的平静与安宁,以及心灵的智慧与清醒。 12、一个人的人生注定会遇到两个人,一个人令人惊叹,另一个人温柔。 24、永远不要打破生活中的四件事:信任,关系,诺言和内心,因为一旦破裂,就不会发出声音,但这是非常痛苦的。 4、首先过自己的生活,让自己变得更好,这样,相同频率的人才能看到它;即使您愿意,也必须有资本过上更好的生活。 24、做事的最佳状态是:不是故意的。不要刻意自我表达,不要刻意淡化名利;不故意迎合,也不故意自大;不要刻意追逐流行,也不刻意 出类拔萃。如果是这样,您不会感到疲倦,纠结或失望。
人教版初中化学九下11.1 生活中常见的盐 课件 (1)

3 4 氢氧化钙溶液
有白色沉淀产生的是碳酸钠溶液 无明显现象的为氯化钠溶液 Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
5
5.进一步讨论实验室里如何区分氯化钠溶液(中性)和
碳酸钠溶液(碱性)?
方法
1 2
实验现象、结论
原理 (用化学方程式表示)
3
4
5氯化钙溶液
有白色沉淀产生的是碳酸钠溶液 无明显现象的为氯化钠溶液
颜色状态 溶水性
白色固体 能溶于水
白色固体 能溶于水
小苏打 大理石(石灰石)
的主要成分
白色固体 白色固体 能溶于水 难溶于水
水溶液酸 碱性
中性
碱性 碱性
用途
生理盐水、融
雪剂、食品防 腐、调味品、 农业选种、工
玻璃、造纸、 纺织、洗涤剂、
蒸馒头
焙制糕点、治 疗胃酸过多
业原料
建筑材料、补 钙制剂
【练习一】
Na2CO3+2HCl=2NaCl+H2O+CO2↑
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
【练习四】 进一步讨论实验室里如何区分氯化钠溶液和 碳酸钠溶液?
方法
1
实验现象、结论
原理 (用化学方程式表示)
2
3 4 5
5.进一步讨论实验室里如何区分氯化钠溶液(中性)和
碳酸钠溶液(碱性)?
【练习二】
我们学习过以下常见的酸、碱、盐,归纳 HCl、 Ca(OH)2、Na2CO3请你归纳这三种物质能两两相 互发生化学反应的共有(C )组。
A.1组 B.2组 C.3组 D.4组
2
HCl 1 Ca(OH)2
人教版初中化学九下11.1 生活中常见的盐-盐的化学性质 课件 ppt

小结 盐的化学性质之三
盐 + 碱 → 新盐 + 新碱
实验探 究
实验一:取少量的硫酸铜溶液到试管中,在向 其中滴入氯化钡溶液,观察现象
现象:产生白色沉淀
化学方程式:CuSO4+BaCl2=CuCl2+BaSO4↓ 实验二:取少量的氯化钠溶液到试管中,在向 其中滴入硝酸银溶液,观察现象
现象:产生白色沉淀
21、如果您不够好,网络就不会有价值,这不是追求,而是吸引。只有同等的交易所才能获得合理的帮助。 16、不要假装自己不爱金钱。毕竟,星星和大海需要门票。诗和车费很贵。您可能会因自己的能力而上瘾。 21、低质量的勤奋只是我辛勤工作的一种幻想。勤奋不是马不停蹄,而是有效利用眼前的时间;努力不是努力工作,而是用智慧解决问题。 11、要评论一件事,只有处于正确的位置,您才能用语言说话和轻蔑。在评估一个人时,只有先衡量自己,才能使自己内心贤惠并仁慈。 18、我不在乎是风,雨还是晴天。我只知道,如果是您,无论何时何地,即使我押注自己一生的运气,我也会如期到达。 17、人的感觉就像牙齿。如果您丢失了它,那么您将丢失它。如果您假装是假货,请不要拾起丢失的东西,接受突然的损失,并珍惜意外的 惊喜。
盐 + 酸 → 新盐 + 新酸
温故知新
回顾知识: 碱的化学性质并完成下列 化学方程式
CuSO4 + N2NaOaOHH = Na2SO4 + C蓝u色(O沉H淀)2↓源自FeCl33+
N3NaOaOHH
=
3NaCl
+
Fe(OH)3↓
红褐色沉淀
Na2CO3 + Ca(OH)2 = CaCO3↓+ 2NaOH
4、有人来打开我们的眼睛。因此,人们必须能够承受虚假事实并容忍敷衍。很明显,您需要知道什么。 4、有人来打开我们的眼睛。因此,人们必须能够承受虚假事实并容忍敷衍。很明显,您需要知道什么。 4、有人来打开我们的眼睛。因此,人们必须能够承受虚假事实并容忍敷衍。很明显,您需要知道什么。 23、不要对任何人太了解,不要以为开始时的主题是一样的,并且有很多共同点。您是见面和恨晚的朋友。语言经常是假的,我们在一起经 历的确是事实。
人教版化学九下11.1--生活中常见的盐 (共28张PPT)

(2)步骤②中发生反应的化学方程式是__________________ __C_a_C__O_3_+__2_H_C__l=__=_=_C_a_C__l2_+__C_O__2_↑_+__H_2_O______________。
(3)步骤③中产生白色沉淀A的反应的化学方程式是: ______C__a_C_l_2+__N__a_2C__O_3_=_=_=__C_a_C_O__3_↓_+__2_N_a_C__l ____。 (4)白色固体X中的物质有__氯__化__钠__、__碳__酸__钙__和__氯__化__钙________。 (5)将白色固体X全部转化成氯化钠固体的实验方案是_取__白___
(3)Na2CO3作为反应物之一,写出一个符合A+B→C+D 的化学方程式__N_a_2_C__O_3_+__B_a_(_O_H__)_2=_=__=_B_a_C_O__3_↓_+____ _2_N_a_O__H_(_符__合__题__意__即__可__)___________________。
返回
______________,
点拨 15题 返回
点拨: 碳酸钠俗称纯碱或苏打;(2)碳酸钠可以是氢氧化钠 和二氧化碳反应的产物;(3)碳酸钠可以与氢氧化钙反应生 成氢氧化钠和碳酸钙沉淀;(4)氯化钠溶液不能使紫色石蕊 试液变色,因此Na+和Cl-与溶液的酸碱性无关,碳酸钠溶 液显碱性,能使无色酚酞试液变红色,滴加CaCl2溶液后, CaCl2和Na2CO3反应生成白色沉淀CaCO3和NaCl,溶液由 红色变为无色,因此CO32-与溶液的酸碱性有关。 返回
_色__固__体__X__于__烧__杯__中__,__加__足__量__水__溶__解__,__再__加__入__过__量__的__碳__酸___ _钠__溶__液__,__过__滤__,__向__滤__液__中__加__入__过__量__的__稀__盐__酸__,__蒸__发__结___晶__, _便__可__得__到__氯__化__钠__固__体___________________。 点拨 返回
(3)步骤③中产生白色沉淀A的反应的化学方程式是: ______C__a_C_l_2+__N__a_2C__O_3_=_=_=__C_a_C_O__3_↓_+__2_N_a_C__l ____。 (4)白色固体X中的物质有__氯__化__钠__、__碳__酸__钙__和__氯__化__钙________。 (5)将白色固体X全部转化成氯化钠固体的实验方案是_取__白___
(3)Na2CO3作为反应物之一,写出一个符合A+B→C+D 的化学方程式__N_a_2_C__O_3_+__B_a_(_O_H__)_2=_=__=_B_a_C_O__3_↓_+____ _2_N_a_O__H_(_符__合__题__意__即__可__)___________________。
返回
______________,
点拨 15题 返回
点拨: 碳酸钠俗称纯碱或苏打;(2)碳酸钠可以是氢氧化钠 和二氧化碳反应的产物;(3)碳酸钠可以与氢氧化钙反应生 成氢氧化钠和碳酸钙沉淀;(4)氯化钠溶液不能使紫色石蕊 试液变色,因此Na+和Cl-与溶液的酸碱性无关,碳酸钠溶 液显碱性,能使无色酚酞试液变红色,滴加CaCl2溶液后, CaCl2和Na2CO3反应生成白色沉淀CaCO3和NaCl,溶液由 红色变为无色,因此CO32-与溶液的酸碱性有关。 返回
_色__固__体__X__于__烧__杯__中__,__加__足__量__水__溶__解__,__再__加__入__过__量__的__碳__酸___ _钠__溶__液__,__过__滤__,__向__滤__液__中__加__入__过__量__的__稀__盐__酸__,__蒸__发__结___晶__, _便__可__得__到__氯__化__钠__固__体___________________。 点拨 返回
人教版化学九年级下说课 第十一单元 课题一 生活中常见的盐 说课课件( 53张PPT)
调查汇报
1. 重要的调味品
2.沐浴时,水中加入少量食盐,可使皮 肤强健。
氯化钠 的用途
3.鲜花插入稀盐水中,可数日不凋谢。 4.用食盐腌渍蔬菜、鱼、肉、蛋等,
使食品风味独特,还延长保质期。
5.洗有颜色的衣服时,先用5%的食盐水
浸泡10分钟, 然后再洗,则不掉色。 6.误食有毒物,喝一些食盐水可以起解毒作用。
对碳酸盐、食 氯化钠 盐用途的充分 用途 认识 能解决实际 问题 实际 应用
根据什么 选取鉴别 方法
食盐与碳酸 钠的鉴别 解决问题
还有什么 方法
实践:现场 制作汽水
教 学
过
程
环节4 实践再 创
环节1
引入环 节
2:用搜集到的可 能含有碳 酸盐的 物质与盐酸反应
1:碳酸盐与 酸的反应
环节2
实验探 究
环节3
问题1 你用的物质是什么?
问题2 根据什么选这种物质? 问题3 观察到的现象是什么? 问题4 该物质中是否含有碳酸盐?
制碱工业先驱:侯德榜
调查汇报
汇报展示
碳酸盐用途
氯化钠用途
碳酸钙用途:补钙剂
碳酸钙用途:大理石建筑
碳酸钙用途:大理石建筑
碳酸钙用途:大理石工艺品
碳酸钙用途:大理石雕刻
碳酸钙用途:大理石雕刻
自学能力
思维能力 科学探究能力
教学目标
1
知识与技能 过程与方法 情感态度与价值观
2
3
教学目标
1.能说出氯化钠、碳酸钠、碳酸 氢钠和碳酸钙等常见盐在生活中 的主要用途
知识与 技能
2.学会检验碳酸盐 3.逐步学会用化学知识分析和 解决与生活有关的一些常见的 实际问题
化学九年级下人教版第十一单元课题1 生活中常见的盐课件(38张)
CaCO3+2HCl=CaCl2+CO2↑+H2O
Na2CO3+2HCl=2NaCl+CO2↑+H2O
碳酸氢钠+盐酸
NaHCO3+HCl=NaCl+CO2↑+H2O
其中都含
有CO32-或 者HCO32-
(5) CO32-和 HCO3-离子的检验
❖取样品于试管中,加入适量的稀 盐酸,若有气体生成,把生成的 气体通入澄清的石灰水,若石灰 水变浑浊,则证明该盐中含有
❖ 2、可简记为AB+CD=AD+CB
❖ 3、复分解反应条件:生成物有沉淀或气体或水
讨 论
1.酸和碱作用生成盐和水的反应是 否也是复分解反应?为什么?
2.是不是所有的酸、碱、盐之间都 能发生复分解反应?(P72活动与探 究)
复分解反应发生的条件
❖复分解反应的本质是溶液中的离 子结合成难电离的物质(如水)、 难溶的物质或挥发性气体,而使 复分解反应趋于完成。
;
(3)可用作补钙剂和牙膏填充剂的是
;
(4)可用于生产玻璃的是
;
(5)可用作发酵粉和治疗胃酸过多症的是 ;
(6)既是钙盐又是碳酸盐的
是
。
推断
已知:①在化工生产中,原料往往不能全部 转化成产品;②工业上常用电解纯净的饱和 食盐水的方法来得到烧碱溶液,再经过浓缩、 蒸发等步骤制造固体烧碱;③氯化银不溶于 稀硝酸。现要分析一种仓库里的固体烧碱样 品。
资料:石笋和钟乳石的形成
CaCO3+H2O+CO2==Ca(HCO3)2 Ca(HCO3)==2CaCO3↓+H2O+CO2↑
练习
下列物质间能否发生复分解反应(可 利用书后P111附录Ⅰ所提供的信息)? 如能发生反应,写出有关反应的化学 方程式。
人教九年级化学下册第十一单元课题1 生活中常见的盐 第1课时(共19张PPT)
结
论
解密泡腾片
原理:泡腾片主要是由NaHCO3和有机酸(如:枸 橼酸、酒石酸、柠檬酸、富马酸等)组成的混合物, 当泡腾片放入水中之后,两种物质发生反应,产生 大量二氧化碳,使片剂迅速崩解和融化。
本节课我的收获 一、碳酸钠、碳酸氢钠和碳酸钙的组成、物理性质和用途
二、 碳酸钠、碳酸氢钠、碳酸钙与酸的反应 CaCO3+2HCI=CaCI2+H2O+CO2↑ Na2CO3+2HCl=2NaCl+H2O+CO2↑ NaHCO3+HCl =NaCl +H2O+CO2↑ Na2CO3+H2SO4=Na2SO4+H2O+CO2↑ 2NaHCO3+H2SO4=Na2SO4+2H2O+2CO2↑
合作交流
分析 现 象 碳酸钠+ 盐酸
碳酸 产生气泡, 碳酸钠、 钠+ 澄清石灰 与盐酸反 应产生二 水变浑浊 盐酸 氧化碳
碳酸钠、 碳酸 产生气泡, 氢钠 澄清石灰 与盐酸反 水变浑浊 应产生二 +盐 氧化碳 酸
化
学
方
程
式
Na2CO3+2HCl=2NaCl+H2O+CO2↑ NaHCO3+HCl=NaCl+ H2O+CO2↑
三、CO32-及HCO3-的检验 (1)试剂:稀盐酸、澄清石灰水 (2)方法: +盐酸 某物质 +澄清石灰水 产生气体 CO32-或 HCO3-
变浑浊
【结论】
组成里含有碳酸根离子(CO32-)或碳酸氢根离子 (HCO3-)的物质能与酸反应生成使澄清石灰水变浑 浊的CO2
碳酸根离子或碳酸氢根离子的检验
