11种间相互作用
麻醉药理学 围手术期的药物相互作用(14.2.1)--围术期常用药物的相互作用

(五)抗高血压药
主张不停药 避免血压骤升 血管扩张的麻醉药合用时注意循环稳定
钙通道阻滞药增强麻醉药的作用 合用对心肌的抑制作用 增强骨骼肌松弛药作用
(六)激素
1. 皮质激素及促皮质激素 长期服用糖皮质激素易出现应激反应的异常,血压低
、心梗、出血、呼吸抑制 巴比妥类药物使其分泌减少;增强肌松作用;强心苷
毒性增加;与肝素合用增加出血 2. 甲状腺素 提高心肌对儿茶酚胺的敏感性,心律失常 增强抗凝药的作用;增高血糖 3. 缩宫素 氟烷和乙醚使子宫松弛;硫喷妥钠和吗啡使子宫收缩减
弱
(七)其他
1. 支气管解痉药 氨茶碱具有松弛支气管平滑肌、心脏及中枢兴奋作用 惊厥 地西泮 心律失常 利多卡因
2. 抗凝药 肝素 过量可引起自发性出血
术中用药: 麻醉用药:盐酸戊乙奎醚、咪达唑仑、依托咪酯、舒芬太尼、维库溴铵 、罗库溴铵、丙泊酚、七氟醚( 8 种) 输液用药:氯化钠注射液、钠钾镁钙葡萄糖注射液、羟乙基淀粉、奥美 拉唑、阿托品、肝素、鱼精蛋白( 7 种) 体外循环用药:晶体液、羟乙基淀粉、甘露醇、肝素、万古霉素、硫酸 镁、速尿、去甲肾上腺素、多巴胺、肾上腺素、硝普钠( 11 种) 术后用药:万古霉素、速尿、碳酸氢钠、多巴胺、肾上腺素、硝普 钠……
缺氧、 Cபைடு நூலகம்2 蓄积、 甲亢、高血压等
心律失常
β 受体阻断药: 常用于心律失常、心绞痛、高血压 β 受体阻断药 不停药 为什么?
协同作用 吸入麻醉药 降压、心律失常 安全性由大到小:
异氟烷> 镇痛药>氟烷>恩氟烷>环丙烷>乙醚>甲氧氟烷
(四)抗心律失常及心力衰竭药
心律失常:儿茶酚胺升高室性心律失常(利多卡因) 洋地黄中毒心律失常(苯妥英钠)
3. 抗菌药 增强肌松的作用
9.1 电荷 —【新教材】人教版(2019)高中物理必修第三册同步练习
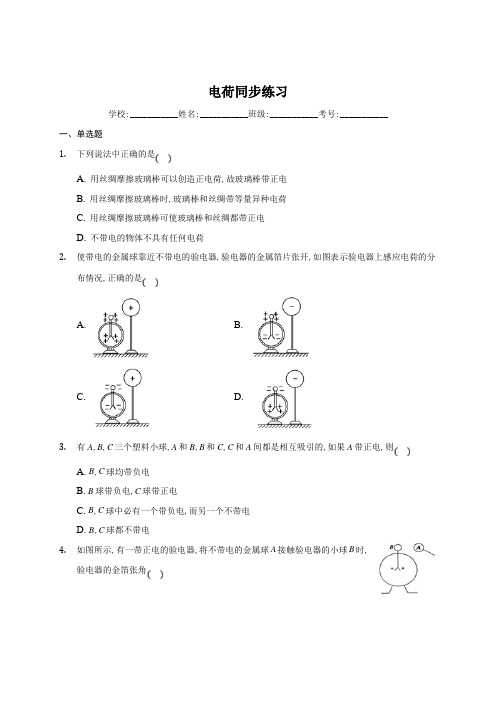
电荷同步练习学校:___________姓名:___________班级:___________考号:___________一、单选题1.下列说法中正确的是A. 用丝绸摩擦玻璃棒可以创造正电荷,故玻璃棒带正电B. 用丝绸摩擦玻璃棒时,玻璃棒和丝绸带等量异种电荷C. 用丝绸摩擦玻璃棒可使玻璃棒和丝绸都带正电D. 不带电的物体不具有任何电荷2.使带电的金属球靠近不带电的验电器,验电器的金属箔片张开,如图表示验电器上感应电荷的分布情况,正确的是A. B.C. D.3.有A,B,C三个塑料小球,A和B,B和C,C和A间都是相互吸引的,如果A带正电,则A. B,C球均带负电B. B球带负电,C球带正电C. B,C球中必有一个带负电,而另一个不带电D. B,C球都不带电4.如图所示,有一带正电的验电器,将不带电的金属球A接触验电器的小球B时,验电器的金箔张角A. 变大B. 变小C. 不变D. 先变小,后变大5.把两个完全相同的小球接触后分开,两球相互排斥,则两球原来的带电情况不可能是A. 个小球原来带电,另一个小球原来不带电B. 两个小球原来分别带等量异种电荷C. 两个小球原来分别带同种电荷D. 两个小球原来分别带不等量异种电荷6.关于点电荷、元电荷,下列说法正确的是A. 元电荷是最小的电荷量,和一个电子所带电荷量数值相等B. 一个物体带负电,这是它失去电子的缘故C. 电荷不能够创造,但可以消灭D. 只有很小的球形带电体才叫做点电荷7.如图所示,两个不带电的导体A和B,用一对绝缘柱支持使它们彼此接触.把一带正电荷的物体C置于A附近,贴在A、B下部的金属箔都张开,则A. 此时A带正电,B带负电B. 此时A电势低,B电势高C. 移去C,贴在A、B下部的金属箔都闭合D. 先分开A、B,再移去C,贴在A、B下部的金属箔都闭合8.绝缘细线上端固定,下端悬挂一轻质小球a,a的表面镀有铝膜,在a的近旁有一绝缘金属球b,开始时a、b都不带电,如图所示,现使b带电,则A. ab之间不发生相互作用B. b将吸引a,吸住后不放开C. b立即把a排斥开D. b先吸引a,接触后又把a排斥开9.如图所示,放在绝缘支架上带正电的导体球A,靠近放在绝缘支架上不带电的导体B,导体B用导线经开关接地,现把S先合上再断开,再移走A,则导体A. 带负电B. 带正电C. 不带电D. 不能确定10.某同学在研究电容式充放电实验时。
讲义24 化学键

讲义24 化学键一、化学键1、定义:分子内相邻..的相互作用叫做化学键。
(概念理解)..的两个或多个原子之间强烈2、说明:直接相邻的原子间强烈的相互作用,破坏这种作用需较大能量。
中学阶段所学的化学键主要为离子键和共价键。
(联系水的状态变化认识化学键和分子间作用力)二、离子键1、定义:阴、阳离子间通过静电作用所形成的化学键叫做离子键。
2、说明:①成键元素:活泼金属(主要是ⅠA和ⅡA族元素)和活泼非金属(如:F、Cl、Br、O、S、N等,主要是ⅥA族和ⅦA族元素)②成键粒子:阴、阳离子③成键原因:阴、阳离子间的静电作用④离子键构成离子化合物。
三、共价键1、定义:原子间通过共用电子对所形成的相互作用。
2、形成条件:①同种或不同种非金属元素原子结合。
②部分金属元素原子与非金属元素原子。
如:AlCl33、共价键的本质:原子间的静电作用4、分类:非极性键与极性键:①非极性键:同种原子形成的共价键。
(单质)②极性键:不同种原子形成的共价键。
(化合物)★③非极性键与极性键的存在关系:非极性键可以存在于共价化合物、离子化合物、非金属单质(稀有气体除外)中,如H2O2、Na2O2、Cl2等极性键可以存在于共价化合物,也可以存在于离子化合物中,如HCl、NaOH等④共价键可存在于单质分子、共价化合物分子和离子化合物中。
【例1】判断下列说法是否正确?1、非极性共价键只存在于非金属单质中。
2、离子化合物一定含金属元素。
3、有离子键的化合物一定是离子化合物。
4、离子化合物中可能有极性共价键。
5、共价化合物中只有共价键。
6、气态单质一定含有非极性键。
四、电子式★在元素符号周围用“.”或“╳”来表示原子的最外层电子(价电子)的式子。
1、表示原子:【例2】C N O F Cl Mg Al2、表示离子: 单核阳离子、原子团的阳离子单核阴离子、原子团的阴离子【例3】Na+、Mg2+、H-、O2-、Cl-、OH-、O22-。
3、表示离子化合物(注意:相同离子不合并,阴阳离子交替书写)练习:K2S 、CaO、CaF2、Na2O2、NaOH4、表示共价分子【例4】Cl2、N2、NH3、H20、HF、H2O25、表示物质形成过程(注意:左边原子电子式,中间箭头,右边物质电子式)五、化学键及化学反应的本质化学反应的本质:旧键的断裂和新键的形成(与能量关系)【例5】现有A、B、C、D四种元素,前三种元素的离子结构都和氖原子具有相同的核外电子排布。
高中化学必修二第一章 第三节化学键 课时1 离子键和共价键(共59张PPT)

•
下列有关离子化合物的说法正确的
是( )
• A.离子化合物一定易溶于水
• B.离子化合物由非金属元素和金属元素共
同组成
• C.熔融状态下能够导电的物质,一定是离
子化合物
• D.离子化合物在晶体状态下有离子存在,
但不导电
【解析】 离子化合物不一定易溶于水,如 AgCl、BaSO4等;离子化合物不一定由非金 属元素和金属元素共同组成,如NH4Cl等铵 盐全部由非金属元素组成;熔融状态能导电 的物质,不一定是离子化合物,如金属单质; 离子化合物由阴、阳离子构成,在晶体状态 下,离子不能自由移动,故不能导电。
• 【答案】 D
• 4.氯化钠是日常生活中人们常用的调味品。 在下列事实中,可以证明NaCl中一定存在离 子键的是( )
• (3)证明某化合物一定存在离子键的方法是看在熔融 状态下能否导电。
• 3.离子化合物
• (1)定义:由离子键构成的化合物叫做离子化 合物。
• (2)构成微粒:阴离子、阳离子。
• (3)主要物理性质:熔、沸点较高,硬度较大。
• (4)导电性:固态时不导电,溶于水或受热熔 化后导电。
• (5)溶解性:大多数离子化合物易溶于水,难 溶于汽油、苯、四氯化碳等有机溶剂。
子化合物 • C.离子化合物一定能导电 • D.只有在活泼金属元素和活泼非金属元素
化合时,才能形成离子键
• 【解析】 正确理解离子键和离子化合物的 内涵和外延才能解答本题。
• A项,离子键是指阴、阳离子间的静电作用, 包括引力和斥力二者的平衡;B项,离子键 形成的只能是离子化合物;C项,离子化合 物在熔融状态或水溶液里才能导电,D项NH 与活泼非金属元素之间也可形成离子键。
二年级下册科学一课一练-1、6《磁极间的相互作用》练习题教科版(含解析)

第一单元第6课《磁极间的相互作用》练习题一、填空题。
1.磁铁的同极相互________,异极相互________。
2.一个能自由转动的磁铁,静止时一端指向南方,一端指向北方,我们把指南的一方叫________极,用字母________表示;指北的一方叫________极,用字母________表示。
3.一块磁铁的S极与另一块的磁铁的N极接触后会相互________。
4.我们用条形磁铁的一块磁极靠近另一块条形磁铁的磁极,有4种情况,即用________极去靠近________极、用________极去靠近________极、用________极去靠近________极、用________极去靠近________极。
二、判断。
5.一块磁铁没有标明磁极,所以我们就没有办法知道它们的磁极。
()6.用细线悬挂着的能够自由旋转的且已知南北极的磁铁可以指示南北方向。
()7.条形磁铁的S极不会吸引蹄形磁铁的N极。
()8.环形磁铁之间的相互作用规律和条形磁铁之间的相互作用规律是不一样的。
()9.条形磁铁的N极靠近环形磁铁的N极会相互排斥。
()10.当南极和北极用来指示方向时,有着不同的表现,即使有干扰的情况下,南极始终指示南方,北极始终指示北方。
()三、选择题。
11.条形磁铁的S极靠近另一块条形磁铁的______极会相互吸引。
A. SB. NC. S和N都可以D. S和N都不行12.把一块条形磁铁悬挂在空中使它能自由转动等磁铁静止时我们发现——磁极的两端分别指向_______。
A. 东、西B. 东、南C. 南、北D. 东、北13.下图中两块磁铁相互靠近时互相吸引的是_______。
A. 甲、乙B. 乙、丙C. 丙、丁D. 甲、丁14.下图是不同磁铁相互靠近时互相排斥的是_____。
A. 相、互B. 互、作C. 作、用D. 相、作四、应用题15.完成下列表格。
磁极间的相互作用我的发现:相同磁极间相互________,不同磁极间相互________。
GDF11和GDF15之间的相互关系

GDF11和 GDF15之间的相互关系摘要:GDF11和GDF15是TGF-β/BMP超家族的成员。
该家族的配体结合各种TGF-β受体导致招募和激活SMAD家族转录因子,调节基因表达。
在厌食症中,两者都有一定的调节作用,但关于GDF11与GDF15相互作用的报道较少。
本文就GDF11和GDF15在心血管疾病、糖尿病、肥胖、肝损伤和某些癌症中的作用及其相关性进行综述,为今后GDF11和GDF15相互作用的研究提供思路。
关键词:GDF11;GDF15;心血管疾病;糖尿病;肝损伤;癌症INTRDACTION:生长分化因子(Growth differentiation factor, GDF11)是TGF-β/BMP超家族成员之一,可激活Smad和非Smad信号通路,调控其靶核基因的表达。
研究表明,GDF11不仅参与正常生理过程,还参与肝损伤、心血管疾病、糖尿病和癌症的病理生理过程。
GDF11通过类似于其他TGF-β超家族成员蛋白的途径发挥作用。
它与2个II型激活素受体(ActRIIA和ActRIIB)和3个I型受体[激活素受体样激酶4 (ALK4), ALK5和ALK7]结合,通过SMADs 2和3诱导信号转导[1,2,3]。
GDF11也可能通过非规范途径发出信号,包括ERK和p38 MAPK[4]。
生长分化因子-15 (Growth differentiation factor-15, GDF-15)是TGF-β/BMP超级家族的成员之一。
该蛋白在多种细胞类型中表达,作为多效细胞因子并参与细胞损伤后的应激反应程序。
蛋白质水平的升高与组织缺氧、炎症、急性损伤和氧化应激等疾病状态有关。
GDF-15是一种应激反应细胞因子。
在正常和病理状态下,高表达于心肌细胞、脂肪细胞、巨噬细胞、内皮细胞和血管平滑肌细胞。
GDF-15通过抑制JNK (c-Jun n -末端激酶)、Bad (bcl -2相关死亡启动子)和EGFR(表皮生长因子受体),激活Smad、eNOS、PI3K和AKT信号通路,保护心脏、脂肪组织和内皮细胞[7]。
第11章水气岩相互作用
海螺沟冰川搬运的砾石
祁 连 山 七 一 冰 川
第五节 水圈、大气圈、岩石圈相互作用 与冰川、冰缘地貌
一、冰川、冰缘作用
冰川堆积作用,同样与气候、地形条件以及水的相态的变化有关,是大气圈、 水圈、岩石圈共同作用的结果。当温度升高、降雪减少,冰川就会融化、退 缩,冰川所携带的物质就会堆积下来。冰川融水也会对冰川堆积物进行改造 或携带其他物质在冰川外围地区堆积。冰川的堆积作用主要发生在冰川边缘 及地形发生变化的地方。
第二节
气候—水的分布—地球自转速度—构造运动或形变
四、气候―水的分布―地球自转速度—构造运动或形变
岩石圈的变动和构造形变,导致了地球表层物质的重新分配。例如, 大陆的漂移,导致了大陆纬度的变化,造山、造陆运动,使地球表面起 伏增大。这些不仅会改变大气环流、水圈的结构与轮廓,而且还会相应 改变地球的转动惯量,从而改变地球自转的速度。地球自转速度的改变, 不仅会引起新的岩石圈的变动,而且还会通过改变地表水平切向应力而 改变地表水的分布,通过改变洋流运行速度以及改变大气角动量来改变 大气环流和气候。
黄土地貌的发育 与水圈、大气圈、岩石圈相互作用
黄土沟谷地貌
黄土梳状冲沟(陕西富县)
黄土掌状冲沟(甘肃庄浪)
黄土树枝状冲沟(甘肃通渭)
黄土沟谷地貌
纹沟
切沟
冲沟
冲沟
河沟
黄土沟间地貌
黄土塬
黄土沟间地貌
黄土梁
黄土沟间地貌
黄土峁
黄土沟间地貌
黄土墹
黄土沟间地貌
塬梁
塬
梁
黄土地貌的发育 与水圈、大气圈、岩石圈相互作用
第二节
气候—水的分布—地球自转速度—构造运动或形变
一、气候变化与地球表面水的分布
备考2023年中考科学一轮复习-电荷间的相互作用规律-填空题专训及答案(二)
备考2023年中考科学一轮复习-电荷间的相互作用规律-填空题专训及答案(二)电荷间的相互作用规律填空题专训1、(2018福建.中考真卷) 如图,悬挂在一起的两个气球,被毛织品摩擦过后彼此排斥分开,此时两个气球带________(选填“同种”或“异种”)电荷,气球是因为________而带电。
2、(2020门头沟.中考模拟) 两个轻质小球A、B通过绝缘丝线悬挂在O点,它们静止时所处的位置如图所示,若小球A带正电荷,则可判断出小球B带________电荷,判断依据是________。
3、(2020城.中考模拟) 在疫情期间,小明经常在家中刷抖音,突然刷到一个像是《哈利波特》里的魔法棒一样的东西,摩擦了之后能接触金属球,如图所示,发现金属球下端的细线张开了,于是他分析这肯定是一个橡胶棒,橡胶棒与毛皮摩擦,橡胶棒上会带________(选填“正”或“负”)电,然后橡胶棒接触金属球,就有一部分电荷转移到细线上,这细线由于带了________(选填“同种”或“异种”)电荷,由于互相________(选填“吸引”或“排斥”)而张开。
4、(2016南京.中考模拟) 如图甲所示,将两个表面________(选填“光滑”或“粗糙”)的铅块相互紧压,它们会粘在一起,说明分子间有________.如图乙所示,把与毛皮摩擦过的橡胶棒靠近与丝绸摩擦过的玻璃棒,它们会相互________.5、(2017丹阳.中考模拟) 塑料绳很难被拉断,说明了________.将塑料绳的一端扎紧,尽可能将其撕成更多的细丝,用干燥的手从上向下捋几下,观察到如图所示的现象.这是因为塑料丝带了________电荷(选填“同种”或“异种”),塑料丝带电的实质是________在物体间转移.6、(2019兴化.中考模拟) 用丝绸摩擦玻璃棒,玻璃棒由于________(得到/失去)电子带正电,如图所示用这个玻璃棒靠近悬挂的气球,气球被推开,则气球带________电。
高压下DPP-11超分子结构中的π-π相互作用
薹 一
S h me 1 M o e u a t u t r fDP 1 c e l c lr s r cu e o P- 1
收 稿 日期 : 0 71-2 20 —12 .
基金项 目:国家 自然科学基金 ( 批准号 : 0 70 8, 0 7 0 3 、 2 6 34 27 3 ) 新世纪优 秀人才支持计划 ( 4 批准号 : C T0 -33 、长江学者和创 N E -60 1 ) 新团队发展计划 ( 批准号 : R 0 2 和国家基础研究项 目( I T 65) 批准号 : 0 5 B 2 40) 20 C 7 40 资助.
维普资讯
Vo . 9 12
高 等 学 校 化 学 学 报
CHEMI AL J C OURNAL OF CHI NES E UNI VERSTI S I E
No 6 .
l8 1 1~l压 下 D P 1 P -1超 分 子 结构 中的
0 4 . O 4 . 6 34; 6 1 3 文献标识码 A 文章编号 0 5 -7 0 2 0 )6 18 - 2 1 9 (0 8 0 ・1 1 4 0 0 作用 ; 同步辐射 ; 红外光谱 远 中图分类 号
7 7相 互 作用 是一 种弱 的相 互作 用 ,普 遍存 在 于化 学 和 生 物体 系 中 ..作 为超 分 子 体 系 中 重要 rr . 2 J 的驱动力 之一 , 其对 分 子体 系 的 自组 装 和分子 识 别具 有 重 要作 用 ,它 可 以决 定 分子 构 型 、分 子 聚集 状 态并 影 响该 分子 体系 特有 的功 能 J 噻 吩二 酮 吡咯 并 吡 咯 ( P 类 颜料 中 ,7共 轭 的染 料 基 团之 .在 D P) r
共轭 的染料基 团 的 仃 7相 互作用 规则 排列 . - r 12 高压 实验装 置 . 本文 采 用 的 高 压 装 置 为 Ma.e 型 D C1 , oB l l A 【] 2
第二章 化学键与分子间作用力总结[选修3]鲁科版
第二章化学键与分子间作用力知识建构:专题归纳:一、微粒间相互作用力的比较1、化学键的比较键比较离子键共价键金属键非极性键极性键配位键本质阴、阳离子间的静电作用相邻原子间通过共用电子对(电子云重叠)与原子核间的静电作用形成电性作用成键条件电负性相差较大的活泼金属元素的阳离子和活泼非金属元素的阴离子(成键电子的得、失电子能力相差较大)成键原子得失电子能力相同成键原子得失电子能力差别较小(不同种非金属)成键原子一方有孤对电子,一方有空规道同种金属或不同种金属(合金)特征无方向性、饱合性有方向性、饱合性无方向性成键微粒阴、阳离子原子金属阳离子和自由电子存在离子化合物非金属双原子单质、共价化合物(H2O2),离子化合物(Na2O2)共价化合物(HCl)离子化合物(NaOH)离子化合物(NH4Cl)金属或合金2、范德华力和氢键的比较范德华力氢键概念范德华力是分子之间普遍存在的一种相互作用,它使得许多由分子构成的物质能以一定的聚集态存在正电性较强的氢原子与电负性很大且半径小的原子间存在的一种静电相互作用存在范围分子间某些强极性键氢化物的分子间(HF、H2O、NH3)强度比较比化学键弱得多比化学键弱得多,比范德华力强影响因素①随着分子极性和相对分子量的增大而增大②组成和结构相似的物质,相对分子质量越大,范德华力越大形成氢键的非金属原子吸引电子的能力越强,半径越小,则氢键越强特征无方向性和饱合性有方向性和饱合性对物质性质的影响影响物质的物理性质,如熔点、沸点等。
组成和结构相似的物质,相对分子质量越大,熔沸点越高,如熔沸点:O2>N2,HI>HBr>HCl分子间氢键的存在,使得物质的熔沸点升高,在水中的溶解度增大,如熔沸点:H2O > H2S二、分子的极性和键的极性、分子构型的关系分子类型分子形状键角键的极性分子极性代表物A 球形非极性He、NeA2直线形非极性非极性H2、O2AB 直线形极性极性HCl、NOABA 直线形180°极性非极性CO2、CS2ABA 角形≠180°极性极性H2O、SO2A4正四面体形60°非极性非极性P4AB3平面三角形120°极性非极性BF3、SO3AB3三角锥形≠120°极性极性NH3、NCl3AB4正四面体形109°28′极性非极性CH4、CCl4AB3C 四面体形≠109°28′极性极性CH3Cl、CHCl3AB2C2四面体形≠109°28′极性极性CH2Cl2由上表可知:分子的极性取决于键的极性,分子中每一个键两端的原子的电负性的差异,差异越大的,键的极性越强;很明显,若分子中没有极性键,则相应的分子不可能是极性分子,但含有极性键的分子也不一定都是极性分子,若成键的原子在空间呈对称分布的话,则键的极性彼此抵消,分子仍为非极性分子,否则的话为极性分子。
