乳酸测定
乳酸测定——精选推荐

乳酸是糖代谢的中间产物,主要来源于骨骼肌、脑、皮肤、肾髓质和红细胞。
血液中乳酸浓度和这些组织产生乳酸的速率以及肝脏对乳酸的代谢速度有关,约65%乳酸由肝脏利用。
乳酸循环是指葡萄糖在外周组织转化为乳酸,而乳酸在肝脏中又转化为葡萄糖。
肝外乳酸通过骨骼肌和肾皮质的氧化作用清除。
乳酸产物增加会促进肝对乳酸的清除,但当乳酸浓度超过2mmol/L时,肝脏对其的摄取就会达到饱和。
剧烈运动晌,乳酸浓度可在短时间内明显增加,乳酸中毒没有可接受的浓度标准,但一般认为乳酸浓度超过5mmol /L以及PH小于7. 25时提示有明显的乳酸中毒。
乳酸中毒在下列两类临床情况下发生:A型(缺氧型):常见,与组织氧合作用降低有关,如休克、低血容量和左心室衰竭;B型:与某些疾病(如糖尿病、肿瘤、肝病)、药物或毒物如乙醇、甲醇、水杨酸或先天代谢紊乱(如甲基丙二酸血症,丙酮酸血症和脂肪酸氧化缺陷)有关。
机制还不清楚,但推测是线粒体功能缺陷,使氧的利用削弱。
乳酸中毒比较常见,住院患者发生率约1%。
其所致死亡率超过60%,而如果同时存在有低血压,则死亡率接近100%。
乳酸中毒另一个不常见但难以诊断的病因是D-乳酸中毒。
D-乳酸不由人代谢产生,而是由肠道吸收后在体内积累。
D-乳酸可以导致全身性酸中毒,常见于空回肠分流术后,表现为乳酸性脑病(意识模糊、共济失调、嗜睡),并有血浆D-乳酸浓度升高。
实际上所有测定乳酸的方法都使用L乳酸脱氢酶,而不能测定D-乳酸。
D乳酸可用气液色谱法或用D-乳酸脱氢酶测定。
脑脊液中乳酸浓度通常与血中乳酸相同。
但是当CSF发生生物化学改变时,其乳酸浓度的变化与血中浓度无关。
CSF中乳酸浓度上升可见于脑血管意外、颅内出血、细菌性脑膜炎、癫痫和其他一些中枢神经系统疾病。
在病毒性脑膜炎,CSF乳酸浓度常不增加。
因此,CSF乳酸浓度可用于鉴别病毒性和细菌性脑膜炎。
一全血乳酸分光光度法测定原理在NAD+存在下,LDH催化乳酸,氧化成丙酮酸。
乳酸测定
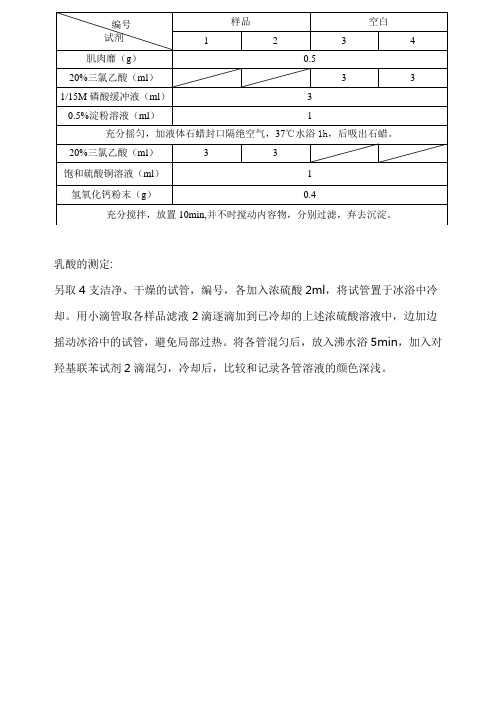
乳酸的测定:
另取4支洁净、干燥的试管,编号,各加入浓硫酸2ml ,将试管置于冰浴中冷却。
用小滴管取各样品滤液2滴逐滴加到已冷却的上述浓硫酸溶液中,边加边摇动冰浴中的试管,避免局部过热。
将各管混匀后,放入沸水浴5min ,加入对羟基联苯试剂2滴混匀,冷却后,比较和记录各管溶液的颜色深浅。
编号 试剂 样品 空白
1
2
3
4
肌肉靡(g ) 0.5
20%三氯乙酸(ml )
3 3
1/15M 磷酸缓冲液(ml ) 3 0.5%淀粉溶液(ml )
1
充分摇匀,加液体石蜡封口隔绝空气,37℃水浴1h ,后吸出石蜡。
20%三氯乙酸(ml ) 3
3
饱和硫酸铜溶液(ml ) 1 氢氧化钙粉末(g )
0.4
充分搅拌,放置10min,并不时搅动内容物,分别过滤,弃去沉淀。
五、实验结果:
肌糖原酵解作用实验结果
空白组(左,基本透明无色)样品组(右,紫罗兰色)
根据实验图判断,样品管中发生了肌糖元酵解,生成的乳酸转变为乙醛后与对羟基联苯反生明显的显色反应,呈现紫罗兰色,空白管因酶失活未发生反应,无颜色变化。
六、实验注意事项
1、实验中用淀粉代替了肌糖元,因为淀粉与肌糖元结构类似,均为葡萄糖分子的高聚糖,淀粉因支链少分解较糖原稍慢,应保证37度水浴时间充足。
2、滴加液体甘油石蜡不宜过多,避免后期过滤困难。
3、测定乳酸的试管必须保证干燥、洁净。
4、最后除糖及蛋白质步骤一定要彻底,保证滤液无杂质干扰,以免影响显色结果。
乳酸含量的测定

乳酸的测定—中和滴定法应用范围:本方法采用滴定法测定乳酸(C3H6O3)的含量。
方法原理:供试品加水溶解后,再精密加入氢氧化钠滴定液(1mol/L)25mL,煮沸5分钟,加酚酞指示液2滴,趁热用硫酸滴定液(0.5mol/L)滴定,并将滴定的结果用空白试验校正,酚酞指示液变红时停止滴定,读出硫酸滴定液使用量,计算乳酸含量。
试剂:1. 水(新沸放置至室温)2. 氢氧化钠滴定液(1mol/L)3. 硫酸滴定液(0.5mol/L)4. 酚酞指示液5. 甲基红-溴甲酚绿混合指示液6. 乙醇7.基准邻苯二甲酸氢钾8.基准无水碳酸钠试样制备:1. 氢氧化钠滴定液(1mol/L)配制:取澄清的氢氧化钠饱和溶液56mL,加新沸过的冷水使成1000mL。
标定:取在105℃干燥至恒重的基准邻苯二甲酸氢钾约6g,精密称定,加新沸过的冷水50mL,振摇,使其尽量溶解;加酚酞指示液2滴,用本液滴定,在接近终点时,应使邻苯二甲酸氢钾完全溶解,滴定至溶液显粉红色。
每1mL氢氧化钠滴定液(1mol/L)相当于204.2mg的邻苯二甲酸氢钾。
根据本液的消耗量与邻苯二甲酸氢钾的取用量,算出本液的浓度。
C(NaOH)=m/0.2042*(V1-V2)M——邻苯二甲酸氢钾的质量;V1——氢氧化钠的消耗量;V2——空白贮藏:置聚乙烯塑料瓶中,密封保存;塞中有2孔,孔内各插入玻璃管1支,1管与钠石灰管相连,1管供吸出本液使用。
2.酸滴定液(1 mol/L)配制:取硫酸30m L,缓缓注入适量的水中,冷却至室温,加水稀释至1000mL,摇匀。
标定:取在270-300℃干燥恒重的基准无水碳酸钠约1.5g,精密称定,加水50mL 使溶解,加甲基红-溴甲酚绿混合指示液10滴,用本液滴定至溶液由绿色变为紫红色时,煮沸2分钟,冷却至室温,继续滴定至溶液颜色有绿色变为暗紫色。
细胞内乳酸检测方法-概念解析以及定义

细胞内乳酸检测方法-概述说明以及解释1.引言1.1 概述细胞内乳酸检测方法在现代生物医学领域中扮演着重要的角色。
乳酸是一种产生于细胞内的有机酸,它在人体代谢过程中起着至关重要的作用。
细胞内乳酸水平的变化与多种疾病的发展和治疗效果密切相关,因此准确、快速地检测细胞内乳酸水平对于疾病的预防和诊断具有重要的意义。
目前,针对细胞内乳酸的检测方法已经有了相应的研究。
早期的检测方法主要借助于生化实验和组织切片的染色技术,但这些方法存在耗时长、需要大量细胞和昂贵的设备等缺点。
随着技术的进步,现代的细胞内乳酸检测方法不断涌现,包括光谱法、质谱法、生物传感技术等。
这些方法不仅能够准确测量细胞内乳酸的水平,还能够提供更多关于细胞代谢状态的信息。
然而,当前的细胞内乳酸检测方法仍然存在一些优缺点和局限性。
例如,某些方法需要使用特殊的标记物或昂贵的设备,限制了它们在临床实践中的应用范围;部分方法需要破坏细胞以获取样本,可能对细胞的完整性造成损伤。
此外,一些方法的灵敏度和准确性还有待进一步提高,以满足对微量乳酸变化的检测需求。
综上所述,细胞内乳酸检测方法在生物医学研究和临床应用中具有重要地位。
虽然现有的方法在不同程度上能够满足细胞内乳酸检测的需求,但仍有一些问题需要解决。
因此,进一步的研究和改进细胞内乳酸检测方法,以提高灵敏度、准确性和便捷性,将对未来的疾病预防、诊断和治疗产生积极的影响。
1.2 文章结构文章结构部分的内容如下:文章结构的主要目的是为读者提供一个清晰的指导,确保文章的逻辑性和条理性。
本文将按照以下结构进行论述。
首先,引言部分将概述细胞内乳酸检测方法的重要性,并简要阐述文章的结构和目的。
接着,正文部分将详细探讨细胞内乳酸的重要性。
我们将介绍乳酸在细胞内的生成和代谢途径,并解释其在细胞内能量代谢、肿瘤发展等方面的重要作用。
然后,我们将介绍现有的细胞内乳酸检测方法,包括传统的生化方法和近年来发展起来的新技术。
针对每种方法,我们将详细描述其原理、操作步骤以及优缺点。
乳酸含量测定

在Tris-Hcl-水合肼缓冲液中(pH=9.2),利用乳酸在氧化型烟酰胺腺嘌呤二核苷酸(NAD)存在的条件下,由乳酸脱氢酶(L-LDH)催化生成丙酮酸和还原型烟酰胺腺嘌呤二核苷酸(NADH)。
,利用NADH 是一种强荧光物质,而NAD+则无荧光的性质,通过测定NADH 在340nm 处吸光度的变化率,可得出酶促反应速度,并制得标准曲线,样品中的乳酸可由标准曲线求得。
由于酶促反应的专属性,可以避免试样中众多共存组分的干扰,减少繁杂的预处理过程。
L-乳酸脱氢酶催化反应为可逆反应,且反应平衡偏向于丙酮酸转化为乳酸。
因此,为了保证反应平衡偏向于正方向,需加水合肼截获丙酮酸而生成丙酮酸腙,以减少丙酮酸的积累,加快酶促反应的速度。
而水合肼对乳酸脱氢酶又有抑制作用,过量的水合肼反而会降低酶促反应速度。
反应溶液的pH 值会影响酶的稳定性,酶活性部位中重要基团的解离状态,酶-底物复合物以及底物的解离状态,从而影响酶促反应速度。
最适pH 值为9.2。
最适温度为37℃。
发现Ni2+、Mn2+、Cu2+、Cr3+、Co2+对酶促反应速度有抑制作用根据米氏方程,1/v~1/c 为直线关系,因此用双倒数作图法所绘1/v~1/c 线作为测定乳酸的标准曲线, 线性范围较宽: 1.2 ×10-4~ 2.0 ×10-3mol/L 。
步骤:1. 配制50ml的甘氨酸缓冲液:甘氨酸3.75g,硫酸肼2.6g.,E D T A•2 N a 0.1 g,加适量去离子水用10 mol/ L N aO H 溶液调整p H 至9.3,再加去离子水至50 ml2. 配制5ml2.1mol/l的硫酸铵溶液,吸取0.8ml置于乳酸脱氢酶中进行稀释3. 称量NAD 0.01658g(663.4)溶于5ml蒸馏水瓶中(5mM),4℃保存至少可用2周4.在pcr小管中加入100μl的甘氨酸缓冲液,100μlNAD+,20μl不同浓度的乳酸锂,2μl的乳酸脱氢酶溶液,置于37℃中反应1小时后,用石英比色皿在340nm处测定吸光度,以乳酸锂浓度为横坐标,A340为纵坐标绘制标准曲线4. 在pcr小管中加入100μl的甘氨酸缓冲液,100μlNAD+,20μl不同时间段的进行适当稀释的发酵液,2μl的乳酸脱氢酶溶液,置于37℃中反应1小时后,用石英比色皿在340nm处测定吸光度,利用标准曲线得出稀释后的发酵的乳酸根含量。
乳酸测定

白酒中乳酸的测定方法1、气相色谱法1.1仪器与试剂安捷伦6890气相色谱仪,FID检测器,酸度计色谱纯乳酸(Aldrich Chemical company提供),苄基溴,2-乙基丁酸,无水乙醇1.2 色谱条件色谱柱为HP-FFAP19091F-413型(30m*0.32mm*0.25μm)毛细管柱,进样口温度250℃,检测器温度300℃,柱箱升温程序170℃保持8min,以15℃/min升温到200℃保持5min,进样口压力为35kpa,柱流量0.6ml/min,分流比为进样0.1min以内不分流,之后分流比为30ml/min。
1.3 试剂及标准溶液的配制1.3.1 内标溶液的配制精确称取2-乙基正丁酸0.25克,置于50ml容量瓶中,以60%(V/V)的酒精定容至刻度,摇匀。
1.3.2 标准物储备液的配制精确称取乳酸0.5g,置于50ml的容量瓶中,以蒸馏水定容至刻度,摇匀,配成标准储备液。
1.4 样品预处理1.4.1 试样处理准确吸取20ml酒样,在250ml烧杯中,准确加入5.0g/L的2-乙基丁酸内标溶液1.0ml ,电磁搅拌下用0.035mol/L 左右的四丁基氢氧化铵中和至pH8.5~9。
定量移至125ml 的蒸发皿中,水浴蒸干。
冷却后加入5命令丙酮,使充分溶解,静置片刻,吸取上层清液2ml 于10ml 洁净、干燥的带盖比色管中备用。
CH 2Br HON(CH 3CH 2CH 2CH 2)4CH 2OH+CH 2OH +CH 3CH OHCH 2OOC CH 31.4.2 酯化按计算用100μl 微量注射器吸取苄基溴,加入上述比色管中加盖,摇匀。
在室温(不低于15℃)下静置酯化反应2h 备用。
3.152438.104.171⨯⨯⨯⨯V c 苄基溴加入量=式中: c ——四丁基氢氧化铵的浓度(mol/L )V ——四丁基氢氧化铵的滴定体积(ml ) 171.04——苄基溴的相对分子量 1.438——苄基溴的相对密度 2/5——试样分取比例1.3——苄基溴过量30%,以保证酯化完全1.5 结果与讨论 1.5.1线性关系的测定精确吸取乳酸标准储备液0.1ml 、0.4ml 、0.8ml 、1.2ml 、1.6ml 、分别置于5个250ml 烧杯中,然后各精确加入1ml 的内标液,加入20ml 蒸馏水,配成5个不同浓度的标准工作液,按上述方法进行样品预处理,分别平行测定4次,取平均值。
乳酸的测定——EDTA滴定乳酸钙法
乳酸的测定——EDTA滴定乳酸钙法1 实验原理1.1 乙二胺四乙酸(简称EDTA,常用H4Y表示)难溶于水,通常使用其二钠盐配制标准溶液。
标定EDTA溶液常用的基准物有Zn、ZnO、CaCO3、Bi、Cu、MgSO4·7H2O、Hg、Ni、Pb等。
通常选用其中与被测组分相同的物质作基准物,这样滴定条件较一致。
EDTA溶液若用于测定石灰石或白云石中CaO、MgO的含量,则宜用CaCO3为基准物。
首先可加HCl溶液与之作用,其反应如下:CaCO3+2HCl═CaCl2+H2O+CO2↑然后把溶液转移到容量瓶中并稀释,制成钙标准溶液。
吸取一定量钙标准溶液,调节酸度至pH≥12,用钙指示剂作指示剂以EDTA滴定至溶液从酒红色变为纯蓝色,即为终点,其变色原理如下:钙指示剂(常以H2Ind表示)在溶液中按下式电离:H3Ind═2H++HInd2-在pH≥12溶液中,HInd2-与Ca2+离子形成比较稳定的络离子,反应如下:HInd2-+Ca2+═CaInd-+H+纯蓝色酒红色所以在钙标准溶液中加入钙指示剂,溶液呈酒红色,当用EDTA溶液滴定时,由于EDTA与Ca2+离子形成比CaInd-络离子更稳定的络离子CaY2-,因此在滴定终点附近,CaInd-络离子不断转化为较稳定的CaY2-络离子,而钙指示剂则被游离了出来,其反应可表示如下:CaInd-+H2Y2-═CaY2-+ HInd2-+H2O酒红色无色纯蓝色由于CaY2-离子无色,所以到达终点时溶液由酒红色变成纯蓝色。
用此法测定钙,若Mg2+离子共存(在调节溶液酸度为pH≥12时,Mg2+离子将形成Mg(OH)2沉淀),此共存的少量Mg2+离子不仅不干扰钙的测定,而且会使终点比Ca2+离子单独存在时更敏锐。
当Ca2+、Mg2+离子共存时,终点由酒红色变到纯蓝色,当Ca2+离子单独存在时则由酒红色变紫蓝色,所以测定单独存在的Ca2+离子时,常常加入少量Mg2+离子溶液。
D乳酸测定
D-乳酸比色法检测试剂盒(产品编号K667-100,100检测,试剂盒储存在-20°C)D-乳酸在哺乳动物中的产生,主要是由于乙二醛通路,在正常血清中浓度是极低的在纳米至微摩尔范围内。
通常情况下,在人群中由于细菌感染或短肠综合征,D-乳酸可上升至毫摩尔水平。
异常高浓度的D-乳酸被认为是败血症,缺血或外伤的指标。
由于缓慢的新陈代谢和排泄,高D-乳酸可引起酸中毒和脑病。
BioVision公司的D-乳酸检测试剂盒提供了一种快速,简便的方法来精确地测量各种生物样品中的D-乳酸。
D-乳酸分析试剂盒,D-乳酸被D-乳酸脱氢酶特异性氧化,并产生正比颜色(最大= 450纳米)。
该试剂盒检测样品如血清,血浆,细胞,培养基和发酵基质中的D-乳酸。
样品中有效的浓度范围为0.01mM - 10mM的D-乳酸。
2.试剂盒包括:3.试剂制备和贮存条件:酶混合物:溶解在0.22ml的D-乳酸缓冲液中。
枪头上下吹打至完全溶解。
分装和储存在-20°C。
在两个月的时间内可用。
底物混合物:用每瓶0.22ml的D-乳酸缓冲液混匀。
该溶液在4℃下可存放两个月。
4.乳酸含量检测步骤:1标准曲线制备:通过添加10μl 的标准品到990μL检测缓冲液中,稀释100mM 的D-乳酸标准品至1mM,混合均匀。
添加0,2,4,6,8,10 μl到不同的孔中中。
用缓冲液添加至50μl/孔体积,以产生0,2,4,6,8,10nmol/孔的D-乳酸标准品。
2样品制备:准备1-50μl的测试样品在96孔板中。
用缓冲液将体积调整到50μl/孔。
我们建议使用几种剂量的样品,以确保读数在标准曲线范围内。
注:(1)组织(20mg)或细胞(2×106),可在100μl缓冲液中匀浆。
离心机10,000 g、10分钟,以去除不溶物。
可溶部分可直接测定。
(2)内源酶的活性可能引起D-乳酸损失。
含活性酶样品(如培养基或组织裂解液)应保持在-80℃下储存,或通过10KD分子量自旋过滤器(BioVision的,目录号1997---25年)过滤,以除去所有的蛋白质。
试验二血乳酸测定
6、9、15、30分钟时手指末梢血进行检测。
五、实验结果记录
受试者姓名: 负荷: 体重: 试验后5min血乳酸值:
试验后7min 血乳酸值:
六:结果分析
结合受试者试验前后血乳酸水平的变化分 析机体的无氧糖酵解代谢能力。
受试者运动后最大血乳酸水平达到或超过14mmol/L 则无氧糖酵解代谢供能能力强,最大血乳酸水平在10-14
mmol/L之间则无氧糖酵解代谢供能能力尚可,如果最大
血乳酸水平低于10 mmol/L则糖酵解代谢供能能力较差。
Hale Waihona Puke 酸的方法2、掌握血乳酸的运动生物化学评定方法及意义 二、实验原理
根据生物电化学分析法进行血乳酸分析
三、主要实验设备及试剂 Lactate-scout便携式乳酸盐分析仪、Lactatescout便携式乳酸盐分析仪测试专用试剂条、 Monark-894型功率自行车。 四、实验步骤 1、安静状态下血乳酸的测定 取受试者安静时手指末梢血测定乳酸基础值。
2、1分钟最大强度运动后血乳酸的测定 受试者在Monark-894型功率自行车上进行蹬骑, 采用Wingate法全力蹬车40秒。适当准备活动后撤去
负荷,令受试者空蹬至90r/min,在2-3秒内加上8.5%
受试者体重的负荷,并同时发出“开始”口令,受试
者全力快速蹬骑60秒。测试过程中不断给予大声口
实验二 血乳酸的测定
[血乳酸简介]
乳酸是糖酵解代谢的产物,正常人安静时血乳酸浓度保 持在l一2mM,运动时血乳酸的变化与所动用的能量系统有关。 以磷酸原系统供能为主的运动.血乳酸一般不超过4mM;以 糖酵解系统供能为主的运动,血乳酸可达15 mM以上;而以 有氧氧化系统供能为主的运动.血乳酸在4mM左右。 在训练时可通过测血乳酸峰值的变化掌握运动强度以及 运动员代谢能力的变化。运动后血乳酸浓度变化可评定运动 员训练水平及用于选材;还可根据运动后乳酸的消除速率评 定运动员机能能力。
细胞中乳酸的测定__概述说明以及解释
细胞中乳酸的测定概述说明以及解释1. 引言在生物学研究中,对细胞的代谢产物进行测定是十分重要的,乳酸作为一种常见的代谢产物,在细胞中具有重要的作用。
乳酸能够通过乳酸脱氢酶催化反应将其转化为丙酮酸,从而参与细胞内能量代谢过程。
然而,过多的乳酸积累可能会导致细胞功能异常,并在某些疾病状态下出现。
本文旨在概述并解释细胞中乳酸的测定方法与技术,并探讨其在生物学研究中的重要性和应用。
文章将从以下几个方面展开:首先介绍乳酸在细胞中的作用,包括其参与能量代谢以及与其他代谢产物之间的相互关系;接着详细介绍乳酸测定方法的种类,涵盖传统的生化分析方法以及近年来发展起来的新型技术;最后对乳酸测定结果进行分析,并回顾相关研究发现和比较分析。
文章内容将包括实验方法与技术部分,介绍了采集细胞样本的方法、乳酸测定的实验步骤以及常用的乳酸测定技术。
进一步地,文章将提供实验结果与分析部分,对细胞样本中乳酸含量的分析结果进行阐述,并对结果进行解释和讨论。
此外,文章还将从已有研究成果出发,探讨与比较不同研究之间的关联性。
最后,在结论与展望部分,笔者将对实验结果进行总结和归纳,并给出进一步研究方向的展望和建议。
通过这篇长文的撰写,希望能加深对细胞中乳酸测定方法与技术的理解,并为相关领域的研究提供参考和指导。
2. 细胞中乳酸的测定2.1 乳酸在细胞中的作用乳酸是一种重要的代谢产物,在细胞内发挥着关键作用。
它是糖酵解过程中生成的主要产物之一,尤其在无氧代谢情况下积累较多。
乳酸可被肌肉细胞转化为能量并参与体内能量供应。
此外,乳酸还在心肌等组织中起到了调节pH值和血液循环、增加脑功能等方面的作用。
2.2 乳酸测定方法的种类目前常见的测定细胞中乳酸含量的方法有多种,其中包括生化分析方法、色谱法、光谱法等。
生化分析方法通常利用相关试剂对乳酸进行反应,并通过检测反应产物来间接确定乳酸含量。
色谱法则采用气相或液相色谱技术,将混合物中存在的乳酸分离并测定其峰面积或峰高度来计算含量。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
乳酸是体内葡萄糖代谢的产物之一,在正常状态下其产量不多,但在危重病人存在低氧等状态时则明显增多,甚至导致乳酸性酸中毒。
在危重病得到有效控制、低氧状态等获得迅速纠正后,体内的乳酸可很快降低。
因此,测定体内的乳酸清除率可准确提示危重病的控制状况,并对其疾病的预后作出有效评估。
1 乳酸的代谢葡萄糖在氧化供能过程中产生的中间代谢产物为丙酮酸。
丙酮酸+NADH+H+ 乳酸脱氢酶乳酸+NAD+3-磷酸甘油醛脱氢酶(NADH)与3-磷酸甘油醛脱氧酶(NAD+)的比值决定了反应的方向。
在供氧充足时,NADH与NAD+比值适当,丙酮酸经丙酮酸脱氢酶作用氧化脱羧而成乙酰辅助A,后者继而进入三羧酸循环。
当组织灌注不足、乏氧条件下,NADH蓄积,丙酮酸则转化为乳酸,即进入糖酵解过程;当乏氧状况改善后,乳酸又可反转化为丙酮酸并进入三羧酸循环氧化供能。
机体所有组织均有糖酵解产生乳酸的能力,而体内清除血乳酸的脏器主要是肝脏,其次是肾脏。
肝脏通过合成糖元和乳酸经丙酮酸途径进入线粒体氧化供能,在乳酸清除中占有重要的地位。
不仅清除量大(占50%),且速度快。
肾脏在乳酸增高时清除乳酸能力不断增加,其机制是既通过丙酮酸途径进入线粒体氧化供能、合成糖原,又通过分泌排出。
基础状态下,机体对乳酸生成和转化的能力处于一种平衡状态,乳酸的最大生成率可达到3500mmol/d,而乳酸的最大转化能力,仅肝脏就达4400mmol/d,加上肾脏的最大转化能力,说明机体对乳酸的转化清除具有非常大的储备能力。
只有在机体严重缺氧时,全身各组织大量产生乳酸,从而使体内乳酸的产生率超过其清除率,导致高乳酸血症的发生。
2 血乳酸升高的原因正常人血乳酸浓度为(1.0±0.5)mmol/L,危重病人为<2.0mmol/L,≥2.0mmol/L即为高乳酸血症,≥5.0mmol/L时常伴代谢性酸中毒。
2.1 乳酸生成过多(1)组织氧供不足:危重病人全身或局部组织灌注不良,导致氧的供需不平衡,如各类休克时均存在全身组织灌注不足,肠系膜缺血时存在局部组织的低灌注,此外心肺功能不全者全身组织氧供降低、不能满足机体代谢的需要,均会导致高乳酸血症的发生。
高乳酸血症常于休克早期即已出现,且先于休克征群,休克前1~3h即可出现轻度乳酸增高。
CO中毒时,碳氧血红蛋白降低了血液中氧的携带能力,造成低氧血症,且CO与Hb相结合而严重妨碍了氧从毛细血管向组织细胞线粒体弥散的能力,生理氧化受到抑制,细胞产能、供能发生障碍。
(2)隐匿性组织灌注不足:某些疾病状态时虽无明显的组织低灌注现象,如高血压伴发的心脏损伤(包括心肌肥大、心功能障碍),心脏发生病理变化,存在着隐匿的组织灌注不足,心肌细胞对乳酸的利用降低,释放增加。
有研究表明[1],运动性和高血压性心肌肥大重塑时,细胞表型slv(心肌肌膜束泡)乳酸转运载体特征变化不同,前者slv乳酸转运能力提高,后者则降低。
体外循环心脏手术时,因主动脉阻断而使心脏处于空跳状态,心肌耗氧增大,葡萄糖代谢增加,从而使血乳酸含量明显升高[2,3]。
剧烈运动或癫痫发作时,由于肌肉组织的强烈收缩,使其氧供不能满足氧耗的增加所需,出现相对缺氧,也会导致乳酸产生过多。
(3)应激致高儿茶酚胺血症:危重病应激状态下血儿茶酚胺浓度升高,后者与肌细胞膜上的受体结合而使细胞膜cAMP激活,一方面激活糖原磷酸化酶而使糖原分解为6-磷酸葡萄糖,另一方面激活细胞膜上Na+-K+-ATP酶,使ATP水解为ADP,细胞内NADH/NAD+比值增高,促进糖酵解过程,导致高乳酸血症。
1999年James 等观察到败血症和外伤病人虽无组织缺氧现象,但其血乳酸值和儿茶酚胺浓度呈正相关[4]。
Bundgaard等[5,6]也通过体内试验验证了肾上腺素致乳酸增高的现象。
(4)组织中毒性缺氧:由于某些药物、毒物抑制了氧化还原酶,使组织不能充分利用氧,导致用氧障碍性缺氧。
如硝普钠过量时引起的组织中毒性缺氧,硝普钠进入人体就立即分解,每分子硝普钠放出5分子氰化物,后者与氧化型细胞色素氧化酶中的Fe+++结合,使其失去传递电子的功能,以致生物氧化过程中断,丙酮酸的正常利用被抑制而转化成乳酸,因而发生高乳酸血症。
2.2 乳酸清除不足除了上述致血乳酸产生过多的原因外,一些病人仅有或同时存在乳酸清除不足的状况。
Levraut等[7]观察血流动力学稳定的败血症病人,其高乳酸血症并非由于乳酸产生过多,而在于清除障碍,原因可能较细胞的氧化功能缺陷更加复杂。
Jacques等[8]还通过前瞻性研究发现,血流动力学稳定的脓毒症病人中,高乳酸血症组与血乳酸正常组的乳酸产生量是相同的[(1194±230)μmol/(kg·h) vs (1181±325)μm ol/(kg·h),P=0.90],而两组的乳酸清除率却有显著性差异[(473±102)μmol/(kg·h) vs (1002±284)μmol/(kg·h),P <0.001],说明这些病人的高乳酸血症主要是由于乳酸清除上的缺陷所致。
体内产生的乳酸主要依靠肝脏清除,严重肝病时肝脏代谢能力不足,导致对乳酸的处理能力降低,出现高乳酸血症。
Kruse等[9]报道重症肝炎时血乳酸<2.2mmol/L者病死率为38%,血乳酸在2.2~6.9mmol/L之间者病死率为58%,当血乳酸>7.0mmol/L时病死率为100%。
糖尿病病人除存在微血管病变所致的组织供氧障碍而使乳酸生成增多外,降糖药抑制了糖原异生,即抑制了乳酸转化为糖原的过程,也是使血乳酸升高的原因之一。
人体内的乳酸绝大部分为L-乳酸,而D-乳酸含量极少,临床上测定的乳酸包括L-乳酸和D-乳酸,但主要是L-乳酸。
高D-乳酸血症常见于小肠广泛切除,小肠短路术后及慢性胰腺功能不全等疾病时,推测可能系小肠粘膜功能受损而使过量的碳水化合物转到结肠,在结肠经异常菌丛作用而产生D-乳酸。
也有学者发现[10],脓毒性休克时胃粘膜CO2分压、胃粘膜-动脉CO2分压差与血D-乳酸浓度呈显著正相关。
此外,有研究证实[11],成人呼吸窘迫综合征(ARDS)时肺乳酸释放量可>60mmol/h,远超过正常状态下的释放量,且乳酸释放量与肺损伤程度显著正相关,其机制可能系炎性细胞和细胞因子促进了糖酵解的过程。
3 血乳酸升高的危害性血乳酸升高的主要危险不是乳酸根离子,而是酸中毒的威胁。
乳酸(PK38)是一种比碳酸(PK61)更强的代谢酸,基础状态下,肝脏每天约摄取转化乳酸1290mmol/L,当肝摄取转化乳酸的能力完全损害时,H+就会以至少50mmol/h的速率在体内蓄积。
按照这个速度,体内碳酸氢根就会迅速被中和。
几小时内就会发生代谢性酸中毒。
如果伴有乳酸生成过多,这个酸中毒过程就会更快发展,从而导致体内代谢的严重紊乱。
动物实验表明高乳酸血症可以损害蛙心房肌的收缩力,致正常大鼠运动耐力下降,降低氧化磷酸化和抑制心肌组织糖的利用,可能是促使心肌损伤和心律失常的机制之一。
但是,对休克所致的乳酸性酸中毒,应用缓冲剂以纠正酸中毒,并不能实质性地改变临床结果[12]。
对乳酸升高的危害性的本质认识尚未完全明了。
4 血乳酸清除率与危重病预后的关系大量的研究已揭示血乳酸水平与危重病的严重程度和预后密切相关,血乳酸越高,病情越严重,疾病的预后越差。
但由于病人不同的机体基础状态(如肝脏、肾脏基础,及既往药物使用史),受到的应激强度也不完全相同,因此单纯监测某一时刻的血乳酸浓度只能说明此时(可能存在短时间的延迟现象)的组织氧供与氧耗的平衡关系,而不能准确反映机体的状态、疾病的发展情况,尤其是不能准确反映治疗措施对氧供、氧耗的动态影响。
李文雄等[13]对脓毒性休克病人存活组和死亡组初始血乳酸浓度比较,发现两组差异无统计学意义(P>0.05),但动态观察则发现存活组血乳酸值逐步降低到正常,而死亡组则持续升高。
王东浩[14]分析了247例重度脓毒症病人的初始血乳酸浓度和入ICU 12h后乳酸清除率与最终转归的关系,发现存活组与死亡组的初始血乳酸浓度比较,差异无统计学意义(P>0.05),但存活组的乳酸清除率明显高于死亡组[(31.86±16.34)% vs (14.77±10.35)%,P<0.01],高乳酸清除率组脓毒症休克发生率、病死率均明显低于低乳酸清除率组(29.45% vs 90.48%、30.67% vs 85.71%, P均<0.01)。
Levraut等[15]前瞻性观察了56例血乳酸正常或轻度增高的脓毒症病人,分析其乳酸清除率与28d病死率之间的关系,发现存活者的乳酸清除率明显高于死亡者[(0.86±0.32)vs (0.58±0.18)L/(h·kg),P<0.005],说明乳酸清除率低是预后不良的独立预测因素。
Kobayashi等的研究结果也证实了乳酸清除率而不是初始血乳酸浓度对评估预后具有较高的临床价值[16]。
因此,临床为了准确评估机体组织细胞的灌注和氧代谢情况,及病人对治疗的反应,动态监测血乳酸浓度的变化,乳酸清除率可作为一个重要的评估预后的指标[17]。
血乳酸得不到有效清除,说明其组织细胞灌注和氧合未得到改善,病情进展恶化,极易发展成脓毒症休克和多脏器功能失常综合征(MODS)、多器官衰竭(MOF),使病死率升高;反之,如果临床抢救治疗得当,组织灌注和氧合得以迅速好转恢复,组织细胞内乳酸浓度下降,乳酸清除率升高,则病情好转。
而目前临床常用的APACHE Ⅱ评分作为评价病人状态和所患疾病严重程度的评分系统,在短时间内无法迅速出现评分分值的显著变化,故尚不能作为监测危重病病人初始抢救效果的敏感指标。
乳酸清除率虽能敏感地反映组织氧供/氧耗的动态平衡状况,提示治疗的有效性,但由于组织内的乳酸进入血液需要数分钟的时间[18]和一定的组织灌注(洗出现象),可能出现血乳酸水平改变的延迟性和组织灌注严重不良时的局部乳酸潴留现象,而且血乳酸浓度受到肝肾功能的影响,也不能反映原发疾病的可逆状况,因此乳酸清除率作为单独的一个因素来判断预后还是有其局限性的,应结合多种因素综合判断预后。
目前,究竟哪一时段、多少临界阈值的乳酸清除率对预后评估具有最大的敏感性和特异性尚无定论,均需进一步探讨13.患者,女,68岁、胸痛、出冷汗,神志淡漠,口唇发绀、面色苍白,脉搏50次/分,BP74/56mmHg,ECG 示:窦性心动过缓,Ⅱ、Ⅲ、aVF 导联可见S-T 段抬高,CK-MB 为40ng/ml,在补充血容量基础上,中剂量多巴胺治疗的常用剂量是( )A.1~2ug/(kg·min)B.2~6ug/(kg·min)C.1~5ug/(kg·min)D.3~10ug/(kg·min)E.6~10ug/(kg·min)。
