(完整版)药物合成反应_闻韧_第三版_课后习题答案(全)
药物合成习题答案
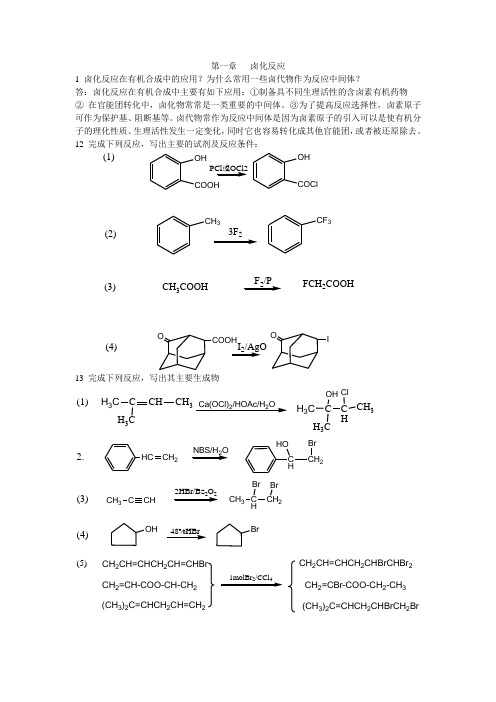
13完成下列反应,写出其主要生成物
第二章烃化反应
一√烃化剂的种类有哪些?进行甲基化和乙基化反应时,应选用那些烃化剂?引入较大烃基时选用那些烃化剂为好?
答:烃化剂种类主要有:卤代烷类;硫酸酯、磺酸酯类;醇、醚类;烯烃类;环氧烷类;重氮甲烷;甲基化和乙基化时选用的烃化剂为:卤代烃RX(R为甲基或乙基,);硫酸二甲酯或硫酸二乙酯,重氮甲烷。引入较大的烃基时选用芳基磺酸酯。
答:KmnO4的氧化能力在酸性条件下最强;中性和碱性条件下氧化能力相当且相对较弱,两者只是使用场合有些不同。KmnO4主要用于烯键的断裂氧化、将醇氧化成醛或酮和将醛氧化成酸。
16完成下列反应(12345)
(1)
(2)
(3)
(4)
(5)
重排反应
完成下列反应,并注明反应名称
1
2
3
4
5
6
3在Backmann重排中常用的催化剂有那几种?
用LiAlH4反应结束后可加入乙醇、无水乙醚或10%氯化胺水溶液以分解未反应的LiAlH4和还原物;NaBH4反应结束后可加稀酸分解还原物并使剩余的NaBH4生成硼酸,便于分离。
七、√完成下列反应
九、√完成下列反应
第三章酰化反应
2.常见的酰化剂有哪些?他们的酰化能力、应用范围、以及使用条件上有何异同点?
答:常见的酰化剂有:羧酸、羧酸酯、酸酐、酰氯、酰胺等。
羧酸的酰化能力较弱,可用于C-酰化、N-酰化和O-酰化,一般需设法活化羧酸以增强羰基的亲电能力。
羧酸酯的酰化能力比羧酸弱,可用于N-酰化和O-酰化反应,一般应在高温下进行反应,且以质子酸、Lewis酸或醇钠进行催化。
相转移催化氢化:指在相转移催化剂的作用下所进行的催化氢化反应。相转移催化剂是指在非均匀相反应中,它能使水相中的反应物转入有机相,从而改变了离子的溶剂化程度,增大离子反应活性,加快反应速率,简化处理手续的一种有机试剂。
药物合成教学资料 药物合成反应(第三版_闻韧)第八章_合成路线

• 1990年获得Noble Prize in chemistry • 16岁进入MIT学工程,但发现自己对化学感兴趣,结果改 学化学, 23岁获PhD, 27岁University of Illinois正教授,回到 Harvard University • He chose to work in organic chemistry because of "its intrinsic beauty and its great relevance to human health" • Now a Emeritus Professor at Harvard University 《The
O
FGI
dis
2O OH OH
+ NaC CNa
O
TM27
OH
OH
OH C COOHFGIOH C Fra bibliotekNdis
O + HCN
Organic Reactions for Drug Synthesis
逆合成分析
• 双官能团化合物的逆合成:1,2-双官能团
OH FGI COOH COOH TM28 FGI COOH FGA OH CN COOH COOH FGI COOH dis CHO FGI COOH CO2Et dis CO2Et CHO CO2Et Br dis CO2Et CO2Et CO2Et
• 合成路线
– 对于复杂的分子理论上可能有很多条合成路线,把 所有可能的合成路线汇合在一起形成所谓的“合成 树”(synthesis tree)
。 。 。 。 。 。 。。 。 。 。 。 。 。 。 。 。 。 。 。。 。 。 。 。 。 。 。 。 。 。 。 。 。 。 。 。 。 。 。 。 。 。 。 。 。 。 。
药物合成反应习题集.doc详解

《药物合成技术》习题集适用于制药技术类专业第一章 概论一、本课程的学习内容和任务是什么?学好本课程对从事药物及其中间体合成工作有何意义?二、药物合成反应有哪些特点?应如何学习和掌握? 三、什么是化学、区域选择性?举例说明。
四、什么是导向基?具体包括哪些类型?举例说明。
五、药物合成反应有哪些分类方法?所用试剂有哪些分类方法?举例说明。
六、查资料写一篇500字左右的短文,报道药物合成领域的新技术及发展动态?第二章 卤化技术(Halogenation Reaction )一、简答下列问题1.何为卤化反应?按反应类型分类,卤化反应可分为哪几种?并举例说明。
2.在药物合成中,为什么常用卤化物作为药物合成的中间体?3.在较高温度或自由基引发剂存在下,于非极性溶剂中,B r 2和NBS 都可用于烯丙位和苄位的溴取代,试比较它们各自的优缺点。
4.比较X 2、HX 、HOX 对双键离子型加成的机理、产物有何异同,为什么?5.解释卤化氢与烯烃加成反应中,产生马氏规则的原因(用反应机理)。
为什么Lewis 酸能够催化该反应?6.解释溴化氢与烯烃加成反应中,产生过氧化效应的原因?7.在羟基卤置换反应中,卤化剂(HX 、SOCl 2、PCl 3、PCl 5)各有何特点,它们的使用范围如何?二、完成下列反应CCH 3CH 3CHCH 3Ca(OCl)2/AcOH/H 2O1.Ph 2CHCH 2CH 2OH PBr 2.CH 3SO 2ClCl /AIBN3.OH 48%HBr4CH 3CH 35.2OC O CH 3OHI 2/CaOTHF/MeOHAcOK Me 2CO?6.三、为下列反应选择合适的试剂和条件,并说明原因。
(CH 3)2CCHCH 3CHCH 2Br(CH 3)2C1.CH 3CH CH COOHCH 3CH CH COCl 2.HOCH 2(CH 2)4CH 2OH(CH 2)4CH 2I CH 2I 3.CH 3OCH 2CH 2CO 2HCH 2CHCOBrBrCH 3O 4.CH 3CH CH CO 2CH 3CH 2CH CH CO 2CH 3Br 5.OCH 2CH 2OH CH 2CH 2OHO2CH 2CH 2CH 2ClCl 6.CH 2OH3CH 2Cl37.8.BrCH 2(CH 2)9COOH CH 3CH(CH 2)8COOHBrCH 2CH(CH 2)8COOHCH 3NO 2CH 2C(COOC 2H 5)3CH 2Br2CH 2C(COOC 2H 5)NHCOCH 39.CH 22CH 2N(CH 2CH 2OH)2C(COOC 2H 5)3(抗肿瘤药消卡芥)CH 2NO 2CH 2N(CH 2CH 2Cl)2CHCOOH NH 2CH 22CH 2N(CH 2CH 2Cl)2C(COOC2H 5)310.CH 3(CH 2)5OCH 3C 2H 5CH 3(CH 2)5OCH 2BrC 2H 5CH3(CH 2)5OOHC 2H 5CH 3(CH 2)4CH 2OHCH 3(CH 2)4CH 2Cl CH 3(CH 2)4CH 2Cl (构型反转)(构型保持)11.OC 2H 5OC 2H 5Br12.四、分析讨论1.试预测下列各烯烃溴化(Br 2/CCl 4)的活性顺序。
《药物合成反应》-闻韧主编第三章酰化反应-知识点总结

#2.11打卡# 完成学习目标第三章酰化反应Acylation Reaction1 定义:有机物分子中O、N、C原子上导入酰基的反应.2 分类:根据接受酰基原子的不同可分为:氧酰化、氮酰化、碳酰化3 用途:药物本身有酰基活性化合物的必要官能团结构修饰和前体药物羟基、胺基等基团的保护。
酰化机理:加成-消除机理加成阶段反应是否易于进行决定于羰基的活性:若L的电子效应是吸电子的,不仅有利于亲核试剂的进攻,而且使中间体稳定;若是给电子的作用相反。
根据上述的反应机理可以看出,作为被酰化物质来讲,无疑其亲核性越强越容易被酰化。
具有不同结构的被酰化物的亲核能力一般规律为;RCH2->R—NH->R—O->R—NH2>R—OH。
在消除阶段反应是否易于进行主要取决于L的离去倾向:L-碱性越强,越不容易离去,Cl- 是很弱的碱,-OCOR的碱性较强些,OH-、OR-是相当强的碱,NH2-是更强的碱。
RCOCl>(RCO)2O>RCOOH 、RCOOR′ >RCONH2>RCONR2′R: R为吸电子基团利于进行反应;R为给电子基团不利于反应R的体积若庞大,则亲核试剂对羰基的进攻有位阻,不利于反应进行酸碱催化碱催化作用是可以使较弱的亲核试剂H-Nu转化成亲核性较强的亲核试剂Nu-,从而加速反应。
酸催化的作用是它可以使羰基质子化,转化成羰基碳上带有更大正电性、更容易受亲核试剂进攻的基团,从而加速反应进行。
氧原子的酰化反应是一类形成羧酸酯的反应,是羧酸和醇的酯化反应,是羧酸衍生物的醇解反应醇的结构对酰化反应的影响伯醇(苄醇、烯丙醇除外)>仲醇>叔醇1) 羧酸为酰化剂:提高收率:(1)增加反应物浓度(2)不断蒸出反应产物之一(3)共沸除水、添加脱水剂或分子筛除水。
(无水CuSO4,无水Al2(SO4)3,(CF3CO)2O,DCC。
)加快反应速率:(1)提高温度(2)催化剂(降低活化能)催化剂(1)质子酸催化法: 无机酸:浓硫酸,氯化氢气体,有机酸:苯磺酸,对甲苯磺酸等。
药物合成反应(第三版_闻韧)第二章烃化反应

O C -CN -COOR' -COOH
O C3H7OH + CH3CH=CHCH
NaOH
CH3 C3H7OCHCH2CHO
CH3OCH2CH2CN
CH3OH+CH2=CHCN
NaOCH3 90℃ 1h
Organic Reactions for Drug Synthesis
(3)烷氧鏻盐为烃化剂
醇(伯醇、仲醇)+三苯基膦+偶氮二羧酸酯→ 烷氧鏻盐(R3P+OR′X-)
ArOH + ROH Ph3P/EtOOCN=NCOOEt
ArOR
EtOOCNHNHCOOEt+Ph3PO
Organic Reactions for Drug Synthesis
ii)当X相同时 卤代丙烯, 卤苄 > 卤代烷 > 卤芳烃ArX OEt Cl NaOH + EtOH 非那西丁中间体 NO2 NO2
当卤代烃为叔卤代烃时,不能在强碱下反应, 易消除HX,可在中性或弱碱性下反应。 CH3 CH2 B CH3 C + CH3-C CH3
Organic Reactions for Drug Synthesis
反应机理:b 碱催化
R'O R-CH-CH2 O O R-CH-CH R'OH
OR'
RCHCH2OR' O
RCHCH2OR'+ R'O OH
SN2 双分子亲核取代,立体位阻原因为
主,反应发生在取代较少的碳原子上。
药物合成反应(第三版_闻韧)第四章 缩合反应总结

R
CH C OH
R'
R
-H
R' R R CH2 C OH
O R'
Hale Waihona Puke CH C- H2O
R'
O C C CR'
CH2R R
Organic Reactions for Drug Synthesis
1)自身缩合 (一般用碱性催化剂)
NaOH 25℃ 2CH3CH2CH2CHO NaOH 80℃ CH3CH2CH2CH OH CH3CH2CH2CH CH CHO CH2CH3 C CHO
试解释上述反应中为什么使用镁?
Organic Reactions for Drug Synthesis
1)
-卤代酸酯的活性顺序为:
R1 R1
ICH2COOC2H5>BrCH2COOC2H5 >ClCH2COOC2H5
X CCOOC2H5 > X CHCOOC H > X CH2COOC2H5 2 5 R2
2) 无水操作:Et2O、THF等。Zn需活化(用20%HCl 处理)
Organic Reactions for Drug Synthesis
Reformatsky反应的应用:
•合成-羟基羧酸酯 •合成-羟基羧酸
•醛、酮增长碳链的方法之一
Organic Reactions for Drug Synthesis
C O Y
Nu
C O Nu
+ Y
Organic Reactions for Drug Synthesis
羰基化合物的结构与反应特征
羰基化合物的结构特征之二: ——羰基C=O的吸电子作用使得a-H具有明显 的酸性,在碱性条件下可以离解,生成烯醇 负离子,从而成为亲核试剂,进攻羰基碳或 卤代烃,发生亲核加成反应、亲核取代反应。
最新《药物合成反应(闻韧主编第三版)》人名反应整理资料

《药物合成反应(闻韧主编第三版)》人名反应整理一、卤化反应1、Hunsdriecke反应(汉斯狄克反应):羧酸银盐和溴或碘反应,脱去二氧化碳,生成比原反应物少一个碳原子的卤代烃。
2、Sandmeyer反应(桑德迈尔反应):用氯化亚铜或溴化亚铜在相应的氢卤酸存在下,将芳香重氮盐转化成卤代芳烃。
3、Gattermann反应(加特曼反应):将Sandmeyer反应条件改为铜粉和氢卤酸。
4、Schiemann反应(席曼反应):将芳香重氮盐转化成不溶性的重氮氟硼酸盐或氟磷酸盐,或将芳胺直接用亚硝酸钠和氟硼酸进行重氮化,此重氦盐再经热分解(有时在氟化钠或铜盐存在下加热),就可以制得较好收率的氟代芳烃。
二、烃化反应5、Willamson合成(威廉姆森合成):醇在碱(钠,氢氧化钠,氢氧化钾等) 存在下与卤代烃反应生成醚的反应。
6、Gabriel合成(盖布瑞尔合成):将氨先制备成邻苯二甲酰亚胺,利用氮上氢的酸性,先与氢氧化钾形成钾盐,然后与卤代烃作用,得N-烃基邻苯二甲酰亚胺,肼解或酸水解即可得纯伯胺。
7、Delepine反应(德勒频反应):用卤代烃与环六亚甲基四胺(乌洛托品Methenamine)反应得季铵盐,然后水解可得伯胺。
8、Leuckart-Wallach反应(鲁卡特-瓦拉赫反应):用甲酸及其铵盐可以对醛酮进行还原烃化,得各类胺。
9、Ullmann反应(沃尔曼反应):卤代芳烃与芳香伯胺在铜或碘化铜及碳酸钾存在并加热的条件下可得二苯胺及其同系物。
三、酰化反应10、Friedel-Crafts反应(傅列德尔-克拉夫茨反应,也称傅-克酰基化反应):羧酸及羧酸衍生物在质子酸或Lewis酸的催化下,对芳烃进行亲电取代生成芳酮的反应。
11、Hoesch反应(赫施):腈类化合物与氯化氢在Lewis 酸催化剂ZnCl2的存在下与烃基或烷氧基取代的芳烃进行反应可生成相应的酮亚胺,再经水解则羟基或烷氧基取代的芳香酮。
12、Gattemann反应(伽特曼反应):将羟基或烷氧基取代的芳烃在AlCl3、ZnCl2催化下与氰化氢及氯化氢反应生成牙胺盐酸盐,再经水解生成相应芳香醛的反应。
《药物合成反应(闻韧主编第三版)》人名反应整理(新)

《药物合成反应(闻韧主编第三版)》人名反应整理一、卤化反应1、Hunsdriecke反应(汉斯狄克反应):羧酸银盐和溴或碘反应,脱去二氧化碳,生成比原反应物少一个碳原子的卤代烃。
☆☆☆☆☆2、Sandmeyer反应(桑德迈尔反应):用氯化亚铜或溴化亚铜在相应的氢卤酸存在下,将芳香重氮盐转化成卤代芳烃。
☆☆3、Gattermann反应(加特曼反应):将Sandmeyer反应条件改为铜粉和氢卤酸。
☆☆4、Schiemann反应(席曼反应):将芳香重氮盐转化成不溶性的重氮氟硼酸盐或氟磷酸盐,或直接将芳胺用亚硝酸钠和氟硼酸进行重氮化,此重氮盐再经热分解(有时在氟化钠或铜盐存在下加热),就可以制得较好收率的氟代芳烃。
☆二、烃化反应5、Willamson合成(威廉姆森合成):醇在碱(钠、氢氧化钠、氢氧化钾等)存在下与卤代烃反应生成醚的反应。
☆☆☆☆6、Gabriel合成(盖布瑞尔合成):将氨先制备成邻苯二甲酰亚胺,利用氮上氢的酸性,先与氢氧化钾形成钾盐,然后与卤代烃作用,得N-烃基邻苯二甲酰亚胺,再经过肼解或酸水解即可得纯伯胺。
☆☆☆☆☆7、Delepine反应(德勒频反应):用卤代烃与环六亚甲基四胺(乌洛托品Methenamine)反应得季铵盐,然后水解即可得伯胺。
8、Leuckart-Wallach反应(鲁卡特-瓦拉赫反应):用甲酸及其铵盐可对醛酮进行还原烃化,得各类胺。
☆9、Ullmann反应(沃尔曼反应):卤代芳烃与芳香伯胺在铜或碘化铜及碳酸钾存在并加热的条件下可得二苯胺及其同系物。
三、酰化反应10、Friedel-Crafts反应(傅列德尔-克拉夫茨反应,也称傅-克酰基化反应):羧酸及羧酸衍生物在质子酸或Lewis酸的催化下,对芳烃进行亲电取代生成芳酮的反应。
☆☆☆☆☆11、Hoesch反应(赫施反应):腈类化合物与氯化氢在Lewis酸催化剂ZnCl2等的存在下与烃基或烷氧基取代的芳烃进行反应可生成相应的酮亚胺,再经水解则得到羟基或烷氧基取代的芳香酮。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
药物合成反应 闻韧 第三版课后习题答案全集
1
药物合成反应 闻韧 第三版
课后习题答案全集
药物合成反应 闻韧 第三版课后习题答案全集
2
药物合成反应 闻韧 第三版课后习题答案全集
3
药物合成反应 闻韧 第三版课后习题答案全集
4
药物合成反应 闻韧 第三版课后习题答案全集
5
药物合成反应 闻韧 第三版课后习题答案全集
6
药物合成反应 闻韧 第三版课后习题答案全集
7
药物合成反应 闻韧 第三版课后习题答案全集
8
药物合成反应 闻韧 第三版课后习题答案全集
9
药物合成反应 闻韧 第三版课后习题答案全集
10
药物合成反应 闻韧 第三版课后习题答案全集
11
药物合成反应 闻韧 第三版课后习题答案全集
12
药物合成反应 闻韧 第三版课后习题答案全集
13
药物合成反应 闻韧 第三版课后习题答案全集
14
药物合成反应 闻韧 第三版课后习题答案全集
15
药物合成反应 闻韧 第三版课后习题答案全集
16
第五章
第五章 重排反应
1、写出主要产物
药物合成反应 闻韧 第三版课后习题答案全集
17
药物合成反应 闻韧 第三版课后习题答案全集
18
2、填入必须的化学试剂和反应条件
药物合成反应 闻韧 第三版课后习题答案全集
19
药物合成反应 闻韧 第三版课后习题答案全集
20
药物合成反应 闻韧 第三版课后习题答案全集
21
药物合成反应 闻韧 第三版课后习题答案全集
22
药物合成反应 闻韧 第三版课后习题答案全集
23
药物合成反应 闻韧 第三版课后习题答案全集
24
第七章 答案
药物合成反应 闻韧 第三版课后习题答案全集
25
药物合成反应 闻韧 第三版课后习题答案全集
26
第八章
