有机重排反应及其在合成中的应用
化学反应中的重排反应机理

化学反应中的重排反应机理化学反应中的重排反应是指原子、原团或官能团的重排或重新排列,从而形成新的化学物质。
这种反应在有机合成、药物合成、环境科学等领域中具有重要的地位。
本文将介绍重排反应的机理,并以几个典型的例子进行详细讨论。
一、质子迁移(质子转移)重排反应质子迁移是重排反应中常见的一种类型。
它涉及质子的转移或移动,通过这种转移形成新的化学键。
质子的迁移可通过电子不足的反应物中的酸性氢原子作为质子的来源来实现。
质子的接受者可以是同一个分子中的其他原子或官能团,也可以是另一个分子。
例如,异戊烷的重排反应可以发生质子迁移,生成戊烯和正丁烷。
反应机理如下:[图示异戊烷重排反应机理]在该反应中,质子从二级碳原子转移到邻近的三级碳原子上,形成新的C-C键。
这种质子迁移反应被称为阻碍式重排反应,因为需要在中间生成一个碳阳离子。
二、脱水重排反应脱水重排反应是指通过脱水作用和质子转移来进行的重排反应。
在脱水重排反应中,水分子从反应物中脱离,同时质子转移发生,从而形成双键或环状化合物。
举例来说,醇的脱水重排反应可以生成烯烃。
在环境条件下,乙醇可以发生脱水重排反应,生成乙烯:[图示乙醇脱水重排反应机理]在此反应中,乙醇中的羟基(OH)与酸处理后的质子结合,形成良好的离去基。
接下来,质子从邻近的碳原子上转移,生成烯烃乙烯。
这种类型的重排反应被广泛应用于工业化学和有机合成中。
三、骨架重排反应骨架重排反应是指分子内骨架的重排或重新排列。
它可以导致分子碳骨架的移位或重组,生成具有不同结构和性质的化合物。
骨架重排反应在天然产物合成、药物合成和环境科学等领域都具有重要的应用。
一个典型的例子是丙二酸的骨架重排反应。
丙二酸在高温下可以发生分子内脱水酯化反应,生成丙烯酸:[图示丙二酸骨架重排反应机理]在该反应中,丙二酸中的羧基(COOH)首先发生脱水反应,生成酸中间体。
然后,质子转移导致骨架重排,生成丙烯酸。
总结化学反应中的重排反应机理是非常复杂的,涉及到质子迁移、脱水重排和骨架重排等不同类型的变化。
有机重排反应详尽总结
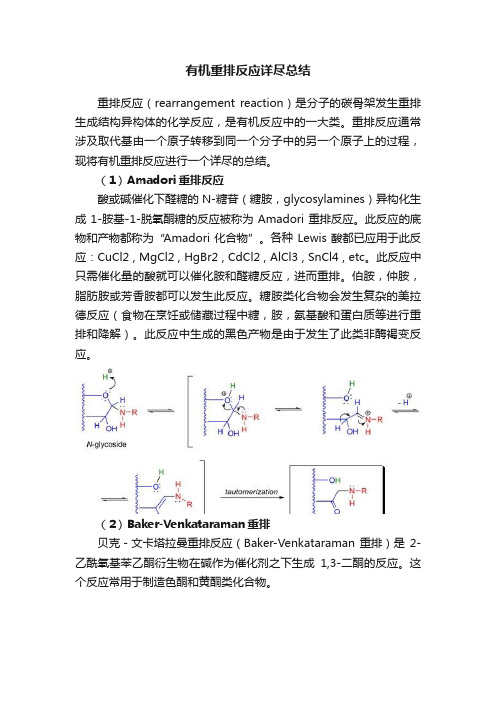
有机重排反应详尽总结重排反应(rearrangement reaction)是分子的碳骨架发生重排生成结构异构体的化学反应,是有机反应中的一大类。
重排反应通常涉及取代基由一个原子转移到同一个分子中的另一个原子上的过程,现将有机重排反应进行一个详尽的总结。
(1)Amadori重排反应酸或碱催化下醛糖的N-糖苷(糖胺,glycosylamines)异构化生成1-胺基-1-脱氧酮糖的反应被称为Amadori重排反应。
此反应的底物和产物都称为“Amadori化合物”。
各种Lewis酸都已应用于此反应:CuCl2 , MgCl2 , HgBr2 , CdCl2 , AlCl3 , SnCl4 , etc。
此反应中只需催化量的酸就可以催化胺和醛糖反应,进而重排。
伯胺,仲胺,脂肪胺或芳香胺都可以发生此反应。
糖胺类化合物会发生复杂的美拉德反应(食物在烹饪或储藏过程中糖,胺,氨基酸和蛋白质等进行重排和降解)。
此反应中生成的黑色产物是由于发生了此类非酶褐变反应。
(2)Baker-Venkataraman重排贝克-文卡塔拉曼重排反应(Baker-Venkataraman重排)是2-乙酰氧基苯乙酮衍生物在碱作为催化剂之下生成1,3-二酮的反应。
这个反应常用于制造色酮和黄酮类化合物。
(3)Bamberger RearrangementN-芳基羟胺在强酸水溶液作用下重排为氨基苯酚的反应。
(4)Beckmann Rearrangement贝克曼重排反应(Beckman rearrangement)指醛肟或酮肟在酸催化下生成N-取代酰胺的亲核重排反应,反应中起催化作用的酸常用五氯化磷。
此反应是由德国化学家恩斯特·奥托·贝克曼发现并由此得名。
(5)Brook RearrangementC-Si→O-Si的离子性重排反应,从羟基硅烷到硅醚的转化。
Brook 重排反应的推动力是产物中键能较高的 Si-O 键的生成。
第四章 重排反应

二、Pinacol重排反应 重排反应
若反应中形成正离子,除了上面的相应双键进行亲电加成外, 若反应中形成正离子 , 除了上面的相应双键进行亲电加成外 ,还 可以由迁移H原子、烃基、芳基或其它带有一对电子的基团而变得稳定。 可以由迁移 原子、烃基、芳基或其它带有一对电子的基团而变得稳定。 原子 当这些迁移进行十分顺利时,在合成上就有应用价值。 当这些迁移进行十分顺利时,在合成上就有应用价值。特别是与形成正 离子的相邻碳原子上带有羟基时, 离子的相邻碳原子上带有羟基时,由羟基转变为羰基化合物是一个有利 的重排方式。由酸催化邻二醇形成酮的反应,称为“ 重排。 的重排方式。由酸催化邻二醇形成酮的反应,称为“Pinacol”重排。 重排
O TFA, C6H6
O
∆
H 2400C
100% H
H
H 83%
2、Claisen 重排 、
其与Cope重排完全相似, 只不过将其中的一个 重排完全相似,只不过将其中的一个CH2 变为氧 。 在有 变为氧。 其与 重排完全相似 机合成中常用于构建一些难以合成的官能团,具有非常重要的应用价值。 机合成中常用于构建一些难以合成的官能团,具有非常重要的应用价值。
烯烃 异丁烯 苯乙烯
.CCl3 1.00 >19
:CBr2 1.00 0.4 3.2
Br2 1.00 0.6 1.9
环氧化反应 1.00 0.1 13.5
3-甲基 丁烯 0.17 甲基1-丁烯 甲基
一些与环状共轭体系相连的卡宾如环丙烯卡宾和环庚三烯卡宾, 一些与环状共轭体系相连的卡宾如环丙烯卡宾和环庚三烯卡宾,在 这些分子中,空的P轨道参与共轭体系 不显示明显的缺电子特征, 轨道参与共轭体系, 这些分子中,空的 轨道参与共轭体系,不显示明显的缺电子特征,实 际上是环丙烯正离子和卓鎓离子的共轭碱。 际上是环丙烯正离子和卓鎓离子的共轭碱。
wittig 重排

Wittig重排反应及其应用杨艳M090110104(上海工程技术大学服装学院)摘要:本文简单介绍[1,2]-Wittig重排反应和[2,3]-Wittig重排反应以及这两个反应的研究进展及应用。
关键词:[1,2]-Wittig重排 [2,3]-Wittig重排Wittig rearrangement of reaction and its applicationYang Yan M090110104(Institute of Clothing Technology,Shanghai University of Engineering and Science )Abstract:The paper simply introduces [1, 2] - Wittig rearrangement of reaction and [2,3] - Wittig rearrangement of reaction , and their research progress and application .Key words: [1, 2] - Wittig rearrangement [2,3] – Wittig rearrangement1. Wittig重排反应简介Wittig重排反应分为[1,2]-Wittig重排反应和[2,3]-Wittig重排反应,都所于σ重排反应,σ重排反应是由轨道对称性控制的周环反应的一种类型,它通过σ键及π电子的协同迁移重组而构建新的分子结构。
[1,2]-Wittig重排反应由Wittig (诺贝尔化学奖获得者)和Löhmann 于1942年首先报道,指醚类化合物在强碱(如有机锂试剂)作用下重排为烷氧基化合物。
图1-1[2,3]-Wittig重排是一种重要的合成复杂有机分子的重排反应。
借助辅助剂可以控制重排反应的速率和立体化学,指烯丙基醚用碱处理转化为高烯丙基醇,也称为Still-Wittig重排,发现1960年[1],但直到20世纪50年代,Still[2]和Nakai[3]建立了高立体选择性的反应体系,它在合成上的作用开始得体现。
克莱森重排反应机理

克莱森重排反应是有机化学中一种重要的反应类型,常用于合成芳香化合物。
本文将从反应机理的角度对克莱森重排反应进行详细介绍。
克莱森重排反应是指通过醛或酮与二酮或二醇在碱性条件下反应,生成α,β-不饱和酮的反应。
该反应通常在碱性条件下进行,碱的作用是使醛或酮发生亲核加成,生成一个稳定的醇醚中间体。
这个中间体经过质子转移和脱水反应,形成α,β-不饱和酮产物。
克莱森重排反应的机理可以分为三步。
首先,醛或酮与碱反应生成醇醚中间体。
这个中间体是通过醛或酮的羰基碳上的亲核加成形成的。
其次,醇醚中间体发生质子转移反应,质子从羰基碳上转移到相邻的碳上,形成一个稳定的碳阳离子中间体。
最后,碳阳离子中间体通过脱水反应,失去一个水分子,生成α,β-不饱和酮产物。
克莱森重排反应的机理中,质子转移是一个关键步骤。
质子转移的位置取决于碱的性质以及反应条件。
通常情况下,质子转移到离羰基碳最近的一个碳上,形成稳定的碳阳离子。
然而,在特殊情况下,质子转移也可能发生到离羰基碳更远的位置上。
克莱森重排反应的应用非常广泛。
它可以用于合成芳香化合物,尤其是那些具有α,β-不饱和酮结构的化合物。
这类化合物在药物合成和天然产物合成中具有重要的地位。
此外,克莱森重排反应还可以用于合成含有杂环结构的化合物,如吡咯、噻吩等。
总之,克莱森重排反应是一种重要的有机化学反应,通过醛或酮与二酮或二醇在碱性条件下反应,生成α,β-不饱和酮。
该反应的机理包括醛或酮的亲核加成、质子转移和脱水反应等步骤。
克莱森重排反应在有机合成中有广泛的应用,特别是在合成芳香化合物和含有杂环结构的化合物方面。
羟基反应中的重排

羟基反应中的重排羟基反应是有机化学中一类常见的反应类型,它涉及到羟基(OH)官能团的转化。
在羟基反应中,有时会发生重排现象,即分子内部的原子或官能团重新排列位置。
本文将详细介绍羟基反应中的重排现象,包括其定义、机理、分类以及实际应用。
一、定义在有机化学中,重排是指分子内部原子或官能团重新排列位置的过程。
在羟基反应中的重排现象,主要指在羟基(OH)官能团转化过程中,碳骨架发生重新排列。
二、机理羟基反应中的重排可以通过两种机理进行解释:1)质子迁移机理;2)电子迁移机理。
1. 质子迁移机理质子迁移是指质子(H+)从一个原子或官能团转移到另一个原子或官能团上的过程。
在羟基反应中的重排过程中,质子迁移起到了至关重要的作用。
一般而言,在质子迁移过程中,孤立对电子云较稳定且亲核性较大的位置会成为质子迁移的首选位置。
这通常是由相邻原子或官能团的电子密度分布决定的。
质子迁移过程中,碳骨架上的原子或官能团会重新排列,形成新的化学键。
2. 电子迁移机理除了质子迁移外,羟基反应中的重排还可以通过电子迁移机理进行解释。
在这种机理下,电子会从一个原子或官能团转移到另一个原子或官能团上,从而导致碳骨架重新排列。
与质子迁移类似,电子迁移也受到相邻原子或官能团的亲核性和稳定性影响。
通常情况下,在反应条件下,相对稳定且亲核性较大的位置会成为电子迁移的首选位置。
三、分类羟基反应中的重排可以按照不同的标准进行分类。
以下是几种常见分类方法:1. 酯酸转化重排酯酸转化重排是指在酯酸转化为其衍生物(如醇、醚等)过程中发生的重排现象。
在这类反应中,羟基所处位置的改变会导致碳骨架的重排。
2. 羟基脱水重排羟基脱水重排是指在羟基脱水反应中,由于质子迁移或电子迁移,羟基所处位置发生改变,导致碳骨架的重新排列。
3. 羧酸转化重排羧酸转化重排是指在羧酸转化为其衍生物(如醛、酮等)过程中发生的重排现象。
在这类反应中,羟基所处位置的改变会引起碳骨架的重新排列。
有机重排反应总结
有机化学中重排反应有机化学中重排反应很早就被人们发现,研究并加以利用。
第一次被Wohler发现的,由无机化合物合成有机化合物,从而掀开有机化学神秘面纱的反应—加热氰酸铵而得到尿素,今天也被化学家归入重排反应的范畴。
一般地,在进攻试剂作用或者介质的影响下,有机分子发生原子或原子团的转移和电子云密度重新分布,或者重键位置改变,环的扩大或缩小,碳架发生了改变,等等,这样的反应称为是重排反应。
按照反应的机理,重排反应通常可分为亲核反应、亲电反应、自由基反应和周环反应四大类。
也有按照不同的标准,分成分子内重排和分子间重排,光学活性改变和不改变的重排反应,等等。
一、亲核重排重排反应中以亲核重排为最多,而亲核重排中又以1,2重排为最常见。
(一)亲核1,2重排的一般规律1.亲核1,2重排的三个步骤:离去基团离去,1,2基团迁移,亲核试剂进攻2.发生亲核1,2重排的条件(1)转变成更稳定的正离子(在非环系统中,有时也从较稳定的离子重排成较不稳定的离子)(2)转变成稳定的中性化合物(3)减小基团间的拥挤程度,减小环的张力等立体因素。
(4)进行重排的立体化学条件:带正电荷碳的空p轨道和相邻的C-Z键以及α碳和β碳应共平面或接近共平面(5)重排产物在产物中所占的比例不仅和正电荷的结果有关,而且和反应介质中存在的亲核试剂的亲核能力有关3.迁移基团的迁移能力(1)多由试验方法来确定基团的固有迁移能力(2)与迁移后正离子的稳定性有关(3)邻位协助作用(4)立体因素4.亲核1,2重排的立体化学:(1)迁移基:构象基本保持,没有发现过构型反转,有时有部分消旋(2)迁移终点:取决于离去及离去和迁移基进行迁移的相对时机5.记忆效应:后一次重排好像和第一次重排有关,中间体似乎记住了前一次重排过程(二) 亲核重排主要包括基团向碳正离子迁移,基团向羰基碳原子迁移,基团向碳烯碳原子迁移,基团向缺电子氮原子转移,基团向缺电氧原子的迁移,芳香族亲核重排,下面就这六种迁移作简要介绍:1.基团向碳正离子迁移:(1)Wagner-Meerwein重排:烃基或氢的1,2移位,于是醇重排成烯(2)片那醇重排:邻二醇在酸催化下会重排成醛和酮(3)Demyanov重排,Tiffeneau-Demyanov扩环以及有关反应(4)二烯酮-酚重排:4,4-二取代环己二烯酮经酸处理重排成3,4-二取代酚的反应(5)醛酮同系物的合成:醛或酮和重氮甲烷作用生成高一级的同系物(6)烯丙基重排:烯丙基系统中双键发生位移的反应2.基团向羰基碳原子迁移:(1) Benzil-Benzilic Acid重排:α-二酮经强碱处理会发生重排,生成α-羟基乙酸盐(2) 酸催化下醛酮的重排:在烃基的交换后,醛重排成酮,酮则重排成另一种酮3.基团向碳烯碳原子迁移:(1) Arndt-Eistert合成和Wolff重排:由羧酸经酰卤,重氮酮合成高一级同系物的方法(2) 其他的碳烯重排反应,主要是1,2氢迁移生成烯4.基团向缺电子氮原子转移:(1)Beckmann重排:醛肟或酮肟重排成酰胺(2)Hoffmann重排:氮上无取代基酰胺经溴及碱处理,脱羰生成伯胺(3)Curtius重排:酰基叠氮热分解生成异氰酸酯(4)Schmidt重排:酸、醛和酮在酸催化下和叠氮酸反应,生成胺、酰胺等的反应(5)Lossen重排:异羟肟酸及O-酰基衍生物经类似Hoffmann的重排生成少一个碳的胺(6)Neber重排:肟酮的磺酸酯在乙醇钾处理后水解生成α-氨基酮5.基团向缺电氧原子的迁移:(1)氢过氧化物的重排:氢过氧化物在酸催化下,O-O键断裂,同时烃基从碳原子迁移到氧原子上(2)Baeyer-Villiger重排:酮在酸催化下与过酸作用,在分子中插入氧生成酯的反应6.芳香族亲核重排:(1)芳羟胺重排(Bamberger重排):经硫酸处理重排成氨基酚(2)Sommelet-Hauser重排:苄基季胺盐经氨基钠等强碱处理重排成邻位取代的苄基叔胺二、自由基重排反应1.1,2迁移:比正离子重排反应少得多,主要发生在:(1)某些双自由基的1,2-烷基和氢(2)烯基(迁移的乙烯基若是环的一部分,则发生重排)2.非1,2迁移:多发生1,5迁移3.Barton反应:处于羟基δ位上的甲基氧化成醛基的反应4.Hofmann-loffler-freytag反应:质子化N-卤化胺经热分解或光解形成六氢吡啶等的反应。
二苯羟乙酸重排反应机理
二苯羟乙酸重排反应机理二苯羟乙酸重排反应是有机化学中一个重要的反应过程,它可以在不同的环境下进行。
作为一种酚重排反应,它在有机合成中具有广泛的应用。
本文将深入探讨二苯羟乙酸重排反应的机理,并对其应用进行综述。
1. 二苯羟乙酸的结构与性质二苯羟乙酸是一种具有两个苯环的羧酸类化合物。
由于羧基的存在,二苯羟乙酸具有酸性和电子吸引性。
苯环的存在使得二苯羟乙酸具有芳香性和稳定性。
这些结构与性质决定了二苯羟乙酸在反应中的特殊性质。
2. 二苯羟乙酸重排反应机理二苯羟乙酸重排反应是一个复杂的反应过程,包括多个步骤和中间产物。
在碱性条件下,首先发生负离子交换反应,将羧基转化为羧酸负离子。
接下来,负离子会发生亲核加成反应,使得负离子与另一个苯环发生碳碳键的形成。
这一步骤通常被称为酯化反应。
通过质子化,形成苯环上一个氧原子的去负离子,得到二苯酯的产物。
整个反应过程中,酸碱中性和芳香性是反应进行的关键因素。
3. 二苯羟乙酸重排反应的应用二苯羟乙酸重排反应在有机合成中具有广泛的应用。
它可以用于合成对称二苯酯化合物。
二苯羟乙酸重排反应还可以合成多种其他有机化合物,如酚酯、酚酮等。
通过选择合适的底物和反应条件,可以实现一系列不同的有机合成目标。
4. 个人观点与理解对于二苯羟乙酸重排反应的机理及其应用,我认为深入了解反应过程和其背后的化学原理非常重要。
只有理解了机理,才能从理论上指导实际的合成工作。
对于反应机理的理解也可以帮助我们预测反应的产物及其可能的副产物,进一步优化反应条件。
我还认为二苯羟乙酸重排反应的应用潜力很大,未来可能会有更多的应用领域被发现。
二苯羟乙酸重排反应是一种重要的有机反应,通过负离子交换、亲核加成和质子化等步骤实现。
该反应具有广泛的应用领域,可用于合成多种有机化合物。
在实际应用中,深入理解其机理对于指导合成工作至关重要。
我对于该反应的个人观点是,进一步研究和探索其机理及应用潜力,有助于拓宽有机化学的发展空间。
碳正离子参与的重排反应和串联反应及其应用实例
碳正离子参与的重排反应和串联反应及其应用实例吴昊哲【摘要】碳正离子作为活性中间体在有机反应中有着极其重要的作用.认识碳正离子有助于对复杂有机反应原理和本质的理解.近年来,碳正离子在有机合成中的应用越来越广泛,尤其是碳正离子参与的串联反应,大大提高了有机合成的效率.本文着重介绍了由碳正离子作为中间体参加的重排反应和串联反应,并通过实例介绍其应用.【期刊名称】《化工中间体》【年(卷),期】2017(000)009【总页数】2页(P109-110)【关键词】碳正离子;有机合成;重排反应;串联反应【作者】吴昊哲【作者单位】辽宁师范大学附属中学辽宁 116000【正文语种】中文【中图分类】O1.碳正离子作为中间体的重排反应(1)Wagner-Meerwein反应Wagner-Meerwein是醇失水反应过程中,生成的中间体碳正离子发生1,2-重排,伴随有烷基或芳基等基团迁移的一类反应。
重排后的碳正离子既可以发生消除反应生成烯,也可以被羟基负离子或卤素负离子等亲核试剂捕获,形成新的醇或新的卤化物等,具体如下图所示。
由于碳正离子的性质,Wagner-Meerwein重排一般得到多种混合产物,碳正离子一旦形生,多个官能团均能够发生迁移,所以存在很多竞争反应,因此很难得到单一的重排产物,产率往往较低,而产物相对复杂,使Wagner-Meerwein重排在天然产物合成中较难更好应用。
(2)Demyannov重排Demyannov重排是指脂肪族伯胺或脂环族的伯胺经过重氮化作用行成碳正离子进行重排的反应。
反应过程与Wagner-Meerwein反应相类似。
(3)Pinacol和Semipinacol反应Pinacol反应是邻二醇在酸催化下发生分子内重排脱水而生成羰基化合物的反应。
Pinacol反应过程中,首先邻二醇质子化并失水形成碳正离子,之后发生1,2—迁移从而形成更加稳定的碳正离子,由于在此正碳原子上连有另一个氧原子,其未共用电子对能提供正碳原子所需要的电子而成为质子化的酮。
片呐醇重排完成反应题
片呐醇重排完成反应题一、引言1.1 任务描述本文将深入探讨片呐醇重排完成反应题,包括反应机制、影响因素、应用领域以及实验方法等内容。
1.2 背景知识片呐醇重排反应是有机化学中一种重要的反应,通过醇的内部质子迁移,在碱存在下发生C-C键重排。
该反应是合成有机化合物的重要手段之一,具有广泛的应用价值。
二、反应机制片呐醇重排反应的机理包括以下步骤:2.1 酸碱反应首先,醇通过与碱反应,质子被转移至邻近的官能团上,如羰基或烯烃等。
这一步骤是整个反应的关键步骤。
2.2 质子迁移随后,在质子迁移的作用下,质子从邻近的官能团上迁移到碳骨架上,形成稳定的碳正离子中间体。
2.3 重排碳正离子中间体在碱的存在下进行重排,使得原来的醇分子结构发生改变,生成新的有机化合物。
三、影响因素影响片呐醇重排反应的因素有多个,以下是其中几个重要的因素:3.1 碱的选择碱的选择对反应的速度和选择性有着重要影响。
常用的碱包括碳酸钠、钠甲醇等。
不同的碱对反应的影响不同,需要根据具体反应进行选择。
3.2 温度温度是控制反应速率的重要因素。
较高的温度有助于提高反应速率,但过高的温度也可能导致副反应的发生。
3.3 溶剂的选择溶剂的选择对反应速率和产率都有一定影响。
常用的溶剂有乙醇、氯仿等。
要根据反应物的性质和反应条件选择合适的溶剂。
3.4 反应时间反应时间也是影响反应结果的重要因素。
过短的反应时间可能导致反应不完全,而过长的反应时间可能导致副反应的发生。
四、应用领域片呐醇重排反应在有机合成中具有广泛的应用。
以下是几个常见的应用领域:4.1 药物合成片呐醇重排反应可以用于合成各类药物的中间体或活性分子,是药物化学领域中不可或缺的合成方法之一。
4.2 天然产物合成许多天然产物都包含片呐醇结构,通过片呐醇重排反应,可以合成与天然产物类似的化合物,有助于天然产物的合成和研究。
4.3 高分子合成片呐醇重排反应可以用于高分子材料的合成,具有调控分子结构和改善材料性能的作用。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
本科生毕业论文(设计) 题目: 有机重排反应及其在合成中的应用
系 部 化学化工系 学科门类 化学 专 业 化学 学 号 0809111059 姓 名 朱林 指导教师 汪晓波
2011年 11 月 15 日
装 订 合肥师范学院2011届本科生毕业论文(设计) 合肥师范学院本科生毕业论文(设计)任务书 (指导教师用表)
学 生 姓 名 指 导 教 师 论文(设计)题目
主要研 究内容
研究方法 主要任务及目标
主要参 考文献
进度安排 论文(设计)各阶段名称 日期
注:本表一式两份,学生、系部各存档一份。 指导教师签字: 教研室指导小组组长签字: 系部领导小组组长签字:
装 订 合肥师范学院2011届本科生毕业论文(设计) 合肥师范学院本科生毕业论文(设计)开题报告 (学生用表)
课题 有机化学重排反应及其在合成中的应用 系部 化学化工系 专业 化学(非师范) 学科 化学 学生 朱林 指导教师 汪晓波
装 订 合肥师范学院2011届本科生毕业论文(设计) 一、课题的来源及意义 有些有机化学反应,在试剂或介质等的影响下,或发生重键位置的移动或发生官能团的转移,或发生扩环、缩环作用,或发生基本碳骼的改变等等,这些反应的过程谓分子重排(Molecular Rearrangement)。分子重排反应是一类十分重要的反应,对它的研究和实践丰富了有机化学结构理论的内容,加深了人们对该类反应的规律性的认识。分子重排又是合成有机化合物的重要手段之一,许多重要的有机化合物可以由其得以合成,因而对它的研究有力地推动着有机合成化学的发展。正是基于这点,本课题将对分子重排做一系统地论述,并对它在有机合成中的应用进行探讨。 二、研究目标
总结各种分子重排,探究其重排反应机理,利用逆合成分析法将分子重排运用于合成路线设计之中,合成各种很难或者不能直接合成的物质。依据重排原理判断物质的稳定性,预测反应产物,提高产物收率。探究重排反应在新型分子、合成新型材料、新型药物、天然药物等研究领域里的具体应用。 三、研究内容 按照反应的机理,讨论重排反应类型:亲核反应、亲电反应、自由基反应和周环反应四大类。同时也按照分子内重排和分子间重排,光学活性改变和不改变的重排反应,分类进行探究。 一、亲核重排 1.亲核重排步骤:离去基团离去,1,2基团迁移 2.发生亲核1,2重排的条件 (1)转变成更稳定的正离子 (2)转变成稳定的中性化合物 (3)减小基团间的拥挤程度,减小环的张力等立体因素。 3.迁移基团的迁移能力 (1)多由试验方法来确定基团的固有迁移能力 (2)与迁移后正离子的稳定性有关 (3)邻位协助作用 (4)立体因素 合肥师范学院2011届本科生毕业论文(设计) 4.亲核1,2重排的立体化学: 迁移基:构象基本保持,有时有部分消旋 5.亲核重排主要包括基团向碳正离子迁移,基团向羰基碳原子迁移,基团向碳烯碳 原子迁移,基团向缺电子氮原子转移,基团向缺电氧原子的迁移,芳香族亲核重 排,具体将涉及: Wagner-Meerwein重排、频哪醇重排、烯丙基重排、酸催化下醛酮的重排、碳烯重排反应、Beckmann重排、Hoffmann重排、 Schmidt重排、Baeyer-Villiger重排、芳香族亲核重排等 二、亲电重排 1.Wittig重排 2.Fries重排 3.芳醚重排 三、自由基重排反应 1.1,2迁移 (1)某些双自由基的1,2-烷基和氢 (2)烯基(迁移的乙烯基若是环的一部分,则发生重排) 2.非1,2迁移:多发生1,5迁移 四、周环反应中的重排反应 1.电环反应 2.σ键迁移反应 3.Cope重排 4.Claisen重排 四、研究方法
在查阅文献的基础上,利用分子重排的原理探讨各种反应机理和条件,对合成各种药物、材料、试剂等进行分析、归纳、总结,以探究重排反应在合成中应用的规律。 五、进度安排
1、2011年11月:完成相关文献的初步查找工作,编写论文开题报告; 2、2012年1月中旬;完成课题的框架性整理与归纳,编写论文中期报告; 3、2011年2,3,4月;进行论文相关举证及论文撰写工作并提交论文初稿。 4、2011年5月份:提交论文最后定稿,准备论文答辩的ppt材料,整理论文准备答辩问题;进行论文正式答辩。 六、参考文献 1、王玉炉.《有机合成化学》,科学出版社,2005年第一版 2、曾昭琼.《有机化学》,高等教育出版社,1991年第三版 合肥师范学院2011届本科生毕业论文(设计) 3、杜汝励.《分子重排反应》,北京:人民教育出版社,1981 4、邢其毅.徐瑞秋,周政.《基础有机化学(下册)》,北京:高等教育出版社,1984 5、胡宏纹.《有机化学(下册)》,北京:高等教育出版社,1992 6、屠树江,荣良策,高原等.《有机化学》,2002 7、李经伟,徐利文,夏春谷.《有机化学》,2004 8、卖凯R K,史密斯D M.《有机合成指南》,科学出版社,1998 9、徐家业.《有机合成化学及近代技术》,西安,西北工业大学出版社,1997 10、顾可权,林吉文.《有机合成化学》,上海,上海科学技术出版社,1987
选题是否合适: 是 否 课题能否实现: 能 不能 指导教师(签字) 年 月 日 选题是否合适: 是 否 课题能否实现: 能 不能 指导小组组长(签字)
年 月 日 注:本表不够可增加空白页。 合肥师范学院2011届本科生毕业论文(设计) 题目 (居中三号黑体) 摘 要
(“摘要”之间空两格,居中三号黑体,与内容空一行) (小四号宋体)中文摘要及关键词:“摘要”二字采用三号字黑体、居中书写,“摘”与“要”之间空两格,内容采用小四号宋体。要有高度的概括力,语言精练、明确。同时有中、英文对照,中文摘要约300—400汉字;英文摘要约200—300个实词。
关键词:×××××□□×××××□□×××××□□××××
小四号宋体,3—5个,各关键词间空一格 顶格、小四号黑体
(“关键词”三字采用小四号字黑体,顶格书写,一般为3—5个。从论文标题或正文中挑选3~5个最能表达主要内容的词作为关键词) 装
订 合肥师范学院2011届本科生毕业论文(设计) ABSTRACT (另起一页,居中三号Times New Roman加黑,与内容空一行) (空两格,英文摘要应与中文摘要相对应,字体为小四号Times New Roman。)
Key words: 合肥师范学院2011届本科生毕业论文(设计) 目 录 (另起一页,“目录”两字中间空两格,居中三号黑体、与正文空一行) 一☆☆☆(空两格、小三号宋体)„„„„„„„„„„„„„× 1.1☆☆☆☆(四号宋体)„„„„„„„„„„„„„„„„„„× 1.2☆☆☆☆„„„„„„„„„„„„„„„„„„„„„„„„× „„„„„„ 参考文献(小三号宋体)„„„„„„„„„„„„„„„„× 附录(小三号宋体)„„„„„„„„„„„„„„„„„„× (目录中行距多倍行距,设置值为1.25倍,目录不标页码)
装 订 合肥师范学院2011届本科生毕业论文(设计)
1 一 前言(另起一页、居中小三号黑体) 1.1 第二层次题序和标题(顶格、四号黑体) 1.1.1 第三层次及以下题序和标题(顶格、四号黑体) (正文用小四号宋体。第一层次题序和标题用小三号黑体字;第二层次题序和标题用四号黑体字;第三层次及以下题序和标题与第二层次同;正文用小四号宋体。毕业论文各页均加页眉,采用宋体五号宋体居中,打印“合肥师范学院XXXX届本科生毕业论文(设计)”[1]。页码从正文开始在页脚按阿拉伯数字(宋体小五号)连续编排,居中书写。
正文的全部标题层次应整齐清晰,相同的层次应采用统一的字体表示。论文中的章、节、条、款各级标题:论文正文中各标题要突出重点、简明扼要,不得使用标点符号。标题中尽量不采用英文缩写词,对必须采用者,应使用本学科的通用缩写词。理科按“1、1.1、1.1.1、1.1.1.1” 安排段落标题编号,文科按“一、(一)1、(1)①”安排段落标题编号。论文正文的层次应根据实际需要而定。) 合肥师范学院2011届本科生毕业论文(设计)
2 二 实验(另起一页、居中小三号黑体) 2.1 实验药品(顶格、四号黑体) 正文(空两格、小四号宋体)
2.2 实验仪器(顶格、四号黑体) 正文(空两格、小四号宋体)
2.3 实验步骤(顶格、四号黑体) 正文(空两格、小四号宋体)
2.4 测试表征(顶格、四号黑体) 正文(空两格、小四号宋体) 合肥师范学院2011届本科生毕业论文(设计)
3 三 结果与讨论(另起一页、居中小三号黑体) 正文(空两格、小四号宋体)
图1-2□□×××试验中心组织结构图 表2-3□□☆☆☆ ××× ××× ××× ×××
××× ××× (宋体五号,水平、垂直居中) ××× ××× ××× ×××
宋体五号,居中,位于表上表与正文空一行 装
订
宋体五号居中,位于图下 图与下文空一行
实验中心 计算机部 物理学部 化学学部 多媒体实验室 网络实验室 无机化学
