化学上册必背知识点(精华)
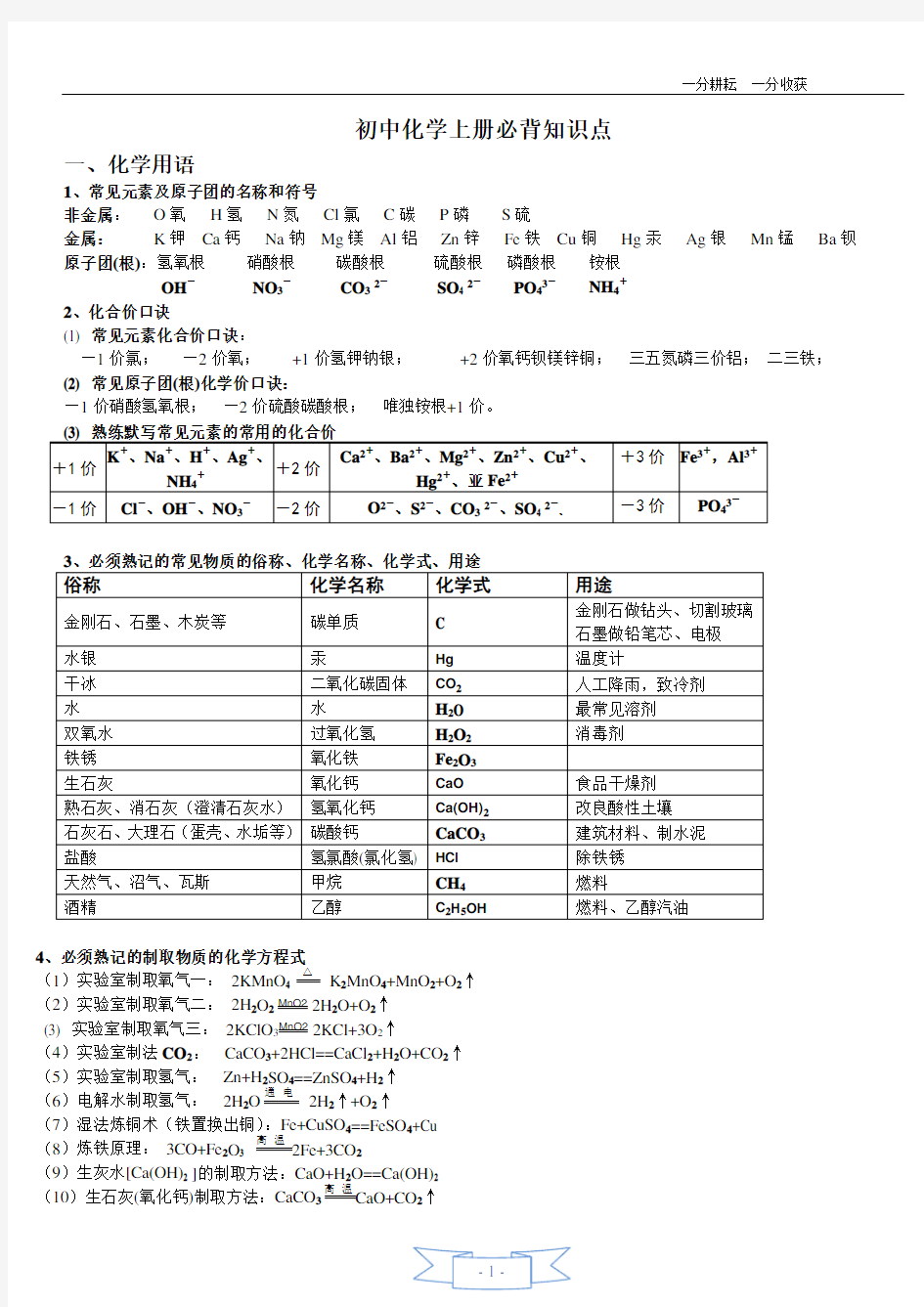

初中化学上册必背知识点
一、化学用语
1、常见元素及原子团的名称和符号
非金属:O氧H氢N氮Cl氯C碳P磷S硫
金属:K钾Ca钙Na钠Mg镁Al铝Zn锌Fe铁Cu铜Hg汞Ag银Mn锰Ba钡原子团(根):氢氧根硝酸根碳酸根硫酸根磷酸根铵根
OH-NO3-CO32-SO4 2-PO43-NH4+
2、化合价口诀
(1) 常见元素化合价口诀:
—1价氯;—2价氧;+1价氢钾钠银;+2价氧钙钡镁锌铜;三五氮磷三价铝;二三铁;
(2) 常见原子团(根)化学价口诀:
—1价硝酸氢氧根;—2价硫酸碳酸根;唯独铵根+1价。
4、必须熟记的制取物质的化学方程式
(1)实验室制取氧气一:2KMnO K2MnO4+MnO2+O2↑
(2)实验室制取氧气二:2H2O2MnO22H2O+O2↑
(3) 实验室制取氧气三:2KClO3MnO22KCl+3O2↑
(4)实验室制法CO2:CaCO3+2HCl==CaCl2+H2O+CO2↑
(5)实验室制取氢气:Zn+H2SO4==ZnSO4+H2↑
(6)电解水制取氢气:2H2O2H2↑+O2↑
(7)湿法炼铜术(铁置换出铜):Fe+CuSO4==FeSO4+Cu
(8)炼铁原理:3CO+Fe2O3 高温2Fe+3CO2
(9)生灰水[Ca(OH)2 ]的制取方法:CaO+H2O==Ca(OH)2
(10)生石灰(氧化钙)制取方法:CaCO3高温CaO+CO2↑
二.金属活动性顺序:
金属活动性由强至弱:K Ca Na Mg Al ,Zn Fe Sn Pb (H) ,Cu Hg Ag Pt Au。(按5个一句顺序背诵)钾钙钠镁铝,锌铁锡铅(氢),铜汞银铂金。
三、常见物质的颜色、状态
1、白色固体:MgO、P2O5、CaO、NaOH、Ca(OH)
2、KClO
3、KCl、Na2CO3、NaCl、无水CuSO4;
铁、镁为银白色(汞为银白色液态),除了有颜色的固体,其他固体一般为白色。
2、黑色固体:炭粉、铁粉、CuO、MnO2、Fe3O4▲KMnO4为紫黑色
3、红色固体:Cu、Fe2O3、HgO、红磷▲硫磺:淡黄色
4、溶液的颜色:
含Cu2+的溶液呈蓝色(如CuSO4溶液);含Fe2+的溶液呈浅绿色(如FeCl2溶液);
含Fe3+的溶液呈黄色(如FeCl3溶液),其余溶液一般为无色。(高锰酸钾溶液为紫红色)
5、(1)具有刺激性气体的气体:NH3(氨气)、SO2、HCl(皆为无色)
(2)无色无味的气体:O2、H2、N2、CO2、CH4、CO(剧毒)、空气、稀有气体
▲注意:具有刺激性气味的液体:盐酸、硝酸、醋酸(即醋);氨水;酒精为有特殊气体的液体。
6、有毒的:气体:CO ;
四、一些物质的特性及用途:
可燃性的气体:H2、CO、CH4 (甲烷) 都可做燃料,点燃前都要验纯,与空气混合点燃会爆炸。
还原性的物质:C、H2、CO 都可用来冶炼金属,将金属氧化物还原成金属单质。
具有氧化性的物质:O2、CO2
助燃性物质:O2 能使带火星木条复燃,或使燃着木条燃烧更旺。
有毒的气体:CO,能与血红蛋白结合使人中毒,煤气中毒就是指CO中毒。
使澄清石灰水变浑浊气体:只有CO2
最轻气体:H2也是唯一燃烧无污染的气体燃料
干冰(CO2固体):用于人工降雨,致冷剂;CO2气体:用于灭火,做温室肥料,制汽水等
盐酸(HCl):用于除铁锈,是胃酸的主要成份,浓盐酸有挥发性(挥发出HCl气体)
石灰石(CaCO3):建筑材料,制水泥、高温煅烧制CaO;
生石灰CaO:易与水反应并放热,做食品干燥剂,可用来制取Ca(OH)2。
熟石灰Ca(OH)2:用于改良酸性土壤,配制波尔多液,与Na2CO3反应制取NaOH
五、化学与社会相关常识。
空气中主要的气体体积分数:氮气78%,氧气21%。
不同元素的本质区别:质子数不同。影响元素的化学性质:最外层电子数。
催化剂:能改变反应速率,本身的质量和化学性质不变(一变二不变)
硬水和软水的鉴别:肥皂水。硬水的软化:煮沸、蒸馏。
三大化石燃料:煤(固)、石油(液)、天然气(气)
铁生锈条件:铁同时与空气(主要是O2)和水接触
防锈方法是:保持铁制品表面干燥和洁净,并在金属表面形成保护膜(涂油漆、涂油、镀其它金属等)。
生铁和钢的性能不同:是因为含碳量不同,生铁2%—4.3%,钢0.03%—2%。
可燃物燃烧条件:⑴是可燃物;⑵与空气(或O2)接触⑶温度达到可燃物着火点
灭火的方法:⑴隔离可燃物,如建立隔离带、釜底抽薪;⑵隔绝空气(或O2),
如用湿布、灯帽、土盖灭火焰,用CO2灭火⑶降低温度至可燃物着火点以下,如用水灭火。环境污染名词:
酸雨:主要由SO2、NO2造成,酸雨危害是使河流、土壤酸化,建筑物、金属被腐蚀。
臭氧层空洞:臭氧能吸收紫外线,由于臭氧被氟里昂等破坏而形成
温室效应:空气中CO2排放过多引起全球气温上升
白色污染:塑料随意丢弃,不易被降解而造成的污染。
空气质量日报:污染物主要指标是:总悬浮颗粒、SO2、氮氧化物(如NO2)
六、基本反应类型
化合反应:A+B→AB多变一例:C+ O CO2 CaO+H2O===Ca(OH)2
分解反应:AB→A+B一变多例:2H2O通电2H2↑+O2↑H2CO3==CO2↑+ H2O
置换反应:A+BC→AC+B 一换一例:Fe+CuSO4==FeSO4+Cu H2+CuO Cu+ H2O
七、化学之最
1、地壳中含量最多的金属元素是铝(Al)。
2、地壳中含量最多的非金属元素是氧元素(O)。
3、空气中含量最多的物质是氮气(N2)。
4、天然存在最硬的物质是金刚石(C)。
5、最简单的有机物是甲烷(CH4)。
6、人体含量最多的金属元素是钙元素(Ca)。
7、相对分子质量最小的氧化物是水(H2O)8、相同条件下密度最小的气体是氢气(H2)。
9、导电性最强的金属是银(Ag)。10、相对原子质量最小的原子是氢(H)。
11、熔点最低的金属是汞(Hg)。12、地壳中、人体中、海水中含量最多的元素为氧元素(O)。
13、组成化合物种类最多的元素是碳元素(C)。14、日常生活中应用最广泛的金属是铁(Fe)。
八、气体的鉴别
(1)O2与其它任何一种气体:用带火星的木条鉴别,能复燃的是O2
(2)CO2与其它任何一种气体:用澄清石灰水鉴别,能使石灰水变浑浊的是CO2
(3)空气、O2、CO2、N2、H2等多种气体:先用燃着的木条,再用澄清石灰水鉴别
(4)H2、CO、CH4三种可燃性气体:先点燃在火焰上罩干冷烧杯,后往烧杯中倒少许澄清石灰水鉴别。
九、物质的除杂:(括号内是杂质)
1、CO(CO2):通过NaOH溶液吸收掉CO2气体方程式为:CO2+2NaOH=Na2CO3+H2O
2、CO2(CO):通过灼热的CuO除去CO气体(也可除去氢气)方程式为:CO+CuO △Cu+CO2
3、CO2(O2):通过灼热的铜网除去O2气体方程式为:2Cu+O22CuO
4、Cu(Fe):加入足量CuSO4溶液。方程式为:Fe+CuSO4=Cu+FeSO4
5、KCl(MnO2):先溶解,后过滤,再蒸发。(凡两种固体一种可溶,一种难溶均可用该法除杂)
6、CaO(CaCO3):高温煅烧方程式为:CaCO CaO+CO2↑
十、初中化学中的“三”
1、构成物质的三种微粒是:分子、原子、离子。
2、还原氧化铜常用的三种还原剂:氢气、一氧化碳、碳。
3、氢气作为燃料有三大优点:资源丰富、发热量高、燃烧后的产物是水不污染环境。
4、构成原子一般有三种微粒:质子、中子、电子。
5、收集气体一般有三种方法:排水法、向上排空法、向下排空法。
6、CO2可以灭火的原因有三个:不能燃烧、不能支持燃烧、密度比空气大。
7、当今世界上最重要的三大矿物燃料是:煤、石油、天然气。
8、氢气和碳单质有三个相似的化学性质:常温下的稳定性、可燃性、还原性。
9、过滤操作中有“三靠”:(1)漏斗下端紧靠烧杯内壁;(2)玻璃棒的末端轻靠在滤纸三层处;
(3)盛待过滤液的烧杯边缘紧靠在玻璃捧引流。
过滤失败的三个原因:(1)滤纸被捅破;(2)滤液高于滤纸边缘;(3)承接容器不干净。
10、三大气体污染物:SO2、CO、NO2
11、酒精灯的火焰分为三部分:外焰、内焰、焰心,其中外焰温度最高。
12、取用药品“三不”原则:(1)不用手接触药品(2)不把鼻子凑到容器口闻气体气味(3)不尝药品的味道。
13、可以直接加热的三种仪器:试管、坩埚、蒸发皿(另外还有燃烧匙)
14、质量守恒解释的原子三不变:原子种类不改变、数目不增减、质量不变化
15、原子中的三等式:核电荷数=质子数=核外电子数=原子序数
装置气密性检查:(1) 利用热胀冷缩:将导气管浸入水中,用手紧握试管,若管口有气泡冒出,则装置气密性好。
(2) 利用气压的原理:先在锥形瓶内加入水,使长颈漏斗下端液封,关闭止水夹,再往长颈漏斗中加水至
形成一段水柱为止,静置,水柱高度不变,则装置不漏气。
十一:初中化学上必备化学反应方程式:
(一)化合反应
1、木炭在氧气中燃烧:C+O2点燃CO2
2、硫在氧气中燃烧:S+O SO2
3、镁在空气中燃烧:2Mg+O2MgO
4、铁在氧气中燃烧:3Fe+2O Fe3O4
5、磷在氧气中燃烧:4P+5O2点燃2P2O5
6、铜在空气中加热:2Cu+O2△2CuO
7、氢气在氧气中燃烧:2H2+O2H2O
8、一氧化碳在空气中燃烧:2CO+O2CO2
9、碳不充分燃烧:2C+O2(不充分)点燃2CO
10、二氧化碳通过灼热的碳层:CO2+C2CO
11、二氧化碳与水反应:CO2+H2O=H2CO3
12、生石灰和水化合:CaO+H2O=Ca(OH)2
(二)分解反应:
13、氯酸钾与二氧化锰共热(实验室制O2):2KClO3MnO22KCl+3O2↑
14、加热高锰酸钾:2KMnO K2MnO4+MnO2+O2↑
15、分解过氧化氢制取氧气:2H2O2MnO22H2O+O2↑
16、电解水:2H2O2H2↑+O2↑
17、碳酸不稳定分解:H2CO3=H2O+CO2↑
18、高温煅烧石灰石:CaCO CaO+CO2↑
(三)置换反应
19、锌和稀硫酸反应(实验室制H2):Zn+H2SO4=ZnSO4+H2↑
20、锌和盐酸的反应:Zn+2HCl=ZnCl2+H2↑
21、铁和盐酸:Fe+2HCl=FeCl2+H2↑
22、铁和稀硫酸:Fe+H2SO4=FeSO4+H2↑
23、铝和稀硫酸:2Al+3H2SO4=Al2(SO4)3+3H2↑
24、氢气还原氧化铜:H2+CuO△Cu+H2O
25、木炭还原氧化铜:C+2CuO2Cu+CO2↑
26、碳还原氧化铁:3C+2Fe2O=4Fe+3CO2↑
27、氢气还原氧化铁:3H2+Fe2O32Fe+2H2O
28、铁和硫酸铜溶液:Fe+CuSO4=Cu+FeSO4
29、铜和硝酸汞溶液:Cu+2AgNO3=2Ag+Cu(NO3)2
(四)复分解反应
30、大理石和稀盐酸(实验室制CO2):CaCO3+2HCl=CaCl2+H2O+CO2↑
31、碳酸钠和盐酸(灭火器原理):Na2CO3+2HCl=2NaCl+H2O+CO2↑
32、盐酸除铁锈:Fe2O3+6HCl=2FeCl3+3H2O
(五)其他:
33、二氧化碳使澄清石灰水变浑浊:CO2+Ca(OH)2=CaCO3↓+H2O
34、二氧化碳通入氢氧化钠溶液:CO2+2NaOH=Na2CO3+H2O
35、一氧化碳还原氧化铜:CO+CuO Cu+CO2
36、一氧化碳还原氧化铁(炼铁):3CO+Fe2O2Fe+3CO2
37、甲烷在空气中燃烧:CH4+2O CO2+2H2O
38、乙醇在空气中燃烧:C2H5OH+3O2点燃2CO2+3H2O
初中化学必背知识点
初中化学必背知识点 一、化学用语 1、常见元素及原子团的名称和符号 非金属: O氧 H氢 N氮 Cl氯 C碳 P磷 S硫 金属: K钾 Ca钙 Na钠 Mg镁 Al铝 Zn锌 Fe铁 Cu铜 Hg汞 Ag银 Mn锰 Ba钡 原子团(根):氢氧根硝酸根碳酸根硫酸根磷酸根铵根 OH- NO3- CO32- SO4 2- PO43- NH4+ 2、化合价口诀 > (1) 常见元素化合价口诀: 钾钠银氢正一价;氟氯溴碘负一价;钙镁钡锌正二价;铜一二铁二三 铝三硅四氧负二二四六硫二四碳 (2) 常见原子团(根)化学价口诀: 一价硝酸氢氧根;二价硫酸碳酸根;三价常见磷酸根;通常负价除铵根。 : (1)实验室制取氧气一: 2KMnO4===K2MnO4+MnO2+O2↑ (2)实验室制取氧气二: 2H2O2 ===2H2O+O2↑ (3) 实验室制取氧气三: 2KClO3===2KCl+3O2↑ (4)实验室制法CO2: CaCO3+2HCl==CaCl2+H2O+CO2↑ (5)实验室制取氢气: Zn+H2SO4==ZnSO4+H2↑ (6)电解水制取氢气: 2H2O===2H2↑+O2↑ (7)湿法炼铜术(铁置换出铜):Fe+CuSO4==FeSO4+Cu (8)炼铁原理: 3CO+Fe2O3===2Fe+3CO2 ( (9)生灰水[Ca(OH)2 ]的制取方法:CaO+H2O==Ca(OH)2 (10)生石灰(氧化钙)制取方法:CaCO3 ===CaO+CO2↑ 二.金属活动性顺序: 金属活动性由强至弱:K Ca Na Mg Al , Zn Fe Sn Pb (H) ,Cu Hg Ag Pt Au。 (按5个一句顺序背诵)钾钙钠镁铝,锌铁锡铅(氢),铜汞银铂金。 三、常见物质的颜色、状态 1、白色固体:MgO、P2O5、CaO、 NaOH、Ca(OH) 2、KClO 3、KCl、Na2CO3、NaCl、无水CuSO4; 铁、镁为银白色(汞为银白色液态),除了有颜色的固体,其他固体一般为白色。 2、黑色固体:炭粉、铁粉、CuO、MnO2、Fe3O4▲KMnO4为紫黑色 3、红色固体:Cu、Fe2O3、HgO、红磷▲硫磺:淡黄色 4、溶液的颜色: 含Cu2+的溶液呈蓝色(如CuSO4溶液);含Fe2+的溶液呈浅绿色(如FeCl2溶液);含Fe3+的溶液呈
高考化学必背基础知识点归纳
高考化学必背基础知识点归纳 1.注意加热方式 有机实验往往需要加热,而不同的实验其加热方式可能不一样。 ⑴酒精灯加热。 酒精灯的火焰温度一般在400~500℃,所以需要温度不太高的实验都可用酒精灯加热。教材中用酒精灯加热的有机实验是:“乙烯的制备实验”、“乙酸乙酯的制取实验”“蒸馏石油实验”和“石蜡的催化裂化实验”。 ⑵酒精喷灯加热。酒精喷灯的火焰温度比酒精灯的火焰温度要高得多,所以需要较高温度的有机实验可采用酒精喷灯加热。教材中用酒精喷灯加热的有机实验是:“煤的干馏实验”。 ⑶水浴加热。水浴加热的温度不超过100℃。教材中用水浴加热的有机实验有:“银镜实验(包括醛类、糖类等的所有的银镜实验)”、“ 硝基苯的制取实验(水浴温度为6 0℃)”、“酚醛树酯的制取实验(沸水浴)”、“乙酸乙酯的水解实验(水浴温度为70℃~80℃)”和“糖类(包括二糖、 淀粉和纤维素等)水解实验(热水浴)”。 ⑷用温度计测温的有机实验有:“硝基苯的制取实验”、“乙酸乙酯的制取实验”(以上两个实验中的温度计水银球都是插在反应液外的水浴液中,测定水浴的温度)、“乙烯的实验室制取实验”(温度计水银球插入反应液中,测定反应液的温度)和“
石油的蒸馏实验”(温度计水银球应插在具支烧瓶支管口处,测定馏出物的温度)。 2、注意催化剂的使用 ⑴ 硫酸做催化剂的实验有:“乙烯的制取实验”、 “硝基苯的制取实验”、“乙酸乙酯的制取实验”、“纤维素硝酸酯的制取实验”、“糖类(包括二糖、淀粉和纤维素)水解实验”和“乙酸乙酯的水解实验”。 其中前四个实验的催化剂为浓硫酸,后两个实验的催化剂为稀硫酸,其中最后一个实验也可以用氢氧化钠溶液做催化剂 ⑵铁做催化剂的实验有:溴苯的制取实验(实际上起催化作用的是溴与铁反应后生成的溴化铁)。 ⑶氧化铝做催化剂的实验有:石蜡的催化裂化实验。 3、注意反应物的量 有机实验要注意严格控制反应物的量及各反应物的比例,如“乙烯的制备实验”必须注意乙醇和浓硫酸的比例为1:3,且需要的量不要太多,否则反应物升温太慢,副反应较多,从而影响了乙烯的产率。 4、注意冷却 有机实验中的反应物和产物多为挥发性的有害物质,所以必须注意对挥发出的反应物和产物进行冷却。 ⑴需要冷水(用冷凝管盛装)冷却的实验:“蒸馏水的制取实验”和“石油的蒸馏实验”。
高考化学必背知识点99177
高中化学必背知识点归纳与总结 一、俗名 无机部分: 纯碱、苏打Na2CO3、天然碱、口碱:Na2CO3小苏打:NaHCO3大苏打:Na2S2O3 石膏(生石膏):CaSO4.2H2O熟石膏:2CaSO4·.H2O莹石:CaF2重晶石:BaSO (无毒)碳铵:NH4HCO3石灰石、大理石:CaCO3生石灰:CaO食盐:NaCl 熟4 石灰、消石灰:Ca(OH)2芒硝:Na2SO4·7H2O(缓泻剂)烧碱、火碱、苛性钠:NaOH 绿矾:FaSO4·7H2O干冰:CO2明矾:KAl (SO4)2·12H2O漂白粉:Ca (ClO)2、 CaCl2(混和物)泻盐:MgSO4·7H2O胆矾、蓝矾:CuSO4·5H2O 双氧水:H O2皓矾:ZnSO4·7H2O 硅石、石英:SiO2刚玉:Al2O3水玻璃、泡花碱、矿物胶:N 2 a2SiO3铁红、铁矿:Fe2O3磁铁矿:Fe3O4黄铁矿、硫铁矿:FeS2铜绿、孔雀石: Cu2(OH)2CO3菱铁矿:FeCO3赤铜矿:Cu2O 波尔多液:Ca(OH)2和CuSO4石 硫合剂:Ca(OH)2和S 玻璃的主要成分:Na2SiO3、CaSiO3、SiO2过磷酸钙(主要成 分):Ca(H2PO4)2和CaSO4重过磷酸钙(主要成分):Ca (H2PO4)2天然气、沼气、 坑气(主要成分):CH4水煤气:CO和H2硫酸亚铁铵(淡蓝绿色):Fe (NH4)2(SO4) 溶于水后呈淡绿色 2 光化学烟雾:NO2在光照下产生的一种有毒气体王水:浓HNO3:浓HCl按体积比1:3混合而成。 铝热剂:Al + Fe2O3或其它氧化物。尿素:CO(NH2) 2 有机部分: 氯仿:CHCl3电石:CaC2电石气:C2H2 (乙炔)TNT:三硝基甲苯 氟氯烃:是良好的制冷剂,有毒,但破坏O3层。酒精、乙醇:C2H5OH 裂解气成分(石油裂化):烯烃、烷烃、炔烃、H2S、CO2、CO等。 焦炉气成分(煤干馏):H2、CH4、乙烯、CO等。醋酸:冰醋酸、食醋CH3COOH 甘油、丙三醇:C3H8O3石炭酸:苯酚蚁醛:甲醛HCHO 二、颜色 铁:铁粉是黑色的;一整块的固体铁是银白色的。 Fe2+——浅绿色Fe3O4——黑色晶体Fe(OH)2——白色沉淀 Fe3+——黄色Fe (OH)3——红褐色沉淀Fe(SCN)3——血红色溶液 FeO——黑色的粉末Fe(NH4)2(SO4)2——淡蓝绿色 Fe2O3——红棕色粉末 铜:单质是紫红色 Cu2+——蓝色CuO——黑色Cu2O——红色 CuSO4(无水)—白色CuSO4·5H2O——蓝色 Cu2 (OH)2CO3—绿色 Cu(OH)2——蓝色[Cu(NH3)4]SO4——深蓝色溶液 FeS——黑色固体 BaSO4、BaCO3、Ag2CO3、CaCO3、AgCl 、Mg (OH)2、三溴苯酚均是白色沉 淀 Al(OH)3白色絮状沉淀H4SiO4(原硅酸)白色胶状沉淀 Cl2、氯水——黄绿色F2——淡黄绿色气体Br2——深红棕色液体 I2——紫黑色固体HF、HCl、HBr、HI均为无色气体,在空气中均形成白雾 CCl4——无色的液体,密度大于水,与水不互溶
中考必背化学知识点总结归纳
初中化学知识点总结 1、常见元素、原子图化合价口诀 正一氢锂钠钾银铵根;负一氟氯溴碘氢氧根;二价氧钙镁钡锌;三铝四硅五价磷;二三铁、二四碳,二四六硫都齐全;锰有二四六和七,铜汞二价最常见,单质为0永不变;酸根负,一价硝酸根,二价硫酸碳酸根,三价就是磷酸根。 一些常见元素、原子团(根)的化合价 2、初中常见物质的化学式
) 白色沉淀:CaCO3、BaCO3、Mg(OH)2、Al(OH)3、Zn(OH)2、AgCl、BaSO4(其中仅BaSO4、AgCl是不溶于HNO3的白色沉淀)微溶于水:Ca(OH)2、CaSO4、Ag2SO4 3、物质的学名、俗名及化学式 (1)金刚石、石墨:C (2)水银、汞:Hg (3)生石灰、氧化钙:CaO (4)干冰(固体二氧化碳):CO2 (5))盐酸、氢氯酸:HCl (6)亚硫酸:H2SO3 S (7)氢硫酸:H 2 (8)熟石灰、消石灰:Ca(OH)2 (9)苛性钠、火碱、烧碱:NaOH (10)纯碱、苏打:Na2CO3碳酸钠晶体、纯碱晶体:Na2CO3?10H2O (11)碳酸氢钠、酸式碳酸钠、小苏打:NaHCO3 (12)胆矾、蓝矾、硫酸铜晶体:CuSO4?5H2O (13)铜绿、孔雀石:Cu2(OH)2CO3(分解生成三种氧化物的物质) (14)甲醇(有毒、误食造成失明甚至死亡):CH3OH (15)酒精、乙醇:C2H5OH (16)醋酸、乙酸(具有酸的通性)CH3COOH(CH3COO—醋酸根离子) (17)氨气:NH3(碱性气体) (18)氨水、一水合氨:NH3?H2O(为常见的碱,具有碱的通性,是一种不含金 属离子的碱) (19)亚硝酸钠:NaNO2 (工业用盐、有毒) 4、常见物质的颜色 (1)固体物质颜色 A 、白色固体:氧化钙、氢氧化钙、碳酸钠、碳酸钙、氢氧化钠、五 氧化二磷、白磷、氧化镁、氯酸钾、氯化钾、氯化钠、 B、黄色固体:硫粉(S) C、红色固体:红磷(P)、氧化铁、铜(Cu)、氧化汞(HgO) .5H2O D、蓝色固体:胆矾CuSO 4 E、黑色固体:木炭、石墨、氧化铜、二氧化锰、四氧化三铁、铁粉、 F 、绿色固体:碱式碳酸铜Cu2(OH)2CO3、锰酸钾K2MnO4 G、紫黑色固体:高锰酸钾 H、无色固体:冰,干冰,金刚石 I 、银白色固体:银、铁、镁、铝、锌等金属。
高中化学学业水平考试必背知识点
20XX 年高中毕业会考 高中化学学业水平测试必修1、2必背考试点 1、化合价(常见元素的化合价): Na 、K 、Ag 、H :+1 F :—1 Ca 、Mg 、Ba 、Zn :+2 Cl :—1,+1,+5,+7 Cu :+1,+2 O :—2 Fe :+2,+3 S :—2,+4,+6 Al :+3 Mn :+2,+4,+7 N :—3,+2,+4,+5 2、氧化还原反应 定义:有电子转移(或者化合价升降)的反应 本质:电子转移(包括电子的得失和偏移) 特征:化合价的升降 氧化剂(具有氧化性)——得电子——化合价下降——被还原——还原产物 还原剂(具有还原性)——失电子——化合价上升——被氧化——氧化产物 口诀:得——降——(被)还原——氧化剂 失——升——(被)氧化——还原剂 四种基本反应类型和氧化还原反应关系: 3、金属活动性顺序表 K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au 还 原 性 逐 渐 减 弱 4、离子反应 定义:有离子参加的反应 电解质:在水溶液中或熔融状态下能导电的化合物 非电解质:在水溶液中和熔融状态下都不能导电的化合物 离子方程式的书写步骤: 第一步:写。写出化学方程式 第二步:拆。易溶于水、易电离的物质拆成离子形式;难溶(如CaCO 3、BaCO 3、BaSO 4、AgCl 、AgBr 、 AgI 、Mg(OH)2、Al(OH)3、Fe(OH)2、Fe(OH)3、Cu(OH)2等),难电离(H 2CO 3、H 2S 、CH 3COOH 、HClO 、H 2SO 3、NH 3·H 2O 、H 2O 等),气体(CO 2、SO 2、NH 3、Cl 2、O 2、H 2等),氧化物(Na 2O 、MgO 、Al 2O 3等)不拆 第三步:删。删去方程式两边都有的离子 第四步:查。检查前后原子守恒,电荷是否守恒。 离子共存问题判断: ①是否产生沉淀(如:Ba 2+和SO 42-,Fe 2+和OH -); ②是否生成弱电解质(如:NH 4+和OH -,H +和CH 3COO -)
(完整)高中化学_全知识点总结记忆,推荐文档
高一化学各章必记知识点 第一章化学实验基本方法 一.化学实验基本方法 1、易燃易爆试剂应单独保存,防置在远离电源和火源的地方。 2、酒精小面积着火,应迅速用湿抹布扑盖;烫伤用药棉浸75%-95%的酒精轻涂伤处;眼睛的化学灼伤应立即用大量水清洗,边洗边眨眼睛。浓硫酸沾在皮肤上,立即用大量水清洗,最后涂上3%-5%的NaHCO3溶液。碱沾皮肤,用大量水清洗,涂上5%的硼酸溶液。 3、产生有毒气体的实验应在通风橱中进行。 4、防暴沸的方法是在液体中加入碎瓷片或沸石。 5、过滤是把难溶固体和水分离的方法;蒸发是把易挥发液体分离出来,一般都是为了浓缩结晶溶质。 6、粗盐含杂质主要有泥沙,CaCl2、MgCl2、Na2SO4等,需用的分离提纯方法是“钡碳先,碱随便,接过滤,后盐酸”的方法。 7、溶液中SO42-检验法是先加盐酸酸化,后加BaCl2溶液,如有白色沉淀产生,证明含有SO42-。 8、Cl-检验法是用AgNO3溶液和稀HNO3溶液,如有白色沉淀生成,则证明含Cl-;酸化的目的是防止碳酸银等沉淀的生成。 9、蒸馏是分离液液互溶物的方法,常见主要仪器是蒸馏烧瓶和冷凝器。温度计的水银球应放在蒸馏烧瓶的支管口附近,冷凝水流方向要注意逆流。 10、萃取是用某种物质在互不相溶的溶剂中溶解度的不同,从溶解度小的溶剂中转移到溶解度大的溶剂中的过程。一般萃取后都要分液,需用在分液漏斗中进行,后者操作时下层液体从下口放出,上层液体从上口倒出。 11、常见的有机萃取剂是CCl4和苯,和水混合后分层,分别在下层和上层。 12、Fe2+(浅绿色)、Fe3+(黄色)、Cu2+(蓝色)、MnO4-(紫或紫红色)、[Fe(SCN)]2+(血红色或红色);淀粉溶液+I2→显蓝色 溴、碘的单质在几种溶剂中的颜色: 单质水苯汽油、四氯化碳 溴橙黄→橙红橙红橙红 碘棕黄紫红紫红 13、仪器的洗涤 ⑴标准:仪器内壁水膜均匀附着,既不聚成水滴,也不成股流下,表示仪器已洗干净。 ⑵若附着不易用水洗净的物质时,应选不同的“洗涤剂”区别对待。如: 残 留 物洗 涤 剂 盐酸 久置石灰水的瓶壁上的白色固体 (CaCO3) 铁 锈盐酸 制氯气时残留的二氧化锰浓盐酸(温热) 久置FeCl3溶液的瓶壁上的沉淀(Fe2O3)盐酸 容器壁上附着的碘酒精或NaOH溶液 容器壁上附着的硫二硫化碳或热NaOH溶液 试管壁上的银镜稀硝酸 二、化学计量在实验中的应用 1、注意“同种微粒公式算”的途径
高考化学必记知识点总结
20XX届高考化学必记知识点和常考知识点总 结 第一部分化学反应和化学方程式 一、记住下列化学反应的转化关系(注意向前走得通,倒退能否行) 1、Na → Na2O → Na2O2 →NaOH → Na2CO3→ NaHCO3→ NaCl → Na Na → NaOH → CaCO3→ CaCl2 → CaCO3→ CaO → C a(O H)2→ NaOH 2、Mg → MgO → MgCl2→ M g(O H)2→ MgSO4→ MgCl2→ Mg 3、Al → Al2O3→ AlCl3→ A l(O H)3→ Al2(SO4)3→ A l(O H)3→ Al2O3 → Al → NaAlO2→ A l(O H)3→ AlCl3→ NaAlO2 铝热反应: 4、Fe → Fe2O3→ FeCl3→ F e(N O3)3→ F e(O H)3→ Fe2(SO4)3→ FeSO4→ F e(O H)2→ F e(O H)3→ FeCl3→ Fe(SCN)3 5、Cu → CuO → CuSO4→ C u(O H)2→ CuO → Cu → CuCl2 → [Cu(N H3)4]SO4 6、C→ CO→ CO2→ CO→ CO2→ CaCO3 → Ca(HCO3)2→ CO2→ A l(O H)3 7、Si → SiO2→ Na2SiO3→ H2SiO3 → SiO2→ Si(粗硅) → SiCl4→ Si ( 纯硅)→ SiO2→ SiF4 8、NH3→ N2→ NO→ NO2→ HNO3→ NO2→ N2O4 NH3→ NH4Cl → NH3→ NH3·H2O → (NH4)2SO4→ NH3→ NO→ HNO3→ C u(N O3)2→ NO2→ HNO3→ NO2 9、H2S → S → SO2→ SO3→ H2SO4→ SO2→ H2SO4→ BaSO4 10、Cl2→ HCl → Cl2→ NaClO → Cl2→ Ca(ClO)2→ HClO → O2 金属+Cl2、、卤素间的置换、H2S+Cl2 二、记住下列有关气体制备的反应和实验装置 11、制备气体和生成气体 H2:Mg+H+、Fe+H+、Na+H2O、Na+乙醇、Na+丙三醇、Al+H+、Al+OH—、*Zn+OH—、Fe + H2O 、H2O+C 、*Si+HF 、*Si+NaOH、
高中化学必背知识点
高中化学必背知识点 物理性质 1、有色气体:F2(淡黄绿色)、Cl2(黄绿色)、Br2(g)(红棕色)、I2(g)(紫红色)、NO2(红棕色)、O3(淡蓝色),其余均为无色气体。其它物质的颜色见会考手册的颜色表。 2、有刺激性气味的气体:HF、HCl、HBr、HI、NH 3、SO2、NO2、F2、Cl2、Br2(g);有臭鸡蛋气味的气体:H2S。 3、熔沸点、状态: ①同族金属从上到下熔沸点减小,同族非金属从上到下熔沸点增大。 ②同族非金属元素的氢化物熔沸点从上到下增大,含氢键的NH3、H2O、HF反常。 ③常温下呈气态的有机物:碳原子数小于等于4的烃、一氯甲烷、甲醛。 ④熔沸点比较规律:原子晶体>离子晶体>分子晶体,金属晶体不一定。 ⑤原子晶体熔化只破坏共价键,离子晶体熔化只破坏离子键,分子晶体熔化只破坏分子间作用力。 ⑥常温下呈液态的单质有Br2、Hg;呈气态的单质有H2、O2、O3、N2、F2、Cl2;常温呈液态的无机化合物主要有H2O、H2O2、硫酸、硝酸。 ⑦同类有机物一般碳原子数越大,熔沸点越高,支链越多,熔沸点越低。
同分异构体之间:正>异>新,邻>间>对。 ⑧比较熔沸点注意常温下状态,固态>液态>气态。如:白磷>二硫化碳>干冰。 ⑨易升华的物质:碘的单质、干冰,还有红磷也能升华(隔绝空气情况下),但冷却后变成白磷,氯化铝也可;三氯化铁在100度左右即可升华。 ⑩易液化的气体:NH3、Cl2 ,NH3可用作致冷剂。 4、溶解性 ①常见气体溶解性由大到小:NH3、HCl、SO2、H2S、Cl2、CO2。极易溶于水在空气中易形成白雾的气体,能做喷泉实验的气体:NH3、HF、HCl、HBr、HI;能溶于水的气体:CO2、SO2、Cl2、Br2(g)、H2S、NO2。极易溶于水的气体尾气吸收时要用防倒吸装置。 ②溶于水的有机物:低级醇、醛、酸、葡萄糖、果糖、蔗糖、淀粉、氨基酸。苯酚微溶。 ③卤素单质在有机溶剂中比水中溶解度大。 ④硫及白磷皆易溶于二硫化碳。 ⑤苯酚微溶于水(大于65℃易溶),易溶于酒精等有机溶剂。 ⑥硫酸盐三种不溶(钙银钡),氯化物一种不溶(银),碳酸盐只溶钾钠铵。 ⑦固体溶解度大多数随温度升高而增大,少数受温度影响不大(如NaCl),极少数随温度升高而变小[如Ca(OH)2]。气体溶解度随温度升高而变小,随压强增大而变大。
初中化学必背知识点(专题复习)
初中化学必背知识点一、化学用语 1、化合价口诀 (1) 常见元素化合价口诀: 一价氢氯钾钠银;二价氧钙钡镁锌;三铝四硅五价磷; 铜汞一二铁二三;二、四、六硫四价碳;许多元素有变价,条件不同价不同。 (2) 常见原子团(根)化学价口诀: 一价硝酸氢氧根;二价硫酸碳酸根;三价常见磷酸根;通常负价除铵根。 二.金属活动性顺序: 金属活动性由强至弱:K Ca Na Mg Al , Zn Fe Sn Pb (H) ,Cu Hg Ag Pt Au。(按5个一句顺序背诵)钾钙钠镁铝,锌铁锡铅(氢),铜汞银铂金。三、常见物质的颜色、状态 2.溶液中离子的颜色 4.(1)具有刺激性气体的气体: NH3(氨气)、SO2、HCl(皆为无色) (2)无色无味的气体:O2、H2、N2、CO2、CH4、CO(剧毒)、空气、稀有气体 ▲注意:具有刺激性气味的液体:盐酸、硝酸、醋酸(即醋);氨水;酒精为有特殊气体的液体。 四、一些物质的特性及用途: 可燃性的气体:H2、CO、CH4 (甲烷) 都可做燃料,点燃前都要验纯,与空气混合点燃会爆炸。
还原性的物质:C、H2、CO 都可用来冶炼金属,将金属氧化物还原成金属单质。 具有氧化性的物质:O2,CO2 助燃性物质:O2 能使带火星木条复燃,或使燃着木条燃烧更旺。 有毒的气体:CO,能与血红蛋白结合使人中毒,煤气中毒就是指CO中毒。 使澄清石灰水变浑浊气体:只有CO2 最轻气体:H2也是唯一燃烧无污染的气体燃料 干冰(CO2固体):用于人工降雨,致冷剂;CO2气体:用于灭火,做温室肥料,制汽水等 盐酸(HCl):用于除铁锈,是胃酸的主要成份,浓盐酸有挥发性(挥发出HCl气体) 石灰石(CaCO3):建筑材料,制水泥、高温煅烧制CaO; 生石灰CaO:易与水反应并放热,做食品干燥剂,可用来制取Ca(OH)2。 熟石灰Ca(OH)2:用于改良酸性土壤,配制波尔多液,与Na2CO3反应制取NaOH 五、化学与社会相关常识。 三大化石燃料:煤(固)、石油(液)、天然气(气) 六大营养物质:糖类(主要供能物质,如:米、面、蔗糖、葡萄糖等)、 油脂、蛋白质(鱼、肉、蛋、奶、豆)、维生素(蔬菜、水果)、水、无机盐 缺乏某些元素导致的疾病:缺钙:骨质疏松症(老年人)、佝偻病(儿童);缺铁:贫血缺碘:甲状腺肿大(大脖子病)缺维生素A:夜盲症;缺维生素C:坏血病 合金:生铁和钢都是铁的合金,区别是含碳量不同,钢含碳量低,黄铜是Cu-Zn合金 铁生锈条件:铁同时与空气(主要是O2)和水接触 防锈方法是:保持铁制品表面干燥和洁净,并在金属表面形成保护膜(涂油漆、涂油、镀其它金属等)。 可燃物燃烧条件:⑴是可燃物;⑵与空气(或O2)接触⑶温度达到可燃物着火点 灭火的方法:⑴隔离可燃物,如建立隔离带、釜底抽薪;⑵隔绝空气(或O2),如用湿布、灯帽、土盖灭火焰,用 CO2灭火⑶降低温度至可燃物着火点以下,如用水灭火。 环境污染名词: 酸雨:主要由SO2、NO2造成,酸雨危害是使河流、土壤酸化,建筑物、金属被腐蚀。 臭氧层空洞:臭氧能吸收紫外线,由于臭氧被氟里昂等破坏而形成 温室效应:空气中CO2排放过多引起全球气温上升 白色污染:塑料随意丢弃,不易被降解而造成的污染。 空气质量日报:污染物主要指标是:总悬浮颗粒、SO2、氮氧化物(如NO2) 六、基本反应类型 化合反应:A+B→AB多变一例:C+ O2== CO2 CaO+H2O===Ca(OH)2 分解反应:AB→A+B一变多例:2H2O===2H2↑+O2↑ H2CO3==CO2↑ + H2O 置换反应:A+BC→AC+B单换单例:Fe+CuSO4==FeSO4+Cu H2+CuO==Cu+ H2O 七、化学之最 1、地壳中含量最多的金属元素是铝。 2、地壳中含量最多的非金属元素是氧元素。 3、空气中含量最多的物质是氮气。 4、天然存在最硬的物质是金刚石。 5、最简单的有机物是甲烷(CH4)。 6、人体含量最多的金属元素是钙元素。 7、相对分子质量最小的氧化物是水 8、相同条件下密度最小的气体是氢气。 9、导电性最强的金属是银。 10、相对原子质量最小的原子是氢。 11、熔点最低的金属是汞。 12、地壳中、人体中、海水中含量最多的元素为氧元素。 13、组成化合物种类最多的元素是碳元素。14、日常生活中应用最广泛的金属是铁。 八、气体的鉴别 (1)O2与其它任何一种气体:用带火星的木条鉴别,能复燃的是O2 (2)CO2与其它任何一种气体:用澄清石灰水鉴别,能使石灰水变浑浊的是CO2 (3)空气、O2、CO2、N2、H2等多种气体:先用燃着的木条,再用澄清石灰水鉴别 (4)H2、CO、CH4三种可燃性气体:先点燃在火焰上罩干冷烧杯,后往烧杯中倒少许澄清石灰水鉴别。 九、物质的除杂:(括号内是杂质) 1、CO(CO2):通过NaOH溶液吸收掉CO2气体方程式为:CO2+2NaOH=Na2CO3+H2O 2、CO2(CO):通过灼热的CuO除去CO气体(也可除去氢气)方程式为:CO+CuO = Cu+CO2 3、CO2(O2):通过灼热的铜网除去O2气体方程式为:2Cu+O2 = 2CuO 4、Cu(Fe):加入足量CuSO4溶液。方程式为:Fe+CuSO4=Cu+FeSO4 5、KCl(MnO2):先溶解,后过滤,再蒸发。(凡两种固体一种可溶,一种难溶均可用该法除杂) 6、CaO(CaCO3):高温煅烧方程式为:CaCO3==CaO+CO2↑ 十、初中化学中的“三”(熟悉即可) 1、构成物质的三种微粒是:分子、原子、离子。 2、还原氧化铜常用的三种还原剂:氢气、一氧化碳、碳。 3、氢气作为燃料有三大优点:资源丰富、发热量高、燃烧后的产物是水不污染环境。 4、构成原子一般有三种微粒:质子、中子、电子。 5、溶液的特征有三个(1)均一性;(2)稳定性;(3)混合物。 6、收集气体一般有三种方法:排水法、向上排空法、向下排空法。 7、水污染的三个主要原因:(1)工业生产中的废渣、废气、废水;(2)生活污水的任意排放;(3) 农业生产中施用的农药、化肥随雨水流入河中。
最新高三化学回归课本必记知识点和常考知识点汇总
高三化学回归课本必记知识点和常考知识点汇总 第一部分化学反应和化学方程式 一、记住下列化学反应的转化关系(注意向前走得通,倒退能否行) 1、Na → Na2O → Na2O2 → NaOH → Na2CO3→ NaHCO3→ NaCl → Na Na → NaOH → CaCO3→ CaCl2 → CaCO3→ CaO → C a(O H)2→ NaOH 2、Mg → MgO → MgCl2→ M g(O H)2→ MgSO4→ MgCl2→ Mg 3、Al → Al2O3→ AlC l3→ A l(O H)3→ Al2(SO4)3→ A l(O H)3→ Al2O3 → Al → NaAlO2→ A l(O H)3 → AlCl3→ NaAlO2 铝热反应: 4、Fe → Fe2O3→ FeCl3→ F e(N O3)3→ F e(O H)3→ Fe2(SO4)3→ FeSO4→ F e(O H)2→ F e(O H)3 → FeCl3→ Fe(SCN)3 5、Cu → CuO → CuSO4→ C u(O H)2→ CuO → Cu → CuCl2 → [Cu(NH3)4]SO4 6、C→ CO→ CO2→ CO→ CO2→ CaCO3 → Ca(HCO3)2→ CO2→ A l(O H)3 7、Si → SiO2→ Na2SiO3→ H2SiO3 → SiO2→ Si(粗硅) → SiCl4→ Si ( 纯硅)→ SiO2→ SiF4 8、NH3→ N2→ NO→ NO2→ HNO3→ NO2→ N2O4 NH3→ NH4Cl → NH3→ NH3·H2O → (NH4)2SO4→ NH3→ NO→ HNO3→ C u(N O3)2→ NO2→ HNO3→ NO2 9、H2S → S → SO2→ SO3→ H2SO4→ SO2→ H2SO4→ BaSO4 10、Cl2→ HCl → Cl2→ NaClO → Cl2→ Ca(ClO)2→ HClO → O2 金属+Cl2、、卤素间的置换、H2S+Cl2 二、记住下列有关气体制备的反应和实验装置 11、制备气体和生成气体 H2:Mg+H+、Fe+H+、Na+H2O、Na+乙醇、Na+丙三醇、Al+H+、Al+OH—、*Zn+OH—、Fe + H2O 、H2O+C 、*Si+HF 、*Si+NaOH、 O2: KMnO4、Na2O2+H2O、Na2O2+CO2;分解H2O2、O3、*KClO3、* HNO3。 N2:* NH3+Cl2 Cl2:MnO2+HCl、KMnO4+HCl;电解NaCl、电解饱和食盐水;NaClO+HCl、CaCl2+HCl、*KClO3+HCl NO:N2+O2、Cu+HNO3、NH3+O2 NO2:NO+O2、Cu+HNO3(浓)、Cu+KNO3(s)+H2SO4(浓) CO2:CO32—+H+;NaHCO3、NH4HCO3、(NH4)2CO3、CaCO3、MgCO3分解;浓H2SO4+C、浓HNO3+C;有机物燃烧C x H y O z + O2; NH3:NH4Cl+Ca(OH)2、NH4++OH—、NH4HCO3分解、N2+H2、蛋白质分解 CO:C+O2、CO2+C、H2O+C、SiO2+C CH4:* CH3COONa+NaOH
初中化学必背知识点总结
初中化学必背知识点总结 1、化学是研究物质的组成、结构、性质以及变化规律的基础科学。 2、物理变化和化学变化的本质区别:有无新物质生成 变化和性质的区别:性质中有“能”“可以”“容易”等字眼 3、绿色化学-----环境友好化学(化合反应符合绿色化学反应) ①四特点(原料、条件、零排放、产品)②核心:利用化学原理从源头消除污染 4、蜡烛燃烧实验(描述现象时不可出现产物名称) (1)火焰:焰心、内焰(最明亮)、外焰(温度最高) (2)比较各火焰层温度:用一火柴梗平放入火焰中。现象:两端先碳化;结论:外焰温度最高 (3)检验产物H2O:用干冷烧杯罩火焰上方,烧杯内有水雾 CO2:取下烧杯,倒入澄清石灰水,振荡,变浑浊 (4)熄灭后:有白烟(为石蜡蒸气),点燃白烟,蜡烛复燃 5、吸入空气与呼出气体的比较 结论:与吸入空气相比,呼出气体中O2的量减少,CO2和H2O的量增多(吸入空气与呼出气体成分是相同的) 6、学习化学的重要途径——科学探究 一般步骤:提出问题→猜想与假设→设计实验→实验验证→记录与结论→反思与评价化学学习的特点:关注物质的性质、变化、变化过程及其现象; 7、化学实验(化学是一门以实验为基础的科学) 一、常用仪器及使用方法 (一)可以直接加热的仪器是--试管、蒸发皿、燃烧匙坩埚 只能间接加热的仪器是--烧杯、烧瓶、锥形瓶(垫石棉网—受热均匀) (二)测容器--量筒 量取液体体积时,量筒必须放平稳。读数时,视线与量筒内液体凹液面的最低点保持水平。 量筒不能用来加热,不能用作反应容器。量程为10毫升的量筒,一般只能读到0.1毫升。 选择合适的量程:所测液体不能超过量程,也不能比量程太小为宜 (三)称量器--托盘天平(用于粗略的称量,一般能精确到0.1克。) 注意点:(1)先调整零点(2)称量物和砝码的位置为“左物右码”。(3)称量物不能直接放在托盘上。 一般药品称量时,在两边托盘中各放一张大小、质量相同的纸,在纸上称量。潮湿的或具有腐蚀性的药品(如氢氧化钠),放在加盖的玻璃器皿(如小烧杯、表面皿)中称量。 (4)砝码用镊子夹取。添加砝码时,先加质量大的砝码,后加质量小的砝码(先大后小) (5)称量结束后,应使游码归零。砝码放回砝码盒。
(完整版)初三化学全册必背知识点(精华)
初中化学全册必背知识点 一、化学用语 1、常见元素及原子团的名称和符号 非金属: O氧 H氢 N氮 Cl氯 C碳 P磷 S硫 金属: K钾 Ca钙 Na钠 Mg镁 Al铝 Zn锌 Fe铁 Cu铜 Hg汞 Ag银 Mn锰 Ba钡 原子团(根):氢氧根硝酸根碳酸根硫酸根铵根 OH- NO3- CO32- SO4 2- NH4+ 2、(1) 常见元素化合价口诀:一价氯氢钾钠银,二价氧钙钡镁锌,二三铁二四碳,二四六硫都齐全;铜汞二 价最常见,三铝四硅五氮磷,单质零价要记清。 (2) 常见原子团(根)化学价口诀:负一硝酸氢氧根,负二硫酸碳酸根,正一价的是铵根。 4、必须熟记的制取物质的化学方程式 (1)实验室制取氧气一: 2KMnO4===K2MnO4+MnO2+O2↑ (2)实验室制取氧气二: 2H2O2 ===2H2O+O2↑ (3) 实验室制取氧气三: 2KClO3===2KCl+3O2↑ (4)实验室制法CO2: CaCO3+2HCl==CaCl2+H2O+CO2↑ (5)实验室制取氢气: Zn+H2SO4==ZnSO4+H2↑ Zn + 2HCl= ZnCl2 +H2↑ (6)电解水制取氢气: 2H2O===2H2↑+O2↑ (7)湿法炼铜术(铁置换出铜):Fe+CuSO4==FeSO4+Cu (Fe与盐、酸反应都生成的是+2价亚铁离子) (8)炼铁原理: 3CO+Fe2O3===2Fe+3CO2 (Fe2O3与酸反应生成的是+3价铁离子) (9)熟灰水[Ca(OH)2 ]的制取方法:CaO+H2O==Ca(OH)2 (10)生石灰(氧化钙)制取方法:CaCO3 ===CaO+CO2↑ 二.金属活动性顺序: 金属活动性由强至弱: K Ca Na Mg Al , Zn Fe Sn Pb (H) ,Cu Hg Ag Pt Au 。 (按5个一句顺序背诵)钾钙钠镁铝,锌铁锡铅(氢),铜汞银铂金。 三、常见物质的颜色、状态 1、黑色固体:炭粉、铁粉、CuO、MnO 2、Fe3O4 2、红色固体:Cu、Fe2O 3、红磷▲硫磺:淡黄色▲绿色:碱式碳酸铜(铜锈,俗称铜绿)
高三化学必背知识点归纳
高三化学必背知识点归纳 与高一高二不同之处在于,此时复习力学部分知识是为了更好的与高考考纲相结合,尤其水平中等或中等偏下的学生,此时需要进行查漏补缺,但也需要同时提升能力,填补知识、技能的空白。小编为你精心准备了高三化学必背知识点归纳,助你金榜题名! 高三化学必背知识点归纳(一) 一、金属活动性Na>Mg>Al>Fe. 二、金属一般比较活泼,容易与O2反应而生成氧化物,可以与酸溶液反应而生成H2,特别活泼的如Na等可以与H2O发生反应置换出H2,特殊金属如Al可以与碱溶液反应而得到H2. 三、A12O3为两性氧化物,Al(OH)3为两性氢氧化物,都既可以与强酸反应生成盐和水,也可以与强碱反应生成盐和水. 四、Na2CO3和NaHCO3比较 碳酸钠碳酸氢钠 俗名纯碱或苏打小苏打 色态白色晶体细小白色晶体 水溶性易溶于水,溶液呈碱性使酚酞变红易溶于水(但比Na2CO3溶解度小)溶液呈碱性(酚酞变浅红) 热稳定性较稳定,受热难分解受热易分解 2NaHCO3Na2CO3+CO2↑+H2O 与酸反应CO32—+H+HCO3— HCO3—+H+CO2↑+H2O HCO3—+H+CO2↑+H2O 相同条件下放出CO2的速度NaHCO3比Na2CO3快 与碱反应Na2CO3+Ca(OH)2CaCO3↓+2NaOH 反应实质:CO32—与金属阳离子的复分解反应NaHCO3+NaOHNa2CO3+H2O 反应实质:HCO3—+OH-H2O+CO32— 与H2O和CO2的反应Na2CO3+CO2+H2O2NaHCO3 CO32—+H2O+CO2HCO3—
不反应 与盐反应CaCl2+Na2CO3CaCO3↓+2NaCl Ca2++CO32—CaCO3↓ 不反应 主要用途玻璃、造纸、制皂、洗涤发酵、医药、灭火器 转化关系 五、合金:两种或两种以上的金属(或金属与非金属)熔合在一起而形成的具有金属特性的物质. 合金的特点:硬度一般比成分金属大而熔点比成分金属低,用途比纯金属要广泛. 高三化学必背知识点归纳(二) (一)燃烧的一般条件 1.温度达到该可燃物的着火点 2.有强氧化剂如氧气、氯气、高锰酸钾等存在 3.(爆炸物一般自身具备氧化性条件,如硝化甘油、三硝基甲苯、火药等,只要达到温度条件,可以在封闭状态下急速燃烧而爆炸) (二)、镁在哪些气体中可以燃烧? 1、镁在空气或氧气中燃烧 2、镁在氯气中燃烧 3、镁在氮气中燃烧 4、镁在二氧化碳中燃烧 (三)、火焰的颜色及生成物表现的现象 1、氢气在空气中燃烧—-淡蓝色火焰 2、氢气在氯气中燃烧---苍白色火焰,瓶口有白雾。 3、甲烷在空气中燃烧---淡蓝色火焰 4、酒精在空气中燃烧---淡蓝色火焰 5、硫在空气中燃烧---微弱的淡蓝色火焰,生成强烈剌激性气味的气体。 6、硫在纯氧中燃烧---明亮的蓝紫色火焰,生成强烈剌激性气味的气体 7、硫化氢在空气中燃烧---淡蓝色火焰,生成强烈剌激性气味的气体。 8、一氧化碳在空气中燃烧---蓝色火焰 9、磷在空气中燃烧,白色火焰,有浓厚的白烟
最新九年级化学最全必背知识点
最新九年级化学最全必背知识点 九年级化学必背知识点生命之源——水 一、概念 质量守恒定律:在化学反应里,参加反应的各物质的质量总和,等于反应后生成的各物质的质量总和,这就是质量守恒定律。 二、实验题、填空题常考句子 1. 水污染:(1)工业三废的任意排放(2)生活污水的任意排放(3)农药、化肥的不合理使用。 2. 水污染的防治:(1)加强对水质的监测(2)工业三废经过处理后再排放(3)生活污水经处理后排放(4)合理使用农药和化肥。 3. 保护水资源的途径:(1)节约用水(方法:工业用水循环使用、使用节水龙头、使用节水马桶、使用喷灌、滴管设施、随手关闭水龙头、一水多用等)(2)防止水污染。
4. 水净化程度由高到低的顺序:蒸馏、吸附、过滤、沉淀。 5. 硬水和软水的区别:加肥皂水。 6. 生活中降低水硬度的方法:煮沸。 7. 电解水时通的是直流电,给水中加少量NaOH或硫酸的目的是为了增强水的导电性。 8. 电解水实验要点:氧正氢负,氧一氢二,氧八氢一。 9. 电解水:2H2O2H2↑+O2↑ 10. 电解水实验结论:水是由氢、氧两种元素组成的化合物(氧化物);化学反应中,分子可分,原子不可分。 11. 质量守恒的原因:化学变化中,原子总类不变、原子数目不变、原子质量不变。 12. 验证质量守恒定律实验,要选择没有气体参加或生成的反应。如果有气体参加或生成,则需在密
闭容器内进行。 九年级化学必背知识点燃料 一、实验题、填空题常考句子 1. 自然界中密度最小的物质:氢气。 2. 氢气燃烧:2H2+O2==2H2O 现象:氢气燃烧时发出淡蓝色火焰,放出大量热,罩在火焰上方的烧杯内有水珠产生。 3. 点燃任何可燃性气体之前都要验纯。 4. 氢气作为理想能源的优点:(1)来源广泛(2)热值高(3)燃烧产物是水,无污染。 5. 碳单质常考物理性质:金刚石硬度大,石墨能导电,活性炭有吸附性。 6. 金刚石和石墨物理性质不同的原因:碳原子排列方式不同。
高中化学知识点总结与归纳
目录 高中化学学习方法………………………………………( 2 ) 高中化学必背知识点……………………………………( 3 ) 高中化学重点……………………………………………( 16 ) 化学计算………………………………………………....( 2 1 ) 解题技巧…………………………………………………( 2 5 ) 高中化学学习方法 经过初中的学习,学生对化学这一学科有了基础的了解。但针对高中有化学学习,在部分学生还 茫然无措。现在就结合高中化学元素的特点,谈谈我对高中化学的认识和学方法的总结初中化学来说,知识量更加庞大,内容更加繁杂。但经过细细的摸索和分析,它仍有规律可循。只要把握好这些规律,高中化学的学习将会变得比较简单。 首先,牢牢地把握好元素周期律这些规律,就为我们学习元素打下了艰实的基础, 然后结合具体元素的特殊性,加以补充,这样对元素这部分的学习就显得相当容易。 其次,紧紧抓住“结构决定性质,性质决定用途”这条原则,切实掌握物质的结 构和性质,并与应用结合起来,这样就能够从识记的水平提高到运用的水平。这也是 高考考查的能力之一。 还要学会活学活用,通过类比的方法,掌握一系列元素的性质,一类化学反应的实质。这样就在很大程度上解决了记忆量大,内容繁多的问题。 下面我谈谈高中化学的课堂学习方法: 考虑到高中学生的素质,切实做好预习是不可能的,但这并不等于放弃课前预习。要对老师的问题有些了解,为听课做好准备。 课堂上务必要认真听课,跟着老师的点拨思路走,通过老老师的引导,最终解决问题。在课堂上一定要慎防发做笔记代替听课,这样会大大降低听课质量。笔记可以在课后根据自己的记忆和理解补记。课堂上一定要勤,勤问,勤思,勤动手。做到以上这些,就会使课堂学习变得充实而有效。 课后复习也是非常重要的一个环节。要对老师讲过的知识加以总结,再思考,最后成为自己的东西。 希望同学们根据以上学习方法,结合自身学习状况,形成一套适合自已的学习方法,以此来提高学习成绩。
化学高考必背知识点归纳
化学高考必背知识点归纳 分享借鉴,希望可以帮助到各位考生同学. 化学高考必背知识点1 一.物理性质 1.有色气体:F2(淡黄绿色).Cl2(黄绿色).Br2(g)(红棕色).I2(g)(紫红色).NO2(红棕色).O3(淡蓝色),其余均为无色气体.其它物质的颜色见会考手册的颜色表. 2.有刺激性气味的气体:HF.HCl.HBr.HI.NH 3.SO2.NO2.F2.Cl2.Br2(g);有臭鸡蛋气味的气体:H2S. 3.熔沸点.状态: ①同族金属从上到下熔沸点减小,同族非金属从上到下熔沸点增大. ②同族非金属元素的氢化物熔沸点从上到下增大,含氢键的NH3.H2O.HF反常. ③常温下呈气态的有机物:碳原子数小于等于4的烃.一氯甲烷.甲醛. ④熔沸点比较规律:原子晶体离子晶体分子晶体,金属晶体不一定. ⑤原子晶体熔化只破坏共价键,离子晶体熔化只破坏离子键,分子晶体熔化只破坏分子间作用力. ⑥常温下呈液态的单质有Br2.Hg;呈气态的单质有H2.O2.O3.N2.F2.Cl2;常温呈液态的无机化合物主要有H2O.H2O2.硫酸.硝酸. ⑦同类有机物一般碳原子数越大,熔沸点越高,支链越多,熔沸点越低. 同分异构体之间:正异新,邻间对. ⑧比较熔沸点注意常温下状态,固态液态气态.如:白磷二硫化碳干冰. ⑨易升华的物质:碘的单质.干冰,还有红磷也能升华(隔绝空气情况下),但冷却后变成白磷,氯化铝也可;三氯化铁在1_度左右即可升华. ⑩易液化的气体:NH3.Cl2,NH3可用作致冷剂. 4.溶解性 ①常见气体溶解性由大到小:NH3.HCl.SO2.H2S.Cl2.CO2.极易溶于水在空气中易形成白雾的气体,能做喷泉实验的气体:NH3.HF.HCl.HBr.HI;能溶于水的气体:CO2.SO2.Cl2.Br2(g).H2S.NO2.极易溶于水的气体尾气吸收时要用防倒吸装
人教版高中化学会考必考必备知识点复习
高中化学会考复习 必修1、2必背考试点 1、化合价(常见元素的化合价): 碱金属元素、Ag 、H :+1 F :—1 Ca 、Mg 、Ba 、Zn :+2 Cl :—1,+1,+5,+7 Cu :+1,+2 O :—2 Fe :+2,+3 S :—2,+4,+6 Al :+3 P :—3,+3,+5 Mn :+2,+4,+6,+7 N :—3,+2,+4,+5 2、氧化还原反应 定义:有电子转移(或者化合价升降)的反应 本质:电子转移(包括电子的得失和偏移) 特征:化合价的升降 氧化剂(具有氧化性)——得电子——化合价下降——被还原——还原产物 还原剂(具有还原性)——失电子——化合价上升——被氧化——氧化产物 口诀:得——降——(被)还原——氧化剂 失——升——(被)氧化——还原剂 四种基本反应类型和氧化还原反应关系: 3、金属活动性顺序表 K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au 还 原 性 逐 渐 减 弱 4、离子反应 定义:有离子参加的反应 离子方程式的书写: 第一步:写。写出化学方程式 第二步:拆。易溶于水、易电离的物质拆成离子形式;难溶(如CaCO 3、BaCO 3、BaSO 4、AgCl 、 AgBr 、AgI 、Mg(OH)2、Al(OH)3、Fe(OH)2、Fe(OH)3、Cu(OH)2等),难电离(H 2CO 3、H 2S 、CH 3COOH 、HClO 、H 2SO 3、NH 3·H2O 、H 2O 等),气体(CO 2、SO 2、NH 3、Cl 2、O 2、H 2等),氧化物(Na 2O 、MgO 、Al 2O 3等)不拆 第三步:删。删去前后都有的离子 第四步:查。检查前后原子个数,电荷是否守恒 离子共存问题判断: ①是否产生沉淀(如:Ba 2+和SO 42-,Fe 2+和OH -) ②是否生成弱电解质(如:NH 4+和OH -,H +和CH 3COO -) ③是否生成气体(如:H +和CO 32-,H +和SO 32-) ④是否发生氧化还原反应(如:H +、NO 3-和Fe 2+/I -,Fe 3+和I -) 氧化还原反应 置换 化合 分解 复分解
