14-醇、酚、醛、酮、胺的性质鉴别
大学有机化学重点知识总结第十一章 醛、酮
—制备增加2个C原子的伯醇:
+
H2C CH2
-+
RM gBr
O -
(C2H5)2O
R C H 2 C H 2 O M g B r
H 3O + H O C H 2C H 2R
精选可编辑ppt
42
33.
CH3 ( NBS )
CH2Br
Mg
(
干醚
CH2MgBr )
① O / 干醚
(
② H3O+
CH2CH2CH2OH )
R C O R '+H 2 O H +
R CO +2 R 'O H
(R '')HO R '
(R '')H
精选可编辑ppt
33
H +
O O C H 3
( )+ ( )
O
CH2CH2CH2CH CH3OH
HO
O
O
O
C OCH3 H
O O
C OCH3
H OC H2CH 2OH
精选可编辑ppt
34
(3)活性:醛>酮 酮一般用原甲酸三乙酯形成缩酮
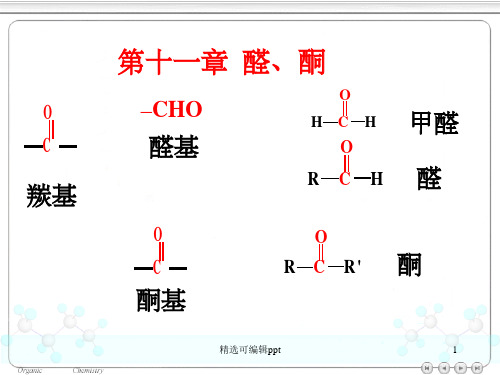
O C
羰基
第十一章 醛、酮
–CHO
醛基
O HCH
O
RCH
甲醛 醛
O
C
酮基
O
R C R' 酮
精选可编辑ppt
1
烃基
脂肪族醛和酮 芳香族醛和酮
醛和酮
饱和醛和酮
的分类 烃基是否饱和 不饱和醛和酮
一元醛和酮
羰基个数 二元醛和酮
多元醛和酮
知识点5_醇_酚_醛 2

知识点5 醇 酚 醛问题1 醇、酚、醛的概况1、醇概况(1) 官能团:—OH (醇羟基);通式: C n H 2n+2O (一元醇 / 烷基醚);代表物: CH 3CH 2OH(2) 结构特点:羟基取代链烃分子(或脂环烃分子、苯环侧链上)的氢原子而得到的产物。
(3)物理性质(乙醇):无色、透明,具有特殊香味的液体(易挥发),密度比水小,能跟水以任意比互溶(一般不能做萃取剂)。
是一种重要的溶剂,能溶解多种有机物和无机物。
2、酚概况(1) 官能团:—OH (酚羟基);通式:C n H 2n-6O (芳香醇 / 酚 / 芳香醚)(2)物理性质:纯净的苯酚是无色晶体,但放置时间较长的苯酚往往是粉红色的,这是由于苯酚被空气中的氧气氧化所致。
具有特殊的气味,易溶于乙醇等有机溶剂。
有毒、有强烈腐蚀性(用酒精洗)。
3、醛概况(1)官能团:醛基(—CHO)、饱和一元醛通式:C n H 2n O(醛/酮)(2)结构特点:醛基或羰基碳原子伸出的各键所成键角为120°,该碳原子跟其相连接的各原子在同一平面上。
(3)物理性质(乙醛):无色无味,具有刺激性气味的液体,密度比水小,易挥发,易燃,能跟水,乙醇等互溶。
问题2醇、酚、醛的氧化规律1、醇的氧化(去H 氧化)(1)条件—O 2/Cu △ 或CuO [>CH-OH ,去H 氧化为>C=O](2)举例: 2、醛的氧化(得O 氧化)(2)反应(1醛+2氧化剂) 2CH 3CH 2OH +O 2 2CH 3CHO +2H 2O Cu△CH CH OH +CuO CH CHO +H O+Cu △CH 3CHO +2Ag(NH 3)2OH CH 3COONH 4+2Ag +3NH 3+H 2O水浴CH 3CHO +2 Cu(OH)2 CH 3COOH+ Cu 2O ↓(砖红) + 2 H 2O △注:① R-CHO ~2Ag HCHO ~4Ag② 发生银镜反应—醛类、葡萄糖、麦芽糖、甲酸及其化合物(3)实验操作银镜反应:在一支洁净的试管中加入硝酸银溶液,逐滴加入氨水,边滴边振荡,直到最初生成的沉淀刚好溶解为止。
补充讲义:有机重要官能团的性质及检验

有机重要官能团的性质及检验一、不饱和烃(双键和叁键)的性质及检验(一)性质1.加成反应(H 2,X 2,HX ,H 2O ) 2.氧化反应 3.聚合反应4.金属炔化物的生成(取代)-----未端炔烃的性质在乙炔或具有“—C ≡CH ”结构的未端炔烃分子中,与C ≡C 键直接相连的氢原子,具有特殊的活泼性,可被某些金属离子取代生成金属炔化物。
该反应可用来鉴别炔烃分子中C ≡C 键碳原子上是否连有氢原子。
硝酸银氨溶液 乙炔银(白色)炔化银氯化亚铜氨溶液 乙炔亚铜(棕红色)上述反应中生成的金属炔化物湿润时比较稳定,干燥状态受热或撞击容易发生爆炸生成金属和碳。
因此,实验结束后,对生成的金属炔化物应加硝酸使其分解,以防发生危险。
(二)检验1.双键或叁键的检验溴-四氯化碳溶液,酸性高锰酸钾溶液 2.未端炔烃的检验硝酸银氨溶液,氯化亚铜氨溶液二、苯及其同系物的性质及检验(一)性质由于苯环结构的特殊性,使之具有特殊的化学性质----芳香性-----即环上难发生加成反应和氧化反应,而易发生取代反应。
1. 取代反应(卤代、硝化、磺化等)2. 氧化反应通常情况下,苯不被高锰酸钾、重铬酸钾等强氧化剂所氧化。
但α-H 的苯的同系物则容易被氧化,且不论侧链多长,都被氧化成羧酸。
例如:CH3+COOHCH 2CH3+COOH3. 加成反应 很难发生 (二)检验+CH A g(NH 3)2NO HC AgC CAg ↓R C CAg+CH Ag(NH 3)2NO C R ↓CuC CCu +CH Cu(NH 3)2Cl HC ↓含α-H 的苯的同系物的检验-----酸性高锰酸钾三、卤代烃(-X )的性质及检验(一)性质 1. 取代反应不同结构的卤代烃与硝酸银的醇溶液反应的难易程度是不同的。
烯丙型卤代烃、苄卤、叔卤代烃在常温下就能与硝酸银作用,伯卤代烃和仲卤代烃在加热条件下才能反应,而乙烯型卤代烃、卤苯则不与硝酸银反应。
不同卤代烃与硝酸银的醇溶液反应由易到难的顺序为: CH 2═CH─CH 2X 、ArCH 2X 、R 3CX > R 2CHX > RX 此类反应常用于不同结构卤代烃的检验。
酚和胺
OH
OH
-CH2- -CH2- -CH2- -CH2-
H
CH2=O H
CH2OH H
-CH2- -CH2- -CH2- -CH2-
OH
OH
OH
OH
CH2O, C6H5OH H+orOH-
OH
OH
OH
OH
-CH2- -CH2- -CH2- -CH2-
CH2
CH2
-CH2- -CH2- -CH2- -CH2-
§12-6 酚和胺
一、酚和胺的概念、分类、和命名
1、概念
(1)酚又称苯酚,羟基跟苯环直接相连的化合物;或,苯环上
的氢被羟基取代所生成的化合物;也可以看成水分子中的氢被苯 环取代形成的化合物。
苯酚的结构式和结构模型
OH
醇与酚的区别
比例模型
球棍模型
OH
苯酚
CH2 OH
苯甲醇
OH
环己醇
(2)胺:氨分子中氢原子被烃基取代而形成的化合物。
N CH3 CH3
N,N-二甲基苯胺
③复杂的胺:以烃基为母体,把氨基作为取代基命名
NH2 CH3CH CHCH2CH3
CH3 2-甲基-3-氨基戊烷
CH3 CH3CHCHNHCH3
CH3
2-甲基-3-甲氨基丁烷
④ 季铵盐和季铵碱:命名同无机铵类化合物。如:
[(CH3)3NC2H5]+Br-
溴化三甲基乙基铵
二甲胺
CH3NHC2H5
甲乙胺
CH3 C2H5 N CH(CH3)2
甲乙异丙胺
②N-取代芳香胺(即N上的氢被取代的苯胺):
一般以苯胺为母体,但要标明烃基与N相连。复杂的也可以
有机化学中的醇和酚的反应

有机化学中的醇和酚的反应在有机化学中,醇和酚是两类重要的有机化合物,它们具有许多相似的性质,但也存在一些差异。
本文将探讨醇和酚的一些典型反应及其在实际应用中的重要性。
一、醇的反应1. 醇的酸碱性醇通常呈中性,但在一些特定条件下,醇也能表现出一定的酸碱性。
当醇与碱反应时,醇会失去一个质子形成醇负离子。
而与酸反应时,醇会失去一个氧原子,生成烯醇阳离子。
2. 醇的脱水反应醇能够经过脱水反应生成烯醇或烯醇醚。
常用的脱水剂有浓硫酸、磷酸三氢钠等。
脱水反应可以通过加热、催化等方式进行。
3. 醇的氧化反应醇在适当条件下能够被氧化为醛、酮或羧酸。
一般情况下,较强的氧化剂如酸性高锰酸钾溶液、酸性过氧化氢等可以将醇氧化成酮或羧酸。
而较弱的氧化剂如氧气、铬酸盐则可以使醇氧化成醛。
4. 醇的酯化反应醇与酸发生酯化反应时,生成酯和水。
该反应通常需要催化剂存在,并加热进行。
二、酚的反应1. 酚的取代反应酚的芳香核上一般具有较强的亲电位,因此容易发生取代反应。
常见的取代反应有烷基取代反应和卤原子取代反应等。
2. 酚的酰化反应酚能够与酰氯反应生成酚酯,该反应需要催化剂存在。
3. 酚的缩合反应酚可以发生缩合反应,生成苯环上含有碳-碳键的化合物。
该反应通常需要酸性条件下进行。
4. 酚的溴化反应酚与溴反应生成溴代化合物,并伴有溴水变色的现象。
酚与溴直接发生反应通常需要加热。
以上仅为醇和酚的一部分重要反应,实际应用中还有许多其他的反应,如醇和酚的还原反应、醇和酚的烷化反应等。
这些反应在有机合成中具有广泛的应用。
例如,醇和酚的脱水反应可以用于制备醚类化合物,而酯化反应则常用于酯类的合成。
总之,在有机化学中,醇和酚的反应是有机合成中的基础内容之一。
深入了解和掌握这些反应对于研究有机化学和进行有机合成具有重要的意义。
通过研究这些反应机理,我们可以更好地设计和合成出具有特定功能的有机化合物,为化学领域的发展做出贡献。
有机化学第二版(高占先)(全14章答案完整版)_第8-13章
有机化学第二版(高占先)(全14章答案完整版) _第9-13章《有机化学第二版(高占先)》全14章答案完整版!(其中包括各种判断题、推断题、思考题以及合成题的答案!)第9章 醇、酚、醚9-1 命名下列化合物。
CH 3CHOHCCHO OO OO OHH 3COCH 3OHCH 2OHPhCHCH 2CH 2CH 3OHPhOCH 2CH=CH 2OOCH 3H 3COOCH 2CH 3CH 3(CH 2)10CH 2SHCH 3SCH 2CH 3O 2S(1)(2)(3)(4)(5)(6)(7)(8)(9)(10)(11)(12)(1)3-丁炔-2-醇; (2)15-冠-5; (3)(1R )-5-甲基-2-异丙基环已醇; (4)3-甲基-5-甲氧基苯酚; (5)3-羟甲基苯酚; (6)1-苯基-1-丁醇; (7)苯基烯丙基醚; (8)4,4’-二甲氧基二苯醚; (9)1,2-环氧丁烷; (10)正十二硫醇; (11)甲乙硫醚; (12)二苯砜。
9-2 完成下列反应(1)25H 3C 6H525H 3C 6H 52H 53(S N i 反应,构型保持)(S N 2反应,构型翻转)OH CH 3H PBr 3H CH 3Br(S N 2反应,构型翻转)(CH 3)3CCH 2OHH 2SO 4CrO 3,(CH 3)2C=CHCH 3(E1反应,碳架发生重排)HOOH CH 3NOOHCH 3(弱氧化剂不能氧化叔醇和双键)O3OH(S N 2反应,进攻位阻较小的碳原子)(2)(3)(4)(5)OHHCO 3H H 2O / H(6)OHH HOHOHH +(中间产物为环氧化物,亲核试剂进攻两碳原子的几率相等)CH 3AlCl 3(8)OH+CH 3OOHCO CH 3(Fries 重排,热力学控制产物)(7)OH OHOOO (频哪醇重排)(邻二醇氧化)222(10)O CH 2CH=CHCH 2CH 3OH(1) NaOH (9)OHOHOO (亲核取代反应)H 3CCH 3*OHH 3C3CH 2CH=CHCH 2CH 3*(发生两次Claisen 重排)OH OHC +(Reimer-Tiemann 反应)(11)C 2H 5SH(13)CH 3CH 2CHCH 2CH 3(15)CH 3Br +(12)OCH 3+CH 3CH 2CHCH 2CH 3OH+(S N 2反应)OHOBrHBr(S N 1反应)(CH 3)2CHCH 2CH 2CH 2Br+OH(CH 3)2CHCH 2CH 2CH 2SVH 2CH 3(S N 2反应)OH HClH H OH H OHOHHOHH (1) OH (2) H 2O(14)9-3 将下列各组组化合物按酸性由强至弱排列成序。
醇、酚、醚的结构、分类和异构现象及化学性质
HX的活性比较: HI > HBr > HCl(HF一般不反应)
由伯醇制备相应的溴代烃和碘代烃,常用比较 便宜的溴化钠加硫酸或碘化钠加磷酸作试剂。例
如:
+ + CH3CH2CH2CH2 OH NaBr H2SO4
+ + CH3CH2CH2CH2Br NaHSO4 H2 O
用浓盐酸与无水氯化锌混合所配制的溶液[称作卢卡斯
+ + C 3 ( H 3 C ) 2 H O H A l C [ ( H 3 C ) 2 H O A ] 3l 3 H / 2 2
反应随着醇分子烃基的加大而反应速率减慢。醇的活性为:
甲醇>伯醇>仲醇>叔醇
醇的酸性比水弱,醇钠碱性比氢氧化钠强,故 醇钠遇水即分解成原来的醇和氢氧化钠。
R O N a+ H O 2 R O H+ N a O H
1-丁醇(正丁醇)
H3C CH CH2 OH CH3
2-甲基-1-丙醇(异丁醇)
C2 H5 O C2 H5
乙醚
H3C CH2 CH CH3 OH
2-丁醇(仲丁醇)
CH3 H3C C CH3
OH
2-甲基-1-丙醇(叔丁醇)
8.1.1 醇的构造、分类和命名
(1) 醇的分类
根据醇分子中羟基所连接的烃基不同,分为饱和 醇、不饱和醇、脂环醇和芳香醇。如:
Collins 试剂: CrO3·吡啶/CH2Cl2 为溶剂. 似Sarett 试 剂。
Jones 试剂: CrO3/稀H2SO4,可将不饱和仲醇氧化成
酮,
不影响碳碳重键。
(b) 仲醇氧化成酮,常用此法制备酮。
CH3-CH-(CH2)5CH3 OH
华南理工大学有机化学期末复习试卷(含答案)
有机化学期末复习二、填空题(33points, 1.5 points for each case). 例如: 1CH 3kMNO43+( )PCl 3( )H 2,Pd-BaSO 4NS( )OH -2CH 3CCH 2BrMg/干醚HCl (dry)OH OHO H 2OO( )( )( )①②3OH(1). H SO ,∆(2). KMnO 4, H+))(41) O 32) Zn/H 2O- )5NH 3/P a Br 2/NaOHH +△△..O 2;V 2O 5 C 。
450( ( )( )( )P463 (四) 完成下列反应(1)、(2)、(3)、(7)、(8):括号中为各小题所要求填充的内容。
(1)C O CO ONH +COOHCON 4(2) H 2OCH 2OHCH 2N(2) HOCH 2CH 2CH 2COOH25∆OOHOCH 2CH 2CH 2CH 2OH(3)CH 2=C COOHCH 3323CH 2=CCOClCH 3CH 2=C COOCH 2CF 3CH 3(7)C NH CO O22COOHNH 2(8)COOHCHOCOClH , Pd-BaSO 3P509,15.15 写出下列季铵碱受热分解时,生成的主要烯烃结构。
P522,15.23 完成下列反应式。
P527,(八) 写出下列反应的最终产物:(1) CH 2ClNaCNLiAlH 4(CH 3CO)2O(CH 2CH 2NHCOCH3)(2)NO Fe, HCl22NO (CH 3)2N )(3)CH 3(CH 2)2CH=CH HBr ROORCN Na CO OH 2O, HO -( CH 3(CH 2)2CH 2CH 2NH 2 )(4)O322N(CH 3)2O)P616,20.2 写出下列反应式中(A )~ (H)的构造式。
三、选择题(反应快慢,鉴别试剂,物质的稳定性,能否发生某种反应等) 例如:P404,11.8 指出下列化合物中,哪个可以进行自身的羟醛缩合。
有机化学第9章醇、酚、醚
–H2O
–H2O
△
重排
–H2O
△
偕二醇: 两个羟基在同一个碳原子上的二元醇, 很不稳定, 容易脱水变成羰基化合物: OH C C = O OH 邻二醇可加热脱水生成醛或酮 (中间经过烯醇的阶段): CH2–CH2 O OH OH CH2=CH–O–H CH3–C–H 1,4 –二醇 或 1,5 –二醇 加热脱水则生成环醚: CH2—CH2 CH2—CH2 CH2 CH2 CH2 CH2 OH OH O
5. 氧化和脱氢反应 常用的氧化试剂: KMnO4溶液 或 K2Cr2O7酸性溶液, 一般将伯醇直接氧化为羧酸 (很难停留在醛的阶段): H O O RCH–OH RC–H RC–OH 仲醇可被上述氧化剂氧化为酮 (酮不易继续被氧化): OH O R–CH–R′ R–C–R′ 叔醇一般不被上述氧化剂所氧化 (∵无α–H). 但如果用更 强的氧化条件, 如与酸性KMnO4溶液一起加热, 可使叔醇 氧化断链, 生成小分子氧化产物. (反应式见书, 了解) 采用特殊氧化剂 CrO3–吡啶的CH2Cl2溶液, 可使伯醇的氧化停留在醛的阶段: CH2=CHCH2OH CH2=CHCHO
9.1.1 醇的结构、分类和命名法 1. 醇的结构 (见图) 醇(alcohol)的官能团是直接与饱和碳原子相连的羟基 (–OH), 醇羟基中 O为 sp3 不等性杂化, 两个sp3杂化轨道分别与C和H形成σ 键, 其余两个sp3杂化轨道各有一对未共用电子, H–O–C的键角接近109.5°. 2. 醇的分类 根据羟基所连接的饱和碳原子的类型, 可分为 伯醇(1°)、仲醇(2°) 和 叔醇(3°). 根据所含羟基的数目, 可分为 一元醇 和 多元醇. 根据羟基所连的烃基结构, 可分为 饱和醇、不饱和醇 和 芳香醇.
大学有机化学鉴别(终极版)-大学有机化学鉴别
有机化学鉴别方法的总结一、鉴别小结1环烷烃C-C、C-H Br2/CCl4 红棕色褪去环丙烷、环丁烷2烯烃碳碳双键Br2/CCl4 红棕色褪去KMnO4/H+ 紫红色褪去3炔烃碳碳叁键Br2/CCl4 红棕色褪去KMnO4/H+ 紫红色褪去银氨配离子灰白色沉淀乙炔、端基炔二氨合亚铜配离子砖红色沉淀乙炔、端基炔4卤代烃-X AgNO3/醇卤化银沉淀可区分不同类型卤代烃5醇1、–OH Lucas试剂浑浊或分层速度不同少于6碳的伯<仲<叔<苯甲醇、烯丙基醇2、-OH K2Cr2O7/H+ 桔红亮绿伯、仲醇反应3、-OH I2/NaOH 淡黄色碘仿含甲基醇6酚Ar-OH FeCl3溶液紫色或其它色酚或烯醇溴水白色沉淀苯酚、苯胺7醛、酮羰基2,4-二硝基苯肼黄色沉淀(羰基试剂)土伦试剂银镜反应醛品红试剂紫红色醛(甲醛加酸不褪色)费林试剂砖红色沉淀芳醛及酮不反应碘仿反应黄色沉淀甲基醛、甲基酮8羧酸羧基NaHCO3 CO2气体少于6个碳的羧酸土伦试剂银镜反应甲酸KMnO4/H+ 紫红色褪去甲酸、乙二酸9O酰卤-C—X AgNO3/乙醇卤化银沉淀10酸酐碳酸氢钠水溶液二氧化碳气体11酰胺氢氧化钠水溶液/加热产生氨气12胺NaNO2+HCl 伯胺产生氮气仲胺黄色油状物叔胺无特殊现象苯磺酰氯伯胺白色晶体溶于强碱仲胺白色晶体不溶于强碱叔胺不反应伯、仲、叔胺的鉴别13杂环化合物盐酸/松木片绿色呋喃及其简单衍生物红色吡咯及其衍生物红色吲哚及其衍生物苯胺/醋酸深红糠醛或戊糖14糖莫力许反应α-萘酚/H2SO4 紫色糖类蒽酮反应蒽酮/H2SO4 蓝绿色糖类间苯二酚/HCl 红色酮糖土伦试剂、费林试剂银镜还原糖I2/KI 蓝色淀粉5-甲基-1,3-苯二酚绿色戊糖二苯胺+H2SO4+乙酸蓝色脱氧戊糖二.鉴别方法1烷烃与烯烃,炔烃的鉴别方法是酸性高锰酸钾溶液或溴的ccl4溶液(烃的含氧衍生物均可以使高锰酸钾褪色,只是快慢不同)2烷烃和芳香烃就不好说了,但芳香烃里,甲苯,二甲苯可以和酸性高锰酸钾溶液反应,苯就不行3另外,醇的话,显中性4酚:常温下酚可以被氧气氧化呈粉红色,而且苯酚还可以和氯化铁反应显紫色5可利用溴水区分醛糖与酮糖6醚在避光的情况下与氯或溴反应,可生成氯代醚或溴代醚。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
化学与环境学院有机化学实验报告实验名称:醇、酚、醛、酮、胺的性质鉴别学生姓名:大芒果学号:专业:理综2班年级班级:2014级理综二班指导老师:曾志日期:2015年10月27日实验报告书写要求1.实验报告应妥善保存,避免水浸、墨污、卷边,保持整洁、完好、无破损、不丢失。
不得缺页或挖补;如有缺、漏页,详细说明原因。
2.实验报告应用字规范,字迹工整,须用蓝色或黑色字迹的钢笔或签字笔书写,不得使用铅笔或其它易褪色的书写工具书写(实验装置图除外)。
3.实验现象必须做到及时、真实、准确、完整记录,防止漏记和随意捏造。
实验结果必须如实记录,严禁伪造数据。
4.实验前必须做好实验预习。
【实验目的】通过实验进一步认识醇类的一般性质,并比较醇和酚之间化学性质上的差异,认识羟基和烃基的相互影响。
通过实验进一步加深对醛、酮的化学性质的认识,掌握鉴别醛、酮的化学方法。
【实验原理】(包括反应机理)醇和酚的结构中都含有羟基,但醇中的羟基与烃基相连,酚中羟基与芳环直接相连,因此它们的化学性质上有很多不相同的地方。
羟基是醇的官能团,O-H键和C-O键容易断裂发生化学反应;同时,α-H和β-H有一定的活泼性,使得醇能发生氧化反应、消除反应等;而邻多元醇除了具有一般醇的化学性质,由于它们分子中相邻羟基的相互影响,具有一些特殊的性质,如甘油能与Cu(OH)2作用。
酚类化合物分子中含有羟基,O-H键已发生断裂,在水溶液中能电离出少量氢离子,使酚溶液显示弱酸性;-OH受苯环上大π键的影响,使得C-OH键显示一定的活性,易发生氧化反应;而苯环也受-OH 的影响,使得苯环上的H的活性增强,易发生取代反应。
醛和酮都含有羰基,可与苯肼、2,4-二硝基苯肼、亚硫酸氢钠、羟胺、氨基脲等碳基试剂发生亲核加成反应,所得产物经适当处理可得到原来的醛酮,这些反应可用来分离提纯和鉴别醛酮。
此外,甲基酮还可发生碘仿反应。
利用Tollens试剂、Fehling试剂、Benedict试剂、Schiff试剂或铬酸试剂可将醛酮加以区别。
配制Tollens试剂所涉及的化学变化如下:配制Tollens试剂时应防止加入过量的氨水,否则,将生成雷酸银。
受热后将引起爆炸,试剂本身还将失去灵敏性。
Tollens试剂久置后将析出黑色的氮化银沉淀,它受震动时分解,发生猛烈爆炸,有时潮湿的氮化银也能引起爆炸。
因此Tollens试剂必须现配现用。
【主要试剂及物理性质】名称分子量熔点/℃沸点/℃外观甲醇32.04 –97 64.7 无色液体乙醇46 -114.1 78.3 无色液体正丁醇74 -88.9 117.25 无色透明液体仲丁醇74 -114.7 99.5 无色透明液体叔丁醇74 25.7 82.42 无色透明液体氢氧化钠39.9971 318 1388 白色不透明的蜡状固体甘油92 18.6 290.9 无色、透明、无臭、粘稠液体苯酚94 40.6 181.9 无色或白色晶体FeCl3162.2 306 315 六水:黄色固体硝酸银169.88 212 444 无色固体甲醛乙醛 44 -121 20.8 无色易流动液体苯甲醛 106 -26 179 无色液体 丙酮58-94.956.53无色透明液体【仪器装置】 1、主要仪器:试管、胶头滴管、量筒、烧杯、pH 试纸、玻璃棒2、实验装置:试管【实验步骤及现象】 反应时间 实验步骤 实验现象2min1、醇的性质(1)比较醇的同系物在水中的溶解度在4支试管中各加入2mL 水,然后分别滴加甲醇、乙醇、丁醇各10滴,振摇。
甲醇、乙醇溶解于水,无分层。
丁醇难溶解于水,放置后分层15min (2)醇与Lucas试剂的作用在3支干燥的试管中,分别加入0.5mL正丁醇、仲丁醇、叔丁醇,每个试管中各加入2mL Lucas试剂,立即用塞子将管口塞住,充分振荡后静置,温度最好保持在26-27℃,观察混合物的变化。
加入叔丁醇的试管中立即出现白色浑浊,放置后分层。
加入仲丁醇的试管放置后有少量浑浊,加入正丁醇的试管无明显现象。
15min (3)醇的氧化向盛有1mL乙醇的试管中滴加1%KMnO4溶液2滴,充分振荡后将试管置于水浴中微热,观察溶液颜色的变化,写出有关的化学反应式。
加入KMnO4后溶液呈紫红色,微热后紫红色褪去试管中出现棕色沉淀。
反应式:CH3CH2OH + KMnO4→CH3COOH + H2O + MnO2↓2min (4)多元醇与氢氧化铜的作用用6mL5%氢氧化钠及10滴10%CuSO4溶液,配制成新鲜的氢氧化铜,然后一分为二,取5滴多元醇样品(甘油)滴入新鲜的氢氧化铜中,记录观察到的现象。
加入氢氧化钠溶液后有蓝色沉淀生成,加入甘油后沉淀溶解,生成绛蓝色络合物4min 2.酚的性质(1)苯酚的酸性在试管中盛放苯酚的饱和水溶液6mL,用玻璃棒蘸取一滴于pH试纸上试验其酸性。
将上述苯酚饱和水溶液一分为二,一份作空白对照,于另一份中逐滴滴入5%氢氧化钠溶液,边加边振荡,直至溶液呈清亮为止,通入二氧化碳到酸性。
测得pH为5。
加入氢氧化钠后溶液变清亮,通入二氧化碳后溶液变浑浊。
C6H5ONa+CO2+ H2O→C6H5OH+ NaHCO31min (2)苯酚的氧化取苯酚的饱和水溶液3mL置于试管中,加5%碳酸钠0.5mL及0.5%高锰酸钾溶液1mL,边加边振荡,观察现象。
高锰酸钾溶液褪色,试管中出现棕色沉淀1min (3)苯酚与FeCl3作用取苯酚的饱和水溶液2滴放入试管中,加入2mL水,并逐滴滴入FeCl3溶液中,观察颜色的变化试管中溶液变为紫色15min 3.醛、酮的区别Tollens试验(1)Tollens试剂的配制加20mL5%硝酸银溶液于一干净试管内,加入1滴10%氢氧化钠溶液,然后滴加2%氨水,随摇,直至沉淀刚好溶解。
(2)在4支洗得十分干净的小试管中分别加入1mL Tollens试剂,然后分别加入2滴试样,摇匀后静置数分钟。
再将试管放在60℃的水浴中温热几分钟,观察银镜的生成。
试样:甲醛、乙醛、苯甲醛、丙酮硝酸银与氢氧化铜反应生成棕黑色固体,加入氨水后溶解,配制好的Tollens试剂无色透明。
加入甲醛的试管中在常温下1min 即有银镜生成,而加入乙醛的试管在常温下5min 后出现银镜,加入苯甲醛的试管需经水浴加热后才出现银镜,而加入丙酮的试管无明显变化。
【实验讨论】1、醇的同系物中碳的个数越多,溶解度越小,即在实验所用的三种醇中,甲醇溶解度最大,乙醇次之,丁醇溶解度最小。
2、正丁醇、仲丁醇、叔丁醇与卢卡斯试剂反应,其中叔丁醇反应最快,仲丁醇次之,正丁醇无明显变化,是因为该反应是是亲核取代反应机理,形成的三级碳正离子的稳定性最强,二级碳正离子次之,而正丁醇几乎就不反应了。
3、醇的氧化中,加入的KMnO4为中性,加入KMnO4后溶液呈紫红色,微热后加快反应速度,紫红色褪去,试管中出现棕色沉淀。
反应式:CH3CH2OH + KMnO4→CH3COOH + H2O + MnO2↓4、硫酸铜与氢氧化钠反应生成蓝色沉淀是因为反应生成了Cu(OH)2蓝色沉淀:CuSO4+2NaOH==Na2SO4+Cu(OH)2↓(蓝色沉淀),加入甘油后沉淀溶解且溶液变为深蓝色,是因为甘油与Cu(OH)2反应生成深蓝色络合物。
5、酚类化合物分子中含有羟基,O-H键已发生断裂,在水溶液中能电离出少量氢离子,使酚溶液显示弱酸性,因此能和氢氧化钠反应生成苯酚钠。
苯酚的酸性比碳酸弱,因此苯酚钠能和碳酸反应生成苯酚。
6、苯酚的氧化中加入Na2CO3后C6H5OH+Na2CO3= C6H5ONa + NaHCO3,因此溶液呈弱碱性,加入高锰酸钾后,KMnO4可将苯酚完全氧化降解为二氧化碳和水,自身还原为MnO2。
7、具有酚羟基的化合物,通常与三氯化铁提供的三价铁离子形成有色的配位化合物而显色。
苯酚与氯化铁反应溶液变紫是因为两者发生络合反应:6C6H5OH+FeCl3→H3[Fe(OC6H5)6](紫色络合物)+3HCl8、硝酸银与氢氧化铜反应生成棕黑色固体是生成了Ag2O黑色沉淀,加入氨水后溶解,是反应生成了[Ag(NH3)2]+溶液:AgNO3+NH3·H2O==AgOH↓+NH4NO3AgOH==Ag2O(黑色)+H2O Ag2O+4NH3·H2O==2Ag(NH3)2OH+3H2O由于甲醛、乙醛和苯甲醛均具有醛基具有较强的还原性,与银氨溶液反应生成生成银镜CH3CHO+2Ag(NH3)2OH==CH3COONH4 + 2Ag↓+3NH3+H2OC6H5-CHO+2Ag(NH3)2OH==C6H5-COONH4 +2Ag↓+3NH3+H2O 影响银镜反应的主要因素是银氨离子浓度、体系pH值、反应温度及反应时间。
对于甲醛、乙醛这些活泼的醛类化合物,在室温下可发生银镜反应,而对于活泼性稍差的芳香醛如苯甲醛,高温下才可得到银镜。
【思考题】1、用Lucas试剂检验伯、仲、叔醇的实验成功的关键何在?对于六个碳以上的伯、仲、叔醇是否都能用Lucas试剂进行鉴别?答:要使Lucas试剂现象明显的关键是所鉴别的醇要溶于Lucas 试剂(C6以下的醇)。
若不溶,则反应前后都出现分层,就无法判断是否起了反应。
其次试管要用棉花塞住,以防氯化氢挥发,否则Lucas实验现象也不明显;对于六个碳以上的伯、仲、叔醇不能用Lucas试剂进行鉴别,Lucas试剂一般仅适用于己醇以下的低级一元醇。
2、与氢氧化铜反应产生蓝色是邻羟基多元醇的特征反应,此外,还有什么试剂能起类似的鉴别作用?答:高碘酸试验。
先加入HIO4溶液,然后加AgNO3溶液,有白色沉淀生成。
3、醛和酮与氨基脲的加成试验中,为什么要加入乙酸钠?答:加入乙酸钠是为了调节溶液的pH值,使反应溶液的酸度即能是一部分羰基化合物不至于使氨衍生物全部变成盐而失去亲核能力。
这样就可以保留部分游离的氨衍生物,以利于反应的进行。
4、为什么Tollen试剂要在临用时才配制?Tollen试验完毕后,应加硝酸少许,立刻煮沸洗去银镜,为什么?答:Tollen试剂久置易易爆,因此必须在临用时才配制;加HNO3可以氧化银单质是生成硝酸银,洗去银镜。
5、如何用简单的化学方法鉴定下列化合物?环己烷环己烯环乙醇丁醛苯甲醛丙酮答:①用碘仿试验可鉴别出丙酮;②用银氨溶液鉴别,可以产生银镜的是丁醛和苯甲醛;再用菲林试剂鉴别,产生砖红色沉淀的是丁醛;③再用溴水鉴别,可以使溴水褪色的是环己烯;④再用酸性高锰酸钾鉴别,可以使酸性高锰酸钾褪色的是环己醇;⑤剩下的是环己烷。
【实验成绩】指导老师签名:。
