锌分光光度法测定
实验 35火焰原子吸收分光光度法测定食盐中的铁,锌,铜含量

实验35 火焰原子吸收分光光度法测定食盐中的铁、锌、铜含量一、实验目的1.了解火焰原子吸收分光光度计的原理与基本结构。
2.掌握火焰原子吸收分光光度法测定食盐中铁、锌、铜含量的实验方法。
二、实验原理火焰原子吸收分光光度计的原理详见实验33。
铁、锌、铜是人体必需的微量元素,人体铁缺乏会引起缺铁性贫血,影响人体健康和儿童的生长发育及智力开发。
缺锌会出现食欲下降、生长迟缓、性发育落后、智能低下等症状,还会降低人体的免疫功能,使人易患病和衰老。
缺铜可导致神经系统失调,大脑功能发生障碍,脑细胞中的色素氧化酶减少,活力下降,从而使记忆衰退、思维紊乱、反应迟钝,甚至步态不稳、运动失常等。
目前食盐市场上除一般的加碘盐外,陆续出现了添加各种微量元素的保健食盐,如加铁盐、加锌盐、加钙盐以及加多种微量元素的复合盐等。
本实验采用火焰原子吸收光谱法来测定食盐中的铁、锌、铜含量,通过将试液喷入火焰中,使铁、锌、铜原子化,在火焰中形成的基态原子对特征谱线产生选择性吸收,由测得的样品吸光度和校准溶液的吸光度进行比较,确定样品中被测元素的浓度。
三、主要仪器与试剂1.仪器原子吸收分光光度计,铁、锌、铜元素空心阴极灯,电子天平,空气压缩机。
2.试剂食盐;硝酸(优级纯);铁、锌、铜标准溶液(国家标准溶液,质量浓度均为1000 μg·mL -1,使用时按要求稀释至所需浓度)。
所有实验用水均为超纯水或亚沸去离子水;所用玻璃器械用10%硝酸浸泡过夜,去离子水冲洗干净。
四、实验步骤安全预防:乙炔是微毒类气体,属危险品,具有弱麻醉作用,高浓度吸入可引起单纯窒息。
它极易燃烧爆炸,应避免与空气混合,与明火、高热能或氧化剂、氟、氯等接触,工作现场严禁吸烟,穿防静电工作服,戴一般作业防护手套。
乙炔气瓶具有不安全隐患,其运输、储存和使用必须严格执行国务院颁发的《化学危险物品安全管理条例》的有关规定。
1.设定仪器操作条件仪器操作条件见表4-10。
表4-10 测定铁、锌、铜仪器工作参数及测定条件元素波长/nm 光谱带宽/nm 灯电流/mA 负高压/V 积分时间/sFe Zn Cu 248.30213.85324.750.20.20.25554553683201.01.01.02.绘制铁、锌、铜工作曲线分别取1 mL 1000 μg·mL-1铁、锌、铜标准溶液,用1.5%的硝酸定容至100 mL,配制成质量浓度均为10.0 μg·mL-1的铁、锌、铜标准使用液。
双硫腙分光光度法测定锌含量
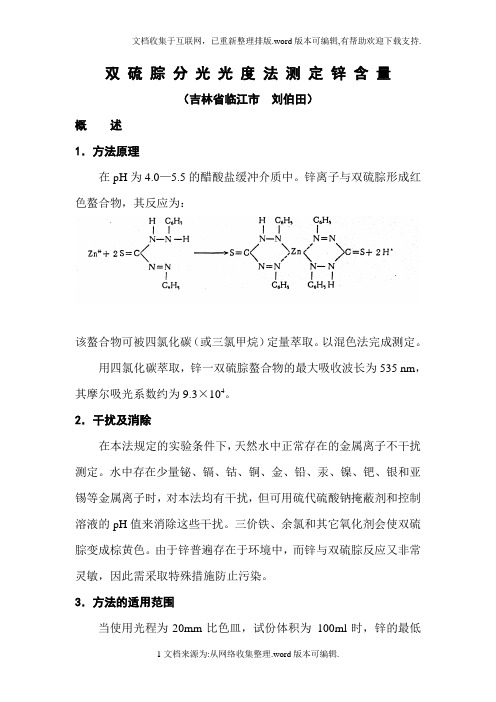
双硫腙分光光度法测定锌含量(吉林省临江市刘伯田)概述1.方法原理在pH为4.0—5.5的醋酸盐缓冲介质中。
锌离子与双硫腙形成红色螯合物,其反应为:该螯合物可被四氯化碳(或三氯甲烷)定量萃取。
以混色法完成测定。
用四氯化碳萃取,锌一双硫腙螯合物的最大吸收波长为535 nm,其摩尔吸光系数约为9.3×104。
2.干扰及消除在本法规定的实验条件下,天然水中正常存在的金属离子不干扰测定。
水中存在少量铋、镉、钴、铜、金、铅、汞、镍、钯、银和亚锡等金属离子时,对本法均有干扰,但可用硫代硫酸钠掩蔽剂和控制溶液的pH值来消除这些干扰。
三价铁、余氯和其它氧化剂会使双硫腙变成棕黄色。
由于锌普遍存在于环境中,而锌与双硫腙反应又非常灵敏,因此需采取特殊措施防止污染。
3.方法的适用范围当使用光程为20mm比色皿,试份体积为100ml时,锌的最低检出浓度为0.005mg/L。
本法适用于测定天然水和轻度污染的地表水中的锌。
4. 仪器(l)分光光度计,应用10 mm或更长光程的比色皿。
(2)分液漏斗:容量为125和150ml,最好配有聚四氟乙烯活塞。
(3)玻璃器皿:所有玻璃器皿均先后用1+l硝酸浸泡和无锌水清洗。
5. 试剂(1)无锌水:将普通蒸馏水通过阴阳离子交换柱以除去水中痕量锌,用于配制试剂。
(2)四氯化碳(CCl4)。
(3)高氯酸(ρ=1.75g/ml)。
(4)盐酸(ρ=1.18g/ml)。
(5)6mol/L盐酸:取500ml浓盐酸用水稀释至1000ml。
(6)2mol/L盐酸:取100ml浓盐酸用水稀释至600ml。
(7)0.02mol/L盐酸:取2mol/L盐酸10ml用水稀释到1000ml。
(8)乙酸(含量36%)。
(9)氨水(ρ=0.90g/ml)。
(10)1+100氨溶液:取氨水10ml用水稀释至1000ml。
(11) 硝酸(ρ=1.4g/ml)。
(12) 2%(V/V)硝酸溶液:取硝酸20ml 用水稀释至1000 ml。
水质 铜、锌、铅、镉的测定--原子吸收分光光度法

1 适用范围本标准规定了测定水中铜、锌、铅、镉得火焰原子吸收分光光度法。
本标准分为两部分。
第一部分为直接法,适用于测定地下水、地面水与废水中得铜、锌、铅、镉;第二部分为螯合萃取法,适用于测定地下水与清洁地面水中低浓度得铜铅、镉。
2定义2、1溶解得金属,未酸化得样品中能通过0、45um滤膜得金属成分。
2、2金属总量:未经过滤得样品经强烈消解后测得得金属浓度,或样品中溶解与悬浮得两部分金属浓度得总量。
3试剂与材料除非另有说明,分析时均使用符合国家标准得分析纯试剂;实验用水,GB/T 6682,二级。
3、1硝酸:ρ(HNO3)=1、42 g/mL,优级纯。
3、3 硝酸:ρ(HNO3)=1、42 g/mL,分析纯。
)=1、67 g/mL,优级纯。
3、3 高氯酸:ρ(HClO43、4燃料:乙炔,用钢瓶气或由乙炔发生器供给,纯度不低于99、6%。
3、5 氧化剂:空气,一般由气体压缩机供给,进入燃烧器以前应经过适当过滤,以除去其中得水、油与其她杂质。
3、6硝酸溶液:1+1。
用硝酸(3、2)配制。
3、7 硝酸溶液:1+499。
用硝酸(3、1)配制。
3、8 金属储备液:1、000g/L。
称取1、000g光谱纯金属,准确到0、001g,用硝酸(3、1)溶解,必要时加热,直至溶解完全,然后用水稀释定容至1000mL。
3、9中间标准溶液。
用硝酸溶液3、7稀释金属贮备液3、8配制,此溶液中铜、锌、铅、镉得浓度分别为50、00、10、00、100、00、10、00mg/L。
4 采样与样品4、1用聚乙烯塑料瓶采集样品。
采样瓶先用洗涤剂洗净,再在硝酸溶液3、6中浸泡,使用前用水冲洗干净。
分析金属总量得样品,采集后立即加硝酸3、1酸化至PH=1~2,正常情况下,每1000mL样品加2ml硝酸3、1。
4、2试样得制备分析溶解得金属时,样品采集后立即通过0、45um滤膜过滤,得到得滤液再按4、1中得要求酸化。
5适用范围5、1测定浓度范围与仪器得特性有关。
水质-铜、锌、铅、镉的测定--原子吸收分光光度法

1 适用范围本标准规定了测定水中铜、锌、铅、镉的火焰原子吸收分光光度法。
本标准分为两部分。
第一部分为直接法,适用于测定地下水、地面水和废水中的铜、锌、铅、镉;第二部分为螯合萃取法,适用于测定地下水和清洁地面水中低浓度的铜铅、镉。
2 定义2.1溶解的金属,未酸化的样品中能通过0.45um滤膜的金属成分。
2.2金属总量:未经过滤的样品经强烈消解后测得的金属浓度,或样品中溶解和悬浮的两部分金属浓度的总量。
3 试剂和材料除非另有说明,分析时均使用符合国家标准的分析纯试剂;实验用水,GB/T 6682,二级。
3.1 硝酸:ρ(HNO3)=1.42 g/mL,优级纯。
3.3 硝酸:ρ(HNO3)=1.42 g/mL,分析纯。
3.3 高氯酸:ρ(HClO4)=1.67 g/mL,优级纯。
3.4 燃料:乙炔,用钢瓶气或由乙炔发生器供给,纯度不低于99.6%。
3.5 氧化剂:空气,一般由气体压缩机供给,进入燃烧器以前应经过适当过滤,以除去其中的水、油和其他杂质。
3.6 硝酸溶液:1+1。
用硝酸(3.2)配制。
3.7 硝酸溶液:1+499。
用硝酸(3.1)配制。
金属储备液:g/L。
称取1.000g光谱纯金属,准确到0.001g,用硝酸(3.1)溶解,必要时加热,直至溶解完全,然后用水稀释定容至1000mL。
3.9 中间标准溶液。
用硝酸溶液3.7稀释金属贮备液3.8配制,此溶液中铜、锌、铅、镉的浓度分别为50.00、10.00、100.00、10.00mg/L。
4 采样和样品4.1用聚乙烯塑料瓶采集样品。
采样瓶先用洗涤剂洗净,再在硝酸溶液中浸泡,使用前用水冲洗干净。
分析金属总量的样品,采集后立即加硝酸酸化至PH=1~2,正常情况下,每1000mL样品加2ml硝酸。
4.2试样的制备分析溶解的金属时,样品采集后立即通过0.45um滤膜过滤,得到的滤液再按4.1中的要求酸化。
5 适用范围测定浓度范围与仪器的特性有关。
5.2 地下水和地面水中的共存栗子和化合物在常见浓度下不干扰测定。
硫氰络锌萃取-PAN分光光度法测定铁矿石中的锌

硫 氰酸铵 洗液 : 称取 4g氯化 铵 于塑 料烧 杯 中 , 加 5 L水 溶 解 后 , 入 4 L 硫 氰 酸 铵 溶 液 0m 加 0m ( % ) 5mL氟化钠 饱 和溶 液 , 水稀 释 至 3 0 m 6 , 用 0 L,
曾波 , : 等 硫氰络锌萃取 一 A P N分光光度法测定铁矿石中的锌
9 3
硫 氰络 锌 萃 取 一P N分 光 光 度 法 测 定铁 矿石 中的锌 A
曾 波 张水 菊
3 82 ) 30 8 ( 新余 钢铁有限责任公司检测中心 , 新余
锌 在铁 矿 中普遍存 在 , 含量 高 的达 1 以上 , % 低 的在 0 0 1 以下 。在 高 炉 冶 炼 生铁 时 , .0 % 由于 锌 的 沸点低 , 还原 后形 成蒸 气 随 煤 气 上升 到 高 炉 的上 部
2 结果 与讨论 2 1 分析 波 长的选择 .
测手段 较多 , IP及原 子 吸收 的仪器 检测方 法 _ , 如 C 2 J
湿 法检 测有 P N显 色 方 法 , 于 湿 法 检 测 方 法 而 A 对
言 ,O O( 正 辛 基 磷 化 氧 的 苯 溶 液 ) 、 氯 甲 TP 三 J三 烷、 甲基 异丁基 甲酮提 取 或萃 取 方法 I , 这 些 方 5但 J
m n 放 置分层 后 弃 去 水 相 , 入 1mL P N溶 液 摇 i, 加 A 匀再 加入 0 2m . L氨水 ( 1+4 , 匀 后 静 置 1m n )摇 i, 小心放 掉少 量 的水 相 , 有 机相 移 入 1c 比色皿 , 将 m
于 5 8n 处测定 吸光 度 。 4 m
实验发 现 , 直接 加 P N 于有 机 相 中 , 液 不显 A 溶
食物中铁、铜、锰、镁、锌的测定方法

食物中铁、铜、锰、镁、锌的测定方法原子吸收分光光度法1.原理每种元素的原子能够吸收其特定波长的光能,而吸收的能量值与该光路中该元素的原子数目成正比。
用特定波长的光照射这些原子,测量该波长的光被吸收的程度,用标准溶液制成校正曲线。
根据被吸收的光量求出被测元素的含量。
2.适用范围依据中华人民共和国国家标准,铁:GB12396-90,铜:GB/T5009.13-96,锰:GB12396-90,镁:GB12396-90,锌:GB/T5009.14-96。
适用于所有食品及保健品中元素含量的测定,其元素含量在1mg/kg浓度以上。
3.仪器原子吸收光谱分光光度计4.试剂(1)硝酸(GB)高氯酸(GB)(2)混合酸消化液:硝酸+高氯酸按4:1混合(3) 0.5mol/L硝酸溶液:取33mL硝酸,加去离子水稀释至1000mL,定溶即成。
(4) 0.121%盐酸(5)去离子水:(KΩ)80万以上。
(6)国家标准物质研究中心提供的标准贮备液:铁标准溶液、铜标准溶液、锰标准溶液、锌标准溶液、镁标准溶液,以上标准液浓度均为1000μg/mL(7)标准质控物:国家标准物质研究中心提供的猪肝粉,室温干燥保存。
(8)标准储备液的配制:吸取上述标准溶液各10mL(镁5mL),分别移入100 mL容量瓶中,然后用稀释用溶液定容至100 mL(铁、铜、锰、镁用0.5mol/L硝酸溶液稀释定容,锌用1%盐酸稀释定容)。
以上各溶液须放聚乙烯瓶内,4℃冰箱保存。
5.操作步骤5.1样品制备:每种样品采集的总重量不得少于1.5Kg,样品须打碎混匀后再称重。
鲜样(如:蔬菜、水果、鲜鱼等)应先用水冲洗干净后,再用去离子水充分洗净,凉干后打碎称重。
所有样品应放在塑料瓶或玻璃瓶中4℃或室温保存。
5.2样品消化:准确称取样品干样(0.3-0.7g左右),湿样(1.0g左右),饮料等其他液体样品 (1.0-2.0g左右),然后将其放入50mL消化管中, 加混酸15mL左右,过夜。
水质 锌的测定 双硫腙分光光度法
FHZHJSZ0010 水质锌的测定双硫腙分光光度法F-HZ-HJ-SZ-0010水质双硫腙分光光度法l 范围 本方法规定了用双硫腙分光光度法测定水中的锌有关干扰问题见附录Aµ±Ê¹Óùâ³Ì³¤20mm比色皿检出限为5ìg/LÔÚ×î´óÎü¹â²¨³¤535nm测量时104 L/mol本方法规定水样经酸消解处理后2 原理在pH为4.0~5.5的乙酸盐缓冲介质中用四氯化碳萃取后进行分光光度测定铜镉铋金银对锌的测定有干扰3 试剂 本方法所用试剂除另有说明外实验中均用不含锌的水将普通蒸馏水通过阴阳离子交换柱以除去水中锌3.2 高氯酸(HClO4) 1. 75g/mLñ3.3.1 盐酸取500mL盐酸(3.3)用水稀释至1000mL2mol/L溶液3.3.3盐酸取10mL盐酸(3.3.2)溶液用水稀释到1000mL3.5 氨水(NH3ñ3.5.1 氨水 取10mL氨水(3.5)用水稀释至1000mLñ3.6.1 硝酸溶液 取20mL硝酸(3.6)用水稀释到1000mL0.032mol/L3.7 乙酸钠缓冲溶液3H2O)溶于水中另取1份乙酸将上述两种溶液按等体积混合直到最后的萃取液呈绿色3.8 硫代硫酸钠溶液5H2O)溶于100mL水中直到双硫腙溶液呈绿色为止3.9 双硫腙称取0.25g双硫腙(C13H12N4S)溶于250mL四氯化碳(3.1)·ÅÖÃÔÚ±ùÏäÄÚ¿É°´ÏÂÊö²½ÖèÌá´¿ÂËÒºÖ÷ÖҺ©¶·ÖдËʱ˫Áòëê½øÈëË®²ãÈ»ºóÓÃÑÎËá(3.3.1)中和合并四氯化碳层保存于冰箱内备用0.1g/L四氯化碳溶液3.11 双硫腙取40mL双硫腙四氯化碳溶液(3.10)当天配制0.004g/L四氯化碳溶液用四氯化碳(3.1)稀释至100mL(此溶液的透光度在500nm波长处用10mm比色皿测量时)3.13 柠檬酸钠溶液2H2O)溶解在90mL水中此试剂用于玻璃器皿的最后洗涤称取0.1000g锌粒(纯度99.9ÒÆÈë1000mL容量瓶中此溶液每毫升含100ìg锌取锌标准贮备溶液(3.14)10.00mL置于1000mL容量瓶中此溶液每毫升含1.00ìg¹â³Ì10mm或更长的比色皿容量为125和150mL4.3 玻璃器皿5 试样制备 5.1 实验室样品根据水样的类型提出的特殊建议进行采样使用前用硝酸然后用无锌水冲洗干净每1000mL水样立即加入2.0mL硝酸(3.6)加以酸化(pH约1.5)ÀýÈç·ñÔòÒª°´ÏÂÊö¶þÖÖ·½·¨´¦Àíÿ100mL水样加入1mL硝酸(3.6)冷却后用快速滤纸过滤然后用硝酸(3.6.2)稀释至一定体积5.2.2 含悬浮物和有机质较多的地面水或废水在电热板上加热消解到10mL左右再加入5mL硝酸(3.6)和2mL高氯酸(3.2)Õô·¢ÖÁ½ü¸ÉÀäÈ´ºóÂËÖ½ÓÃÏõËá(3.6.2)洗涤数次供测定用5.3 试份如果水样中锌的含量不在测定范围内如锌的含量太低如果取加酸保存的试样以除去过量酸(注意因为此类试剂中的含锌量往往过高)¼ÓÈÈÖó·Ð5min2~3之间6 操作步骤 6.1 测定6.1.l 显色萃取取10mL(含锌量在0.5~5置于60mL 分液漏斗中混匀后振摇4min½«ËÄÂÈ»¯Ì¼²ãͨ¹ýÉÙÐí½à¾»ÍÑÖ¬ÃÞ¹ýÂËÈë20mm 比色皿中采用合适的(如20mm)光程长的比色皿第一次采用本方法时以后的测定中均使用此波长)´ÓУ׼ÇúÏßÉϲé³ö²âÁ¿Ð¿Á¿6.2 空白试验 用适量(如10°´5.3和6.1的方法进行处理分别加入锌标准溶液(3.15)0 1.00 3.005.00mL向各分液漏斗中加入5mL 乙酸钠溶液(3.7)和1mL 硫代硫酸钠溶液(3.8)6.3.2 显色萃取上述溶液(6.3.1)用10.0mL 双硫腙四氯化碳溶液(3.12)摇动萃取4min ½«ËÄÂÈ»¯Ì¼²ãͨ¹ýÉÙÐí½à¾»ÍÑÖ¬ÃÞ¹ýÂËÈë20mm 比色皿中采用20mm 光程长的比色皿6.3.4 校准曲线的绘制从6.3.3测得的吸光度扣去试剂空白(零浓度)的吸光度后这条校准线应为通过原点的直线特别是分析一批水样或每使用一批新试剂时要检查一次Vm c =式中ìg mL8 精密度和准确度46个实验室曾用本方法分析过一个合成水样其他离子含量(以ìg/L计)为镉50铜470铅70得到的相对标准偏差为18.2相对误差为25.9 9 参考文献GB7472-87附录A 干扰及其消除 (补充件) 水中存在少量铋钴金汞钯对本方法均有干扰三价铁由于锌普遍存在于环境中因此需要采取特殊措施防止污染这种现象往往是起源于含氧化锌的玻璃橡胶制品试剂级化学药品或蒸馏水单独放置。
5BrPADAP分光光度法测定大米中的微量锌
第18卷第3期南阳师范学院学报Vol.18No 32019年5月JournalofNanyangNormalUniversityMay2019收稿日期:2018-12-14作者简介:段宁鑫(1997 ㊀)ꎬ女ꎬ河南周口人ꎬ南阳师范学院2016级应用化学专业学生.通信作者:包晓玉(1963 ㊀)ꎬ河南南阳人ꎬ教授ꎬ主要从事分析化学方面的研究.5 ̄Br ̄PADAP ̄分光光度法测定大米中的微量锌段宁鑫ꎬ王浩洋ꎬ王孟乐ꎬ包晓玉(南阳师范学院化学与制药工程学院ꎬ河南南阳473061)㊀㊀摘㊀要:用5 ̄Br ̄PADAP ̄分光光度法对大米中微量锌进行了测定.以5 ̄Br ̄PADAP为显色剂ꎬTritonX ̄114为表面活性剂ꎬ在pH=8的硼酸 ̄氢氧化钠缓冲溶液中ꎬ考察了显色剂用量㊁表面活性剂用量㊁缓冲液用量及pH等反应条件对测定结果的影响.实验结果表明:Zn2+与5 ̄Br ̄PADAP形成1ʒ2型络合物ꎬ其稳定常数为6.8ˑ108ꎬ最大吸收波长为λ=560nmꎬ吸光度与锌浓度在0.01~0.60μg/mL范围内呈线性关系ꎬ其线性回归方程为A=2.046C+0.0161ꎬ相关系数R=0.9996ꎬ相对标准偏差为4.5%ꎬ加标回收率在91%~96%之间.关键词:5 ̄Br ̄PADAPꎻ分光光度法ꎻ锌ꎻ大米中图分类号:O655.9㊀㊀㊀文献标志码:A㊀㊀㊀文章编号:1671-6132(2019)03-0022-040㊀引言锌是人体必需的微量元素之一ꎬ体内缺乏锌时ꎬ将引起锌酸活力减退而产生营养不良ꎬ免疫力下降ꎬ肝脾肿大及心血管疾病等[1].因此ꎬ通过食物或药物补锌是生长发育所必需的ꎬ而大米作为主食ꎬ测定其中锌的含量有一定的实际意义.微量锌的测定有许多方法ꎬ如极谱法[2]㊁分光光度法[3-4]㊁原子吸收光谱法[5-6]㊁ICP ̄OES法[7]㊁原子荧光光谱法[8]等.分光光度法具有操作简便㊁测定快速等优点ꎬ近年来常被用于测定微量金属元素[9-11].5 ̄Br ̄PADAP全称2 ̄(5 ̄溴 ̄2 ̄吡啶偶氮) ̄5 ̄二乙氨基苯酚ꎬ分子中含有四个带孤对电子的氮原子ꎬ故可在酸性㊁中性和弱碱性介质中质子化ꎬ并随溶液的pH值增大ꎬ酚羟基上的氢与质子化的氢逐渐离解ꎬ能与很多过渡元素离子形成有色配合物ꎬ是一种优良的分析试剂ꎬ广泛应用于测定岩石㊁矿物㊁合金中的多种金属元素[12-14].本文依据5 ̄Br ̄PADAP与Zn(Ⅱ)生成灵敏的紫色络合物ꎬ建立了5 ̄Br ̄PADAP ̄分光光度法测定大米中微量锌的方法ꎬ并测定了络合物的组成.1㊀实验部分1.1㊀主要仪器与试剂722N型可见分光光度计(上海仪电分析仪器有限公司)ꎻFA1004型分析天平(上海天平仪器厂)ꎻKQ ̄100B型超声波清洗器(昆山市超声仪器有限公司)ꎻpHS ̄3C型精密酸度计(上海大普仪器有限公司)ꎻWS70 ̄2型红外快速干燥箱(巩义市英峪予华仪器厂)ꎻTKA ̄GenPureUV ̄TOC/UF型超纯水制备仪(德国TKA公司).Zn(Ⅱ)储备溶液(1mg/mL):准确称取0.8392gZn(CH3COO)2 2H2O(AR.上海精华科技研究所)用超纯水稀释溶解ꎬ定容至250mL容量瓶中ꎬ摇匀ꎬ用时稀释成10μg/mL的Zn(Ⅱ)标准溶液ꎻ5ˑ10-3mol/L5 ̄Br ̄PADAP(ARꎬ江南结)乙醇溶液ꎻpH6.0~9.5的硼酸 ̄氢氧化钠缓冲溶液ꎻ2%TritonX ̄114(阿拉丁)水溶液ꎻ其余试剂均为分析纯ꎬ实验用水为超纯水.市售大米:105ħ下烘干ꎬ冷却ꎬ粉碎研磨ꎬ冰箱中保存备用[11].1.2㊀实验方法准确量取一定量的Zn(Ⅱ)标准溶液于10mL离心管中ꎬ依次加入0.1mL0.1mol/LpH=8.0的硼㊀第3期段宁鑫ꎬ等:5 ̄Br ̄PADAP ̄分光光度法测定大米中的微量锌酸 ̄氢氧化钠缓冲溶液ꎬ0.3mL2%TritonX ̄114溶液ꎬ0.4mL5ˑ10-4mol/L5 ̄Br ̄PADAP乙醇溶液ꎬ用超纯水稀释至10mLꎬ摇匀.静置10minꎬ用1cm比色皿在波长λ=560nm处ꎬ以试剂空白为参比测定其吸光度.2㊀结果与分析2.1㊀实验条件的选择2.1.1㊀最大吸收波长按照1.2实验方法ꎬ除波长以外其他条件不变ꎬ以试剂空白为参比ꎬ在500~600nm范围内测吸光度.用吸光度对波长作图(如图1所示).由图1可以看出ꎬ最大吸收波长在λ=560nm处.所以ꎬ本实验选560nm作为测定波长.图1㊀吸收曲线图2㊀吸光度A V5-Br-PADAP(mL)的关系曲线2.1.2㊀5 ̄Br ̄PADAP用量为了考察5 ̄Br ̄PADAP用量对络合物吸光度的影响ꎬ在6支离心管依次加入0.1~0.6mL的5ˑ10-3mol/L5 ̄Br ̄PADAP乙醇溶液ꎬ其他条件同1.2实验方法ꎬ在波长λ=560nm处ꎬ以试剂空白为参比ꎬ测定络合物的吸光度ꎬ结果如图2所示.由图2可知ꎬ当5 ̄Br ̄PADAP的用量在0.2~0.6mL时ꎬ基本处于一个平台ꎬ又因0.4mL时吸光度值最大ꎬ故本实验取0.4mL为最佳显色剂用量.2.1.3㊀TritonX ̄114用量按照1.2实验方法ꎬ固定其他条件不变ꎬ改变表面活性剂TritonX ̄114的用量ꎬ考察其对络合物吸光度的影响ꎬ结果见图3.可见ꎬ随着TritonX ̄114用量的增加络合物的吸光度迅速增大ꎬ0.3mL时达最大值ꎬ而后又缓慢减小.故本实验TritonX ̄114的用量取0.3mL.2.1.4㊀缓冲液最佳的pH值固定其他条件不变ꎬ改变缓冲溶液的pH值ꎬ按照1.2实验方法ꎬ测定络合物的吸光度ꎬ结果如图4所示.由图4不难看出ꎬ吸光度随pH值的增大先迅速增大ꎬpH值在6.0~9.5之间ꎬ变化不大ꎬ但以pH=8为最大.故本实验取pH=8的硼酸 ̄氢氧化钠缓冲溶液.图3㊀吸光度A VTritonX ̄114(mL)的关系曲线图4㊀吸光度A pH值的关系曲线32南阳师范学院学报㊀第18卷㊀2.1.5㊀缓冲溶液用量按照1.2实验方法ꎬ固定其他条件不变ꎬ测试硼酸 ̄氢氧化钠缓冲溶液用量对络合物吸光度的影响.结果表明:缓冲溶液加与不加对吸光度影响很大ꎬ当它的用量在0.02~0.3mL时ꎬ络合物的吸光度基本处于一个平台ꎬ为了保持实验的稳定性ꎬ取缓冲溶液用量为0.1mL.2.1.6㊀平衡时间按照1.2实验方法ꎬ测试平衡时间对络合物吸光度的影响.每隔5min测一次吸光度ꎬ连续测定1h.结果表明:10min以后络合物基本处于稳定状态.为了节省时间ꎬ静置10min后测吸光度.2.2㊀络合比的测定利用等摩尔连续变化法测定络合物的组成.按照1.2实验方法ꎬ配制Zn(Ⅱ)标准溶液浓度(CM)与显色剂5 ̄Br ̄PADAP浓度(CR)之比分别为1ʒ9㊁2ʒ8㊁3ʒ7㊁4ʒ6㊁5ʒ5㊁6ʒ4㊁7ʒ3㊁8ʒ2㊁9ʒ1的溶液ꎬ其他条件不变ꎬ分别测定相应的吸光度.以吸光度对CM/(CM+CR)作图ꎬ结果如图5所示.由图5可计算出Zn(Ⅱ)与5 ̄Br ̄PADAP的络合比为1ʒ2ꎬ稳定常数为6.8ˑ108.2.3㊀标准曲线的绘制按照1.2实验方法ꎬ固定其他条件不变ꎬ改变Zn(Ⅱ)标准溶液的用量ꎬ测定络合物的吸光度.以吸光度对Zn浓度(μg/mL)作图(如图6所示).由图6可知ꎬ吸光度与锌的浓度在0.01~0.60μg/mL范围内成线性相关.线性回归方程为A=2.046C+0.0161ꎬR=0.9996.图5㊀等摩尔连续变化法图6㊀锌的标准曲线2.4㊀干扰实验按照1.2实验方法ꎬ控制相对误差为ʃ5%ꎬ考察K+㊁Ca2+㊁Cu2+㊁Fe3+等对Zn(Ⅱ)测定的干扰.结果表明ꎬ1000倍的K+㊁Ca2+和20倍的Fe3+不影响Zn2+的测定ꎬCu2+的干扰可加入1.5mL200.0g/mLNa2S2O3消除[1].2.5㊀样品分析2.5.1㊀样品处理采用干灰化法处理大米样品[11]:称取处理好的大米5.0000g于100mL坩埚中ꎬ炭化至无烟ꎬ于马弗炉内650ħ灰化6h至成灰白色ꎬ冷却至室温ꎬ加5mmol/L的硝酸溶解ꎬ用超纯水稀释至5mLꎬ保存备用.2.5.2㊀大米中锌含量的测定用2.5.1处理的样品ꎬ按照1.2的实验方法测定吸光度ꎬ利用标准曲线法计算样品中锌的含量ꎬ并进行加标回收实验ꎬ结果如表1所示.表1㊀大米中锌含量的测定结果编号测定值/(μg/mL)加入值/(μg/mL)测定总值/(μg/mL)回收率/%样品锌含量/(mg/kg)样品锌含量平均值/(mg/kg)RSD/%10.0740.10.17195.92.472.334.520.0670.16191.02.2330.0710.16895.82.3740.0680.16392.62.29 4252 ㊀第3期段宁鑫ꎬ等:5 ̄Br ̄PADAP ̄分光光度法测定大米中的微量锌3㊀结论利用锌与5 ̄Br ̄PADAP在表面活性剂TritonX ̄114的存在下ꎬ于pH=8的硼酸 ̄氢氧化钠缓冲溶液中生成稳定络合物的性质ꎬ建立了分光光度法测定微量锌的方法ꎬ用于大米中微量锌的测定ꎬ结果令人满意.参㊀考㊀文㊀献[1]㊀王彦兵ꎬ刘绣华ꎬ李明静.Zn(Ⅱ) ̄5 ̄Br ̄PADAP ̄CPB体系分光光度法测定锌[J].食品研究与开发ꎬ2012ꎬ33(12):77-80.[2]㊀余作霖ꎬ马忠良.示波极谱法测定电炉渣中铁和锌[J].冶金分析ꎬ2000ꎬ20(6):46-48.[3]㊀曹利慧.电热板消解分光光度法测定土壤中锌的含量[J].化学工程与装备ꎬ2018(1):252-254.[4]㊀胡亮ꎬ陈加希ꎬ王鲁民ꎬ等.双硫腙水相光度法快速测定水中微量铅[J].昆明理工大学学报ꎬ2007ꎬ32(6):81-83. [5]㊀宮博ꎬ蓝图ꎬ李崇江ꎬ等.微波消解 火焰原子吸收光谱法测定大米中微量锌[J].粮食科技与经济ꎬ2018ꎬ43(2):69-71.[6]㊀陶建ꎬ蒋炜丽ꎬ王晖ꎬ等.石墨炉原子吸收光谱法测定茶叶中铅含量的方法学研究[J].中国食品学报ꎬ2010ꎬ10(6):208-212.[7]㊀黄易勤ꎬ黄超冠ꎬ苟瑞ꎬ等.微波消解ICP ̄OES法测定离子型稀土矿渣中的铜铅锌镉[J].湿法冶金ꎬ2019ꎬ38(1):75-78.[8]㊀龚少.原子荧光光谱法测定地下水中的锌㊁镉[J].华北国土资源ꎬ2017(6):111-112.[9]㊀金文斌.百里香酚蓝分光光度法测定铝合金中钛[J].冶金分析ꎬ2018ꎬ38(12):75-78.[10]㊀李淑开ꎬ李智高ꎬ左国涛ꎬ等.微波消解 分光光度法测定膨化食品中铝的含量[J].食品安全质量检测学报ꎬ2018ꎬ9(23):6242-6246.[11]㊀孙亚南ꎬ段宁鑫ꎬ叶梦颖ꎬ等.浊点萃取分光光度法测定大米中的铅含量[J].南阳师范学院学报ꎬ2018ꎬ17(3):11-14.[12]㊀李佗ꎬ杨军红ꎬ翟通德ꎬ等.5 ̄Br ̄PADAP分光光度法测定锆合金中铌[J].冶金分析ꎬ2017ꎬ37(5):49-52. [13]㊀GHONEIMEM.SimultaneousdeterminationofMn(Ⅱ)ꎬCu(Ⅱ)andFe(Ⅲ)as2 ̄(5ᶄ ̄bromo ̄2ᶄ ̄pyridylazo) ̄5 ̄diethyl ̄aminophenolcomplexesbyadsorptivecathodicstrippingvoltammetryatacarbonpasteelectrode[J].Talantaꎬ2010ꎬ82(2):646-652.[14]㊀邓秀琴ꎬ吴丽香.微乳液介质 ̄5 ̄Br ̄PADAP显色体系光度法测定渣油中的锌(Ⅱ)[J].应用化工ꎬ2015ꎬ44(11):2142-2144.Determinationoftracezincinriceby5 ̄Br ̄PADAP ̄spectrophotometryDUANNingxinꎬWANGHaoyangꎬWANGMengleꎬBAOXiaoyu(SchoolofChemistryandPhamaceuticalEngineeringꎬNanyangNormalUniversityꎬNanyang473061ꎬChina)Abstract:Thispaperstudies5 ̄Br ̄PADAPandspectrophotometricmethodforthedeterminationoftracezincinriceꎬwith5 ̄Br ̄PADAPaschromogenicagentꎬTritonX ̄114forthesurfaceactiveagentꎬboricacidandsodiumhydroxideinpH=8inthebuffersolutionꎬandtheeffectsofreactionconditionssuchastheamountofcolorantꎬsurfactantꎬbufferandpHonthedeterminationresultsareinvestigated.Theresultsshowthat:Zn2+forms1ʒ2complexwith5 ̄br ̄padapꎬofwhichthestabilityconstantis6.8ˑ108ꎬthemaximumabsorptionwavelengthislambda560nmꎬtheabsorbanceislinearlyrelatedtothezincconcentrationwithintherangeof0.01~0.60μg/mLꎬthelinearregressionequationisA=2.046C+0.0161ꎬthecorrelationcoefficientR=0.9996ꎬtherelativestand ̄arddeviationis4.5%andthestandardrecoveryis91%~96%.Keywords:5 ̄Br ̄PADAPꎻspectrophotometryꎻzincꎻrice。
锌矿测定全套方法
总锌锌(Zn)是人体必不可少的有益元素。
碱性水中锌的浓度超过5mg/L时,水有苦涩味。
并出现乳白色。
水中含锌lmg/L时,对水体的生物氧化过程有轻微抑制作用。
锌对白鲢鱼的安全浓度为0.lmg /L。
农灌水中含锌量低于10mg/L时,对水稻、小麦的生长无影响。
美国天然水中的平均含锌量为64µg/L,海水中的最高含锌量为10µg /L。
锌的主要污染源是电镀、冶金、颜料及化工等部门的排放废水。
方法的选择直接吸入火焰原子吸收分光光度法测定锌,具有较高的灵敏度,干扰少,适合测定各类水中的锌。
不具备原子吸收光谱仪的单位,可选用双硫腙比色法、阳极溶出伏安法或示波极谱法。
一、原子吸收分光光度法(一)直接吸入火焰原子吸收分光光度法GB7475--87 概述1、方法原理将样品或消解处理好的试样直接吸入火焰,火焰中形成的原子蒸气对光源发射的特征电磁辐射产生吸收。
将测得的样品吸光度和标准溶液的吸光度进行比较,确定样品中被测元素的含量。
2、干扰及消除地下水和地面水中的共存离子和化合物,在常见浓度下不干扰测定。
样品中溶解硅的含量超过20mg/L时干扰锌的测定,使测定结果偏低,加入200mg/L钙可消除。
铁的含量超过100mg/L时,抑制锌的吸收。
基于上述原因,分析样品前需要检验是否存在基体干扰或背景吸收。
一般通过测定加标回收率,判断背景吸收的大小。
根据下表选择与选用分析线相对应的非特征吸收谱线。
背景校正用的邻近线波长根据检验的结果, 如存在基体干扰,可加入干扰抑制剂,或用标准加入法测定并计算结果.如果存在背景吸收,用自动背景校正装置或邻近非特征吸收谱线法进行校正。
后一种方法是从分析线处测得的吸收中扣除邻近非特征吸收谱线处的吸收, 得到被测元素原子的真正吸收。
此外, 也可通过萃取或样品稀释、分离或降低产生基体干扰或背景吸收的组分。
3、方法的适用范围本法适用于测定地下水、地面水和废水中的锌。
适用浓度范围与仪器的特性有关,下表列出一般仪器的适用浓度范围。
微乳介质分光光度法测定微量锌
・
5 ・ 6
广 州化 工
20 07年 3 第 4期 5卷
微 乳 介 质 分 光 光 度 法 测 定 微 量 锌
衷 明华 叶 伟2 黄俊生 , ,
( 韩 山师范 学院化 学 系 广 东 潮 州 5 14 ; 1 2 0 1 2防化 指挥 工程 学 院化 学 系 北京 昌平 12 0 ) 0 2 5
fr ic 1) T e to s od tr ie ic I)i t mp swi o n ( . h h di ue t ee n n (I n e s l t z me s d m z aa e h ̄t f tr eut. i a oyr l sc s s
Ke r s s e t p o o ty y wo d : p c r h t me r ;mir e lin;z c e o c o mu s o i ;ta n
多金属元素 的测定 , 曾有文献报道用于锌的萃取 一光度与 也
析相 一光 度 测 定 , 。 本 文 尝 试 着 将 5一B —P D P 显 色 7 8 J r A A 剂应 用 于微 乳 介 质 微 量 锌 的 分 光 光 度 法 测定 , 究 表 明本 文 研
定的干扰 。为 了有效地 校正剩余试 剂在配合 物体 系 中的影
乙 氨基 苯 酚 ( 5一B —P D P) 为 显 色 剂 已 被 广 泛 用 于 许 r AA 作
7 2型光栅分光光度计上 , 2 以蒸馏 水为参 比 , 5 0n l 在 6 l 的测 T
量波长 ,4 / 4 5nn为参 比波长测定溶液的吸光度AA。
AA=
一 l
, K锱
r/ ̄p rA T n M
lr b r t i =10 4×1 I ( o・ ) a 6 n . eBe r slw b y d i h a g f0 1 ./ / a  ̄ p i t i e .6 a vys 0 t l ・o ㈣ 一 t O t Th e ’ o i o e e n t ern eo . -0 5 g mL 5 o s ,
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
锌分光光度法测定
锌是一种重要的金属元素,广泛应用于冶金、化工、电子等领域。
为了准确测定样品中的锌含量,科学家们发展了多种测定方法,其中之一就是锌分光光度法。
本文将介绍锌分光光度法的原理、操作步骤以及一些注意事项。
一、原理
锌分光光度法是利用锌离子在特定波长下的吸收特性来测定锌含量的方法。
在分光光度计的作用下,样品中的锌离子吸收入射光的能量,产生吸光度变化。
通过测定吸光度的大小,可以间接测定样品中锌的含量。
二、操作步骤
1. 样品的制备:将待测样品溶解于适当的溶剂中,并进行必要的预处理,如过滤、稀释等。
2. 仪器的调节:根据实际需要选择合适的波长,调节分光光度计的仪器参数,使其在最佳状态下工作。
3. 标准曲线的绘制:取一系列已知浓度的锌标准溶液,分别测定其吸光度,并绘制标准曲线。
4. 样品吸光度的测定:将经过预处理的样品溶液放入光度池中,通过分光光度计测定其吸光度。
5. 锌含量的计算:根据标准曲线,将样品吸光度值代入计算公式,
计算出样品中锌的含量。
三、注意事项
1. 样品的制备过程中应注意避免污染和挥发损失。
2. 在进行吸光度测定时,要保证光度池的清洁和透明度,避免杂质对测量结果的影响。
3. 在绘制标准曲线时,应选择合适的浓度范围,确保曲线的线性关系。
4. 测定时要严格控制溶液的pH值和温度,以保证测量结果的准确性和可重复性。
锌分光光度法作为一种常用的测定方法,具有操作简便、结果准确、灵敏度高等优点。
然而,也存在一些局限性,比如只适用于锌离子含量较高的样品,不能直接测定锌在有机物中的含量等。
在实际应用中,锌分光光度法已被广泛应用于水质监测、食品安全、环境保护等领域。
例如,在食品中测定锌的含量可以评估其营养价值和安全性;在环境监测中,测定水体中的锌含量可以判断其受到的污染程度。
锌分光光度法是一种可靠、有效的锌含量测定方法。
通过合理操作和仪器调节,可以得到准确可靠的结果。
然而,在实际应用中仍需注意样品制备、仪器调节和测定条件的控制,以确保测定结果的可靠性和准确性。
