复旦大学生物化学笔记
复旦大学课程教学大纲样表

细胞生物学是细胞学与分子细胞生物学的中间课程,所以教学的重点是通过交互的方式,既兼顾基础,又注意与分子的衔接,重点是细胞器的结构体系和生物学功能。
细胞生物学教学中,重点讲授细胞的基本知识及基本实验技术;各个亚细胞结构及超微结构、各结构的装配及功能;细胞的重大生命活动(增殖、分化、衰老、凋亡等)过程及基本的调控。难点是细胞各个结构的功能中涉及的作用机制(包括假说、模型等)以及细胞重大生命活动的调控机制;需多个细胞器参与完成并相互协调的过程、机制(如蛋白质的分选、膜泡运输等),为做到突出重点内容,讲清难点,并跟上生命科学的发展步法,要着重做好以下几点:
第三章细胞生物学研究方法(3学时)
1、细胞形态结构的观察方法
2、细胞组分的分析方法
3、细胞培养、细胞工程与显微操作技术
掌握光学显微镜技术(特点,生物学应用);了解分辨率;了解电子显微镜技术(分辨率,基本结构,分类,超薄切片技术,;扫描隧道显微镜(分辨率)
掌握超速离心技术(差速离心,密度梯度离心);细胞内核酸、蛋白质、酶、糖类与脂质的显示方法;了解特异蛋白抗原的定位与定性(免疫荧光,免疫电镜);了解同位素示踪技术;了解定量细胞化学分析技术
教学目的:
通过理论课和实验课,了解细胞生物学的深层次基础理论与最新进展,使学生感到无论是过去,现在和将来,医学的发展与细胞生物学的发展无不密切相关。掌握细胞生物学实验的基本原理和方法,给研究生今后开展本学科及相关学科的课题研究以启迪。
课程基本内容简介:
细胞生物学是利用分子生物学手段从细胞水平来阐述生命现象的学科,掌握细胞结构、功能和细胞相互作用的分子机制,从而了解有机体的生长发育、繁殖分化、遗传变异、运动、衰老和死亡等生命活动基本规律。采用老师授课结合研讨型课程方式进行教学,既系统阐述本学科的基础理论,又能训练学生主动了解前沿进展的能力。
复旦大学学位评定委员会公告

复旦大学学位评定委员会公告
2013年第3号
复旦大学学位评定委员会于2013年6月25日召开了第81次会议。
会议由校学位评定委员会主席、校长杨玉良主持,参加会议并投票的委员有33人。
会议审议通过78篇论文为我校2012年校级优秀学位论文,其中博士学位论文49篇,硕士学位论文29篇。
根据《复旦大学优秀博士学位论文评选、奖励办法》规定,校学位评定委员会决定公布之日起,任何人均可对相应的决定提出异议。
自2013年6月28日至2013年8月26日,如对本次公布名单有不同意见,可直接向复旦大学学位评定委员会办公室书面提出。
公示无异议者,由学校颁发复旦大学校级优秀学位论文证书。
特此公告。
复旦大学学位评定委员会 2013年6月28日
复旦大学2012年优秀博士学位论文名单
复旦大学2012年优秀硕士学位论文名单。
【考研百科】复旦大学报考指南(最新修订版)

考研VIP百科全书之考研院校篇华东地区章复旦大学报考指南研途教育网络部版权所有苏州研途教育科技有限公司“考研百科知识系列”涵盖考研院校报考指南、考研专业报考指南、考研常识以及考研课程指南,旨在帮助考生了解考研院校、了解报考专业、了解考研流程,集合考研方方面面的知识与备考指导,帮助考生正确认识自身,准确定位报考院校专业,重新选择一条适合自己的研究之路。
其中考研院校覆盖全国39所985高校、76所211高校、500所普通院校及200所科研机构;考研专业指南涵盖13个学科门类(除军事学)中110个一级学科解读,以全面、权威、精准为标准,打造中国研究生考试真正的百科全书。
---------------------------------------------------------------------------内容提要考研百科系列之复旦大学报考指南,旨在帮助考生认识复旦大学及报考复旦大学需要注意的各项事宜,帮助考生认识复旦大学研究生招生情况,了解复旦大学报考情况、分数情况、录取情况,通过各项数据与信息,帮助考生确定报考专业,梳理考研各科复习,明确复习节奏,一步步考上复旦大学研究生!--------------------------------------------------------------------------- 编著研途教育网络部编辑韩晶磊汤琪权丹丹范唯张勇强编审商賀光版权归苏州研途教育科技有限公司所有目录一、复旦大学概述 (3)1.1复旦大学概况与荣誉 (3)1.2复旦大学研究生招生介绍 (3)1.3复旦大学科研成果展示 (3)二、复旦大学重点建设学科 (3)2.1重点建设学科与专业 (3)2.2学科建设成果 (4)三、复旦大学招生简章与目录 (5)3.1复旦大学招生简章 (5)3.2复旦大学招生目录 (6)四、复旦大学历年报考信息 (38)4.1复旦大学历年复试分数线 (38)4.2复旦大学历年报录数据 (39)4.3复旦大学优秀导师推荐 (46)五、复旦大学报考指导 (47)5.1复旦大学研究生就业分析 (47)5.2复旦大学报考指导 (48)5.3复旦大学专业课大纲 (49)5.4复旦大学历年真题 (50)5.5复旦大学备考规划 (51)六、复旦大学同类大学推荐 (52)附件一、复旦大学初试基本分数要求 (52)附件二、复旦大学硕士研究生报录情况 (10)附件三、复旦大学临床医学考研大纲 (23)附件四、复旦大学古代文学专业课备考规划 (24)一、复旦大学概述1.1复旦大学概况与荣誉复旦大学位于中国的经济中心上海市,建于1905年,是一所拥有哲学、经济、法学、教育、文学、历史、理学、工学、医学、管理、艺术等11个学科门类的综合性大学,是教育部与上海市共建的全国首批重点大学,中国首批7所211工程、9所985工程大学,首批“珠峰计划”、“111计划”和中国顶尖学府“九校联盟”(C9联盟)的成员。
复旦大学2013年硕士研究生报录比
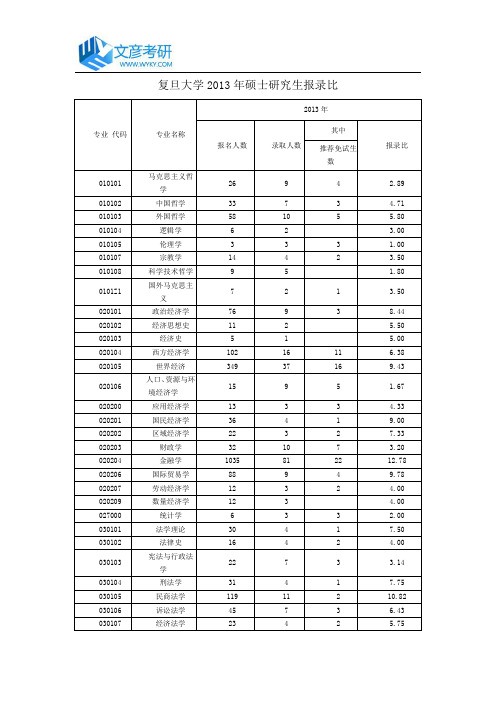
120100
47
程
12
11
120200
工商管理
152
28
25
120203
旅游管理
22
3
2
1202Z3
财务管理
334
47
43
1202Z4
金融工程管理
269
39
32
120401
行政管理
16
14
14
120404
社会保障
9
4
2
1204Z1
环境管理
11
5
5
120422
公共政策
1
120501
图书馆学
9
4
1
130300
影像医学与核
100207
40
15
医学
临床检验诊断
100208
36
8
5
学
100210
外科学
82
31
6
100211
妇产科学
48
12
100212
眼科学
24
8
4
100213
耳鼻咽喉科学
17
7
5
100214
肿瘤学
75
19
康复医学与理
100215
14
4
疗学
100216
运动医学
5
1
100217
麻醉学
7
100218
030103
030104 030105 030106 030107
马克思主义哲 学
中国哲学 外国哲学
逻辑学 伦理学 宗教学 科学技术哲学 国外马克思主 义 政治经济学 经济思想史 经济史 西方经济学 世界经济 人口、资源与环 境经济学 应用经济学 国民经济学 区域经济学 财政学 金融学 国际贸易学 劳动经济学 数量经济学 统计学 法学理论 法律史 宪法与行政法 学 刑法学 民商法学 诉讼法学 经济法学
2009复旦大学年研究生录取统计表
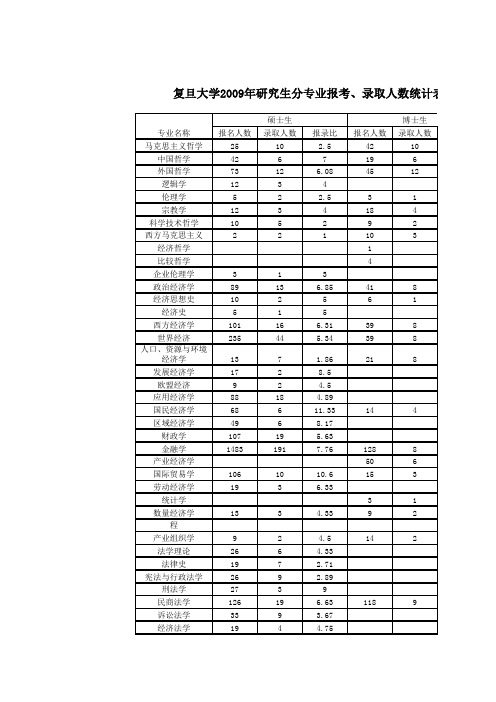
报名人数录取人数报录比报名人数录取人数马克思主义哲学2510 2.54210中国哲学4267196外国哲学7312 6.084512逻辑学1234伦理学52 2.531宗教学1234184科学技术哲学105292西方马克思主义221103经济哲学1比较哲学4企业伦理学313政治经济学8913 6.85418经济思想史102561经济史515西方经济学10116 6.31398世界经济23544 5.34398人口、资源与环境经济学137 1.86218发展经济学1728.5欧盟经济92 4.5应用经济学8818 4.89国民经济学68611.33144区域经济学4968.17财政学10719 5.63金融学14831917.761288产业经济学506国际贸易学1061010.6153劳动经济学1936.33统计学31数量经济学133 4.3392金融管理与金融工程产业组织学92 4.5142法学理论266 4.33法律史197 2.71宪法与行政法学269 2.89刑法学2739民商法学12619 6.631189诉讼法学339 3.67经济法学1944.75复旦大学2009年研究生分专业报考、录取人数统计表专业名称硕士生博士生环境与资源保护法学145 2.8国际法学131177.71526法律硕士648156 4.15政治学理论78136478中外政治制度226科学社会主义与国际共产主义运动83 2.67中共党史94 2.25242国际政治418 5.136010国际关系13320 6.65286外交学7024 2.92175社会学8623 3.74418人口学632人类学73 2.33民俗学313马克思主义基本理论94 2.25184马克思主义中国化研究73 2.3352思想政治教育2810 2.8367课程与教学论154 3.75高等教育学245 4.8教育经济与管理(教育学)3248文艺学309 3.33255语言学及应用语言学335 6.6143汉语言文字学3615 2.4208中国古典文献学197 2.71297中国古代文学12418 6.894511中国现当代文学5711 5.18235比较文学与世界文学458 5.63255中国文学批评史135 2.6134艺术人类学与民间文学422183现代汉语语言学441122影视文学71对外汉语教学206 3.33中国文学古今演变31342文学写作818汉语国际教育硕士163 5.33英语语言文学12919 6.79497俄语语言文学72 3.5法语语言文学103 3.33德语语言文学221日语语言文学1535亚非语言文学2137外国语言学及应用语言学8238新闻学396468.614913传播学3021225.17898广告学124620.67广播电视学50316.67325编辑出版17117公共关系45145媒介管理学39219.5183国际传播3719 1.95电影学92 4.5广播电视艺术学1535史学理论及史学史147222考古学及博物馆学257 3.5771历史地理学7618 4.223513历史文献学11162专门史214 5.25166中国古代史5969.83114中国近现代史388 4.75228世界史478 5.88155文物学254 6.25115人口史11当代中国史41基础数学5519 2.892512计算数学1811 1.6498概率论与数理统计259 2.78123应用数学6317 3.7164运筹学与控制论4111 3.7384理论物理3510 3.51917粒子物理与原子核物理44111原子与分子物理109 1.1132凝聚态物理5728 2.042418光学3519 1.841512无线电物理111无机化学1510 1.52414分析化学3011 2.73169有机化学3910 3.93916物理化学5520 2.753417高分子化学与物理7342 1.744131化学生物学239 2.561914应用化学45植物学74 1.7552动物学623生理学96 1.563微生物学5512 4.5875神经生物学8535 2.432722遗传学9747 2.064832发育生物学128 1.5106细胞生物学818生物化学与分子生物学12744 2.894531生物物理学118 1.3822生态学2112 1.75118生物信息学63253人类生物学41422一般力学与力学基础54 1.25固体力学53 1.67流体力学422119工程力学103 3.33光学工程1243材料物理与化学2418 1.332711材料学215 4.2物理电子学2614 1.861010电路与系统7726 2.96106微电子学与固体电子学354106 3.345427电磁场与微波技术42254信息功能材料与器件53 1.67光电系统与控制技术97 1.29通信与信息技术6019 3.16计算机系统结构37312.33174计算机软件与理论30887 3.547118计算机应用技术15840 3.954711飞行器设计134 3.25环境科学2014 1.433514环境工程159 1.67生物医学工程62322医学电子学116 1.8374生物力学85人体解剖与组织胚胎学155375免疫学175 3.453病原生物学239 2.562112病理学与病理生理学5912 4.92148法医学194 4.7553放射医学53 1.6753分子医学32 1.533医学信息学51511疾病蛋白组学266 4.332016内科学32150 6.4212352儿科学9323 4.043719老年医学1226神经病学5769.5309精神病与精神卫生学762皮肤病与性病学315 6.2164影像医学与核医学8415 5.63615临床检验诊断学236 3.8371护理学1331112.09外科学29144 6.6116953妇产科学1681511.23913眼科学6112 5.083011耳鼻咽喉科学4310 4.34015肿瘤学12119 6.3710921康复医学与理疗学1411442运动医学71731麻醉学4868134急诊医学1025全科医学717口腔临床医学52 2.5流行病学与卫生统计学7722 3.54012劳动卫生与环境卫生学218 2.63114营养与食品卫生学3849.583儿少卫生与妇幼保健学154 3.7533卫生毒理学52 2.542社区卫生与健康促进73 2.33中西医结合基础83 2.6774中西医结合临床387 5.43207药物化学4914 3.553药剂学6320 3.153814生药学95 1.822药物分析学156 2.5药理学4115 2.731912生物医学工程(医学)616社会医学与卫生事业管理(医学)7617 4.47管理科学与工程8126 3.125311工商管理19641 4.78会计学226企业管理20630 6.8713515旅游管理6019 3.16101东方管理学151工商管理硕士1790405 4.42行政管理153169.56295社会医学与卫生事业管理4010社会保障1553环境管理961.5社会管理与社会政策337公共政策22图书馆学83 2.67法律硕士(法学)6564 1.02光学工程(专业学位)212材料工程65 1.2电子与通信工程(专业学位)771集成电路工程(专业学位)4341 1.05计算机技术4443 1.02化学工程硕士19191环境工程(专业学位)991生物工程30301物流工程30301临床医学硕士1251251口腔医学硕士331会计硕士3027 1.11汉语国际教育硕士3935 1.11英汉笔译3732 1.16合计1357432764.1436341139大学2008年招收学历教育研究生分专业报考、录取人数统计表报名人数录取人数报录比报名人数录取人数马克思主义哲学359 3.89369中国哲学2874196外国哲学6912 5.754515逻辑学842伦理学83 2.6741宗教学1243113科学技术哲学1352.6232西方马克思主义82经济哲学71比较哲学企业伦理学政治经济学5911 5.36377经济思想史32 1.551经济史616西方经济学117157.8356世界经济270475.74337专业名称硕士生博士生人口、资源与环境经济学2711 2.45186发展经济学92 4.5欧盟经济52 2.5应用经济学6617 3.88国民经济学4467.33184区域经济学9827 3.63财政学74107.4金融学122710112.159312产业经济学499国际贸易学1271012.7183劳动经济学2538.33统计学数量经济学58319.33112金融管理与金融工程24212211产业组织学112 5.592投资学42221法学理论266 4.33法律史218 2.63宪法与行政法学228 2.75刑法学224 5.5民商法学124148.8610817诉讼法学548 6.75经济法学31310.33环境与资源保护法学174 4.25国际法学169189.398010法律硕士858150 5.72政治学理论103128.585410中外政治制度314科学社会主义与国际共产主义运动74 1.75中共党史74 1.75204国际政治5787.13489国际关系164217.81477外交学5723 2.48194社会学9721 4.62408人口学74 1.75人类学83 2.67民俗学212马克思主义基本理论340.75203马克思主义中国化研究32 1.5222思想政治教育331131356课程与教学论133 4.33高等教育学1243教育经济与管理(教育学)264 6.5文艺学3510 3.5327语言学及应用语言学457 6.43154汉语言文字学4112 3.423513中国古典文献学185 3.6125中国古代文学135177.944511中国现当代文学6711 6.093710比较文学与世界文学4312 3.58315中国文学批评史114 2.75214艺术人类学与民间文学623172现代汉语语言学41471影视文学71对外汉语教学275 5.4中国文学古今演变414文学写作22211英语语言文学13720 6.85597俄语语言文学72 3.5法语语言文学103 3.33德语语言文学616日语语言文学133 4.33亚非语言文学2739外国语言学及应用语言学616319新闻学411459.135713传播学2741321.08694广告学140528广播电视学4659.2395编辑出版35217.5公共关系33133媒介管理学64512.8国际传播32310.67电影学92 4.5广播电视艺术学22211史学理论及史学史264考古学及博物馆学207 2.8664历史地理学5617 3.292510历史文献学3专门史1472115中国古代史357573中国近现代史338 4.132110世界史5717 3.35245文物学163 5.3383人口史21当代中国史基础数学6523 2.832515计算数学137 1.8663概率论与数理统计239 2.56123应用数学5717 3.3583运筹学与控制论4013 3.08116理论物理4822 2.181712粒子物理与原子核物理230.6721原子与分子物理10120.8376等离子体物理111凝聚态物理462323530光学4219 2.21128无线电物理32 1.5无机化学2714 1.932319分析化学2793165有机化学4610 4.64212物理化学6327 2.333622高分子化学与物理703524425化学生物学2217 1.29138应用化学52 2.541植物学61643动物学85 1.6生理学74 1.7585微生物学4912 4.08179神经生物学6327 2.332720遗传学884426137发育生物学72 3.5106细胞生物学1025生物化学与分子生物学11225 4.485932生物物理学87 1.1422生态学2416 1.5105生物信息学73 2.3373人类生物学32 1.5一般力学与力学基础43 1.33固体力学43 1.33流体力学450.81110工程力学115 2.2光学工程65 1.2材料物理与化学2517 1.472510材料学1863物理电子学1714 1.211310电路与系统7521 3.57107微电子学与固体电子学329107 3.074728电磁场与微波技术51522信息功能材料与器件64 1.5光电系统与控制技术95 1.8通信与信息技术5119 2.68计算机系统结构4410 4.4131计算机软件与理论33987 3.98921计算机应用技术14437 3.894116飞行器设计104 2.5环境科学3222 1.452910环境工程1472生物医学工程32 1.532医学电子学145 2.874生物力学63人体解剖与组织胚胎学107 1.4364免疫学255573病原生物学2110 2.12111病理学与病理生理学8213 6.31149法医学205432放射医学340.7544分子医学62364医学信息学522疾病蛋白组学222211412内科学417508.3418154儿科学10322 4.684118老年医学112 5.5288神经病学6061063精神病与精神卫生学52 2.5153皮肤病与性病学381383815影像医学与核医学9317 5.4741临床检验诊断学275 5.4护理学80117.27外科学403439.3722549妇产科学1661511.075412眼科学6712 5.58329耳鼻咽喉科学4312 3.584714肿瘤学148217.059722康复医学与理疗学104 2.573运动医学1311341麻醉学3957.8154急诊医学92 4.5全科医学循证医学口腔临床医学632流行病学与卫生统计学5318 2.943112劳动卫生与环境卫生学2510 2.5125营养与食品卫生学356 5.8331儿少卫生与妇幼保健学95 1.822卫生毒理学53 1.6752社区卫生与健康促进1025中西医结合基础52 2.563中西医结合临床5110 5.1146药物化学2211274药剂学5014 3.574110生药学73 2.3353药物分析学227 3.14药理学3211 2.91195生物医学工程(医学)92 4.5社会医学与卫生事业管理(医学)8618 4.78管理科学与工程9430 3.13419管理科学信息管理与信息系统物流与运营管理112工商管理24039 6.15会计学302企业管理16730 5.5714012旅游管理6119 3.21171技术经济及管理东方管理学223市场营销财务管理金融工程管理工商管理硕士2016375 5.38行政管理140159.33205社会医学与卫生事业管理287教育经济与管理社会保障165 3.2环境管理166 2.67社会管理与社会政策287公共政策6图书馆学1535注:本表统计数字不含港澳台和外籍研究生。
复旦大学2011届本专科毕业生生源信息

类别
专业
人数
类别
专业
人数
人文
博物馆学
30
自然科学
材料化学
12
传播学
20
材料物理
30
广播电视新闻学
43
高分子材料与工程
39
广告学
45
化学
80
汉语言
19
环境科学
70
汉语言文学
63
理论与应用力学
32
历史学
33
生物技术
28
新闻学
61
生物科学
120
艺术设计
26
数学与应用数学
5
3
计算机应用技术
41
11
科学社会主义与国际共运
4
计算数学
6
2
历史地理学
15
14
理论物理
17
10
历史文献学
2
粒子物理与原子核物理
2
2
伦理学
3
1
流体力学
4
13
逻辑学
4
凝聚态物理
21
24
思政教育
8
3
人口、资源与环境经济学
9
4
马克思主义哲学
10
11
生态学
11
9
民商法学
13
8
生物化学与分子生物学
20
30
民俗学
社会工作
21
药学
57
社会学
46
预防医学
68
心理学
26
护理学(高职)
200
思想政治教育
19
行政管理
复旦大学2011届本专科毕业生生源信息
生物物理学
6
2
人口学
4
生物信息学
3
9
人类学
3
生物医学工程
3
1
日语语言文学
3
通信与信息系统
20
社会保障
4
微电子学与固体电子学
108
35
外国语言学及应用语言学
1
5
微生物学
12
11
社会学
16
11
无机化学
12
21
史学理论及史学史
5
无线电物理
1
世界史
15
9
物理电子学
15
12
诉讼法学
7
物理化学
17
18
图书馆学
社会工作
21
药学
57
社会学
46
预防医学
68
心理学
26
护理学(高职)
200
思想政治教育
19
行政管理
47
政治学与行政学
20
外语
朝鲜语
19
德语
16
法语
17
日语
13
英语
58
俄语
15
复旦大学2011届研究生毕业生生源信息
类别
硕士
博士
类别
专业
硕士
博士
文科类
国际传播
21
理科类
材料学
6
比较文学与世界文学
13
4
材料物理与化学
1
医学类
中西医结合临床
6
5
劳动经济学
3
肿瘤学16Leabharlann 9旅游管理3
口腔临床医学
复旦大学高等教育研究所编
第278期复旦大学高等教育研究所编2010年3月15日---------------------------------------------------------------------------- 科学贡献指数与科学鉴赏力指数(中国科学院国家科学图书馆科学前沿分析中心)科学的进步与发展是全世界科学家共同努力的结果。
然而在推进科学发展的过程中,由于世界各国经济发展的不平衡,导致各国对科学技术投入水平参差不齐,而这种差异又具体体现在各国对科学技术与发展所做的不同程度的贡献。
为了观察世界各国对人类科学进步与发展所做的贡献程度,我们以世界1%的高被引文为数据基础,设计了科学贡献指数(简称hc指数。
h代表highly cited papers, c代表cited papers)。
用hc指数分别对国家和中国科研机构进行了统计,用以测度和映射国家层面上和中国机构层面上的科学贡献力。
科学鉴赏力是科学研究能力中的重要组成部分。
因此,我们设计了科学鉴赏力指数(简称ch 指数,c代表citing hot papers,h指代hot papers),用ch指数分别对国家和中国科研机构进行了统计,用以测度和映射国家层面上和中国机构层面上的科学鉴赏力以及在吸收前人成果上的在创新能力。
科学贡献指数和科学鉴赏指数将观察的焦点聚集在为世界科学家所共同关注的科学研究成果,其统计结果反映了国家与科研机构在世界主流科学研究中的基本状态。
本期给出的分子生物学与遗传学、生物学与生物化学、微生物学和动植物学四个领域的这两种指数,指数是根据Tomson Reuters 2008年12月发布的高被引论文和热点论文统计而成。
中国科研机构科学贡献指数表1 物理学领域中国科研机构的hc指数表2 数学领域中国科研机构的hc指数表3 化学领域中国科研机构的hc指数要想获得重大科学发现或原创性科学研究成果,就必须具备科学的鉴赏能力和判断能力。
热点论文之所以“热”,是因为在很短的一段时间内,这些论文受到了国际同行的高度关注,体现了国际同行的科学鉴赏力和判断能力,其中也蕴含着各种科学发现的机会。
2007级复旦临床医学课程设置
2007级复旦临床医学课程设置一、绪论随着社会的发展和人口的增加,医学专业的需求也日益增长。
复旦大学作为国内一流的高等学府,为了培养高素质的临床医学人才,于2007年推出了复旦临床医学课程。
该课程旨在为学生提供全面的医学知识和临床实践机会,培养他们成为具有扎实专业知识和良好医德的医学人才。
二、课程设置1. 基础医学课程复旦临床医学课程的基础医学课程包括人体解剖学、生理学、生物化学、病理学等。
通过这些课程的学习,学生可以掌握人体结构和功能的基本知识,为后续临床实践打下坚实的基础。
2. 临床医学课程临床医学课程是复旦临床医学课程的核心部分。
该课程包括内科学、外科学、妇产科学、儿科学等各个专业的临床课程。
学生将通过理论学习和实践操作,掌握临床诊断、治疗和护理的基本技能,培养临床思维和解决问题的能力。
3. 医学实践课程为了让学生能够将理论知识应用于实际临床工作中,复旦临床医学课程设置了大量的医学实践课程。
学生将在医院临床科室进行实习,与临床医生共同参与患者的诊断和治疗工作。
通过实践,学生可以提高自己的临床技能和专业素养。
4. 专业选修课程除了基础医学课程和临床医学课程,复旦临床医学课程还设置了一些专业选修课程,供学生根据自己的兴趣和需求选择。
这些选修课程包括医学研究方法、医学统计学、医学伦理学等。
学生可以根据自己的职业规划和发展方向,选择适合自己的选修课程。
5. 实验室实践课程在复旦临床医学课程中,实验室实践课程也占有重要地位。
学生将通过实验室实践,学习和掌握医学实验技术和方法,培养科学研究的能力。
实验室实践课程还可以帮助学生深入理解和应用基础医学知识。
三、教学方法1. 理论授课复旦临床医学课程采用多种教学方法,其中包括理论授课。
学生将通过听课、学习教材和参与讨论,掌握医学理论知识。
2. 临床实习临床实习是复旦临床医学课程的重要组成部分。
学生将在医院实习,与临床医生一起参与患者的诊断和治疗工作。
通过实践,学生可以提高自己的临床技能和专业素养。
研究生入学考试生物化学(激素)历年真题试卷汇编1
研究生入学考试生物化学(激素)历年真题试卷汇编1(总分:60.00,做题时间:90分钟)一、判断题请判断下列各题正误。
(总题数:7,分数:14.00)1.(复旦大学2008年考研试题)酪氨酸可以在人体内直接被加碘而转变为甲状腺素。
(分数:2.00)A.正确B.错误√解析:解析:碘化过程发生在甲状腺球蛋白的酪氨酸残基上,10%的酪氨酸残基可被碘化。
碘离子被摄入甲状腺腺泡上皮细胞后,在过氧化酶的作用下,迅速氧化为活化碘,然后经碘化酶的作用使甲状球蛋白中的酪氨酸残基碘化,生成一碘酪氨酸(MIT)和二碘酪氨酸(DIT)。
再在缩合酶的作用下,将它们缩合成T4或T3即有生物活性的甲状腺素激素。
所以酪氨酸不是直接加碘生成甲状腺素。
2.(南京大学2008年考研试题)肝素是带有大量负电荷的糖胺聚糖,临床上常用作抗凝剂。
(分数:2.00)A.正确√B.错误解析:3.(南京大学2008年考研试题)雌性激素和雄性激素虽然都是胆固醇的衍生物,但在体内不能相互转变。
(分数:2.00)A.正确B.错误√解析:解析:雌性激素和雄性激素都是胆固醇衍生而成的,可以相互转变。
雄性激素在机体内可变为雌性激素,由尿排出;雌性激素也可变为雄性激素,由尿排出。
4.(南开大学2009年考研试题)酷氨酸在碘化酶的作用下可直接生成甲状腺素。
(分数:2.00)A.正确B.错误√解析:解析:碘化过程发生在甲状腺球蛋白的酪氨酸残基上,10%的酪氨酸残基可被碘化。
碘离子被摄入甲状腺腺泡上皮细胞后,在过氧化酶的作用下,迅速氧化为活化碘,然后经碘化酶的作用使甲状球蛋白中的酪氨酸残基碘化,生成一碘酪氨酸(MIT)和二碘酪氨酸(DIT)。
再在缩合酶的作用下,将它们缩合成T4或T3即有生物活性的甲状腺素激素。
所以酷氨酸不是在碘化酶的作用下可直接生成甲状腺素。
5.(南开大学2008年考研试题)胰岛素受体具有酪氨酸激酶活性。
(分数:2.00)A.正确√B.错误解析:6.(山东大学2005年考研试题)含氮激素主要是通过与膜受体结合后,引起级联反应而发挥作用的。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第一篇 生物大分子的结构与功能
第一章 氨基酸和蛋白质
一、组成蛋白质的20种氨基酸的分类 1、非极性氨基酸 包括:甘氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、苯丙氨酸、脯氨酸 2、极性氨基酸 极性中性氨基酸:色氨酸、酪氨酸、丝氨酸、半胱氨酸、蛋氨酸、天冬酰胺、谷氨酰胺、苏氨酸 酸性氨基酸:天冬氨酸、谷氨酸 碱性氨基酸:赖氨酸、精氨酸、组氨酸 其中:属于芳香族氨基酸的是:色氨酸、酪氨酸、苯丙氨酸 属于亚氨基酸的是:脯氨酸 含硫氨基酸包括:半胱氨酸、蛋氨酸 注意:在识记时可以只记第一个字,如碱性氨基酸包括:赖精组
二、氨基酸的理化性质 1、两性解离及等电点 氨基酸分子中有游离的氨基和游离的羧基,能与酸或碱类物质结合成盐,故它是一种两性电解质。在某一PH的溶液中,氨基酸解离成阳离子和阴离子的趋势及程度相等,成为兼性离子,呈电中性,此时溶液的PH称为该氨基酸的等电点。 2、氨基酸的紫外吸收性质 芳香族氨基酸在280nm波长附近有最大的紫外吸收峰,由于大多数蛋白质含有这些氨基酸残基,氨基酸残基数与蛋白质含量成正比,故通过对280nm波长的紫外吸光度的测量可对蛋白质溶液进行定量分析。 3、茚三酮反应 氨基酸的氨基与茚三酮水合物反应可生成蓝紫色化合物,此化合物最大吸收峰在570nm波长处。由于此吸收峰值的大小与氨基酸释放出的氨量成正比,因此可作为氨基酸定量分析方法。
三、肽 两分子氨基酸可借一分子所含的氨基与另一分子所带的羧基脱去1分子水缩合成最简单的二肽。二肽中游离的氨基和羧基继续借脱水作用缩合连成多肽。10个以内氨基酸连接而成多肽称为寡肽;39个氨基酸残基组成的促肾上腺皮质激素称为多肽;51个氨基酸残基组成的胰岛素归为蛋白质。 多肽连中的自由氨基末端称为N端,自由羧基末端称为C端,命名从N端指向C端。 人体内存在许多具有生物活性的肽,重要的有: 谷胱甘肽(GSH):是由谷、半胱和甘氨酸组成的三肽。半胱氨酸的巯基是该化合物的主要功能基团。GSH的巯基具有还原性,可作为体内重要的还原剂保护体内蛋白质或酶分子中巯基免被氧化,使蛋白质或酶处于活性状态。
四、蛋白质的分子结构 1、蛋白质的一级结构:即蛋白质分子中氨基酸的排列顺序。 主要化学键:肽键,有些蛋白质还包含二硫键。 2、蛋白质的高级结构:包括二级、三级、四级结构。 1)蛋白质的二级结构:指蛋白质分子中某一段肽链的局部空间结构,也就是该段肽链骨架原子的相对空间位置,并不涉及氨基酸残基侧链的构象。二级结构以一级结构为基础,多为短距离效应。可分为: α-螺旋:多肽链主链围绕中心轴呈有规律地螺旋式上升,顺时钟走向,即右手螺旋,每隔3.6个氨基酸残基上升一圈,螺距为0.540nm。α-螺旋的每个肽键的N-H和第四个肽键的羧基氧形成氢键,氢键的方向与螺旋长轴基本平形。 β-折叠:多肽链充分伸展,各肽键平面折叠成锯齿状结构,侧链R基团交错位于锯齿状结构上下方;它们之间靠链间肽键羧基上的氧和亚氨基上的氢形成氢键维系构象稳定. β-转角:常发生于肽链进行180度回折时的转角上,常有4个氨基酸残基组成,第二个残基常为脯氨酸。 无规卷曲:无确定规律性的那段肽链。 主要化学键:氢键。 2)蛋白质的三级结构:指整条肽链中全部氨基酸残基的相对空间位置,显示为长距离效应。 主要化学键:疏水键(最主要)、盐键、二硫键、氢键、范德华力。 3)蛋白质的四级结构:对蛋白质分子的二、三级结构而言,只涉及一条多肽链卷曲而成的蛋白质。在体内有许多蛋白质分子含有二条或多条肽链,每一条多肽链都有其完整的三级结构,称为蛋白质的亚基,亚基与亚基之间呈特定的三维空间排布,并以非共价键相连接。这种蛋白质分子中各个亚基的空间排布及亚基接触部位的布局和相互作用,为四级结构。由一条肽链形成的蛋白质没有四级结构。 主要化学键:疏水键、氢键、离子键
五、蛋白质结构与功能关系 1、蛋白质一级结构是空间构象和特定生物学功能的基础。一级结构相似的多肽或蛋白质,其空间构象以及功能也相似。 尿素或盐酸胍可破坏次级键 β-巯基乙醇可破坏二硫键 2、蛋白质空间结构是蛋白质特有性质和功能的结构基础。 肌红蛋白:只有三级结构的单链蛋白质,易与氧气结合,氧解离曲线呈直角双曲线。 血红蛋白:具有4个亚基组成的四级结构,可结合4分子氧。成人由两条α-肽链(141个氨基酸残基)和两条β-肽链(146个氨基酸残基)组成。在氧分压较低时,与氧气结合较难,氧解离曲线呈S状曲线。因为:第一个亚基与氧气结合以后,促进第二及第三个亚基与氧气的结合,当前三个亚基与氧气结合后,又大大促进第四个亚基与氧气结合,称正协同效应。结合氧后由紧张态变为松弛态。
六、蛋白质的理化性质 1、蛋白质的两性电离:蛋白质两端的氨基和羧基及侧链中的某些基团,在一定的溶液PH条件下可解离成带负电荷或正电荷的基团。 2、蛋白质的沉淀:在适当条件下,蛋白质从溶液中析出的现象。包括: a.丙酮沉淀,破坏水化层。也可用乙醇。 b.盐析,将硫酸铵、硫酸钠或氯化钠等加入蛋白质溶液,破坏在水溶液中的稳定因素电荷而沉淀。 3、蛋白质变性:在某些物理和化学因素作用下,其特定的空间构象被破坏,从而导致其理化性质的改变和生物活性的丧失。主要为二硫键和非共价键的破坏,不涉及一级结构的改变。变性后,其溶解度降低,粘度增加,结晶能力消失,生物活性丧失,易被蛋白酶水解。常见的导致变性的因素有:加热、乙醇等有机溶剂、强酸、强碱、重金属离子及生物碱试剂、超声波、紫外线、震荡等。 4、蛋白质的紫外吸收:由于蛋白质分子中含有共轭双键的酪氨酸和色氨酸,因此在280nm处有特征性吸收峰,可用蛋白质定量测定。 5、蛋白质的呈色反应 a.茚三酮反应:经水解后产生的氨基酸可发生此反应,详见二、3 b. 双缩脲反应:蛋白质和多肽分子中肽键在稀碱溶液中与硫酸酮共热,呈现紫色或红色。氨基酸不出现此反应。蛋白质水解加强,氨基酸浓度升高,双缩脲呈色深度下降,可检测蛋白质水解程度。
七、蛋白质的分离和纯化 1、沉淀,见六、2 2、电泳:蛋白质在高于或低于其等电点的溶液中是带电的,在电场中能向电场的正极或负极移动。根据支撑物不同,有薄膜电泳、凝胶电泳等。 3、透析:利用透析袋把大分子蛋白质与小分子化合物分开的方法。 4、层析: a.离子交换层析,利用蛋白质的两性游离性质,在某一特定PH时,各蛋白质的电荷量及性质不同,故可以通过离子交换层析得以分离。如阴离子交换层析,含负电量小的蛋白质首先被洗脱下来。 b.分子筛,又称凝胶过滤。小分子蛋白质进入孔内,滞留时间长,大分子蛋白质不能时入孔内而径直流出。 5、超速离心:既可以用来分离纯化蛋白质也可以用作测定蛋白质的分子量。不同蛋白质其密度与形态各不相同而分开。
八、多肽链中氨基酸序列分析 a.分析纯化蛋白质的氨基酸残基组成 (蛋白质水解为个别氨基酸,测各氨基酸的量及在蛋白质中的百分组成) ↓ 测定肽链头、尾的氨基酸残基 二硝基氟苯法(DNP法) 头端 尾端 羧肽酶A、B、C法等 丹酰氯法 ↓ 水解肽链,分别分析 胰凝乳蛋白酶(糜蛋白酶)法:水解芳香族氨基酸的羧基侧肽键 胰蛋白酶法:水解赖氨酸、精氨酸的羧基侧肽键 溴化脯法:水解蛋氨酸羧基侧的肽键 ↓ Edman降解法测定各肽段的氨基酸顺序 (氨基末端氨基酸的游离α-氨基与异硫氰酸苯酯反应形成衍生物,用层析法鉴定氨基酸种类) b.通过核酸推演氨基酸序列。
第二章 核酸的结构与功能 一、核酸的分子组成:基本组成单位是核苷酸,而核苷酸则由碱基、戊糖和磷酸三种成分连接而成。 两类核酸:脱氧核糖核酸(DNA),存在于细胞核和线粒体内。 核糖核酸(RNA),存在于细胞质和细胞核内。 1、碱基:
NH2 NH2 O CH3 O O
O O O NH2 胞嘧啶 胸腺嘧啶 尿嘧啶 鸟嘌呤 腺嘌呤
嘌呤和嘧啶环中均含有共轭双键,因此对波长260nm左右的紫外光有较强吸收,这一重要的理化性质被用于对核酸、核苷酸、核苷及碱基进行定性定量分析。 2、戊糖:DNA分子的核苷酸的 糖是β-D-2-脱氧核糖,RNA中为β-D-核糖。 3、磷酸:生物体内多数核苷酸的磷酸基团位于核糖的第五位碳原子上。
二、核酸的一级结构 核苷酸在多肽链上的排列顺序为核酸的一级结构,核苷酸之间通过3′,5′磷酸二酯键连接。
三、DNA的空间结构与功能 1、DNA的二级结构 DNA双螺旋结构是核酸的二级结构。双螺旋的骨架由 糖和磷酸基构成,两股链之间的碱基互补配对,是遗传信息传递者,DNA半保留复制的基础,结构要点: a.DNA是一反向平行的互补双链结构 亲水的脱氧核糖基和磷酸基骨架位于双链的外侧,而碱基位于内侧,碱基之间以氢键相结合,其中,腺嘌呤始终与胸腺嘧啶配对,形成两个氢键,鸟嘌呤始终与胞嘧啶配对,形成三个氢键。 b.DNA是右手螺旋结构 螺旋直径为2nm。每旋转一周包含了10个碱基,每个碱基的旋转角度为36度。螺距为3.4nm,每个碱基平面之间的距离为0.34nm。 c.DNA双螺旋结构稳定的维系 横向靠互补碱基的氢键维系,纵向则靠碱基平面间的疏水性堆积力维持,尤以后者为重要。 2、DNA的三级结构 三级结构是在双螺旋基础上进一步扭曲形成超螺旋,使体积压缩。在真核生物细胞核内,DNA三级结构与一组组蛋白共同组成核小体。在核小体的基础上,DNA链经反复折叠形成染色体。 3、功能 DNA的基本功能就是作为生物遗传信息复制的模板和基因转录的模板,它是生命遗传繁殖的物质基础,也是个体生命活动的基础。 DNA中的核糖和磷酸构成的分子骨架是没有差别的,不同区段的DNA分子只是碱基的排列顺序不同。
四、RNA的空间结构与功能 DNA是遗传信息的载体,而遗传作用是由蛋白质功能来体现的,在两者之间RNA起着中介作用。其种类繁多,分子较小,一般以单链存在,可有局部二级结构,各类RNA在遗传信息表达为氨基酸序列过程中发挥不同作用。如:
名 称 功 能 核蛋白体RNA (rRNA) 核蛋白体组成成分
信使RNA (mRNA) 蛋白质合成模板
