2019年高三化学二轮复习题型专练07电化学含解析
2019年高考化学二轮复习 第1部分 第7讲 电化学课后热点强化 新人教版.doc

2019年高考化学二轮复习 第1部分 第7讲 电化学课后热点强化 新人教版1.(2015·全国Ⅰ卷·11)微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。
下列有关微生物电池的说法错误的是导学号 43864242( A )A .正极反应中有CO 2生成B .微生物促进了反应中电子的转移C .质子通过交换膜从负极区移向正极区D .电池总反应为C 6H 12O 6+6O 2=6CO 2+6H 2O[解析] 考查对原电池反应的判断。
A .根据C 元素的化合价的变化,C 6H 12O 6生成二氧化碳的反应为氧化反应,应在负极生成,错误;B .微生物加速了葡萄糖的腐蚀,促进了反应中电子的转移正确;C .原电池中阳离子向正极移动,正确;D .电池的总反应实质是葡萄糖的氧化反应,正确,答案选A 。
2.(2015·浙江·11)在固态金属氧化物电解池中,高温下电解H 2O ——CO 2混合气体制备H 2和CO 是一种新的能源利用方式,基本原理如图所示。
下列说法不正确的是导学号 43864243( D )A .X 是电源的负极B .阴极的电极反应式是:H 2O +2e -===H 2+O 2- CO 2+2e -===CO +O 2-C .总反应可表示为:H 2O +CO 2=====通电H 2+CO +O 2D .阴、阳两极生成的气体的物质的量之比是1∶1[解析] 考查电化学基础知识。
从图示可看出,与X 相连的电极发生H 2O→H 2、CO 2→CO 的转化,均得电子,应为电解池的阴极,则X 为电源的负极,A 正确;阴极H 2O→H 2、CO 2→CO 均得电子发生还原反应,电极反应式分别为:H 2O +2e -===H 2+O 2-、CO 2+2e -===CO +O 2-,B 正确;从图示可知,H 2O→H 2、CO 2→CO 转化的同时有氧气生成,所以总反应可表示为:H 2O +CO 2=====通电H 2+CO +O 2,C 正确;从总反应可知,阴、阳两极生成的气体的物质的量之比2∶1,D 不正确。
2019-2020年高考化学大二轮复习专题突破练7电化学

2019-2020年高考化学大二轮复习专题突破练7电化学 1.下列金属防护的方法不正确的是( ) A.对健身器材涂油漆以防止生锈 B.对某些工具的“机械转动部位”选用刷油漆的方法来防锈 C.用牺牲锌块的方法来保护船身 D.自行车的钢圈上镀上一层铬防锈 解析: B项中应选用润滑油来达到润滑和防锈的目的。 答案: B 2.下图所示的日常生活装置中,与手机充电时的能量转化形式相同的是( ) 解析: A项是将电能转化成化学能;B项是将水的势能转化成电能;C项是将太阳能转化成热能;D项是将化学能转化成电能。 答案: A 3.下列有关电化学的示意图中正确的是( )
解析: 选项A,Zn应为原电池负极,Cu为原电池正极;选项B,盐桥两边的烧杯中盛装的电解质溶液应互换;选项C,粗铜应连接电源正极;选项D,电解饱和NaCl溶液,Cl-在阳极放电产生Cl2,溶液中的H+在阴极获得电子而产生H2,正确。 答案: D 4.(xx·江西赣州统考)根据图示判断下列叙述符合事实的是( )
A.按图①连接并放置一段时间后,Fe片表面会“镀”上一层铜 B.按图②连接好导线后(Zn片与Cu片相接触),灵敏电流表指针会发生非常明显的偏转 C.按图③连接并放置片刻,在Fe片附近加一滴KSCN溶液,溶液变为红色 D.按图④连接并放置一段时间后,在Sn片上有无色气泡聚集 解析: 按图①连接后,铁与电源的正极相连,作阳极,铁失去电子,Fe片表面不会“镀”上一层铜,A不正确;按图②连接好导线后,由于Zn片与Cu片相接触,电子直接传递到铜片,因此灵敏电流表指针不会发生非常明显的偏转,B不正确;按图③连接后构成原电池,锌比铁活泼,锌是负极,铁是正极,溶液中不会产生铁离子,所以在Fe片附近加一滴KSCN溶液,溶液不可能变为红色,C不正确;按图④连接后构成电解池;Sn与电源的负极相连,作阴极,溶液中的氢离子放电生成氢气,因此在Sn片上有无色气泡聚集,D正确。 答案: D 5.铜板上铁铆钉长期暴露在潮湿的空气中,形成一层酸性水膜后铁铆钉会被腐蚀,示意图如下。下列说法不正确的是( )
江苏省2019届高考化学二轮复习专项训练 电化学

专项训练电化学选择题(每题有12个选项符合题意)1. (2018·江苏高考)Mg H2O2电池可用于驱动无人驾驶的潜航器。
该电池以海水为电解质溶液,示意图如下。
该电池工作时,下列说法正确的是( )A. Mg电极是该电池的正极B. H2O2在石墨电极上发生氧化反应C. 石墨电极附近溶液的pH增大D. 溶液中Cl-向正极移动2. 大功率Al H2O2动力电池原理如下图所示,下列说法不正确的是( )A. 电池组成中Al电极是负极B. OH-从碳纤维电极透过离子交换膜移向Al电极C. 碳纤维电极的电极反应式是H 2O 2+2e -+2H+2H 2OD. 该电池总反应的离子方程式是2Al+3H 2O 2+2OH-2Al(OH -4)3. 高铁电池是一种新型可充电电池,电解质溶液为KOH ,放电时的总反应式为3Zn+2Fe 2-4O +8H 2O3Zn(OH)2+2Fe(OH)3+4OH -。
图中曲线分别是高铁酸钾电池和高能碱性电池的放电曲线,下列判断正确的是( )A. 充电时阳极反应式为Fe 2-4O +3e -+4H 2OFe(OH)3↓+5OH -B. 充电时阴极附近溶液的pH 变小C. 高铁酸钾电池与高能碱性电池相比优点是放电时间长、工作电压稳定D. 放电时,每转移0.2 mol 电子,正极的质量减少6.5 g4. 固体氧化物电解槽是目前水电解氢能的制备技术之一,其结构示意图如下图(工作温度:800-950℃)。
下列叙述不正确的是( )A. 固体氧化物电解质的主要作用为选择性地使氧离子或质子透过但防止氧气和氢气的透过B. 阴极反应式是H2O+2e-H2↑+O2-C. 阳极反应式是4OH--4e-O2↑+2H2OD. O2-从阴极通过氧化物电解质到达阳极5. (2018·江苏四星高中学情调研)高铁电池是一种新型可充电电池,电解质溶液为KOH,放电时的总反应式为3Zn+2K2FeO4+8H2O3Zn(OH)2+2Fe(OH)3+4KOH。
高考化学二轮复习 第7讲 电化学课堂练习

第七讲电化学[最新考纲]1.理解原电池和电解池的构成、工作原理及应用,能书写电极反应和总反应方程式。
2.了解常见化学电源的种类及其工作原理。
3.了解金属发生电化学腐蚀的原因、金属腐蚀的危害以及防止金属腐蚀的措施。
原电池原理及其应用[学生用书P30]1.(2017·高考天津卷)下列能量转化过程与氧化还原反应无关的是( )A.硅太阳能电池工作时,光能转化成电能B.锂离子电池放电时,化学能转化成电能C.电解质溶液导电时,电能转化成化学能D.葡萄糖为人类生命活动提供能量时,化学能转化成热能解析:选A。
A项,硅太阳能电池工作时,光能转化为电能,与氧化还原反应无关;B 项,锂离子电池放电时,化学能转化为电能,原电池总反应为氧化还原反应;C项,电解质溶液导电时,电能转化为化学能,总反应为氧化还原反应;D项,葡萄糖为人类生命活动提供能量时,葡萄糖发生氧化还原反应,化学能转化为热能。
2.(2016·高考海南卷改编)某电池以K2FeO4和Zn为电极材料,KOH溶液为电解溶质溶液。
下列说法正确的是( )A.Zn为电池的负极B.正极反应式为2FeO2-4+10H++6e-===Fe2O3+5H2OC.该电池放电过程中电解质溶液浓度不变D.电池工作时OH-向正极迁移解析:选A。
A.根据化合价升降判断,Zn化合价只能升高,故为负极材料,K2FeO4为正极材料,正确;B.KOH溶液为电解质溶液,则正极反应式为2FeO2-4+6e-+8H2O===2Fe(OH)3+10OH-,错误;C.该电池放电过程中电解质溶液浓度减小,错误;D.电池工作时阴离子OH -向负极迁移,错误。
[感悟高考]1.题型:选择题(主)、填空题(次)2.考向:高考对原电池原理的考查主要有以下几点:离子运动方向的判断(特别注意盐桥中离子的运动以及离子对于指定交换膜的通过问题),能量转换类型,正负极的判断,正负极与反应类型的对应关系,电极反应式的书写及判断,有关计算问题。
2019届高三化学高考二轮臻品资源专题:电化学基础(附解析)

2019届高三化学高考二轮臻品资源专题:电化学基础(附解析)1.了解原电池和电解池的构成、工作原理及应用,能写出电极反应和总反应方程式。
2.了解常见化学电源的种类及其工作原理。
3.理解金属发生电化学腐蚀的原因、金属腐蚀的危害、防止金属腐蚀的措施。
电化学是氧化还原反应知识的应用和延伸,是历年高考的热点内容。
考查的主要知识点:原电池和电解池的工作原理、电极反应式的书写和判断、电解产物的判断、金属的腐蚀和防护。
对本部分知识的考查仍以选择题为主,在非选择题中电化学知识可能与工业生产、环境保护、新科技、新能源知识相结合进行命题。
Ⅰ.客观题(1)以新型化学电源为载体,考查电极反应式的正误判断及电子、离子的移动方向等。
(2)考查原电池在金属腐蚀与防护方面的应用。
Ⅱ.主观题(1)考查电极反应式、电池反应式的书写。
(2)考查原电池、电解池原理在工业生产中的应用。
(3)考查电子转移、两极产物、pH等的相关计算。
一、原电池原理和化学电池1.构建原电池模型,类比分析原电池工作原理构建如图Zn—Cu—H2SO4原电池模型,通过类比模型,结合氧化还原反应知识(如:化合价的变化、得失电子情况等),能迅速判断原电池的正、负极,弄清楚外电路中电子的移动情况和内电路中离子的移动情况,准确书写电极反应式和电池总反应式,掌握原电池的工作原理。
2.化学电源中电极反应式书写的思维模板(1)明确直接产物:根据负极氧化、正极还原,明确两极的直接产物。
(2)确定最终产物:根据介质环境和共存原则,找出参与的介质粒子,确定最终产物。
(3)配平:根据电荷守恒、原子守恒配平电极反应式。
注意:①H+在碱性环境中不存在;②O2−在水溶液中不存在,在酸性环境中结合H+,生成H2O,在中性或碱性环境中结合H2O,生成OH−;③若已知总反应式时,可先写出较易书写的一极的电极反应式,然后在电子守恒的基础上,总反应式减去较易写出的一极的电极反应式,即得较难写出的另一极的电极反应式。
广东省梅县松口中学2019届高三化学二轮专题复习专题七电化学
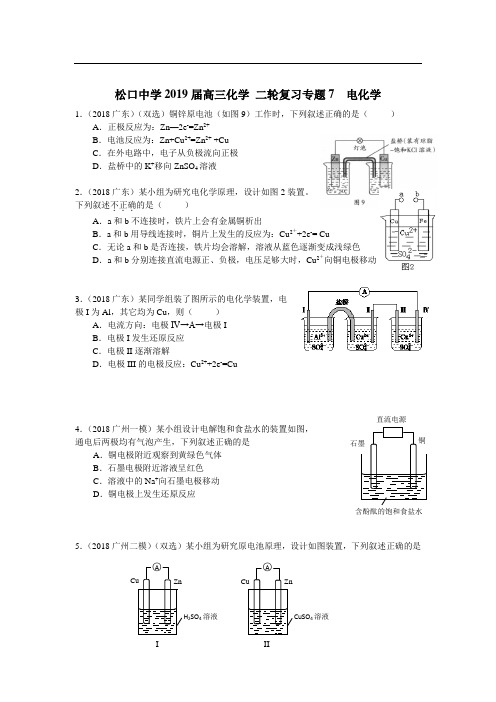
松口中学2019届高三化学 二轮复习专题7 电化学1.(2018广东)(双选)铜锌原电池(如图9)工作时,下列叙述正确的是( )A .正极反应为:Zn —2e -=Zn 2+B .电池反应为:Zn+Cu 2+=Zn 2+ +CuC .在外电路中,电子从负极流向正极D .盐桥中的K +移向ZnSO 4溶液 2.(2018广东)某小组为研究电化学原理,设计如图2装置。
下列叙述不正确...的是( ) A .a 和b 不连接时,铁片上会有金属铜析出B .a 和b 用导线连接时,铜片上发生的反应为:Cu 2++2e -= CuC .无论a 和b 是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色D .a 和b 分别连接直流电源正、负极,电压足够大时,Cu 2+向铜电极移动3.(2018广东)某同学组装了图所示的电化学装置,电极I 为Al ,其它均为Cu ,则( )A .电流方向:电极IV→A→电极IB .电极I 发生还原反应C .电极II 逐渐溶解D .电极III 的电极反应:Cu 2++2e -=Cu 4.(2018广州一模)某小组设计电解饱和食盐水的装置如图, 通电后两极均有气泡产生,下列叙述正确的是 A .铜电极附近观察到黄绿色气体 B .石墨电极附近溶液呈红色 C .溶液中的Na +向石墨电极移动 D .铜电极上发生还原反应 5.(2018广州二模)(双选)某小组为研究原电池原理,设计如图装置,下列叙述正确的是含酚酞的饱和食盐水 直流电源 CuSO 4溶液H 2SO 4溶液I IIA.装置I,铜片上有O2逸出B.装置I,锌片溶解,发生还原反应C.装置II,电池反应为:Zn+ Cu2+= Zn2++ CuD.装置II,外电路中,电子从锌电极流向铜电极6.(2018东莞一模)下列图示中关于铜电极的连接错误..的是()7.(2018惠州二模)甲醇、氧气和强碱溶液做电解质的手机电池中的反应为:2CH3OH+3O2+4OH-2CO32-+6H2O,有关说法正确的是()A.放电时,CH3OH参与反应的电极为正极B.放电时,负极电极反应:CH3OH+8OH--6e- =CO32-+6H2OC.标况下,通入11.2LO2完全反应有1mol电子转移D.充电时电解质溶液的pH逐渐减小8.(2018清远二模)镁—次氯酸盐燃料电池具有比能量高、安全方便等优点,该电池主要工作原理如右图所示,其正极反应为:ClO-+ H2O + 2e-== Cl-+2OH-,关于该电池的叙述正确的是()A.该电池中镁为负极,发生还原反应B.电池工作时,OH-向正极移动C.电池工作时,正极周围溶液的pH将不断变小D.该电池的总反应为:Mg + ClO-+ H2O == Mg(OH)2↓+ Cl-9.(2018湛江一模)(双选)下列叙述正确的是()A.电镀时,通常把待镀的金属制品作阴极B.氢氧燃料电池(酸性电解质)中O2通入负极C.右图中电子由Cu极流向Zn,盐桥中的Cl–移向CuSO4溶液D.在海轮外壳镶嵌锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法10.(2018梅州二模)有关右图的说法正确的是()A.构成原电池时溶液中SO42-移向Cu极B.构成原电池时Cu极反应为:Cu﹣2e-=Cu2+C.要使Fe极不被腐蚀,Cu片换Zn片或a接直流电源负极D.形成电解池,Cu电极不可能溶解11.(2018珠海调研)某小组为研究电化学原理,设计如右图装置,下列叙述不正确的是A.a、b不连接时,只有锌片上有气泡逸出B.a和b用导线连接时,铜片上发生的反应为:2H+ + 2e– =H2↑C.a和b用导线连接或接直流电源,锌片都能溶解D.a和b是否用导线连接,装置中所涉及的化学反应都相同12.(2018广州番禺)查处酒后驾驶采用的“便携式乙醇测量仪”以燃料电池为工作原理,在酸性环境中,理论上乙醇可以被完全氧化为CO2,但实际乙醇被氧化为X,其中一个电极的反应式为:CH3CH2OH—2e—→X+2H+.下列说法中正确的是()A.电池内部H+由正极向负极移动B.另一极的电极反应式为:O2+4e—+2H2O=4OH—C.乙醇在正极发生反应,电子经过外电路流向负极D.电池总反应为:2CH3CH2OH + O2→2CH3CHO + 2H2O13.(2018广东六校联考)某小组利用下列装置进行电化学实验,下列实验操作及预期现象正确的是()A.X和Y与电流表连接,电子由Cu极流向Zn极B.X和Y与电流表连接,将Zn换成Fe测得电流更大C.X和Y分别与电源“—”、“+”极相连,Cu极质量减轻D.X和Y分别与电源“—”、“+”极相连,Zn极质量减轻14.(2018广东七校联考)右图是模拟电化学反应装置图。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
专题07 电化学 1. H2S是一种剧毒气体,如图为质子膜H2S燃料电池的示意图,可对H2S废气资源化利用。下列叙述错误的是
A. a是负极,电池工作时,电子的流动力向是:电极a-负载一电极b-质子膜一电极a B. 电池工作时,化学能转化为电能和热能 C. 电极b上发生的电极反应式为O2+ 4e-+4H+=2H2O D. 当电路中通过4mol电子时,有4molH+经质子膜进入正极区 【答案】A 【解析】根据H2S燃料电池的示意图可知,在a极,H2S→S2,化合价升高,发生氧化反应,a是负极,电池工作时,电子从负极电极a经负载流向正极电极b,电子不能进入溶液中,A错误;原电池工作时,化学能转化为电能和热能,B正确;根据O2→H2O,化合价降低,氧气得电子发生还原反应, 电极反应式为O2+4e-+4H+=2H2O,C正确;根据O2+4e-+4H+=2H2O,所以当电路中通过电子时,有经质子膜进入正极区,D正确。 2. 最近我国科学家设计了一种协同转化装置,实现对天然气中和的高效去除。示意图如右所示,其中电极分别为ZnO@石墨烯(石墨烯包裹的ZnO)和石墨烯,石墨烯电极区发生反应为:
① ② 该装置工作时,下列叙述错误的是( ) A. 阴极的电极反应: B. 协同转化总反应: C. 石墨烯上的电势比ZnO@石墨烯上的低
D. 若采用取代,溶液需为酸性 【答案】C 【详解】A项,石墨烯失电子作阳极,ZnO@石墨烯作阴极,发生反应: ,故A项正确;B项,阴极CO2得电子,阳极Fe2+失电子生成Fe3+,Fe3+继续与H2S反应生成Fe2+与S,故协同转化总反应为,故B项正确;C项,石墨烯上发生反应:EDTA-- Fe2+-e-= EDTA-- Fe3+,为阳极,阳极电势高,故石墨烯上的电势比ZnO@石墨烯上的高,故C项错误;D项,Fe2+、Fe3+易水解,只能在酸性条件下存在,故溶液需为酸性,故D项正确。 3. 混合动力车在刹车和下坡时处于充电状态;上坡或加速时,电动机提供辅助推动力,降低了汽油的消耗。该车一般使用的是镍氢电池采用镍的化合物和储氢金属(以M表示)为两电极材料,碱液(主要为KOH)电解液。镍氢电池充放电原理如图,其总反应式为:H2+2NiOOH = 2Ni(OH)2 下列有关判断正确的是( )
A. 在上坡或加速时,溶液中的K+向甲电极迁移 B. 在刹车和下坡时,甲电极的电极反应式为:2 H2O+2e- H2↑+2OH- C. 在上坡或加速时,乙电极周围溶液的pH将减小 D. 在刹车和下坡时,乙电极增重 【答案】B 【解析】在上坡或加速时,电池处于放电过程即原电池,溶液中的K+向正极即乙极移动,A错误;在在刹车和下坡时,电池处于充电状态即为电解池,甲极是阴极,氢离子得电子发生还原反应,产生氢气,B正确;在上坡或加速时,属于原电池,乙电极为正极,电极极反应为NiOOH+H2O+e-=Ni(OH)2+OH-,乙电极周围因OH-浓度增大,pH将变大,C错误;在刹车和下坡时,属于电解池,乙极为阳极是氢氧化镍转化为氢氧化氧镍的过程,电极质量减轻,D错误。 4. 下图是CO2电催化还原为CH4的工作原理示意图。下列说法正确的是
A. 该过程是化学能转化为电能的过程 B. 一段时间后,①池中n(KHCO3)不变 C. 一段时间后,②池中溶液的pH不变 D. 铜电极的电极反应式为9CO2+6H2O+8e-=CH4+8HCO3- 【答案】D 【解析】该装置是一个电解池,电解池是将电能转化为化学能的装置,A错误;在电解池的阴极上发生二氧化碳得电子的还原反应,即═,一段时间后,氢离子减小,氢氧根浓度增大,氢氧根会和①池中的碳酸氢钾反应,所以会减小,B错误;在电解池的阳极上,是氢氧根离子发生失电子的氧化反应,所以酸性增强,pH一定下降,C错误;电催化还原为的过程是一个还原反应过程,所以铜电极是电解池的阴极,铜电极的电极反应式为9CO2+6H2O+8e-= CH4+8HCO3-, D正确。 5. 甲醇燃料电池由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注,其工作示意图如下,其总反应为 2CH3OH+3O2===2CO2+4H2O。下列说法不正确的是( )
A. 电极 A 是负极,物质 a 为甲醇 B. 电池工作时,电解液中的 H+通过质子交换膜向 B 电极迁移 C. 放电前后电解质溶液的 pH 增大 D. b 物质在电极上发生的电极反应式为: O2+4eˉ+2H2O=4OHˉ 【答案】D 【解析】甲醇的燃料电池,甲醇在负极被氧化,氧气在正极被还原;电子由A流出经过导线流入B,电极A 是负极,物质 a 为甲醇,A正确;H+应该向正极(B 电极)移动,B正确;负极反应:2CH3OH-12eˉ+2H2O=2CO2+12H+,正极反应 3O2+12eˉ+12H+=6H2O,反应前后H+总量没变,但是反应放电后反应生成了水,造成了H+的浓
度减小,电解质溶液的 pH 增大,C正确;酸性环境下,氧气在B电极上发生的电极反应式为: O2+4eˉ+4H+=2H2O ,D错误。
6. 近年来,我国在航空航天事业上取得了令人瞩目的成就,科学家在能量的转化,航天器的零排放作出了很大的努力,其中为了达到零排放的要求,循环利用人体呼出的CO2并提供O2,设计了一种装置(如图)实现了能量的转化,总反应方程式为2CO2=2CO+O2。关于该装置下列说法正确的是( )
A. 装置中离子交换膜为阳离子交换膜 B. 反应完毕,电解质溶液碱性减弱 C. N型半导体为阳极,P型半导体为阴极 D. CO2参与X电极的反应方程式:CO2+2e¯+H2O=CO+2OH¯ 【答案】D 【解析】左半部分为原电池,右半部分为电解池;根据原电池中正电荷的移动方向可知,N型半导体为负极极,P型半导体为正极,C错误;则X电极为阴极,发生还原反应,CO2+2e¯+H2O=CO+2OH¯,D正确;图中OH-在X电极处产生,但是Y电极附近也存在OH-,说明OH¯能够通过离子交换膜,即该膜为阴离子交换膜,A错误;根据总反应2CO2=2CO+O2可知反应前后电解质溶液酸、碱性不变,B错误。 7. 我国科学家研制出“可充室温Na-CO2电池”(Rechargeable Room-Temperature Na-CO2 Batter-ies)现已取得突破性进展,其有望取代即将“枯竭”的锂电池,该电池结构如图所示。下列说法错误的是 A. 电池工作时,正极发生反应:4Na++3CO2+4e-==2Na2CO3+C B. 电池工作时,外电路中流过0.02 mol 电子,负极材料减重0.46 g C. 多壁碳纳米管的作用主要是导电及吸附CO2 D. 电池中四甘醇二甲醚可用饱和食盐水代替实现Na+传导 【答案】D 【解析】根据图中电子流向可知,金属钠为负极,多壁纳米管为正极,正极发生还原反应,二氧化碳被还原为碳,A正确;钠变为钠离子,转移电子0.02mol,减重0.02×23=0.46 g,B正确;多壁碳纳米管为疏松多孔,主要是导电及吸附CO2,C正确;若用饱和食盐水,水会与钠电极反应,不能构成原电池,D错误。 8. 全固态锂硫电池能量密度高、成本低,其工.作原理如图所示,其中电极a常用掺有石墨烯的S8材料,电池反应式为16Li+xS8=8Li2Sx(2≤x≤8)。同时利用此装置的电能在铁上镀铜,下列说法不正确的是
A. 电池工作时,a是正极,外电路中流过0.02mal电子,负极材料减重0.14g B. 石墨烯的作用主要是提高电极a的导电性 C. 当钾硫电池电极提供1mol电子时,则理论上铁电极增重32g D. 放电时,Li+向正极移动,在此电池中加人硫酸可增加导电性 【答案】D 【解析】根据锂离子的移动方向可知,a是正极,b极为负极,锂失电子变为锂离子,负极材料减重为0.02×7=0.14g,A正确;石墨烯具有导电作用,它的使用提高电极a的导电性,B正确;铁上镀铜,铜做阳极,失电子,溶液中的铜离子得电子在阴极(铁极)析出,Cu2++2e-= Cu,当转移1mol电子时,则理论上铁电极析出铜0.5×64=32g,C正确;硫酸能够与金属锂电极反应,不能构成原电池,D错误。 9. 锂-碘电池应用于心脏起搏器,使用寿命超过10 年,负极是锂,正极是聚2-乙烯吡(P2VP) 和I2 复合物,工作原理2Li+ P2VP·nI2=2LiI+ P2VP·(n-1)I2,下列叙述错误的是 A. 该电池是电解质为非水体系的二次电池 B. 工作时Li向正极移动 C. 正极反应式为P2VP·nI2+2Li++2e-=2LiI+ P2VP·(n-1)I2 D. 该电池具有全时间工作、体积小、质量小、寿命长等优点 【答案】A 【解析】金属锂能够与水反应,所以该电池是电解质为非水体系的一次电池,使用寿命超过10 年,A错误;原电池工作时,阳离子(Li+)向正极移动,B正确;原电池正极发生还原反应,P2VP·nI2在正极得电子,C正确;锂-碘电池应用于心脏起搏器,使用寿命超过10 年,该电池具有全时间工作、体积小、质量小、寿命长等优点,D正确。 10. 十九大报告中提出要“打赢蓝天保卫战”,意味着对大气污染防治比过去要求更高。二氧化硫—空气质子交换膜燃料电池实现了制硫酸、发电、环保三位一体的结合,原理如图所示。下列说法正确的是
A. 该电池放电时质子从Pt 2电极经过内电路流到Pt 1电极 B. Pt 1电极附近发生的反应为:SO2+2H2O-2e-=H2SO4+2H+ C. Pt 2电极附近发生的反应为O2+4e-+2H2O=4OH- D. 相同条件下,放电过程中消耗的SO2和O2的体积比为2∶1 【答案】D 【解析】放电时为原电池,质子向正极移动,Pt1电极为负极,则该电池放电时质子从Pt1电极移向Pt2电极,A错误;Pt1电极为负极,发生氧化反应,SO2被氧化为硫酸,极反应为SO2+2H2O-2e-=SO2-4+4H+,硫酸应当拆为离子形式,B错误;酸性条件下,氧气得电子生成水, C错误;相同条件下,放电过程中:负极发生氧化反应:2SO2+4H2O-4e-=2SO2-4+8H+,正极发生还原反应:O2+4e-+4 H+=2H2O,根据转移电子数相等规律可知:放电过程中消耗的SO2和O2的体积比为2∶1,D正确。
