高考化学二轮增分优选练 非选择题规范练 第29题 化学计算题专练
【浙江选考】2019届化学选考复习专题精编:第29题化学计算

mol。 mol·Lˉ1。
8.电子工业常用一定浓度的 FeCl3 溶液腐蚀敷有铜箔的绝缘板,制成印刷线路板。现将一块敷有铜箔的绝 缘板没入 500mL 某浓度 FeCl3 溶液中,一段时间后,将该线路板取出,向所得溶液中加入一定量的铁粉, 充分反应后有固体剩余;将固体滤出并从滤液中取出 20.00mL,向其中滴入 2.00mol/LAgNO3 溶液 60.00 mL 时,溶液中的 Cl-恰好完全沉淀。请回答下列有关问题(忽略反应前后溶液体积的变化):
和硫酸的混合溶液,加入 50 mL Ba(OH)2 溶液充分反应,[来源:] 得到沉淀 0. 233 g,反应后溶液中 OHˉ 浓度为 0.01 mol·Lˉ1 (假设反应后溶液的总体积为 100 mL)。 请计算:
(1) 原混合酸溶液中 H+的物质的量为 (2) 加入的 Ba(OH)2 溶液的物质的量浓度为
m/g (1) 将其中一份配成溶液,逐滴加入一定浓度的 Ba(OH)2 溶液,产生的沉淀
2.33 质量与加入 Ba(OH)2 溶液体积的关系如图。混合物中
n[(NH4)2SO4]∶n(NH4Cl)为
。
(2) 另一份固体混合物中 NH4+与 Ba(OH)2 溶液(浓度同上)恰好完全反应时,
0
溶液中 c(Clˉ)=
液中含有 ClO-0.20 mol、ClO3-0.30 mol(忽略氯气与水反应、盐类水解及溶液体积变化)。回答下列问题。
(1) 所得溶液中 c(Cl-)为
mol·L-1。
(2) 所用氯气和参加反应的氢气的物质的量之比 n(Cl2)∶n(H2)=
。
13.将铜与 Fe2O3 的混合物共 14.4 g 加入 200 mL 2.00 mol·L-1 的稀硫酸中,充分反应后剩余固体的质量为
2020版(2020年4月)浙江选考高考化学:特训4第29题化学计算题专练 Word版含答案
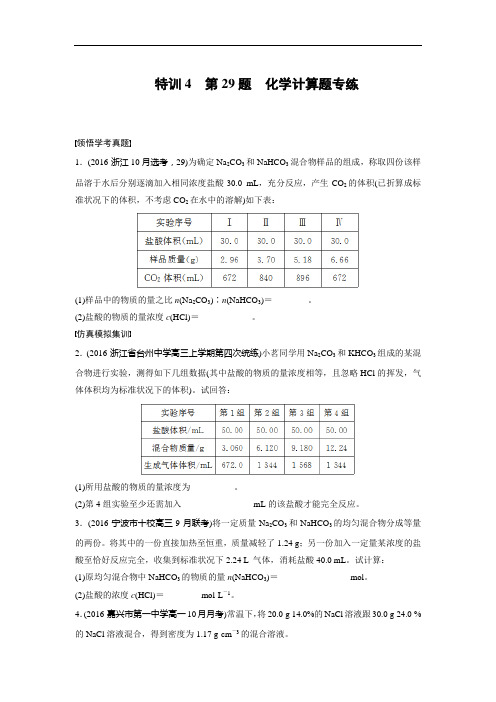
特训4第29题化学计算题专练领悟学考真题1.(2016·浙江10月选考,29)为确定Na2CO3和NaHCO3混合物样品的组成,称取四份该样品溶于水后分别逐滴加入相同浓度盐酸30.0 mL,充分反应,产生CO2的体积(已折算成标准状况下的体积,不考虑CO2在水中的溶解)如下表:(1)样品中的物质的量之比n(Na2CO3)∶n(NaHCO3)=________。
(2)盐酸的物质的量浓度c(HCl)=____________。
仿真模拟集训2.(2016·浙江省台州中学高三上学期第四次统练)小茗同学用Na2CO3和KHCO3组成的某混合物进行实验,测得如下几组数据(其中盐酸的物质的量浓度相等,且忽略HCl的挥发,气体体积均为标准状况下的体积)。
试回答:(1)所用盐酸的物质的量浓度为__________。
(2)第4组实验至少还需加入________________ mL的该盐酸才能完全反应。
3.(2016·宁波市十校高三9月联考)将一定质量Na2CO3和NaHCO3的均匀混合物分成等量的两份。
将其中的一份直接加热至恒重,质量减轻了1.24 g;另一份加入一定量某浓度的盐酸至恰好反应完全,收集到标准状况下2.24 L 气体,消耗盐酸40.0 mL。
试计算:(1)原均匀混合物中NaHCO3的物质的量n(NaHCO3)=________________ mol。
(2)盐酸的浓度c(HCl)=________ mol·L-1。
4.(2016·嘉兴市第一中学高一10月月考)常温下,将20.0 g 14.0%的NaCl溶液跟30.0 g 24.0 %的NaCl溶液混合,得到密度为1.17 g·cm-3的混合溶液。
(1)该混合溶液的质量分数为__________。
(2)该混合溶液的物质的量浓度是_______mol·L -1。
(3)在1 000 g 水中溶解__________ mol NaCl 才能使其浓度与上述混合溶液的浓度相等。
(浙江专版)2019版高考化学考前提升训练28化学计算(第29题)(含答案)

(浙江专版)2019版高考化学考前提升提升训练28 化学计算(第29题)1.(2018·上虞中学模拟)铜有两种常见的氧化物CuO和Cu2O。
某学习小组取0.98 g(用精密天平测量)Cu(OH)2固体,将其加热有铜的氧化物生成,其质量随温度变化的曲线如图所示。
(1)图中A点的固体成分为,B点的固体成分为。
(2)整个过程中质量减轻包括(指出具体的物质和质量)。
2.用11.92 g NaClO配成100 mL溶液,向其中加入0.01 mol Na2S x恰好完全反应,生成Na2SO4和NaCl。
(1)NaClO溶液的物质的量浓度为mol·L-1。
(2)化学式Na2S x中的x=。
3.向一定质量CaCl2和HCl的混合溶液中逐滴加入浓度为1.000 mol·L-1的Na2CO3溶液,反应过程中加入的Na2CO3溶液的体积与产生沉淀或气体的质量关系如图所示。
(1)混合溶液中CaCl2和HCl物质的量之比n(CaCl2)∶n(HCl)=。
(2)V2=L。
4.铁、铜混合粉末20.0 g加入到100 mL5.0 mo l·L-1 FeCl3溶液中,剩余固体质量为5.2 g(忽略反应前后溶液体积变化)。
求:(1)反应后溶液中FeCl2的物质的量浓度为mol·L-1。
(2)原固体混合物中铜的质量分数是。
5.Na与Al混合物共1 mol与足量的水充分反应。
(已知:2Al+2NaOH+2H2O2NaAlO2+3H2↑)(1)当Na与Al的物质的量之比为时,混合物与水反应产生的H2最多。
(2)当Na与Al的物质的量之比为时,混合物与水反应产生的H2的体积为13.44 L(标准状况下)。
6.用沉淀法测定KHCO3和Na2CO3固体混合物的组成,每次称取一定质量的样品溶于水制成溶液,向其中滴加相同浓度的Ba(OH)2溶液,每次实验均充分反应,反应前后溶液体积变化忽略不计,实验记录见下表:实验序号ⅠⅡⅢⅣⅤ样品质量/g 3.06 6.12 9.18 12.24 15.30Ba(OH)2溶液体积/mL 300 300 300 300 300生成沉淀的质量/g 5.91 11.82 17.73 23.64 23.64回答下列问题:(1)样品中KHCO3和Na2CO3的物质的量之比为。
2021届高考化学二轮复习课时规范练29 重要的烃 石油和煤

课时规范练29重要的烃石油和煤基础巩固1.(2020河南顶尖名校4月联考)甲基环戊烷()常用作溶剂,关于该化合物下列说法错误的是()A.难溶于水,易溶于有机溶剂B.其一氯代物有3种C.该有机物在一定条件下可以发生取代、氧化反应D.与2-己烯互为同分异构体2.(2020广东广州一模)关于化合物1,4-二氢萘(),下列说法错误的是()A.能使酸性高锰酸钾溶液退色B.分子中所有原子均处同一平面C.一氯代物有4种(不考虑立体异构)D.与互为同分异构体3.下列有关有机物同分异构体数目的叙述中,不正确的是()4.(2020广西玉林第一次适应性考试)关于①②③三种化合物:,下列说法正确的是()A.它们均能使酸性高锰酸钾溶液退色B.它们的分子式都是C8H8C.它们分子中所有原子都一定不共面D.③的二氯代物有4种5.下列说法正确的是()A.用聚乙烯塑料代替聚乳酸塑料可减少白色污染B.有机化合物的同分异构现象是有机化合物种类繁多的重要原因之一C.石油裂解和油脂皂化都是由高分子物质生成小分子物质的过程D.有机物的二氯代物有3种6.(2020东北三省四市二模)对二乙烯苯(如图)可用作树脂、油漆及特种橡胶的原料。
下列说法正确的是()A.分子中所有原子可能共平面B.易溶于甲苯,沸点比甲苯低C.不能使稀酸性高锰酸钾溶液退色D.1 mol该物质至多可与2 mol H2加成7.(2020甘肃兰州调研)异丙苯()催化脱氢生成2-苯基丙烯(),下列有关这两种有机物说法不正确的是()A.苯、异丙苯互为同系物B.2-苯基丙烯最多有9个碳原子共平面C.异丙苯一氯代物有5种同分异构体D.在一定条件下,二者都能发生加聚反应合成高分子化合物8.螺环化合物具有抗菌活性,用其制成的药物不易产生抗药性。
螺[3.4]辛烷的结构如图,下列有关螺[3.4]辛烷的说法正确的是()A.分子式为C8H16B.分子中所有碳原子共平面C.与2-甲基-3-庚烯互为同分异构体D.一氯代物有4种结构9.下列说法中正确的是()A.分子式为C7H16的烷烃,含有3个甲基的同分异构体有2种B.丙烯能发生取代反应、加成反应,还能使酸性KMnO4溶液退色C.甲苯中所有原子都处于同一平面D.相同质量的甲烷和乙烷完全燃烧,乙烷耗氧量多10.下列有关说法正确的是()A.煤的气化就是将煤在高温条件下由固态转化为气态的物理变化过程B.和互为同分异构体C.淀粉、蛋白质和油脂都是高聚物,在一定条件下都能水解D.石油裂解可以得到更多的汽油,这种汽油是一种纯净物能力提升11.(2019全国1,9)实验室制备溴苯的反应装置如下图所示,关于实验操作或叙述错误的是()A.向圆底烧瓶中滴加苯和溴的混合液前需先打开KB.实验中装置b中的液体逐渐变为浅红色C.装置c中碳酸钠溶液的作用是吸收溴化氢D.反应后的混合液经稀碱溶液洗涤、结晶,得到溴苯12.X()、Y()、Z()三种烃的分子式均为C8H8。
高中高三化学大二轮增分强化练——化学计算中的常用方法与技巧专练(答案解析)

【精品】高三化学大二轮增分强化练——化学计算中的常用方法与技巧专练学校:___________姓名:___________班级:___________考号:___________一、单选题1.用N A 表示阿伏加德罗常数的值,则下列叙述正确的是( )①常温常压下,46g 有机物C 2H 6O 中含有极性键的数目一定为7N A ;②标准状况下,22.4L 四氯化碳中所含有的共价键数目为4N A ;③常温下46gNO 2和N 2O 4混合气体中含有原子数为3N A ;④常温常压下,33.6L 氯气与56g 铁充分反应,转移的电子数为3N A ;⑤足量铁在氯气中反应,lmol 铁失去的电子数为2N A ;⑥标准状况下22.4LH 2中含中子数为2N A ;⑦1LImol/L 的盐酸溶液中,所含氯化氢分子数为N A 。
A .①④B .②⑤⑥C .③D .②④⑦ 2.为了检验某含有NaHCO 3杂质的Na 2CO 3样品的纯度,现将w 1 g 样品加热,其质量变为w 2 g ,则该样品的纯度(质量分数)是( )A .211845331w w w -B .12184()31w w w -C .211734231w w w -D .2111158431w w w - 3.ClO 2 是一种高效安全的杀菌消毒剂。
用氯化钠电解法生成ClO 2的工艺原理示意图如下图, 发生器内电解生成ClO 2。
下列说法正确的是A .a 气体是氯气,b 气体是氢气B .氯化钠电解槽内每生成2 mol a 气体,转移2mol e -C .ClO 2发生器中阴极的电极反应式为:ClO 3- + 2H + + e -ClO 2↑ + H 2OD .为使a 、b 气体恰好完全反应,理论上每生产1molClO 2需要补充44.8Lb 气体(标况下)4.用N A 表示阿伏加德罗常数的值。
下列叙述中正确的是( )A.1mol氢氧根离子所含电子数为9N AB.1.00molNaCl中含有N A个NaCl分子C.常温常压下,92g的NO2和N2O4的混合气体含有的原子数为6N AD.标准状况下,11.2LCH3CH2OH中含有分子的数目为0.5N A5.将10 mL NO和NO2的混合气体通入装满水倒立在水槽中的量筒内,一段时间后,最后剩余4 mL气体,原混合气体中含NO体积为A.1 mL B.3 mL C.5 mL D.7 mL6.N A代表阿伏加德罗常数的值,下列叙述正确的是A.高温下,5.6gFe与足量水蒸气反应,转移的电子数为0.3N AB.60g乙酸与足量乙醇发生酯化反应,充分反应后断裂的C-O键数目为N AC.100g质量分数为17%的H2O2的水溶液中,极性共价键的数目为N AD.室温下向1L pH=1的醋酸溶液中加水稀释,所得溶液中的H+数目大于0.1N A7.一定温度下,向一个容积为2 L的真空密闭容器中(事先装入催化剂)通入1 mol N2和3 mol H2,3 min后测得密闭容器内的压强是起始时的0.7倍,在此时间内v(H2)是A.0.1mol/(L·min)B.0.2mol/(L·min)C.0.3mol/(L·min)D.0.6mol/(L·min)8.将7g铁粉投入400mL1mol/LHNO3溶液中,还原产物为NO。
(浙江选考)新2020版高考化学 考前提升训练28 化学计算(第29题)【下载】

提升训练28 化学计算(第29题)1.(2018·上虞中学模拟)铜有两种常见的氧化物CuO和Cu2O。
某学习小组取0.98 g(用精密天平测量)Cu(OH)2固体,将其加热有铜的氧化物生成,其质量随温度变化的曲线如图所示。
(1)图中A点的固体成分为,B点的固体成分为。
(2)整个过程中质量减轻包括(指出具体的物质和质量)。
2.用11.92 g NaClO配成100 mL溶液,向其中加入0.01 mol Na2S x恰好完全反应,生成Na2SO4和NaCl。
(1)NaClO溶液的物质的量浓度为mol·L-1。
(2)化学式Na2S x中的x=。
3.向一定质量CaCl2和HCl的混合溶液中逐滴加入浓度为1.000 mol·L-1的Na2CO3溶液,反应过程中加入的Na2CO3溶液的体积与产生沉淀或气体的质量关系如图所示。
(1)混合溶液中CaCl2和HCl物质的量之比n(CaCl2)∶n(HCl)=。
(2)V2=L。
4.铁、铜混合粉末20.0 g加入到100 mL5.0 mol·L-1 FeCl3溶液中,剩余固体质量为5.2g(忽略反应前后溶液体积变化)。
求:(1)反应后溶液中FeCl2的物质的量浓度为mol·L-1。
(2)原固体混合物中铜的质量分数是。
5.Na与Al混合物共1 mol与足量的水充分反应。
(已知:2Al+2NaOH+2H2O2NaAlO2+3H2↑)(1)当Na与Al的物质的量之比为时,混合物与水反应产生的H2最多。
(2)当Na与Al的物质的量之比为时,混合物与水反应产生的H2的体积为13.44 L(标准状况下)。
6.用沉淀法测定KHCO3和Na2CO3固体混合物的组成,每次称取一定质量的样品溶于水制成溶液,向其中滴加相同浓度的Ba(OH)2溶液,每次实验均充分反应,反应前后溶液体积变化忽略不计,实验记录见下表:实验序号ⅠⅡⅢⅣⅤ样品质量/g 3.06 6.12 9.18 12.24 15.30Ba(OH)2溶液体积/mL 300 300 300 300 300生成沉淀的质量/g 5.91 11.82 17.73 23.64 23.64回答下列问题:(1)样品中KHCO3和Na2CO3的物质的量之比为。
高考化学考前特训总复习 第一部分 学考70分快练(非选择题)特训4 第29题化学计算题专练(无答案)

(浙江选考)2017版高考化学考前特训总复习第一部分学考70分快练(非选择题)特训4 第29题化学计算题专练(无答案)编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望((浙江选考)2017版高考化学考前特训总复习第一部分学考70分快练(非选择题)特训4 第29题化学计算题专练(无答案))的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为(浙江选考)2017版高考化学考前特训总复习第一部分学考70分快练(非选择题)特训4 第29题化学计算题专练(无答案)的全部内容。
特训4 第29题化学计算题专练领悟学考真题1.(2016·浙江10月选考,29)为确定Na2CO3和NaHCO3混合物样品的组成,称取四份该样品溶于水后分别逐滴加入相同浓度盐酸30。
0 mL,充分反应,产生CO2的体积(已折算成标准状况下的体积,不考虑CO2在水中的溶解)如下表:(1)样品中的物质的量之比n(Na2CO3)∶n(NaHCO3)=________.(2)盐酸的物质的量浓度c(HCl)=____________。
仿真模拟集训2.(2016·浙江省台州中学高三上学期第四次统练)小茗同学用Na2CO3和KHCO3组成的某混合物进行实验,测得如下几组数据(其中盐酸的物质的量浓度相等,且忽略HCl的挥发,气体体积均为标准状况下的体积)。
试回答:(1)所用盐酸的物质的量浓度为__________。
(2)第4组实验至少还需加入________________ mL的该盐酸才能完全反应。
3.(2016·宁波市十校高三9月联考)将一定质量Na2CO3和NaHCO3的均匀混合物分成等量的两份。
高考化学复习 第29题强化突破训练(解析版)
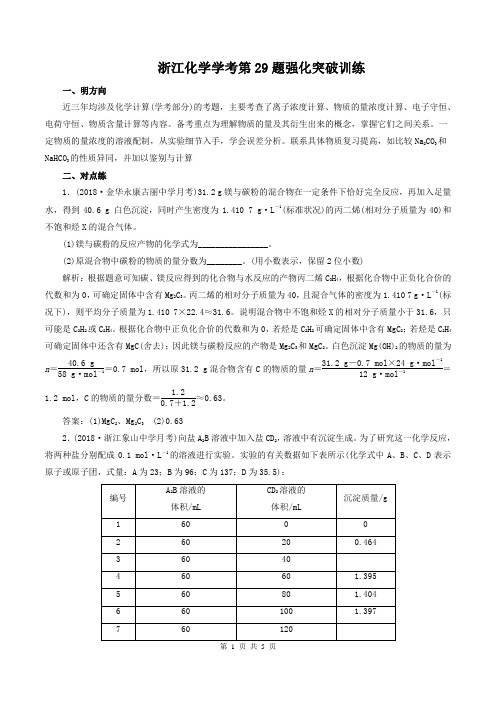
浙江化学学考第29题强化突破训练一、明方向近三年均涉及化学计算(学考部分)的考题,主要考查了离子浓度计算、物质的量浓度计算、电子守恒、电荷守恒、物质含量计算等内容。
备考重点为理解物质的量及其衍生出来的概念,掌握它们之间关系。
一定物质的量浓度的溶液配制,从实验细节入手,学会误差分析。
联系具体物质复习提高,如比较Na2CO3和NaHCO3的性质异同,并加以鉴别与计算二、对点练1.(2018·金华永康古丽中学月考)31.2 g镁与碳粉的混合物在一定条件下恰好完全反应,再加入足量水,得到40.6 g 白色沉淀,同时产生密度为1.410 7 g·L-1(标准状况)的丙二烯(相对分子质量为40)和不饱和烃X的混合气体。
(1)镁与碳粉的反应产物的化学式为________________。
(2)原混合物中碳粉的物质的量分数为________。
(用小数表示,保留2位小数)解析:根据题意可知碳、镁反应得到的化合物与水反应的产物丙二烯C3H4,根据化合物中正负化合价的代数和为0,可确定固体中含有Mg2C3。
丙二烯的相对分子质量为40,且混合气体的密度为1.410 7 g·L-1(标况下),则平均分子质量为1.410 7×22.4≈31.6。
说明混合物中不饱和烃X的相对分子质量小于31.6,只可能是C2H2或C2H4。
根据化合物中正负化合价的代数和为0,若烃是C2H2可确定固体中含有MgC2;若烃是C2H4可确定固体中还含有MgC(舍去);因此镁与碳粉反应的产物是Mg2C3和MgC2。
白色沉淀Mg(OH)2的物质的量为n=40.6 g58 g·mol-1=0.7 mol,所以原31.2 g混合物含有C的物质的量n=31.2 g-0.7 mol×24 g·mol-112 g·mol-1=1.2 mol,C的物质的量分数=1.20.7+1.2≈0.63。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
********灿若寒星竭诚为您提供优质文档********* 灿若寒星 第29题 化学计算题专练 1.已知19.2 g Cu与过量的200 mL 5 mol·L-1稀硝酸充分反应,反应方程式如下:3Cu+8HNO3=====加热3Cu(NO3)2+2NO↑+4H2O。 请计算(忽略反应前后溶液体积的变化)。 (1)转移电子的物质的量为________ mol;标准状况下,产生NO气体的体积为______ mL。 (2)反应后,NO-3的物质的量浓度为________ mol·L-1。 答案 (1)0.6 4 480 (2)4 解析 (1)19.2 g Cu的物质的量是19.2 g÷64 g·mol-1=0.3 mol,硝酸的物质的量是0.2 L×5 mol· L-1=1.0 mol,根据方程式可知0.3 mol铜完全反应消耗0.8 mol硝酸,所以硝酸过量,铜完全反应,因此转移电子的物质的量为0.3 mol×2=0.6 mol;标准状况下,产生NO气体的体积为0.2 mol×22.4 L·mol-1=4.48 L=4 480 mL。(2)根据氮原子守恒可知反应后NO-3的物质的量是1.0 mol-0.2 mol=0.8 mol,所以硝酸根离子的浓度为0.8 mol÷0.2 L=4 mol·L-1。
2.(2018·余姚中学高三选考模拟)(1)溶解28.4 g碳酸钙和碳酸氢钙的混合物,消耗1.0 mol· L-1盐酸500 mL。灼烧等量的上述混合物,得到氧化钙的质量是__________________。 (2)有Na2CO3、NaHCO3、CaO和NaOH组成的混合物27.2 g,把它们溶于足量的水中充分反应后,溶液中Ca2+、CO2-3、HCO-3均转化为沉淀,将反应器内水分蒸干,最后得到白色固体物质共29 g,则原混合物中Na2CO3的质量是________________。 答案 (1)14 g (2)10.6 g 解析 (1)本题考查化学方程式的计算。该题常规解法为先写化学方程式,然后列方程组计算即可得答案;当然也可利用原子守恒妙解之。利用钙原子、氯原子守恒有: CaO~CaCl2~2HCl 56 2 m 1.0 mol·L-1×0.5 L
由此解得氧化钙的质量m=14 g。 (2)依题意知,Na2CO3、NaHCO3、CaO和NaOH充分反应后恰好全部转变为CaCO3和NaOH,Δm********灿若寒星竭诚为您提供优质文档********* 灿若寒星 =29 g-27.2 g=1.8 g。 由原子守恒知固体物质增重是因为水参与了反应,依题意写出方程式: Na2CO3+NaHCO3+2CaO+H2O===2CaCO3↓+3NaOH 106 18 10.6 g 1.8 g 故答案为10.6 g。 3.将1.95 g由Na2SO4和Na2CO3组成的混合物溶于水,向所得溶液中加入10 mL未知浓度的BaCl2溶液恰好完全反应,生成沉淀,向所得沉淀中加入足量稀盐酸,充分反应后剩余沉淀2.33 g。计算: (1)原混合物中Na2CO3的质量分数是_____________________________________________。 (2)BaCl2溶液的物质的量浓度是_______________________________________________。 答案 (1)27.2% (2)1.5 mol·L-1
解析 (1)剩余沉淀是硫酸钡。m(Na2SO4)=2.33 g233 g·mol-1×142 g·mol-1=1.42 g,m(Na2CO3)
=1.95 g-1.42 g=0.53 g,原混合物中Na2CO3的质量分数为0.531.95≈27.2%。 (2)n(Na2SO4)=1.42142 mol=0.01 mol,n(Na2CO3)=0.53106 mol=0.005 mol,n(BaCl2)=n(Na2SO4)+n(Na2CO3)=0.015 mol,c(BaCl2)=0.015 mol0.01 L=1.5 mol·L-1。 4.(2017·温州市高一下学期期末)取Na2CO3和NaOH的混合液100 mL,先向其中滴加Ba(OH)2
溶液至不产生沉淀为止,再向其中滴加稀盐酸至沉淀消失,产生的沉淀的质量与消耗盐酸的
体积如图所示:
(1)原混合液中Na2CO3的物质的量为________ mol。 (2)原混合液中Na2CO3与NaOH 的物质的量浓度之比为________。 (3)稀盐酸的物质的量浓度为________ mol·L-1。 答案 (1)0.01 (2)1∶2 (3)1 解析 (1)根据图像可知碳酸钡的质量是1.97 g,物质的量是1.97 g÷197 g·mol-1=0.01 mol,根据碳酸根守恒可知原混合液中Na2CO3的物质的量为0.01 mol。(2)根据图像可知与氢氧化钠反应消耗盐酸的体积是40 mL,与碳酸钡反应消耗盐酸的体积是60 mL-40 mL=20 mL,根据方程式BaCO3+2HCl===BaCl2+H2O+CO2↑可知碳酸钡消耗盐酸0.02 mol,所以盐酸的浓********灿若寒星竭诚为您提供优质文档********* 灿若寒星 度是0.02 mol÷0.02 L=1 mol·L-1;所以与氢氧化钠反应的盐酸的物质的量是1 mol·L-1 ×0.04 L=0.04 mol,因此根据方程式NaOH+HCl===NaCl+H2O可知氢氧化钠的物质的量是0.04 mol,其中由碳酸钠反应生成的氢氧化钠是0.01 mol×2=0.02 mol,则原溶液中含有的氢氧化钠是0.04 mol-0.02 mol=0.02 mol,因此原混合液中Na2CO3与NaOH的物质的量浓度比为0.01∶0.02=1∶2。 5.测定硫酸铜晶体(CuSO4·xH2O)中结晶水的x值:称取2.41 g硫酸铜晶体,在________(填实验仪器名称)中加热至质量不再改变时,称量粉末的质量为1.6 g。则计算得x=________(计算结果精确到0.1)。 答案 坩埚 4.5 解析 在坩埚中加热硫酸铜晶体至质量不再改变时,所得粉末为CuSO4,计算其物质的量:
n(CuSO4)=mM=1.6 g160 g·mol-1=0.01 mol,而减少的水的质量m(H2O)=2.41 g-1.6 g=0.81 g,
n(H2O)=0.81 g18 g·mol-1=0.045 mol,
CuSO4·xH2O=====△CuSO4+xH2O 1 x 0.01 mol 0.045 mol 10.01 mol=x0.045 mol,解得x=4.5。
6.向含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各离子的物质的量变化如下图所示。
(1)原混合溶液中n(FeBr2)=______________。 (2)原溶液中n(Fe2+)∶n(I-)∶n(Br-)=______________________。 答案 (1)3 mol (2)2∶1∶3 解析 还原性为I->Fe2+>Br-,则先发生2I-+Cl2===I2+2Cl-,I-反应完毕再发生2Fe2++Cl2===2Fe3++2Cl-,最后发生反应2Br-+Cl2===Br2+2Cl-。 (1) AB段发生2I-+Cl2===I2+2Cl-,消耗1 mol氯气,则n(I-)=2n(Cl2)=2 mol,BC段发生2Fe2++Cl2===2Fe3++2Cl-,消耗2 mol氯气,则亚铁离子的物质的量是n(Fe2+)=2×2 mol=4 mol,DE段发生2Br-+Cl2===Br2+2Cl-,消耗氯气3 mol,故n(Br-)=2n(Cl2)=6 mol,因此原混合溶液中n(FeBr2)=3 mol。(2)根据以上分析可知原溶液中n(Fe2+)∶n(I-)∶n(Br********灿若寒星竭诚为您提供优质文档********* 灿若寒星 -)=4 mol∶2 mol∶6 mol=2∶1∶3。
7.(2017·温州十五校联合体高二第二学期期末)为确定Na2CO3和KHCO3混合物样品的组成,称取五份该样品溶于水后分别逐滴加入相同浓度盐酸40.0 mL,充分反应,实验记录见下表: (CO2的体积已折算成标准状况下的体积,不考虑CO2在水中的溶解) 实验序号 Ⅰ Ⅱ Ⅲ Ⅳ 样品质量(g) 1.560 3.900 6.240 8.580 HCl体积(mL) 40.0 40.0 40.0 40.0 CO2体积(mL) 336 840 896 560
回答下列问题: (1)样品中Na2CO3和KHCO3的物质的量之比为______。 (2)盐酸的物质的量浓度为______________________________________________________。 答案 (1)2∶1 (2)2.0 mol·L-1 解析 (1)由表中数据分析,相同浓度盐酸40.0 mL,分别与五份Na2CO3和KHCO3混合物样品充分反应,表中产生CO2的最大体积是896 mL,即0.04 mol,由此可知第Ⅰ组实验中盐酸是过量的。当1.560 g混合物样品与足量盐酸充分反应产生336 mL CO2(即0.015 mol CO2)时,设1.560 g 中含Na2CO3的物质的量为x mol,KHCO3为y mol,则x+y=0.015,106x+100y=1.560,解得x=0.01,y=0.005,样品中Na2CO3和KHCO3的物质的量之比为2∶1。(2)第Ⅳ组CO2的体积比第Ⅲ组小,HCl不足,可以计算HCl的浓度和物质的量,Na2CO3和盐酸的反应分下列两步进行:Na2CO3+HCl===NaCl+NaHCO3、NaHCO3+HCl===NaCl+CO2↑+H2O,固体质量8.580 g是第Ⅰ组1.560 g的5.5倍,所以Na2CO3有0.01 mol×5.5=0.055 mol,第一步消耗盐酸0.055 mol,而第二步中560 mL气体为0.025 mol,需消耗盐酸0.025 mol,所以
盐酸的总物质的量为0.080 mol,则盐酸的物质的量浓度为0.080 mol0.04 L=2.0 mol·L-1。 8.(2017·金华十校高二下期末)常温下,取0.592 g Na2CO3和NaHCO3的固体混合物溶于水配成50.0 mL溶液,往溶液中加入50.0 mL Ba(OH)2溶液恰好使生成的沉淀量最多,测得反应后溶液的pH=13 (混合溶液体积改变忽略不计)。试计算: (1)反应后溶液中的n(OH-)。 (2)原混合物中的n(Na2CO3)∶n(NaHCO3)。 答案 (1)剩余的氢氧根的物质的量n(OH-)=0.1 mol·L-1×0.10 L=0.010 mol。 (2)设原混合物中n(Na2CO3)=x mol,n(NaHCO3)=y mol,往溶液中加入Ba(OH)2溶液,恰好使生成白色沉淀的量最多,根据HCO-3+OH-===CO2-3+H2O,消耗氢氧根离子的物质的量是y mol,反应后碳酸根离子是(x+y) mol,原氢氧化钡溶液中氢氧根离子总物质的量是(0.01+y) mol,钡离子的物质的量是(0.01+y)/2 mol,根据CO2-3+Ba2+===BaCO3↓可知:(0.01+y)/2=x+y,
