氨基酸水杨醛席夫碱铜配合物的合成及其表征
过渡金属组氨酸水杨醛Schiff碱配合物的合成及生物活性

酸 ,a= Sl 水杨醛 ]其结构经 U  ̄R 元素分析 , 电导分析表征 。荧光光谱表 明四种 配合物都 能强烈猝 灭 B A的 内源荧光。生 , VI, 摩尔 S
物活性实验表 明配合物对金黄色葡萄球菌( . u s , S A mu .革兰 氏阳性菌 ) 大肠杆菌 ( . oi , 兰 氏阴性菌 ) 枯草 杆菌 ( . u t , E Cl 革 . , B S bi —
S1 、 o H s a) Mn Hi —S1 , i a) C ( i —S1 、 ( s a) H s=组 氨 酸 ,
l. 革兰氏阳性 菌) 绿脓杆菌( . e g o . 革兰氏阴性菌 ) i, 8 , PA r i s , una 均有不同程度 的抑 菌作用 。 关键词: 组氨酸 ;ci 碱 ; Sh f 过渡金 属配合 物 ; 成; 合 表征 ; 生物活性
中图分类号 : 6 14 0 4 . 文献标识码 : A 文章编号 :08— 2 X( 0 1 0 —00 0 10 0 1 2 1 ) 1 0 7— 4
a t ce a a tvt e pe me s h we d fe e t a tro t ss fe t o t c mp e e a an t n i tr l ciiy x r nt s o d i r n b ce isa i e cs f he o lx s g is ba i i sa y o o c u e s,e c e i h a c l,b cl u tls p e o n sa m g n s tph lc c usa r u s h rc i oi a i uss b ii , s ud mo a e i o a. l
Ke r s h si i e c i a e r n i o tl c mp e y wo d : it n ;S h f b s ;ta st n me a o lx;s n h ss h r c eia in;a t a tra d i y te i ;c aa tr t z o n i ce l b i
席夫碱Cu催化剂的合成及催化性能分析

当代化工研究Modern Chemical R esearch 192019•06综述与专论席夫碱Cu催化剂的合成及催化性能分析*朱剑波(绍兴上虞华伦化工有限公司浙江312369)摘耍:工业废水的主要来源就是印染行业产生的印染废水,而印染废水最大的污染物之一来自于有机染料.有机染料具有三致毒性,通过自然降解的方法难以除去,染料污■染问题成为了印染行业发展面临餉最大的瓶颈.近年来有关金属配合物的研究成为热点,尤其是关于Cu餉配合物,据报道席夫碱配合物拥有可以逆向性吸附氧分子以及催化、氧化等性能.本文主要针对席夫碱Cu催化剂的合成及其性能方面做简要分析.关键词:席夫碱;催化剂合成;催化性能中EB分类号:T文献标识码:ASynthesis and Catalytic Performance Analysis of Schiff Base Cu CatalystZhu Jianbo(Shaoxing Shangyu Warren Chemical CO.,LTD.,Zhejiang,312369)Abstract:The main source of i ndustrial wastewater is the printing and dyeing wastewater p roduced by the p rinting and dyeing industry,and one of t he greatest p ollutants in the printing and dyeing wastewater comes f rom organic anic dyes have triple toxicity,"which is difficult to remove by natural degradation.Dye pollution has become the biggest bottleneck in the development of p rinting and dyeing industry.In recent years, the research on metal complexes has become a hotspot,especially on copper complexes.It is reported that Schiff b ase complexes have the p roperties of r eversible adsorption of o xygen molecules,catalysis and oxidation.In this paper,the synthesis and p roperties of S chiff b ase Cu catalyst are briefly analyzed.Key words:Schiff b ase;catalyst synthesis;catalytic p erformance到目前为止,人们所知道的处理工业有机废水的方法主要有三种。
邻苯二胺缩水杨醛席夫碱配体铜配合物的合成

邻苯二胺缩水杨醛席夫碱配体铜配合物的合成孙文耀(化学化工学院 2011级应用化学)指导教师:刘超摘要:本实验以邻苯二胺与水杨醛在乙醇溶液中反应,缩合生成水杨醛席夫碱,产率为48.3%;而后利用该席夫碱与一水乙酸铜反应生成铜配合物。
在加热温度为87℃,经过回流6个小时合成了席夫碱;铜配合物是在加热条件为87℃,加热回流24小时得到的。
利用元素分析仪,紫外光谱分析仪,傅里叶变换红外分光光度计对产物进行测定表征;再利用荧光分光光度计探究产品的荧光性质,结果显示邻苯二胺缩水杨醛配体以及铜配合物都有荧光性质。
关键词:邻苯二胺;水杨醛;席夫碱;缩合反应;铜配合物引言席夫碱通常是由胺和活性羰基缩合而成,是氮原子与碳原子以双键形式连结的一类化合物,可用作有机合成试剂和液晶材料[1-2]。
席夫碱类化合物及其金属的配合物在诸多科研范围内有着广泛应用,其探索领域涉及医学研究、催化研究、分析化学应用、抗腐蚀增强体以及光致变色等科学前沿。
在医学领域,席夫碱的生物活性表现在能够抑制细菌、抗击病毒、有效限制肿瘤细胞的繁殖扩散[3];在催化领域,席夫碱的锌和铬配合物已经作为催化剂被广泛应用在工业生产中[4-5]。
它们在配位化学、催化合成、信息储存、纳米材料、药物合成等领域具有很高的研究价值和广阔的应用前景[6],因此受到化学工作相关研究人员的广泛关注。
赵斌,南田等人利用水杨醛、三乙胺合成了小分子席夫碱,再以小分子席夫碱和醛类化合物为原料进行反应,得到了酚醛树脂型大分子席夫碱,并探究了其耐热性,显示酚醛树脂型高分子席夫碱比一般材料更耐热,具有很好的稳定性[7-8]。
铜元素在生命体中具有重要的作用,其可协助血红蛋白载血,是生命必需的微量元素,大部分以有机金属蛋白的形式存在[9-10]。
通过研究过渡金属铜离子的配合物、其它配体或药物之间的相互作用,可为我们探索和研究药物分子杀菌抗癌的作用机理提供理论基础和方向的指引。
杨孝辉,郭君,张忠海等合成了乙酰基乙酸氨基硫腙席夫碱Cu(Ⅱ)、Mo(Ⅱ)、Ni(Ⅱ)、Zn(Ⅱ)、Mn(Ⅱ)的配合物,测定出这些配合物的结构,并进行了配合物抗病毒的研究和对比,结果表明,Cu(Ⅱ)配合物具有最强的抗击病毒能力,能很好的抗击流行性感冒流感病毒、呼吸道病毒,抗病毒持久能力远大于普通的有机铜[11-13],这说明对Cu(Ⅱ)配合物生物活性的进一步研究是很必要且很有价值的。
水杨醛缩乙二胺席夫碱及金属配合物的合成
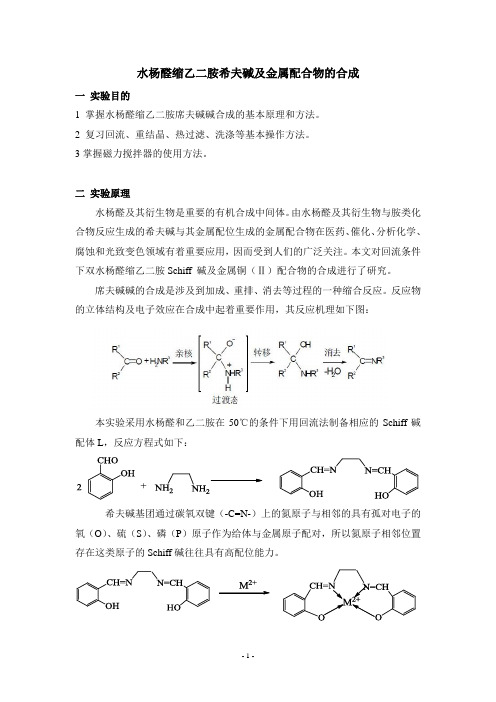
水杨醛缩乙二胺希夫碱及金属配合物的合成一实验目的1 掌握水杨醛缩乙二胺席夫碱碱合成的基本原理和方法。
2 复习回流、重结晶、热过滤、洗涤等基本操作方法。
3掌握磁力搅拌器的使用方法。
二实验原理水杨醛及其衍生物是重要的有机合成中间体。
由水杨醛及其衍生物与胺类化合物反应生成的希夫碱与其金属配位生成的金属配合物在医药、催化、分析化学、腐蚀和光致变色领域有着重要应用,因而受到人们的广泛关注。
本文对回流条件下双水杨醛缩乙二胺Schiff 碱及金属铜(Ⅱ)配合物的合成进行了研究。
席夫碱碱的合成是涉及到加成、重排、消去等过程的一种缩合反应。
反应物的立体结构及电子效应在合成中起着重要作用,其反应机理如下图:本实验采用水杨醛和乙二胺在50℃的条件下用回流法制备相应的Schiff碱配体L,反应方程式如下:希夫碱基团通过碳氧双键(-C=N-)上的氮原子与相邻的具有孤对电子的氧(O)、硫(S)、磷(P)原子作为给体与金属原子配对,所以氮原子相邻位置存在这类原子的Schiff碱往往具有高配位能力。
M2+为金属离子(M2+分别为Cu2+、Zn2+、Ni2+、Mn2+、Ni2+等离子)二仪器和药品1 仪器100mL三口烧瓶恒压滴液漏斗磁力搅拌器玻璃塞抽滤瓶烧杯2 药品水杨醛(相对分子质量122.12,密度1.17g/cm³乙二胺(相对分子质量60.10,密度0.90g/cm³无水乙醇乙酸铜、硝酸钴、乙酸锰、乙酸锌、硝酸锌、氯化镍三实验步骤1 希夫碱配体(L)的合成步骤移取5.2mL(0.05mol)的水杨醛与15 mL的无水乙醇溶于三口瓶中,再量取1.8mL(0.025mol)的乙二胺与10mL的无水乙醇于烧杯中搅拌溶解。
将三口瓶固定在搅拌器上,开启仪器,将乙二胺的无水乙醇溶液逐滴滴加到三口瓶中,恒温55℃反应1小时。
反应结束。
抽滤得黄色的固体,干燥称重并计算产率。
反应装置图如下:乙二胺的无水乙醇溶液2 希夫碱配体(L)与金属离子(M2+)的反应步骤称取1.34g(0.005mol)配体L,与20 mL的无水乙醇混合溶解于三口瓶中,在称取金属盐,若为乙酸铜时质量为1g(0.005mol)。
铜席夫碱配合物及其制备方法和应用的制作技术

本技术涉及一种铜席夫碱配合物及其制备方法和应用,目的是解决现有的铜席夫碱配合物制备方法中存在的操作繁琐、反应时间长、产率低以及存在安全隐患的技术问题,本技术的一种铜席夫碱配合物,其分子式为[Cu2(HL)2(OAc)2]n,其中HL为肼基(2吡啶基)水杨醛亚胺;本技术铜席夫碱配合物的制备方法,将摩尔比为1:2:2的Cu(OAc)2·H2O、2肼基吡啶和水杨醛,加入含有甲醇的聚四氟乙烯管中,所述Cu(OAc)2·H2O与甲醇的摩尔体积比为0.1:(35)mmol/ml;在80100℃下反应4872h,自然降温,析出黑色棒状晶体,用甲醇溶液洗涤后干燥,即制得所述铜席夫碱配合物。
本技术的铜配合物对大肠杆菌、金黄色葡萄球菌及枯草芽孢杆菌具有强的抑菌作用,在生物活性领域有优良的潜在应用前景,可作为新型抗菌剂。
技术要求1.一种铜席夫碱配合物,其特征在于:所述配合物的分子式为[Cu2(HL)2(OAc)2]n,其中HL为2-{(E)-[2-(2-吡啶基)腙基]甲基}苯氧基,n代表重复单元数,所述配合物的结构式为:所述配合物的制备方法包括如下步骤:(1)将摩尔比为1:2:2的Cu(OAc)2·H2O、2-肼基吡啶和水杨醛,加入含有甲醇的聚四氟乙烯管中,所述Cu(OAc)2·H2O与甲醇的摩尔体积比为0.1:3-5mmol/ml;(2)将所述聚四氟乙烯管置于不锈钢反应釜中密封,在80-100℃下反应48-72h,自然降温,析出黑色棒状晶体,用甲醇溶液洗涤后干燥,即制得所述铜席夫碱配合物。
2.根据权利要求1所述的一种铜席夫碱配合物,其特征在于:所述配合物的晶体属单斜晶系,空间群为C2/c,晶胞参数为:α=90°,β=120.7(6)°,γ=90°。
3.一种含有权利要求1所述的铜席夫碱配合物的抑菌剂。
技术说明书一种铜席夫碱配合物及其制备方法和应用技术领域本技术涉及一种铜席夫碱配合物及其制备方法和应用。
水杨醛双Schiff碱与其铜配合物的合成与抗菌活性研究

Ke wods sl yad h d ; shf ae CuCo lx s y te i; a t a tra atvt y r :ai llc y e c i b s ;( ) mpe e ;s nh s c s ni ceil cii b y
f . n i e r g a dCo 1 E gn e i n mme c l g f o t — nr l i e s y f r t n l i s W u a 3 0 5:2 C l g f n r eCo l eo u h Ce t v r i o i ai e . h n 4 0 6 e S a Un t Na o t . o l eo e
crido tT ersl h we a: c i aead i (1) mpe e a eac r i e reo niatr l cii , u h u I o lx sh v etr are u h e ut so dt t S hf b s n sCu 1 Co lx sh v et nd ge fa t cei t t b t eC (I)C mpe e aeab t s h t a b a a vy t e
26p r ie iab x l imie(l) i sl,te h (1)o lx sl kdb c i aeweesnh sz d h ia da dc mplxweec aatrzdb ,一y i n dcro yi da d 1a]f t h nteCu 1c mpe e i e y S hf b s r y teie T el n n o e r h rceie y d c r y n g se t T ea t atra cii n nmu ihbtr o cnrt s nE Coi n tp vo o c s u e so eS hf aea di p cr h ni ceil t t a dmii m ii yc n e taet t o la dSa h lc c u ru fh c i b s n t Cu(I o lx swee a b a vy n o es a t s I)c mpe e r
水杨醛配西佛碱

本科毕业论文(设计)题目:希佛碱-金属配合物镍(II)的合成与表征学院:化学与化工学院班级:06级应用化学2班姓名:方明指导教师:荆补琴职称:讲师完成日期:2010年06月05日希佛碱-金属配合物镍(II)的合成与表征摘要:本文采用分步合成的方法以水杨醛、乙二胺为原料合成了希佛碱以及它与镍的配合物,并用光度法和红外光谱对希佛碱和其配合物进行了表征。
实验结果表明:实验成功达到了预期的目的,用水杨醛、乙二胺为原料合成了它们的希佛碱以及它和镍的配合物。
关键词:希佛碱;镍;合成目录1前言 (1)2实验部分 (2)2.1合成原理 (2)2.2试剂和仪器 (2)2.3实验步骤 (3)2.3.1希佛碱及其配合物的生成 (3)2.3.2光度法测定配体及其配合物 (3)3结果与分析 (3)3.1配合物溶解性实验 (3)3.2配体与配合物的红外光谱测定 (4)3.3配体与配合物的光度法测定 (6)3.3.1配合物最大波长的测定 (6)3.3.2配合物络合比的测定 (6)3.4配合物的熔点测定 (7)4实验结论 (7)参考文献 (8)致谢 (10)1前言希佛碱是指含有亚甲胺基(Anomthine group)-RC=N-, 并通过是由伯胺与活泼的羰基化合物所形成的一类化合物[1]。
希佛碱是含有亚氨基,并通常由伯胺与活泼的羟基化合物所形成,由于金属中心存在自旋-自选交换作用,具有电子转移功能硝基苯甲醛与对氨基苯酚作为反应物合成希佛碱,两个金属离子之间可来凝结一些小的底物分子,可作为金属蛋白质小分子的模拟物。
希佛碱化合物从结构上可大致分为:单齿希佛碱、双齿希佛碱、不对称希佛碱以及异双希佛碱几类。
由于希佛碱化合物合成工艺简单,产率较高(一般产率会在80%以上),产物毒性低,易分离提纯,因而对希佛碱化合物的应用开发研究发展十分迅速。
其主要的应用研究集中在以下几个方面:(1)催化领域希佛碱分子及其金属配合物在催化领域中的应用非常广泛,希佛碱化合物作为催化剂主要应用于聚合反应、不对称催化反应、烯烃催化氧化方面以及电催化领域[2]。
双核铜(ⅱ)-β-丙氨酸缩水杨醛席夫碱配合物的合成及其晶体结构

双核铜(ⅱ)-β-丙氨酸缩水杨醛席夫碱配合物的合成及其晶体结构
本文讨论了双核铜(ⅱ)-β-丙氨酸缩水杨醛席夫碱配合物的合成及其晶体结构。
首先,我们用抗坏血酸与硝酸铜反应,合成了双核铜(ⅱ)离子。
然后,将锡铜金属离子与β-丙氨酸酰基缩水杨醛席夫碱反应,成功地合成了目标配合物。
最后,我们通过X射线晶体学分析技术,分析了该配合物的三维晶体结构。
实验结果表明,所合成的双核铜(ⅱ)-β-丙氨酸缩水杨醛席夫碱配合物具有四角柱形亚单元构型,由八个铜离子聚集而成,并与两个缩水杨醛席夫碱分子存在八个键合点,其中两个存在螯合键,六个存在氢键。
通过结构分析,可以清楚地看到缩水杨醛席夫碱分子存在螯合关系,并与铜离子发生键合作用。
该配合物是一种以金属离子与有机缩水杨醛席夫碱配体结合的金属框架结构,具有很强的稳定性和特殊的催化活性,能够有效地应用
于有机合成中的催化和加氢反应,以及生物领域的药物开发等关键领域。
因此,双核铜(ⅱ)-β-丙氨酸缩水杨醛席夫碱配合物重要性在于其具有良好的稳定性和特殊功能,能够有效应用于有机合成中的催化和加氢反应,以及生物领域的药物开发等关键领域。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
精品文档 可编辑 氨基酸水杨醛席夫碱铜配合物的合成及其表征 周雨515020910133
一、 实验目的 1、 了解氨基酸类、席夫碱类化合物及其重要作用 2、 掌握制备氨基酸水杨醛席夫碱铜配合物的制备方法,熟悉基本实验操作 3、 掌握表征该铜配合物的各种现代仪器分析手段的基本原理以及操作流程
二、 实验原理 氨基酸是羧酸链上碳原子的氢被氨基取代之后的化合物,含有氨基和羧基两种官能团,可以根据氨基在碳链上取代的位置分为α-,β-,γ-氨基酸。其中组成蛋白质的大都是α-氨基酸,有20种,除甘氨酸外均是L-α-氨基酸(具有手性)。常用的非手性氨基酸有甘氨酸、β-丙氨酸,这些氨基酸价格低廉因而广泛应用在生化、医药等领域。 水杨醛是邻羟基苯甲醛,广泛应用于有机合成中,是一种常见的工业原料。 席夫碱主要是指含有亚胺或者甲亚胺官能团的化合物,通常由胺和活性羰基化合物发生缩合反应来制备。席夫碱中的氧原子和氮原子可以与过渡金属形成六元环稳定配合物,其中席夫碱的钴、镍配合物已经作为催化剂在工业上得到应用。同时由于其良好的配位性质,席夫碱可以用于鉴定离子和定量分析离子的含量。 本实验通过使用水杨醛与甘氨酸、β-丙氨酸发生缩合反应生成席夫碱类化合物,席夫碱中含有的氮原子和氧原子和加入的金属铜盐形成稳定的六元环配合物。
合成的金属有机配合物可以通过多种手段进行表征,其中常用的包括通过红外光谱方法、紫外光谱方法鉴定该配合物中含有的官能团,通过XRD表征合成配合物形成的晶体结构,通过核磁分析确定化合物相关信息等。
三、 实验仪器和试剂 仪器:核磁共振仪,红外光谱仪,X射线衍射仪,250mL圆底烧瓶,搅拌子,搅拌器,干燥器,胶头滴管,量筒,锥形瓶,pH试纸等。 试剂:氢氧化钾,β-丙氨酸,醋酸铜,蒸馏水,无水乙醇,无水乙醚,溴化钾,氘代氯仿,水杨醛。试剂均为化学纯级别。
四、 实验流程 1、 制备流程 配体制备流程: 将3.4g(60mmol)氢氧化钾和5.35g(60mmol)β-氨基酸溶于10mL水,加入250mL烧瓶,将7.3g水杨醛溶于40mL无水乙醇,待两者固体完全溶解后,将水杨醛缓慢滴入体系,溶液变成黄色。在85℃情况下加热回流精品文档 可编辑 两小时,点板监测水杨醛反应完后,用100mL无水乙醇稀释旋蒸除去溶剂,得到的黄色固体用甲醇重结晶,过滤得到固体并用二氯甲烷等洗涤固体,干燥。 配合物制备流程 将2.313g(10mmol)配体溶于50mL无水乙醇的250mL烧瓶中,将等当量的一水醋酸铜溶于50mL无水乙醇,并缓慢滴入烧瓶内。随着滴加,溶液的颜色逐渐变成黑绿色。加入完毕后,在85℃情况下回流两小时,除去溶剂后,用少量甲醇重结晶,过滤得到固体并用二氯甲烷等洗涤固体,干燥。
2、 表征过程 核磁表征:取少量配体加入核磁管,并用氘代氯仿溶解后,于400MHz核磁做NMR分析; 红外光谱表征:取适量固体用压片法制样,用傅里叶变换红外光谱仪分析; 紫外-可见光谱表征:取少量固体溶于DMSO,用紫外光谱分析仪进行分析; XRD表征:使用X射线衍射仪测定所制得样品的相关衍射角度。
五、 数据分析 配体核磁共振氢谱图分析:
H1 NMR(300MHz; d6-DMSO; s, singlet; d doublet; t, triplet; q, quartet; m, multiplet) 精品文档
可编辑 从核磁共振谱图中可以看出,没有化学位移超过10以上的出峰,说明原料已经反应完全,否则醛基氢、羧酸氢的化学位移均可能大于10。对比标准谱图以及积分比例,可以看出我们的配体确实发生了缩合生成了亚胺,在化学位移8.40左右有亚胺氢,而且芳环部分的峰能够很好地吻合比例。而对于高场低位移部分比例则不大符合,根据和原料的标准谱图对比,发现低场峰是过量的氨基酸的峰。由于氨基酸的极性较大,与生成的配体钾盐的极性相似,因此重结晶过程中可能未能较好地除去,得到的配体并不是很干净。
配体/配合物紫外-可见光谱分析:
从配体和产物的紫外可见光谱来看,两者的吸收峰位置有明显的不同,这说明配体与铜离子发生了配合。265nm和315nm的吸收峰分别对应π→π* ,n→π* 跃迁;322nm的吸收峰对应配体和铜离子的荷移跃迁,这说明铜离子的确与配体发生了配位作用。
配体/配合物红外光谱分析: 精品文档
可编辑 配体红外光谱图 对配体红外光谱的吸收峰进行归属:3300cm-1-3400 cm-1对应配体中苯酚羟基的振动;1640 cm-1-1620 cm-1对应碳氮双键的伸缩振动;3000 cm-1-2900 cm-1对应杂质-残留的氨基酸的氨基的振动;1608 cm-1 对应配体中羧基峰的不对称的伸缩振动;1403 cm-1 对应配体中羧基的对称的伸缩振动。
配合物红外光谱图 对配合物红外光谱的吸收峰进行归属:3300 cm-1-3400 cm-1水中羟基的振动;1620 cm-1碳氮双键的伸缩振动,也可以是氮配位到铜离子的证据;3000 cm-1-2900 cm-1说明产品中有未反应氨基酸的残留;1604 cm-1羧基峰的不对称的伸缩振动;1456 cm-1 羧基的对称的伸缩振动;1258 cm-1是酚羟基碳氧键的伸缩振动;940 cm-1-920 cm-1和760 cm-1-740 cm-1的弱吸收是配位水的羟基的摇摆振动;520 cm-1-480 cm-1是铜氮键的伸缩振动;440 cm-1-400 cm-1是铜氧键的振动。 碳氮双键的伸缩振动频率和羧基的不对称伸缩振动红移,羧基的对称伸缩振动蓝移,也说明形成了新的化合物,即发生了配位。 红外光谱的数据说明了二价铜离子与席夫碱配体的氧,氧,氮给体以及分子水发生了配位。
X射线粉末衍射图样: 精品文档
可编辑 根据参考文献[1]中得到的理论产物的XRD数据以及布拉格方程λ=2dsinθ,利用XRD衍射仪的铜靶的波长是1.5418*10^-10m,和文献中提供的d值,计算出理论的衍射角度值,再用XRD数据处理软件searchmatech对试验样品的XRD衍射数据的角度进行分析,对比两组角度值的出峰位置和差异,得到如下表格。较小的误差值和较好的对应情况说明了制备的配合物确实含有目标产物,但是含有其它的杂峰极有可能是由于杂质与铜配合,或者是杂质固体衍射所导致。
dexp 2θ理论值 2θ实验值 误差值 0.6632 13.35024 12.973 2.8% 0.5794 15.29192 15.032 1.7% 0.5267 16.83256 16.866 0.2% 0.5127 17.29568 17.256 0.2% 0.5041 17.59306 17.629 0.2% 0.499 17.77432 17.908 0.8% 0.4696 18.897 18.601 1.6% 0.4628 19.17725 19.206 0.1% 0.4196 21.17333 20.16 4.8% 0.4088 21.73942 21.512 1.0%
0.3921 22.67735 22.545 0.6% 0.3742 23.77759 23.493 1.2% 0.3702 24.03832 23.925 0.5% 0.3622 24.57746 24.465 0.5% 0.3556 25.04095 24.705 1.3% 0.3493 25.50013 25.377 0.5% 0.3445 25.86154 25.809 0.2% 0.3319 26.86136 26.597 1.0% 0.3283 27.16152 27.099 0.2% 精品文档 可编辑 0.3127 28.54457 28.272 1.0% 0.3013 29.64886 29.356 1.0% 0.2988 29.90269 29.861 0.1% 0.2895 30.88685 30.855 0.1% 0.2776 32.24617 32.39 0.4% 0.273 32.80472 32.763 0.1% 0.2704 33.12919 33.313 0.6% 0.2679 33.44739 33.964 1.5% 0.2586 34.68766 34.563 0.4% 0.2527 35.52418 35.615 0.3% 0.2479 36.23565 35.952 0.8% 0.2456 36.58695 36.632 0.1% 0.2364 38.06444 38.153 0.2% 0.2283 39.46993 39.132 0.9% 0.2228 40.48636 40.548 0.2% 0.2151 42.00288 41.955 0.1% 0.2121 42.62576 42.774 0.3% 0.2055 44.06517 43.793 0.6% 0.2026 44.72974 44.455 0.6% 0.1989 45.60822 45.999 0.9% 0.1955 46.44742 46.374 0.2% 0.1877 48.49871 48.317 0.4% 0.1817 50.20903 50.13 0.2% 0.1802 50.65636 50.933 0.5% 0.1763 51.85914 51.758 0.2% 0.1663 55.23411 55.118 0.2% 0.1444 64.53384 65.35 1.3%
六、 结论 根据紫外-可见光谱、红外光谱以及XRD的结果来看,我们的配体的确和金属离子形成了配合物。并且,除少数峰缺少或者位置偏差较大外,各个谱的特征峰和标准特征峰吻合良好。以上事实说明我们的合成是基本成功的。
七、 总结与收获 该实验的合成部分进行得并不是很顺利,一开始参考了两篇中文文献的合成步骤,结果并不能够简单地得到配合物。通过与同学的讨论和无机化学老师的交流,最终查阅到了英文文献中一个比较可靠的合成步骤,通过两步合成法对该配合物进行了合成。这说明以后做实验查阅文献的过程中要全面综合考虑,不能仅仅参考某篇文献进行分析。 由于配体是钾盐,氨基酸本身也是自身成盐-两性离子,因此它们的极性都很大,重结晶过程中并没有很好地除去,而且可能是温度降低得太快,固体析出过程速率很快,使得该配体携带了大量的杂质析出,为后面的进
