自噬分子机制的研究进展
细胞自噬的分子机制及其在疾病中的作用

细胞自噬的分子机制及其在疾病中的作用细胞自噬是一种在细胞内进行垃圾清理和重新利用的基本生物学过程。
它通过溶酶体依赖性的降解机制将细胞内的有害或无用的蛋白质、质膜和细胞器等降解成小分子,然后再利用这些小分子来维持细胞的生理活性和能量供应。
细胞自噬在维持细胞稳态、解毒、维持能量代谢平衡、抗衰老和抵抗疾病等方面起着重要的作用。
首先是自噬起始。
细胞自噬的起始信号是ATG1/ULK复合物的激活,该复合物由ULK1、ATG13、FIP200和ATG101等蛋白组成。
自噬起始信号激活后,ULK1磷酸化ATG13和FIP200,促进ULK1的激活和自噬起始。
接下来是自噬包裹体形成。
自噬包裹体是自噬的核心结构,它起到将待降解的细胞成分包裹起来的作用。
自噬包裹体的形成需要两个重要的复合物,分别是Beclin-1复合物和Atg12-Atg5-Atg16复合物。
Beclin-1复合物是最早发现的参与自噬的复合物,它由Beclin-1、VPS34和VPS15等蛋白组成。
Beclin-1复合物在自噬的早期阶段促进自噬膜的起始生成。
Atg12-Atg5-Atg16复合物在自噬的中期阶段起到重要作用,它参与了自噬包裹体的形成和扩张。
然后是自噬体融合。
自噬体是由自噬包裹体与溶酶体融合形成的,使被包裹的细胞成分能够进入到溶酶体内进行降解。
自噬体融合过程非常复杂,涉及多个蛋白质的参与。
其中,Rab7、LC3和LAMP等蛋白是自噬体融合过程的重要调节因子。
最后是自噬体的降解。
自噬体进入溶酶体后,其内部的成分通过溶酶体内膜的酸性环境和内膜上存在的水解酶进行降解。
溶酶体内细胞酸性环境主要是由V-ATP酶和ClC-7通道调节的。
细胞自噬在多种疾病中起到重要的作用。
首先,细胞自噬与肿瘤相关性颇高。
自噬在肿瘤抑制和肿瘤发展过程中起到双重作用。
一方面,自噬能够协助维持细胞稳态,抑制肿瘤细胞的生长和存活;另一方面,自噬也可能通过提供养分和能量来促进肿瘤细胞的生长和存活。
自噬及其在肿瘤发生发展中作用的研究进展

自噬及其在肿瘤发生发展中作用的研究进展自噬是通过溶酶体途径,降解并循环利用受损的细胞器和大分子蛋白,从而维持细胞稳态的分解代谢过程。
这一过程与包括肿瘤在内的多种疾病有着极其密切的关系。
最新研究表明,在肿瘤不同的发生发展阶段,自噬可能发挥着正反两方面的作用,而在不同的肿瘤中,自噬所发挥的作用也不尽相同。
因此,自噬在肿瘤发生发展中的具体作用机制正在成为研究热点,对促进肿瘤的临床治疗也有一定的指导意义。
本文就自噬及其在肿瘤发生发展中作用的研究进展做一综述。
标签:自噬;肿瘤;调控机制;信号通路自噬是通过溶酶体途径降解并循环利用受损的细胞器和大分子蛋白以维持细胞稳态的分解代谢过程。
这一过程与包括肿瘤在内的多种疾病有着极其密切的关系。
最新研究表明,在肿瘤发生发展的不同阶段以及不同种类的肿瘤中,自噬的作用可能截然相反。
因此,对自噬与肿瘤发生发展中的相互关系和具体机制进行深入研究极为重要,对促进肿瘤的临床治疗也有一定的指导意义。
1 自噬1.1 自噬发生的基本过程细胞自噬(autophagy)是作为细胞器和大分子蛋白降解的主要途径和细胞内重要物质的分解代谢过程,广泛存在于真核细胞中[1]。
自噬是实现细胞内物质的循环再利用,维持细胞稳态方面的重要途径。
其发生时自噬泡(autophagosome)先对受损的细胞器或错误蛋白进行包裹,之后和溶酶体(lysosome)发生融合,在溶酶体酸性水解酶的作用下分解代谢为氨基酸等生物分子而被细胞重新利用[2]。
因此无论是病态细胞还是正常细胞,维持一种基础的、较低水平的自噬活性非常重要。
1.2 自噬的分类自噬根据其底物进入溶酶体的途径可以分为,微自噬(microautophagy)、巨自噬(macroautophagy)和分子伴侣介导的自噬(chaperone medited autophagy,CMA),其中CMA途径降解的底物必须是可溶性的蛋白,而前两者对底物无选择性[3]。
通常所说的“细胞自噬”或者“自噬”一般指巨自噬,本文中所提到的自噬也是巨自噬。
细胞自噬的基础知识与研究进展

细胞自噬的基础知识与研究进展细胞自噬(autophagy)是指细胞自身分解和回收废弃物质的一种过程,具有维持细胞内环境平衡、细胞生长、代谢和身体适应力等方面的重要作用。
它是细胞生物学领域中的一大研究热点,得到了广泛关注。
一、细胞自噬的三种类型细胞自噬分为三种类型:微型自噬(microautophagy)、宏型自噬(macroautophagy)和小体自噬(chaperone-mediated autophagy,CMA)。
其中,微型自噬与宏型自噬是非选择性自噬,而小体自噬则是选择性自噬。
微型自噬是指细胞通过直接将废物分解成小的空泡来完成清除废物的过程。
宏型自噬则是通过将废物包裹进一个由双层膜组成的泡膜内,使其与溶酶体融合、分解的过程。
而小体自噬则是通过由Hsc70蛋白、LAMP-2A和HSP90组成的复合物来识别、捕获并分解特定蛋白质的过程。
二、细胞自噬的生化机制细胞自噬不仅涉及大量的细胞生物学蛋白质,还涉及到一些细胞内化学物质。
自噬的基本过程首先涉及由Atg(autophagy-related gene)基因编码的多种蛋白质在细胞内的调节作用。
这些蛋白质可以调节自噬与外环境的联系,以及与涉及的细胞运输相关的分解系统的作用。
细胞自噬的开始通常是由Atg1和Atg13等蛋白复合体的存在调节的,这些蛋白质作为自噬衍生的起点,启动成为自我糖化的起点。
蛋白复合体说大多是保存在细胞滋生蛋白(ER)突出物内或腺苷酸酰化酶(mTOR)等控制细胞自我代谢的重要酶中。
细胞自噬的早期主要涉及细胞内与mTOR有关的信号转导通路和PtdIns3K(磷脂酰肌醇3-激酶)通路。
其中,mTOR通路通过进一步活化Ras相关蛋白、主导蛋白(PKB或AKT)等蛋白的更多生物活性,使得下游的Atg1和Atg13蛋白被阻止,从而抑制细胞自噬的过程。
而PtdIns3K通路则是自噬开始的关键,它通过生成PtdIns3P(磷脂酰肌醇3-磷酸)在细胞的自噬小泡形成中发挥了作用。
自噬在肝细胞癌治疗中的研究进展

自噬在肝细胞癌治疗中的研究进展1㊀210002㊀东部战区总医院秦淮医疗区全军肝病中心2㊀通讯作者,E⁃mail:leep2002@163.com571100㊀海南海口㊀海南现代妇女儿童医院检验科王华强,李㊀平1,2㊀㊀ʌ摘㊀要ɔ㊀自噬是细胞在自噬相关基因的调控下利用溶酶体降解自身受损的细胞器和大分子物质的过程㊂自噬对肝细胞癌的发生㊁发展具有双重作用,既能通过维持肝脏稳态清除癌细胞,又能促进肿瘤微环境中癌细胞增殖㊂目前研究发现针对肝细胞癌治疗的传统化疗药物㊁分子靶向药物㊁RNA干扰和天然药物等均与自噬关系密切㊂大部分情况下抑制自噬可增强药物抗肝癌的活性,也有药物可直接激活自噬依赖性性癌细胞死亡㊂本文结合近年国内外研究现状,就自噬与肝细胞癌发生发展的关系和自噬调控肝细胞癌治疗的作用作一综述,以期为肝细胞癌的治疗提供新思路㊂㊀㊀ʌ关键词ɔ㊀肝细胞癌;㊀自噬;㊀机制;㊀治疗中图分类号:R735 7㊀㊀文献标识码:A㊀㊀文章编号:1009⁃0460(2021)01⁃0089⁃05Researchprogressofautophagyinthetreatmentofhepatocellularcarcinoma㊀㊀WANGHuaqiang,LIPing.DepartmentofClinicalLaboratory,HainanModernWomenandChildrenHospital,Haikou571100,ChinaCorrespondingauthor:LIPing,E⁃mail:leep2002@163.com㊀㊀ʌAbstractɔ㊀Autophagyisaprocessinwhichcellsuselysosomestodegradetheirdamagedorganellesandmacromoleculesunderthecontrolofautophagy⁃relatedgenes.Autophagyhasadualeffectontheoccurrenceanddevelopmentofhepatocellularcarcinoma.Itcannotonlymaintainthesteadystateoftheliverbyeliminatecancercells,butalsopromotetheproliferationofcancercellsinthetumormicroenvironment.Thecurrentresearchfoundthattraditionalchemotherapydrugs,moleculartargeteddrugs,RNAinterferenceandnaturaldrugsforthetreatmentofhepatocellularcarcinomaarecloselyrelatedtoautophagy.Inmostcases,inhibitionofautophagycanenhancetheactivityofdrugsagainstlivercancer,andsomedrugscandirectlyactivatingautophagy⁃dependentcancercelldeath.Inthisarticle,wewillreviewtherelationshipbetweenautophagyandtheoccurrenceanddevelopmentofhepatocellularcarcinoma,andtheroleofautophagyinregulatingthetreatmentofhepatocellularcarcinomainordertoprovidenewideasforthetreatmentofhepatocellularcarcinoma.㊀㊀ʌKeyWordsɔ㊀Hepatocellularcarcinoma;㊀Autophagy;㊀Mechanism;㊀Therapy㊀㊀在全球范围内,肝癌是导致癌症相关死亡的第四大常见原因,在发病率方面排第6位㊂肝癌以肝细胞肝癌(hepatocellularcarcinoma,HCC)为主,尽管近年HCC的内科治疗和外科手术方面取得了很多突破,但5年生存率仅为18%,仅次于胰腺癌的第二大致死性肿瘤[1]㊂近年来大量研究表明,自噬可以对HCC产生促进或抑制的双向调节,调控自噬可影响HCC的治疗㊂本文总结了自噬与HCC发生发展的关系以及近年自噬调控HCC治疗的相关研究,通过全面了解自噬在HCC中的作用,以期为HCC的治疗提供新思路㊂1㊀自噬对HCC发生发展的双向影响1 1㊀自噬与肿瘤发生相关㊀自噬又称Ⅱ型细胞死亡,是细胞在自噬相关基因的调控下将自身受损的细胞器和大分子物质运输到溶酶体进行消化降解的过程[2]㊂自噬在肿瘤发生发展中所扮演的角色具有促进和抑制双面作用㊂在正常情况下,细胞自噬是一种抵抗癌变的途径,自噬可以控制炎症反应㊁清除损伤坏死的细胞器㊁降低细胞内压力㊁稳定细胞基因组㊁阻止癌细胞恶变,并可以通过介导细胞凋亡和免疫反应清除癌变细胞㊂另一方面,细胞一旦发生癌变,自噬反而会扮演促进肿瘤的角色,自噬可维持肿瘤细胞稳定,为肿瘤细胞提供营养物质及能量,增强肿瘤细胞放化疗抗性等[3]㊂这种双重作用说明了自噬在肿瘤发生发展中的复杂性,深入了解自噬的调控作用,对于探索肿瘤发生机制并开拓新的治疗途径具有重要意义㊂1 2㊀细胞自噬抑制HCC㊀细胞自噬有利于维持肝脏的代谢稳态,一旦自噬缺陷可导致肝脏肿瘤发生㊂自噬相关基因(autophagy⁃relatedgene,ATG)参与自噬的调控,其中ATG5和ATG7在肝脏高表达,Atg5-/-和Atg7-/-基因敲除的小鼠会发生肝脏肿瘤,通过对Atg5flox/flox杂合小鼠的肝脏肿瘤分析发现,肿瘤源自于那些Atg5自噬基因缺失的肝细胞[4]㊂Be⁃clin1基因是酵母ATG6的同系物,是哺乳动物参与自噬的特异性基因,在HCC组织中Beclin1的表达显著低于癌旁组织,且Beclin1的表达与HCC病理分级呈负相关[5]㊂自噬抑制HCC还表现为增强自噬可直接诱导肿瘤细胞自噬性死亡㊂Yu等[6]合成了一种化合物,可通过抑制AKT信号而激活自噬,在体外实验中表现为HepG2㊁Hep3B㊁Huh⁃7和SMMC⁃77214种肝癌细胞的增殖均被显著抑制;而在动物实验中,随着自噬的增强,裸鼠肝脏肿瘤的体积和重量均出现明显下降㊂1 3㊀细胞自噬促进HCC㊀自噬是细胞的一种应激反应和生存机制,其可能更有助于HCC细胞能适应外界的一系列应激压力,从而增强HCC细胞的增殖㊁转移能力和对治疗的抵抗㊂自噬和HCC发生相关,研究发现二乙基亚硝胺可诱导小鼠发生HCC,但在自噬受损小鼠中却无法发生HCC,只能诱导出良性肿瘤[7]㊂自噬还在HCC的发展中扮演重要角色㊂在肝癌病程的进展中,自噬体的重要标志分子LC3⁃Ⅱ的表达水平不断增加,而同时高表达LC3⁃Ⅱ和自噬起始分子ULK1的患者具有较差的5年生存率和无进展生存率[8]㊂对于自噬的促癌作用,有研究认为自噬调节是肝癌发生的一个非常早期的事件,并且仅针对最具侵袭性的肝细胞亚群具有特异性㊂他们使用自噬诱导剂胺碘酮可显著促进肝脏癌前病变细胞的增殖能力,而使用自噬抑制剂氯喹可显著抑制肝脏癌前病变细胞的生长[9]㊂关于自噬促进肿瘤转移的分子机制,有研究认为可能和自噬激活Wnt/β⁃catenin信号通路,从而上调HCC细胞中的致癌基因单羧酸转运蛋白1(MCT1)的表达有关[10]㊂2㊀自噬与HCC治疗2 1㊀常规化疗药物㊀化疗是HCC系统治疗方案之一,通过直接杀伤和诱导凋亡等途径抑制肿瘤细胞的增殖和转移,但HCC经过多次化疗后,治疗效果往往会出现下降,而这一现象和化疗药物上调肿瘤细胞的自噬有关㊂Du等[11]发现奥沙利铂在抑制HCC细胞增殖的同时也上调了HCC细胞的自噬,当联合使用ATG7siRNA干扰或氯喹预处理抑制HCC自噬后,奥沙利铂诱导的HCC细胞凋亡活性可分别上升23%和9%,而单独使用ATG7siRNA干扰或氯喹预处理却不能诱导HCC的凋亡㊂Guo等[12]的研究发现,顺铂和5⁃氟尿嘧啶(5⁃FU)在SMMC⁃7721㊁Hep3B和HepG23种不同HCC细胞系中均可增加自噬小体的形成,使用3⁃甲基腺嘌呤(3⁃MA)或siRNA抑制自噬后可明显增强顺铂和5⁃FU的化疗效果;在动物实验中,联合自噬抑制剂组较单用顺铂组的裸鼠肝脏肿瘤平均重量减少了28 57%,体积减小33 4%㊂Tong等[13]研究发现培美曲塞耐药也与自噬有关,抑制自噬相关MEK/ERK信号通路可增强培美曲塞对HCC细胞的化学毒性㊂有研究发现,在自噬诱导HCC对表柔比星产生化学耐药性的过程中,热休克转录因子1(HSF1)通过上调ATG4B活性促进HCC自噬,加入RNAi干扰HSF1后可抑制HCC细胞自噬,增强表柔比星的化疗效果[14]㊂这些研究均表明自噬可诱导HCC细胞对化疗药物产生抗性,干扰自噬是增强HCC化疗敏感性的潜在方法㊂2 2㊀靶向小分子㊀目前大部分研究认为,靶向药物在治疗过程中可诱导HCC自噬从而导致耐药,抑制自噬活性可增强靶向药物抗HCC的作用㊂索拉非尼是首个经美国食品药品管理局(FDA)批准用于治疗HCC的酪氨酸激酶抑制剂(TKI)㊂关于索拉非尼诱导自噬耐药的机制已有一系列研究,通过调控相应通路抑制自噬活性可增强索拉非尼的靶向效果㊂Liu等[15]认为索拉非尼耐药和细胞内质网应激引起的自噬有关,通过siRNA干扰凋亡抑制蛋白cFLIP后可降低内质网应激,减少HCC细胞自噬,逆转索拉非尼的耐药性㊂Lu等[16]研究发现,肝癌组织中细胞表面分子CD24的高表达和索拉非尼耐药密切相关,他们利用shRNA干扰CD24表达后,可激活mTOR/AKT信号通路而抑制HCC自噬,提高索拉非尼的敏感性㊂Turcios等[17]合成了2,5⁃二氯⁃N⁃(2⁃甲基⁃4⁃硝基苯基)苯磺酰胺(别名FH535),利用FH535及其衍生物(FH535⁃N)均可抑制Wnt/β⁃catenin信号通路,降低HCC细胞自噬,进而增强索拉非尼对HCC细胞的靶向抑制作用㊂除了使用RNA干扰和合成化合物阻滞自噬外,国内学者发现[18]中药单体20(S)⁃人参皂苷(Rg3)也可调控自噬增加靶向药物的作用,他们发现索拉非尼联合Rg3后LC3⁃Ⅱ水平明显上调,而不同浓度(0 5μg/ml㊁1μg/ml和2μg/ml)索拉非尼联合Rg3对Hep3B细胞抑制作用均表现为协同增强作用,他们认为Rg3可增加索拉非尼的敏感性,其机制可能是通过抑制HCC细胞自噬活性来实现的㊂也有一些研究与这些报道相反,他们认为增强自噬可诱导HCC细胞发生自噬依赖性细胞死亡,增强靶向药物的效果㊂AZD4547是一种成纤维细胞生长因子受体(FGFR)抑制剂,在索拉非尼耐药HCC细胞中,AZD4547联合索拉非尼可增加LC3㊁Beclin1蛋白水平,降低p62蛋白水平,通过增强自噬水平促进耐药HCC发生自噬依赖性细胞死亡[19]㊂瑞戈非尼是继索拉非尼后另一个多靶点TKI药物,除了直接诱导HCC细胞凋亡外,还可以通过抑制mTOR/AKT信号,促使HCC细胞发生自噬依赖性细胞死亡[20]㊂增强自噬促进HCC细胞死亡这一现象可能是由于这些研究中的自噬活性更强,将肿瘤细胞保护性自噬转变为诱导细胞死亡的途径㊂2 3㊀非编码RNA㊀非编码RNA(ncRNA)与自噬关系密切,其中微小RNA(miRNA)和长链非编码RNA(lncRNA)在HCC中经常失调,近年引起了较多的关注和研究㊂大部分报道认为miRNA通过抑制自噬具有抗肿瘤活性㊂Fu等[21]研究发现,miR⁃30a靶向自噬相关蛋白Beclin1和ATG5mRNA的3 ⁃UTR抑制其翻译,通过下调自噬抑制HCC细胞的生长和转移;他们还通过对52例HCC患者的研究发现,miR⁃30a在肿瘤组织中显著低表达,并且与微血管转移㊁肿瘤复发呈负相关,miR⁃30a低表达患者具有更差的生存期㊂Ou等[22]发现miR⁃490⁃3p在HCC组织中低表达,其过表达可靶向ATG7下调癌细胞自噬,从而抑制HCC细胞增殖㊁延迟细胞周期并促进细胞凋亡㊂Jin等[23]发现阿霉素诱导的HCC细胞自噬降低了miR⁃26水平,而miR⁃26通过靶向自噬蛋白ULK1下调自噬,可抑制HCC细胞增殖并促进凋亡;动物实验表明,miR⁃26或阿霉素均可降低裸鼠移植肝脏肿瘤的体积和重量,当miR⁃26与阿霉素联合使用时,miR⁃26可进一步增强HCC对阿霉素的治疗敏感性㊂Ren等[24]研究发现跨膜蛋白166(EVA1A)通过上调自噬促进HCC对奥沙利铂耐药,而miR⁃125b可与EVA1AmRNA的3 ⁃UTR结合,通过下调EVA1A的翻译抑制自噬活性,提高了HCC对奥沙利铂的敏感性㊂也有一些研究有不同结论,他们认为miRNA抑制自噬后反而起促癌作用㊂Yang等[25]研究发现,miR⁃181a可以通过靶向ATG5抑制HCC的自噬,导致HCC细胞凋亡减少,当使用miR⁃181a⁃sponge干扰后,HCC肿瘤的体积和重量明显下降㊂Zhuang等[26]研究也发现,甘氨酸脱羧酶(GLDC)是miR⁃30d⁃5p的靶标,miR⁃30d⁃5p可下调GLDC活性,减少细胞自噬反而促进HCC的增殖,干扰miR⁃30d⁃5p可抑制HCC进的展㊂LncRNA激活自噬后在HCC中同样具有双向调节作用,但大部分研究认为lLncRNA会增强自噬促进HCC发展㊂LncRNAHULC是第一个在肝癌中鉴定的lncRNA,在肝癌组织中高表达㊂研究表明lncRNAHULC可通过下调miR15a来增加自噬相关基因p62㊁LC3和Becline⁃1的表达,激活自噬促进肝癌细胞增殖[27]㊂LncRNAHOTAIR是第一个被发现具有反式作用的lncRNA,在多种肿瘤中表达上调且与不良预后相关㊂在肝癌中,lncRNAHOTAIR可通过增加ATG3和ATG7表达来激活自噬,进而促进HCC细胞增殖[28]㊂另有一些lncRNA,如PVT1㊁HAGLROS等均可通过靶向miRNA而促进自噬,参与HCC细胞增殖[29⁃30]㊂也有一些研究认为lncRNA虽然增强自噬活性,但可诱导HCC细胞发生自噬依赖性细胞死亡㊂Chen等[31]研究发现lncRNAPTENP1调控抑癌基因PTEN,过表达的PTENP1可与miRNA17㊁miRNA19b和miRNA20A相互作用,抑制PI3K/Akt致癌信号途径,引发HCC细胞发生自噬依赖性细胞死亡㊂Cui等[32]报道lncRNAH19在不同肿瘤中可通过不同的途径发挥致癌或抑癌的生物学功能,在肝癌中可激活HCC细胞中的PI3K⁃Akt⁃mTOR途径,增加自噬,诱导缺氧/复氧损伤,促使肝癌细胞死亡㊂2 4㊀天然药物㊀已发现多种天然药物可调节自噬,大部分天然药物抗HCC的机制是直接诱导HCC细胞发生自噬依赖性死亡㊂黄当归醇(xanthoangelol,XGA)来自中药当归,可通过诱导自噬发挥抗HCC转移的作用,该自噬是由AMPK/mTOR信号通路的激活介导,因此使用3⁃MA抑制自噬后反而拮抗XAG的抗肿瘤作用[33]㊂槐耳颗粒是证据等级较高的可用于肝癌辅助治疗的药物,槐耳的抗肿瘤机制可能与抑制Akt/mTOR通路诱导自噬有关,自噬抑制剂3⁃MA可减少槐耳处理组的自噬,降低槐耳抗肿瘤活性[34]㊂石蒜碱(Ly⁃corine,LCC)是一种多功能的生物活性化合物,其诱导HCC细胞自噬性死亡和舌癌耐药相关基因(TCRP1)表达下调有关,而TCRP1可以降低Akt的磷酸化水平并抑制Akt/mTOR通路,因此LCC可能是通过抑制TCRP1/Akt/mTOR信号通路促进肝癌细胞自噬性死亡[35]㊂另有研究报道小檗碱㊁大蒜素㊁苦参碱㊁甘草次酸㊁蜜环菌素㊁甘草甜素㊁β⁃桧木醇㊁没食子鞣质这些天然植物来源的药物,均可通过诱导肿瘤细胞自噬性死亡而具有抗HCC作用[36⁃37]㊂也有一些研究认为部分天然药物的抗HCC作用是通过抑制自噬活性而产生的㊂一种新型姜黄素衍生物WZ35在胃癌细胞中表现出潜在的抗肿瘤活性,WZ35同样具有抗HCC活性,其作用机制是通过下调YAP介导的自噬活性来抑制肝癌细胞的生长[38]㊂另一方面,在抑制自噬后,部分天然药物的抗HCC作用进一步增强㊂来自蟾蜍毒液的蟾蜍灵可抑制HCC的增殖并促进凋亡,使用自噬抑制剂3⁃MA或氯喹后,可进一步增强蟾蜍灵的抗HCC作用[39]㊂棉酚是一种黄色多酚羟基双萘醛类化合物,主要通过激活细胞凋亡表现出抗HCC的活性㊂由于棉酚诱导的自噬可以保护HCC细胞免受内质网应激相关凋亡的影响,因此棉酚和自噬抑制剂的联用可显著增强抗HCC作用[40]㊂近年报道芹菜素㊁甘草查尔酮A和18β⁃甘草次酸等天然药物都具有抗HCC作用,但同时因诱导自噬而产生耐药,联合使用自噬抑制剂后,可明显提高抗HCC治疗效果[41⁃43]㊂2 5㊀其他治疗㊀其他抗HCC的治疗研究也主要集中于两个方面:抑制自噬增强抗肿瘤活性,或者直接增强自噬诱导HCC细胞死亡㊂Liu等[44]报道,全长肿瘤抑素的活性片段T7肽在抗肿瘤过程中可通过抑制Akt/mTOR信号通路诱导自噬激活,联合自噬抑制剂3⁃MA可显著增强T7肽的抗HCC作用㊂Xu等[45]研究发现,HCC经射频消融治疗后容易出现复发,这与残留癌细胞通过HIF⁃1α/BNIP3途径激活自噬有关,他们针对BNIP3设计靶向抑制剂来下调自噬后,可有效阻止残留HCC细胞的生长和转移㊂也有一些研究发现增强自噬可发生自噬相关细胞死亡,Li等[46]报道IL⁃37除了抗炎细胞因子外,还具有抗HCC作用,其通过抑制PI3K/Akt/mTOR信号通路上调细胞自噬活性,诱导HCC发生自噬依赖性细胞死亡㊂Huang等[47]报道阿司匹林也具有抗肿瘤作用,可通过激活JNK㊁AMPK和GSK⁃3等信号通路上调ULK1㊁Beclin⁃1等自噬相关蛋白活性,诱导HCC细胞发生自噬相关死亡㊂3㊀小结与展望传统观念认为自噬给肿瘤细胞提供营养物质及能量,自噬是促癌因素,抑制自噬可增强药物抗肿瘤的活性㊂然而越来越多研究表明,自噬也可诱导肿瘤细胞发生自噬依赖性细胞死亡㊂自噬在HCC中具有双重作用,既能通过维持细胞稳态清除癌细胞,又能促进肿瘤微环境中癌细胞的存活㊂随着对自噬的认识不断深入,针对HCC治疗的传统化疗药物㊁分子靶向药物㊁RNA干扰和天然药物等均发现与自噬关系密切㊂了解HCC不同阶段自噬作用的具体分子机制仍然是一个挑战,这种深入研究将更有助于抗HCC的治疗㊂参考文献[1]㊀VillanuevaA.HepatocellularCarcinoma[J].NEnglJMed,2019,380(15):1450-1462.[2]㊀LevineB,KroemerG.Biologicalfunctionsofautophagygenes:Adiseaseperspective[J].Cell,2019,176(1⁃2):11-42.[3]㊀陈品珍,杨丁丁,陈兴宇,等.自噬基因Beclin1对乳腺癌作用的研究进展[J].临床肿瘤学杂志,2019,24(1):87-91.[4]㊀YangH,NiHM,DingWX.Emergingplayersinautophagydefi⁃ciency⁃inducedliverinjuryandtumorigenesis[J].GeneExpr,2019,19(3):229-234.[5]㊀SunH,YuJ,WenZ,etal.DecreasedexpressionofBeclin⁃1inpatientswithhepatocellularcarcinoma[J].JBUON,2019,24(2):634-641.[6]㊀YuM,ZengM,PanZ,etal.Discoveryofnovelakt1inhibitorinducesautophagyassociateddeathinhepatocellularcarcinomacells[J].EurJMedChem,2020,189:112076.[7]㊀TianY,KuoCF,SirD,etal.Autophagyinhibitsoxidativestressandtumorsuppressorstoexertitsdualeffectonhepatocarcino⁃genesis[J].CellDeathDiffer,2015,22(6):1025-1034.[8]㊀WuDH,WangTT,RuanDY,etal.CombinationofULK1andLC3Bimproveprognosisassessmentofhepatocellularcarcinoma[J].BiomedPharmacother,2018,97:195-202.[9]㊀KowalikMA,PerraA,Ledda⁃ColumbanoGM,etal.Inductionofautophagypromotesthegrowthofearlypreneoplasticratlivernodules[J].Oncotarget,2016,7(5):5788-5799.[10]㊀FanQ,YangL,ZhangX,etal.AutophagypromotesmetastasisandglycolysisbyupregulatingMCT1expressionandWnt/β⁃cate⁃ninsignalingpathwayactivationinhepatocellularcarcinomacells[J].JExpClinCancerRes,2018,37(1):9.[11]㊀DuH,YangW,ChenL,etal.Roleofautophagyinresistancetooxaliplatininhepatocellularcarcinomacells[J].OncolRep,2012,27(1):143-150.[12]㊀GuoXL,LiD,HuF,etal.Targetingautophagypotentiateschemotherapy⁃inducedapoptosisandproliferationinhibitioninhepatocarcinomacells[J].CancerLett,2012,320(2):171-179.[13]㊀TongY,HuangH,PanH.InhibitionofMEK/ERKactivationattenuatesautophagyandpotentiatespemetrexed⁃inducedactivityagainstHepG2hepatocellularcarcinomacells[J].BiochemBio⁃physResCommun,2015,456(1):86-91.[14]㊀ZhangN,WuY,LyuX,etal.HSF1upregulatesATG4Bex⁃pressionandenhancesepirubicin⁃inducedprotectiveautophagyinhepatocellularcarcinomacells[J].CancerLett,2017,409:81-90.[15]㊀LiuD,FanY,LiJ,etal.InhibitionofcFLIPovercomesac⁃quiredresistancetosorafenibviareducingERstress⁃relatedauto⁃phagyinhepatocellularcarcinoma[J].OncolRep,2018,40(4):2206-2214.[16]㊀LuS,YaoY,XuG,etal.CD24regulatessorafenibresistanceviaactivatingautophagyinhepatocellularcarcinoma[J].CellDeathDis,2018,9(6):646.[17]㊀TurciosL,ChaconE,GarciaC,etal.AutophagicfluxmodulationbyWnt/β⁃cateninpathwayinhibitioninhepatocellularcarcinoma[J/OL].PLoSOne,2019[2020⁃07⁃20].https://pubmed.ncbi.nlm.nih.gov/30794613/.[18]㊀郑㊀侠,华海清,杨爱珍,等.20(S)⁃人参皂苷Rg3对肝癌细胞自噬介导的索拉非尼敏感性的影响[J].临床肿瘤学杂志,2016,21(4):297-303.[19]㊀冯㊀云,亢君君,方宗平,等.AZD4547促进自噬并促进索拉非尼耐药肝癌细胞的死亡[J].细胞与分子免疫学杂志,2019,35(4):339-343.[20]㊀HanR,LiS.Regorafenibdelaystheproliferationofhepatocellularcarcinomabyinducingautophagy[J].Pharmazie,2018,73(4):218-222.[21]㊀FuXT,ShiYH,ZhouJ,etal.MicroRNA⁃30asuppressesauto⁃phagy⁃mediatedanoikisresistanceandmetastasisinhepatocellularcarcinoma[J].CancerLett,2018,412:108-117.[22]㊀OuY,HeJ,LiuY.MiR⁃490⁃3pinhibitsautophagyviatargetingATG7inhepatocellularcarcinoma[J].IUBMBLife,2018,70(6):468-478.[23]㊀JinF,WangY,LiM,etal.MiR⁃26enhanceschemosensitivityandpromotesapoptosisofhepatocellularcarcinomacellsthroughinhibitingautophagy[J/OL].CellDeathDis,2017[2020-07-16] https://pubmed.ncbi.nlm.nih.gov/30794613/.[24]㊀RenWW,LiDD,ChenX,etal.MicroRNA⁃125breversesox⁃aliplatinresistanceinhepatocellularcarcinomabynegativelyreg⁃ulatingEVA1Amediatedautophagy[J].CellDeathDis,2018,9(5):547.[25]㊀YangJ,HeY,ZhaiN,etal.MicroRNA⁃181ainhibitsautophagybytargetingAtg5inhepatocellularcarcinoma[J].FrontBiosci(LandmarkEd),2018,23:388-396.[26]㊀ZhuangH,WuF,WeiW,etal.GlycinedecarboxylaseinducesautophagyandisdownregulatedbymiRNA⁃30d⁃5pinhepatocel⁃lularcarcinoma[J].CellDeathDis,2019,10(3):192.[27]㊀崔大炜,邢育柏,金宏远,等.肝癌高表达长链非编码RNA在肝癌中的表达及其对自噬水平的影响[J].中国医科大学学报,2019,48(11):970-974.[28]㊀YangL,ZhangX,LiH,etal.ThelongnoncodingRNAHO⁃TAIRactivatesautophagybyupregulatingATG3andATG7inhepatocellularcarcinoma[J].MolBiosyst,2016,12(8):2605-2612.[29]㊀YangL,PengX,JinH,etal.Longnon⁃codingRNAPVT1pro⁃motesautophagyasceRNAtotargetATG3byspongingmicroRNA⁃365inhepatocellularcarcinoma[J].Gene,2019,697:94-102.[30]㊀WeiH,HuJ,PuJ,etal.LongnoncodingRNAHAGLROSpro⁃motescellproliferation,inhibitsapoptosisandenhancesautophagyviaregulatingmiR⁃5095/ATG12axisinhepatocellularcarcinomacells[J].IntImmunopharmacol,2019,73:72-80.[31]㊀ChenCL,TsengYW,WuJC,etal.Suppressionofhepatocellularcarcinomabybaculovirus⁃mediatedexpressionoflongnon⁃codingRNAPTENP1andMicroRNAregulation[J].Biomaterials,2015,44:71-81.[32]㊀CuiC,LiZ,WuD.Thelongnon⁃codingRNAH19induceshy⁃poxia/reoxygenationinjurybyup⁃regulatingautophagyinthehep⁃atomacarcinomacells[J].BiolRes,2019,52(1):32.[33]㊀YangX,XieJ,LiuX,etal.Autophagyinductionbyxanthoan⁃gelolexhibitsanti⁃metastaticactivitiesinhepatocellularcarcinoma[J].CellBiochemFunct,2019,37(3):128-138.[34]㊀黎文信,王喜城,向美焕,等.槐耳通过诱导自噬抑制肝癌细胞增殖与迁移[J].中华肝脏外科手术学电子杂志,2019,8(2):169-174.[35]㊀YuH,QiuY,PangX,etal.LycorinePromotesAutophagyandApoptosisviaTCRP1/Akt/mTORAxisInactivationinHumanHepatocellularCarcinoma[J].MolCancerTher,2017,16(12):2711-2723.[36]㊀李㊀霄,张㊀玄,张卓超,等.甘草甜素体外诱导肝癌细胞MHCC97⁃H自噬性死亡的实验[J].中华肝胆外科杂志,2018,24(2):116-121.[37]㊀KwonHY,KimJH,KimB,etal.RegulationofSIRT1/AMPKaxisiscriticallyinvolvedingallotannin⁃inducedsenescenceandimpairedautophagyleadingtocelldeathinhepatocellularcarci⁃nomacells[J].ArchToxicol,2018,92(1):241-257.[38]㊀WangL,ZhuZ,HanL,etal.Acurcuminderivative,WZ35,suppresseshepatocellularcancercellgrowthviadownregulatingYAP⁃mediatedautophagy[J].FoodFunct,2019,10(6):3748-3757.[39]㊀ShengX,ZhuP,QinJ,etal.Thebiologicalroleofautophagyinregulatingandcontrollingtheproliferationoflivercancercellsin⁃ducedbybufalin[J].OncolRep,2018,39(6):2931-2941.[40]㊀ZhangG,WangZ,ChenW,etal.Dualeffectsofgossypolonhumanhepatocellularcarcinomaviaendoplasmicreticulumstressandautophagy[J].IntJBiochemCellBiol,2019,113:48-57.[41]㊀YangJ,PiC,WangG.InhibitionofPI3K/Akt/mTORpathwaybyapigenininducesapoptosisandautophagyinhepatocellularcarcinomacells[J].BiomedPharmacother,2018,103:699-707.[42]㊀NiuQ,ZhaoW,WangJ,etal.LicAinducesautophagythroughULK1/Atg13andROSpathwayinhumanhepatocellularcarcinomacells[J].IntJMolMed,2018,41(5):2601-2608.[43]㊀ChenJ,ZhangZQ,SongJ,etal.18β⁃Glycyrrhetinic⁃acid⁃medi⁃atedunfoldedproteinresponseinducesautophagyandapoptosisinhepatocellularcarcinoma[J].SciRep,2018,8(1):9365.[44]㊀LiuF,WangF,DongX,etal.T7peptidecytotoxicityinhumanhepatocellularcarcinomacellsismediatedbysuppressionofauto⁃phagy[J].IntJMolMed,2019,44(2):523-534.[45]㊀XuWL,WangSH,SunWB,etal.Insufficientradiofrequencyablation⁃inducedautophagycontributestotherapidprogressionofresidualhepatocellularcarcinomathroughtheHIF⁃1α/BNIP3signalingpathway[J].BMBRep,2019,52(4):277-282.[46]㊀LiTT,ZhuD,MouT,etal.IL⁃37inducesautophagyinhepato⁃cellularcarcinomacellsbyinhibitingthePI3K/AKT/mTORpathway[J].MolImmunol,2017,87:132-140.[47]㊀HuangZ,FangW,LiuW,etal.AspirininducesBeclin⁃1⁃de⁃pendentautophagyofhumanhepatocellularcarcinomacell[J].EurJPharmacol,2018,823:58-64.收稿日期:2020-04-01;㊀修回日期:2020-08-24。
细胞自噬过程的分子机制研究

细胞自噬过程的分子机制研究细胞自噬(autophagy)是细胞的一种重要生理过程,通过这个过程可以将细胞内不需要的或老化的物质在溶酶体内降解成小分子化合物,为细胞提供新的营养物质和能量。
自噬过程通常被分为3个步骤:引起自噬体形成的信号,自噬体与裂解体的融合和相关废物的分解和再利用。
其中,细胞自噬过程的分子机制一直是科学研究的热点之一。
近年来,随着研究工具和技术的进步,越来越多的分子机制被揭示出来,这些发现对理解细胞自噬过程的调控及与相关疾病的关系具有非常重要的意义。
下面将针对一些重要的分子机制探讨细胞自噬的调控机制。
一、mTORC1的调控细胞自噬过程随着细胞营养状况的不同而发生明显的变化。
研究发现,mTORC1是一个非常重要的自噬抑制分子,它的活性和自噬的发生是负相关的。
营养丰富的环境中,细胞会通过激活mTORC1抑制自噬的发生,当环境缺乏营养物质时,mTORC1被抑制,自噬过程开始发生。
mTORC1的激活需要一系列因素的参与,如营养物质、生长因子、环境压力等。
Akt和ERK等信号通路均可通过对mTORC1的调控来控制细胞自噬的发生。
此外,AMPK和SPK2也是mTORC1的负调控因子。
二、Atg基因家族的调控除mTORC1外,Atg基因家族也是细胞自噬过程中一个重要的调控因子。
该基因家族共包含31个基因,其中Atg1-Atg10和 Atg12-Atg16L1是自噬体形成过程不可或缺的基因。
Atg基因家族的表达水平也可以影响细胞自噬的发生。
当Atg基因过度表达时,自噬体的形成会增多,而当Atg基因缺失或靶向基因缺失时,自噬体的形成会发生障碍。
三、自噬体的内部分解和再利用Autophagosome和lysosome的融合是自噬体内部分解和再利用的一个重要步骤,这个过程中还涉及到很多基因的调控。
获得国际专利的药物例如,Rab7和Arf6蛋白质参与了自噬体和溶酶体的运输和融合;SNARE蛋白是自噬体与溶酶体融合的关键蛋白;Vps34/Beclin-1和PI3K等酶促反应也对自噬体形成和分解具有重要的调控作用。
m6A修饰调控酶及其结合蛋白在细胞自噬中作用的研究进展
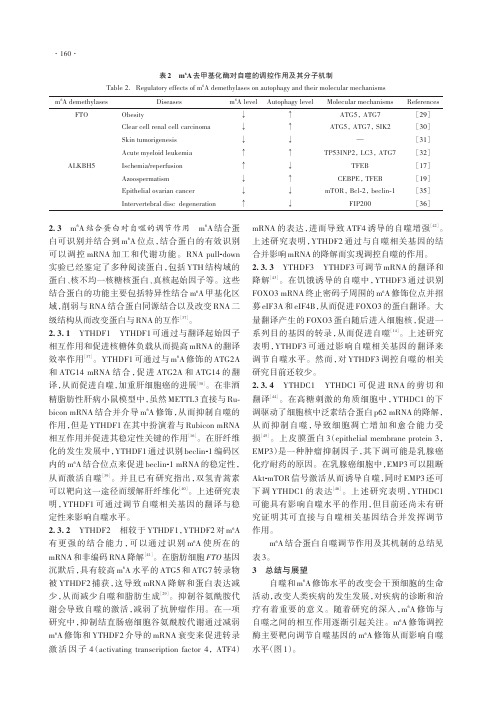
2.3 m 6A 结合蛋白对自噬的调节作用 m 6A 结合蛋白可识别并结合到m 6A 位点,结合蛋白的有效识别可以调控mRNA 加工和代谢功能。
RNA pull -down实验已经鉴定了多种阅读蛋白,包括YTH 结构域的蛋白、核不均一核糖核蛋白、真核起始因子等。
这些结合蛋白的功能主要包括特异性结合m 6A 甲基化区域,削弱与RNA 结合蛋白同源结合以及改变RNA 二级结构从而改变蛋白与RNA 的互作[37]。
2.3.1 YTHDF1 YTHDF1可通过与翻译起始因子相互作用和促进核糖体负载从而提高mRNA 的翻译效率作用[37]。
YTHDF1可通过与m 6A 修饰的ATG2A和ATG14 mRNA 结合,促进ATG2A 和ATG14的翻译,从而促进自噬,加重肝细胞癌的进展[38]。
在非酒精脂肪性肝病小鼠模型中,虽然METTL3直接与Ru‐bicon mRNA 结合并介导m 6A 修饰,从而抑制自噬的作用,但是YTHDF1在其中扮演着与Rubicon mRNA 相互作用并促进其稳定性关键的作用[16]。
在肝纤维化的发生发展中,YTHDF1通过识别beclin -1编码区内的m 6A 结合位点来促进beclin -1 mRNA 的稳定性,从而激活自噬[39]。
并且已有研究指出,双氢青蒿素可以靶向这一途径而缓解肝纤维化[40]。
上述研究表明,YTHDF1可通过调节自噬相关基因的翻译与稳定性来影响自噬水平。
2.3.2 YTHDF2 相较于YTHDF1,YTHDF2对m 6A 有更强的结合能力,可以通过识别m 6A 使所在的mRNA 和非编码RNA 降解[41]。
在脂肪细胞FTO 基因沉默后,具有较高m 6A 水平的ATG5和ATG7转录物被YTHDF2捕获,这导致mRNA 降解和蛋白表达减少,从而减少自噬和脂肪生成[29]。
抑制谷氨酰胺代谢会导致自噬的激活,减弱了抗肿瘤作用。
在一项研究中,抑制结直肠癌细胞谷氨酰胺代谢通过减弱m 6A 修饰和YTHDF2介导的mRNA 衰变来促进转录激活因子4(activating transcription factor 4, ATF4)mRNA 的表达,进而导致ATF4诱导的自噬增强[42]。
细胞自噬及其分子机制研究

细胞自噬及其分子机制研究细胞自噬是一种细胞自身分解和回收过程,通过吞噬损坏或老化的细胞器、蛋白质和细胞膜来维持细胞的代谢平衡。
自噬途径在人类生命周期的不同阶段、不同器官和组织中发挥重要作用,它对许多疾病的发生和发展都有重要影响。
这一过程的研究受到广泛关注,迄今已经揭示了许多分子机制。
自噬的过程包括自噬囊泡形成、融合和降解等几个步骤,每个步骤都涉及不同的分子机制。
自噬囊泡的形成是自噬过程中最开始的一步。
在这个阶段,细胞膜上的特定蛋白质会形成一个隔离膜,包裹代表着需要回收的细胞成分,形成自噬囊泡。
龙头复合体(Atg1-Atg13-FIP200)和Beclin 1-Vps34复合体可在这个过程中起着关键作用。
这些复合体都是关键的人类自噬蛋白质成分,它们能够调节自噬囊泡的形成和生长。
自噬囊泡的形成以后,细胞膜上的各种蛋白质和膜蛋白就能够识别并吞噬细胞中的老化器官或其他蛋白质。
这个过程中的重要成分包括 LC3、Atg5、Atg7和Atg3 等。
它们相互作用后,促进自噬囊泡的生长,并吞噬靶蛋白。
最后,囊泡会与各种液泡结合并形成自噬体。
在形成自噬体的过程中,囊泡中的内容被降解,回收的成分可以进入细胞代谢,为生长和分裂提供所需的物质。
自噬体的降解过程是通过溶酶体实现的,其中主要参与的蛋白质包括lamp1和cathepsin等。
这些蛋白质能够识别自噬体中的内容,并开始其降解过程。
除了常规的形式,还有许多子型的自噬过程,如微噬、非囊泡体自噬、自噬清除等。
前者是一种非约束性自噬过程,后两者都是自噬过程的特殊类型。
非囊泡体自噬还涉及Atg类蛋白质和LC3,但不需要通过囊泡来进行。
自噬清除是一种快速的自噬方式,可以在短时间内拆卸和降解有毒或病原体。
细胞自噬在有机体体内的严格控制中发挥着重要的作用。
自噬的过程是由一组高度保守的蛋白质和酶控制的,这些蛋白质和酶可以被刺激性因素激活。
这些刺激性因素包括饥饿、氧气限制等生理和化学刺激。
细胞自噬调控机制研究

细胞自噬调控机制研究随着生命科学的发展,对于细胞自噬调控机制的研究也越来越深入。
细胞自噬是一种细胞内的降解和再利用方式,主要功能是把细胞内的垃圾、老化的蛋白质等分解成小的蛋白质,供能和新陈代谢需要。
这种结构奇特的细胞降解途径,受到越来越多的关注,它的研究可能会有助于开发新型的治疗方法,例如消除肿瘤细胞,预防脑部退化性疾病,治疗2型糖尿病等。
本文将对于细胞自噬调控机制的研究进展进行一些探讨。
一、细胞自噬的类型细胞自噬有三种类型:巨噬细胞容器介导的自噬( CMA )、微噬细胞介导的自噬 ( microautophagy ) 和膜介导的自噬 (MAC) 。
其中,CMA 是一种特殊的自噬通路。
当需要降解的蛋白质的膜内序列被一个介导分子 HSC70 定位到赤霉素酰化酶的表面时,HSC70 就会招募 LAMP2A。
LAMP2A 会形成开放的孔道使需要降解的蛋白质进入溶酶体。
与 CMA 不同,m icroautophagy 是一种非膜介导的细胞激活自噬,其中大量垃圾为通过内胞质过程在线粒体内聚。
二、细胞自噬的调控机制细胞自噬的调控机制非常复杂,其中核酸药物、蛋白质修饰、小的非编码 RNA、磷酸酸化、CLEC16A、Numb 以及肿瘤抑制因子等因素均可以调节自噬。
下面我们介绍一些关键的细胞自噬调控机制。
1. 基因调控自噬活性的调控有许多大量的基因调控,其中最为重要的是歧化相关基因 8 ( ATG8)。
它可以被脯氨酸酶和 E1 自噬酵素活化,成为后续的自噬反应物,并调节了细胞自噬过程。
2. 感受器调控目前已知的自噬负性调控感受器有 mTORC1、PI3K、Akt、AMPK 和 MAPK 这些自噬蛋白质与ATG 1 功能上最为相似,因为它们部分调节自噬的信号通路,如 AMPK 和 mTORC1 对于自噬的调节作用已经被证实。
3. 信号转导及其过程的调节在细胞自噬过程中,信号传导是一个重要的环节。
PINK1 、PARKIN 、 VPS34 等被证实参与自噬的调节过程中。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
现代生物医学进展
坑“
。
枷
山坛’】
自噬分子机制的研究进展张志才邵增务
华中科技大学同济医学院协和医院骨科武汉
摘要自噬是广泛存在于真核细胞中的生命现象是生物在其发育老化过程中都存在的一个净化自身多
余或受损细胞器的共同
机制生命体借此维持蛋白代谢平衡及细胞环境稳定这一过程在细胞清除废物结构重建生长发育中起重要作用本文主要时自噬体的发生过程分子机制和信号调控等方面进行概述以期较为全面地解细胞自噬作用和最新研究动态的相关资料
关键词自
噬分子机制信号调控
中图分类号文献标识码文章编号】
刀石齐翩,任
及附
叩咖衡比口纽飞挤几伦己沁日勺罗月乙刁劝四乙”、饥今殆
“几
缪
晰功刀,了口优扮’
丑叼
盯
即即宜而
加由五叮
概述近年来一种新的程序性细胞死亡方式一自噬吸引了越来越多科学家的注意人们将自噬称为
型
程序性细胞死亡在生命的进化过程中自噬是一个古老的生物学现象广泛存在于植物和其它较简单生命体中是生物降解胞内蛋白完成细胞器转化保持内环
境稳定的重要方式
自噬是细胞通过单层或双层膜包裹待降解物形成自噬体然后运送到溶酶体形成自噬溶酶体并进行多种酶的消化及降
解以实现细胞本身的代谢需要和某些细胞器的更新而细胞对这种合成与降解的精细调节对维持细胞的自身稳态有重要意义自噬是溶酶体降解途径的主要步骤通过对自噬体的检测可了解自噬体形态和发生过程分子机制与细胞凋亡的关系及其在某些疾病发生中的作用自噬的启动出于维持细胞内环境稳定的目的正常情况下细胞自噬的
基础水平保持在一个较低的状态在某些危机状况下可以快
速上调如生长激素缺乏饥饿细胞重建细胞内出现过多的受损细胞器或代谢废物等’而自噬的消长受多种因素影响营养缺乏胰高血糖素可以诱导自噬胰岛素抑制自噬还有研究发现亮氨酸苯丙氨酸酪氨酸是细胞内自噬性蛋白降解的重
要调节因子阎细胞肿胀也有同胰岛素一样的抑制自噬作用在
肝组织细胞容积的增大促进糖原脂肪蛋白质的合成抑制自噬性蛋白降解困由于酵母是较简单的真核细胞易于进行基因操作被作
为理想的研究模式目前至少已经鉴定出种参与酵母自噬
作者简介张志才男医学硕士在读研究方向骨肿瘤联系电话电子邮件
吻
曲
£
收稿日期接收日期
的特异性基因另外还有多种相关基因其命名从最初称为
和现已被统一命名为酵母自噬相关基因
叩哺乳动物自噬基因的命名与酵母相似但也有个别差异如酵母的在哺乳动物称为酵母的在哺乳动物则称为随着研究的深入许多
酵母中自噬相关基因的同源物均已在哺乳动物中找到并分离鉴定成功这说明自噬是一个进化保守的过程其分子机制从酵母到哺乳动物十分相似这一方面揭示了自噬与凋亡之间可能存在的内在联系另一方面证明了自噬基因在进化上具有高度的保守性叹
自噬体的发生过程
根据酵母自噬体的发生过程可分为①自噬的诱导雷帕
霉素作用的靶位点飞是氨基酸和激素的感受器它在调节细胞生长和自噬的发生过程有重要作用与卜作用的蛋白可以促进缺乏自噬作用的酵母细胞中的自噬作用此外结合的蛋白亚基是自噬的活化因子高浓度也会诱导自噬的发生②自
噬体的形成在酵母中发现自噬体的形成依赖于两个泛素样结
合系统和系统阁这种蛋白系统的高度保
守性已被实验证明在人类发现的自噬基因有③自噬体的运输融合家族涉及细胞骨
架与自噬体的运输有关自噬体的融合机制与蛋白等密切相关通过附着于微管还与导管素相互作用以完成自
噬体向溶酶体的运输④自噬体的裂解在此起重要作用的有巧和巧通过多囊泡小体途径向小囊泡转
运
这种蛋白最终起着脂肪酶相似的作用与相比
是一种囊泡内膜蛋白其只对自噬体降解起作
用
。’
发生过程的分子机制参与自噬体形成的两个泛素样蛋白系统及其作
用
参与自噬体形成的两个泛素样蛋白系统在哺乳动物自噬的自噬泡形成过程中由和
参与组成的两条泛素样蛋白加工修饰过程结合过程和修饰过程起着至关重要的作用结合过程与前自噬泡的形成相关而修饰过程对自噬泡的形成必
不可少
首先由样酶活化之后转运至样酶最后与结合形成自噬体前体前体形成后首先加工成胞浆可溶性形式并暴露出其梭基末端的甘
氨酸残基同样也被活化转运至第二种样酶
并被修饰成膜结合形式定位于前自噬体和自噬体使之成为自噬体的标志分子一旦自噬体与溶酶体
融合自噬体内的即被溶酶体中的水解酶降解哺乳动物细胞内源性和主要以结合形式存在而胞浆可溶性和膜结合型的比例在不同组织和细胞类型变化很大哺乳动物细胞自噬过程中两条泛素样加工修饰过程可以互相调节互相影响
崛基因缺陷的鼠胚胎干细胞缺乏复合物
其到的修饰同时受到影响问在哺乳动物细胞中除作用于其底物分子量为的高尔基体相关酶增强子和,记丫氨基丁酸受体相关蛋白外还与和复合物相互作用虽然细胞中单独超表达游离的促进了到的修饰过多一复合物的存在却可抑制上述修饰过程在存在的情况下细胞超表达哺乳动物可促进复合物的形成这些研究结果提示与和复合物的相互作用在结合和修饰两条泛素化修饰过程中起重要作用哺乳动物除结合外还与相互作用与形成样底物中间物但不与结合在存在下超表达还可促进到的修饰句这些结果说明结合和修饰两条泛素样修饰过程相互偶联和两种样酶在调控自噬上述两条泛素样修饰过程中发挥重要作用泛素化修饰在自噬泡形成过程中的作用哺乳动物细胞自噬泡的形成过程与结合和修饰两条泛素样修饰过程息息相关在自噬泡形成的早期阶段由吵形成的复合物即与其外膜结合这种结合一方面促进了自噬泡的伸展扩张使之由开始的小囊泡样杯样结构逐渐发展为半环状环状结构另一方面复合物与自噬泡膜的结合还促进了向自噬泡的募集复合物在膜上的定位决定膜的弯曲方向膜向着背对复合物的方向延伸当双层膜结构的自噬泡即将形成环状闭合结构或刚刚闭合时复合物便从膜上脱离下来只留下膜结合形式的定位于自噬泡膜上因此含量的多少与自噬泡数量的多少成正比可通过检测细胞内的含量变化可以方便地判断细胞状态判断其自噬是被诱导还是被抑制正常哺乳动物细胞中绝大多数和以复合物形式存在说明复合物的存在并不会导致自噬泡的形成和活化哺乳动物绝大多数复合物存在于胞浆中在自噬自噬泡膜的延伸过程中一部分一一复合物定位于膜表面自噬体的双层膜结构形成后此复合物便从膜上解离下来因此复合物的存在是自噬过程中膜的延伸所必需的同样哺乳动物中比也要首先经历泛素样翻译后修饰过程然后定位于自噬自噬泡膜表面哺乳动物合成之后在同源物的催化下其末端个氨基酸残基被切割下来暴露出端的甘氨酸残基这种经过加工的称为定位于胞浆中之后在哺乳动物泛素样酶和泛素样酶的催化下与自噬泡膜表面的磷脂酞乙醇胺结合称为的形成依赖于一复合物型磷脂酞肌醇磷酸激酶自噬体的形成也依赖于型磷脂酞肌醇三磷酸激酶的作用可磷酸化磷脂酞肌醇生成磷酸磷脂酞肌醇募集胞浆中含一一或一一基序的蛋白质用于自噬体膜的形成还可与形成复合物参与自噬体的形成而抑制剂甲基腺嚓吟可干扰或阻断自噬体形成其它基因在
中参与了自噬体膜的形成另外中间丝微管等细胞骨架成分也参与了自噬体形成晚期步骤的完成
‘
自噬过程的信号调控参与自噬过程的信号转导分子非常复杂目前尚未完全被我们所了解《电月信号途径激酶是氨基酸仰和激素的感受器对细胞生长具
有重要调节作用抑制自噬的发生是自噬的负调控分子并发挥门卫作用例酵母中蛋白激酶与其它分子结合共定位于自噬前体膜上饥饿刺激下去磷酸化并与结合导致依赖性自噬的发生一哺乳动物细胞中的核糖体蛋白质抑制自噬的发生它位于信号途径下游其活性受功调节雷帕霉素〔通过抑制的活性有助于去磷酸化和活化发挥抑制活性诱导自噬发生的
作
用激酶抑制自噬的信号通路目前尚未完全明了在酵
母细胞激酶可能通过抑制激酶的活性来抑制自
噬的发生几甲途径
是自噬的负调节分子它可磷酸化和生成和山然
后结合和它的活化分子抑制自噬的发
生结
节性硬化复合物和蛋白位于于途径的下游可通过抑制小毋白抑制激酶的活性对自噬发挥正向调节作用洲磷酸酶也是自噬的正向调节分子它使去磷酸化从而解除了途径对自噬的抑制抑制的功能从
而抑制自
噬
蛋白和氨基酸
