注射用甲磺酸左氧氟沙星的无菌检查方法验证
HPLC法测定注射用甲磺酸左氧氟沙星有关物质

注射 用 甲磺 酸左 氧 氟沙 星为 甲磺酸 左 氧氟 沙星 的无菌冻 干 品 , 用 于敏感 菌引起 的呼 吸系统 感染 、 适 生 殖系统 感染 、 肤组 织 感 染 、 道 感染 、 血 症 等 皮 肠 败 中重度感 染 的治 疗 。为 了便 于用 药 , 加 药 品规 格 增 的多样性 , 笔者 研制 了冻 干制 剂 , 方法 的建 立 过程 在
中研究 了用 HP C法 测定 有关 物质 。 L
5肚 , P 一4 0紫外 分光 光度 计 。 m) UV— C 2 5 甲醇为 色谱 纯 ( i e 公 司 提 供 ) 乙腈 为 色 谱 Fs r h ,
纯 ( ih r 司提供 ) 水 为重 蒸馏 水 , Fs e 公 , 其他 试 剂均 为 分 析纯 。
庄 0 0 1) 5 0 8
0 0 1 ;. 北科技 大 学实业 开发 总公 司 , 5 0 12 河 河北石 家
摘 要 : 建立 了注射 用 甲磺 酸 左氧 氟 沙星有 关物质 的 HP C测定 方 法 , L 色谱 柱 为 C8 ( . - 4 6mmX 柱
2 0mm, m) 以 己烷磺 酸钠 溶 液一 0 5“ , 甲醇 为流 动相 , 流速 为 1 0mL mi, 测 波长 为 2 3n 最低 . / n 检 9 m,
t ed t r n t n o h eae u sa c so e olx cnme yaefrijcin h ee miai ft erltds b tn e flv f a i s lt o n t . o o e o Ke r s HPL meh d;lv fo a i s lt o neto lv fo a i s lt y wo d : C t o e olx cn meya ef rijcin;e o lx cn meyae
乳酸左氧氟沙星氯化钠注射液无菌检查方法的建立及验证

乳酸左氧氟沙星氯化钠注射液无菌检查方法的建立及验证刘栋;汤长明;郝哲【摘要】Objective To establish a sterility test of levofloxacin lactate and sodium chloride injection .Methods The test was carried out by thin-membrane filtration method with different volume of flushing liquid or adding neutralization into culture medium according to the Appendix of Chinese Pharmacopoeia (2010 edition) .Results When 0 .1% peptone water was used as flushing liquid ,Staphylococcus aureus gave no evidence of growth until the amount of flushing liquid reached 700 ml per tube (100 ml each time) .At the same time ,all of the six positive control bacteria grew normally when there was 300 ml flushing liquid in each tube with neutralization as culture medium .Conclusion This method was simple and convenient ,suggesting that it was suitable for the sterility test of levofloxacin lactate and sodium chloride injection .%目的:建立乳酸左氧氟沙星氯化钠注射液的无菌检查方法。
无菌检查法及其验证

供试品溶液的制备
④非水溶性制剂供试品 取规定量,直接过滤或混合溶于含聚山梨酯80或其
它适宜乳化剂的稀释液中,充分混合,立即过滤。 用含0.1%-1%聚山梨酯80的冲洗液冲洗滤膜至少3 次。滤膜于含或不含聚山梨酯80的培养基中培养。 培养基接种照水溶液供试品项下的方法操作。 其他类供试品: ⑤可溶于十四烷酸异丙酯的膏剂和粘性油剂供试 品 ⑥无菌气(喷)雾剂供试品 ⑦装有药物的注射器供试品 ⑧具有导管的医疗器具(输血、输液袋等)供试品
❖ 若供试品中任何1管显混浊并确证有菌生长, 判供试品不符合规定。
❖ 除非能充分证明,生长的微生物非供试品所含。 ❖ 当符合下列至少一个条件时,方可判试验结果
无效:
15-30
❖ 对无菌检查试验所用的设备及环境的微生物监控结 果不符合无菌检查法的要求;
❖ 回顾无菌试验过程,发现有可能引起微生物污染的 因素;
❖ 供试液经薄膜过滤后,若需要用冲洗液冲洗滤膜,每张滤 膜每次冲洗量为100ml,且冲洗量不超过1000ml,以避免 滤膜上的微生物受损伤。
❖ 过滤器应优先选择封闭式薄膜过滤),也可使用一般薄膜 过滤器。滤膜孔径不大于0.45μm,直径约为50mm。
15-21
供试品的无菌检 查法
❖ 检验数量 指一次检验所用供试品最小包装容器的数量 ❖ 采用薄膜过滤法应增加1/2的最小检验数量作为阳性对照;
❖试验同时应做空白对照
15-16
培养基说明
❖ 无菌检验培养基所能支持生长的微生物是有限的。 ❖ 微生物种类繁多,这些微生物有广泛的生长要求,如:营
养、温度和氧等。 ❖ 无菌检验培养基不可能支持所有微生物的生长,选择了支
持那些最有可能污染药品和在药品中生长的微生物的营养 的培养基。
盐酸左氧氟沙星氯化钠注射液无菌检查法Mg(2+)加入方法验证

年版《中国药典 》规定 :无菌 验证 中冲洗液 的冲洗 量不
能 超 过 1 000 mL ·管 _1]。有 研 究 表 明 ,M g 可 以
对抗该类 药 物 的抑 菌 性 。 ],但 是 未 对 Mg 浓 度 和
加入方 式进一 步研究 。本文 就此进 行进 一步 的探讨 。
1 仪 器 与 试 药
均用 氯化钠溶液制成菌悬液 ,进行菌数测定 。氯化镁加 入硫 乙醇和冲洗液 中,分别制成含 0.1和 0.2 t ool·L Mg 硫 乙醇 培 养 基 和 冲洗 液 ,进 行 高压 灭 菌 。结 果 见 表 1。 2.2 供试 液制备 取供试 品 300 mL·管 _。,按无菌 操作方 法操作 。 2.3 茵 液 组 及 中和 剂 效 应 测 定 取 50~ 100 cfu实 验 菌 1 mL注 入 平皿 ,依 法 测 定其 菌 落 数 ,结 果 见 表 1。将菌液分别加入 含 M 的硫 乙醇酸盐 流体培养基 和改 良马丁培养基 中,观 察到 培养 基颜 色没 有太 大变 化 ,不影 响实验观察 ;菌落生长未受到影 响 ,见表 1。 表 1 验证用菌液的菌落数及加入 Me 对菌液生长的影响
1.1 仪 器 HTY 2000A 型 智 能 集 菌 仪 (杭 州 泰 林
医疗机械 厂);KSF330型全 封闭 集 菌培 养 器 (杭州 高 得 医 疗 器 械 公 司 )。
1.2 试 药
1.2.1 培 养 基 硫 乙 醇 酸 盐 流 体 培 养 基 (批 号 071026),改 良马丁 培养 基 (批 号 071016),营养 肉汤 培 养基 (批 号 070518),培养 基 均 由北 京 三 药科 技 开 发公 司 生 产 ;氯 化 镁 (上 海 化 工 试 剂 厂 生 产 ,批 号
无菌检查方法学验证

无菌检查方法学验证无菌检查方法学验证1. 概述将规定量的供试品按无菌检查法中的薄膜过滤法进行操作,并接种小于100cfu 的试验菌,同时设置阳性对照,按规定温度培养3~5 天,与各相应的阳性对照管比较: 如含供试品各管中的试验菌均生长良好,则供试品的该检验量在该检验条件下无抑菌作用,可按此法进行供试品的无菌检查;如含供试品的任一管中的试验菌生长微弱、缓慢或不生长,则说明供试品的该检验量在该检验条件下有抑菌作用,应采用增加冲洗量或使用中和剂等方法消除供试品的抑菌作用,并再重新进行验证试验。
2. 验证前提条件供试品的选择原则:相同配方,不同规格的制品,选择其中装量最大的制品进行验证。
种类相同,含量不同的制品,选择含量最高的制品进行验证。
照此原则,多规格制品按下表选择供试品进行验证。
3. 验证方法3.1菌液制备3.1.1细菌菌液制备程序①取金黄色葡萄球菌、枯草芽抱杆菌、铜绿假单胞菌的冻干菌种管各一支,分别在无菌操作下打开,以毛细吸管加入适量营养肉汤,轻柔吹吸数次,使菌种融化分散后,吸出滴入营养琼脂斜面上,使均匀分布,置30~35C培养18h~24h。
用接种环取适量第1代培养菌苔,划线接种于营养琼脂培养基斜面上,于30~35C培养18h~24h o 同法操作,培养得第3代培养物。
②取生抱梭菌的冻干菌种管一支,在无菌操作下打开,以毛细吸管加入适量营养肉汤,轻柔吹吸数次,使菌种融化分散后,吸出滴入胃酶肉肝疱斜面上,使均匀分布,置30~35C培养18h~24h o用接种环取适量第1代培养菌苔,划线接种于胃酶肉肝疱斜面上,于30~ 35°C培养18h~24h。
取生抱梭菌的第二代新鲜培养物至硫乙醇酸盐流体培养基中,30~35C培养18h~24h,得第3代培养物。
③分别取金黄色葡萄球菌、枯草芽抱杆菌、铜绿假单胞菌的第3代营养琼脂斜面新鲜培养物,用5.0ml吸管吸取3.0ml~5.0ml稀释液加入斜面试管内,反复吹吸,洗下菌苔。
无菌检查方法验证
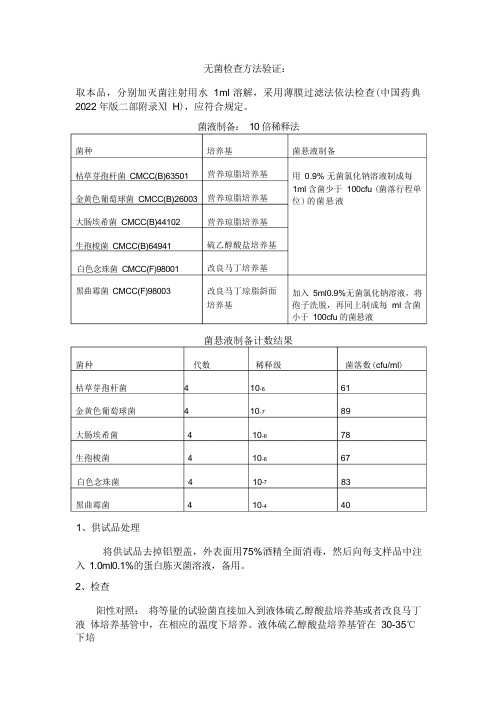
无菌检查方法验证:取本品,分别加灭菌注射用水 1ml 溶解,采用薄膜过滤法依法检查(中国药典 2022 年版二部附录Ⅺ H ),应符合规定。
菌液制备: 10 倍稀释法培养基 营养琼脂培养基营养琼脂培养基营养琼脂培养基硫乙醇酸盐培养基改良马丁培养基改良马丁琼脂斜面 培养基菌悬液制备计数结果菌种 代数 稀释级 菌落数(cfu/ml )枯草芽孢杆菌 4 10-6 61金黄色葡萄球菌 4 10-7 89大肠埃希菌 4 10-6 78生孢梭菌 4 10-6 67白色念珠菌 4 10-7 83黑曲霉菌 4 10-4 401、供试品处理将供试品去掉铝塑盖,外表面用75%酒精全面消毒,然后向每支样品中注 入 1.0ml0.1%的蛋白胨灭菌溶液,备用。
2、检查阳性对照: 将等量的试验菌直接加入到液体硫乙醇酸盐培养基或者改良马丁液 体培养基管中,在相应的温度下培养。
液体硫乙醇酸盐培养基管在 30-35℃下培菌种枯草芽孢杆菌 CMCC(B)63501 金黄色葡萄球菌 CMCC(B)26003 大肠埃希菌 CMCC(B)44102生孢梭菌 CMCC(B)64941白色念珠菌 CMCC(F)98001黑曲霉菌 CMCC(F)98003菌悬液制备用 0.9% 无菌氯化钠溶液制成每 1ml 含菌少于 100cfu (菌落行程单 位)的菌悬液加入 5ml0.9%无菌氯化钠溶液,将 孢子洗脱,再同上制成每 ml 含菌 小于 100cfu 的菌悬液养;改良马丁液体培养基管在23-28℃下培养3-5 天。
观察记录。
阴性对照:将灭菌的液体硫乙醇酸盐培养基或者改良马丁液体培养基管直接放在相应的温度下培养。
液体硫乙醇酸盐培养基管在30-35℃下培养;改良马丁液体培养基管在23-28℃下培养3-5 天。
观察记录。
样品 (薄膜过滤法):每种实验菌取10 支处理好的供试品溶液,将溶液合并后加入制备好的菌悬液1ml,用0.1%的蛋白胨灭菌溶液稀释至100ml,按薄膜过滤法过滤,取出滤膜,将其分为3 等份,分别置于含硫乙醇酸盐流体培养基及改良马丁培养基的容器中,其中一份作为阳性对照用。
无菌微生物限度检查及方法验证

甘油冷冻管保藏法
• 将待保藏菌接种至平板或琼脂斜面,培养 • 用无菌接种环轻轻刮取菌台,用接种环使细菌充分扩散到预先装于
试管中的无菌蒸馏水中 • 调整菌液浓度,使其等同于麦氏比浊管第10号管 • 向已制备好的菌悬液中加入等体积、浓度为20%的无菌甘油,得到
10%甘油菌悬液。 • 轻轻振摇小管,使内容物充分混合,分装于无菌小试管。 • 制好的甘油冷冻管最好在-30℃条件下贮存。
•建立无菌室使用登记册
•使用日期,时间,使用人,设备运转状况,温、湿度,洁净度状况 (沉降菌数、浮游菌数、尘埃粒子数),报修原因,报修结果,清洁 工作(台面、地面、墙面、天花板、传递窗、门把手),消毒液名称 等
微生物实验室的质量管理
实验室使用管理
1. 每天工作前用消毒液消毒工作台,开紫外灯(最少半小时)进行空气消 毒,每月定期做彻底清洁工作,适当时用消毒剂进行熏蒸。
• 将微生物接种至一新鲜培养基上/内,每萌发一次即称为“一代”。
冷冻真空干燥保藏法
主要是将待保藏菌种混于有保护作用介质内制成菌液,分装在安 瓿中于冷冻条件下使其快速冻结,因冻结可使晶型细致,不致损伤活 菌细胞。然后用真空抽气减压,是安瓿内的冰晶液体升华,水气迅速 被真空抽走,冰晶型的菌液很快变成疏松的干燥固体物,最后在真空 状态下熔封管口,使干燥物在局部真空条件下封存,并置冷暗处,在 很长时间内菌种仍可维持活力不变。
•应定期更换消毒剂品种,按标准准确配制。
微生物实验室的质量管理
一、菌种的保存与管理
菌种名称:金黄色葡萄球菌
1. 菌种—特殊的标准品 应保持基生长特性和减少污染,是微生物实 验结果一致性的重要保证。
2. 制定菌种保藏管理制度
菌种系列号:[CMCC(B)26003]
盐酸左氧氟沙星氯化钠注射液无菌检查方法学验证

盐酸左氧氟沙星氯化钠注射液无菌检查方法学验证吴羽岚;嵇海澄【期刊名称】《中国医药科学》【年(卷),期】2013(3)13【摘要】目的对盐酸左氧氟沙星氯化钠注射液的无菌检查方法进行探讨,建立其无菌检查方法。
方法按《中国药典》(2010年版)附录ⅪH无菌检查方法进行。
结果在验证条件下,该方法能消除对微生物生长的抑制作用。
结论可以采用此法对本品的无菌进行检查。
%Objective To discuss and establish the sterile examination method of levofloxacin hydrochloride and sodium chloride injection. Methods The test were done according to appendix XIH-sterile examination method in"Chinese Pharmacopeia"(2010 edition). Results The method could eliminate the inhibition of microbe growth under the validation condition. Conclusion This method can be used for the sterile examination of levofloxacin hydrochloride and sodium chloride injection.【总页数】2页(P95-96)【作者】吴羽岚;嵇海澄【作者单位】江苏豪森药业股份有限公司,江苏连云港222000;江苏豪森药业股份有限公司,江苏连云港222000【正文语种】中文【中图分类】R-331【相关文献】1.盐酸左氧氟沙星氯化钠注射液无菌检查法Mg2+加入方法验证 [J], 裴小龙;黎隽;杨晓莉;王云2.盐酸左氧氟沙星氯化钠注射液无菌检查方法的验证 [J], 闫秀红3.注射用门冬氨酸乌氨酸无菌检查方法学验证 [J], 冯雅;贝鎏銮;冯巧霞;4.盐酸左氧氟沙星氯化钠注射液无菌检查方法的验证 [J], 闫秀红5.18F-FDG注射液的无菌检查及方法学验证 [J], 陈立光;雷震山;梁明泉;邓庆荣因版权原因,仅展示原文概要,查看原文内容请购买。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
注射用甲磺酸左氧氟沙星的无菌检查方法验证
【摘要】目的:验证注射用甲磺酸左氧氟沙星的无菌检查方法。
方法:按《中国药典》2005版二部(附录XIH)所载“无菌检查法”项下进行试验。
通过对阳性对照菌条件的选择和每筒500ml0.1%蛋白胨(含1%0.1mol/LMnSO4)缓冲液的冲洗,建立了无菌检查方法。
结果:阴性、样品管无菌生长,六株阳性菌生长良好。
结论:经方法学验证该检验结果准确可靠。
可做为注射用甲磺酸左氧氟沙星的无菌检查方法验证的无菌检查。
【关键词】注射用甲磺酸左氧氟沙星无菌检查法(薄膜过滤法)方法验证
注射用甲磺酸左氧氟沙星为喹诺酮类药物。
主要作用于革兰氏阴性菌,对革兰氏阳性菌作用弱,有的药物对金葡菌作用强,对其他病原微生物也有不同的作用。
它的主要作用机制为抑制细菌DNA旋转酶活性,抑制细菌DNA复制。
本品剂型属注射剂类,为了确保临床用药安全。
中国药典2005年版要求其做无菌检查。
本试验旨在按中国药典2005年版所载“无菌检查法”探索并建立注射用甲磺酸左氧氟沙星的无菌检查方法。
1.材料和试药
1.1供试品
注射用甲磺酸左氧氟沙星(规格:g/支,批号:,生产厂家:福建省闽东力捷迅药业有限公司)
1. 2培养基、稀释液及冲洗液
硫乙醇酸盐流体培养基(批号:);
改良马丁培养基(批号:);
营养肉汤培养基(批号:);
营养琼脂培养基(批号:);
蛋白胨 (批号:);
玫瑰红钠琼脂培养基(批号:),
上述试剂试药均由北京三药科技开发公司提供。
改良马丁琼脂培养基(批号:)上海中科昆虫生物开发有限公司提供。
0.9%NaCl注射液(批号:09011403)上海长征富民药业铜陵有限公司。
分析纯MnSO4(批号: )
1. 3仪器和滤器
HTY2000B型集菌仪及KSF型全封闭式无菌集菌培养器(厂家:)
YXQ-LS-50立式压力蒸汽灭菌器(厂家:上海博迅实业有限公司医疗设备厂)
SPX-250B-2生化培养箱(厂家:上海博迅实业有限公司医疗设备厂)
MJP-150霉菌培养箱(厂家:上海精宏实验设备有限公司)
20ml注射器(厂家:)
1. 4菌种(第代)
①金黄色葡萄球菌(Staphylococcus aureus)[CMCC(B)26003]
②大肠埃希菌(Escherichia coli)[CMCC(F)44102]
③枯草芽孢杆菌(Bacillus subtilis)[CMCC(B)63501]
④生孢梭菌(Clostridium sporogenes)[CMCC(B)64941]
⑤白色念珠菌(Candida albicans)[CMCC(F)98001]
⑥黑曲霉(Aspergillus niger)[CMCC(F)98003]
2. 试验前准备
2.1培养基、冲洗液及稀释液的制备和灭菌
本实验均采用市售干的培养基、冲洗液,按照说明书要求配制,并于灭菌器内121℃灭菌15min。
2.2菌液的制备[3]
2.2.1取金黄色葡萄球菌、大肠埃希菌、枯草芽孢杆菌的新鲜培养物至营养肉汤培养基中于35℃培养18-24h,采用培养物直接稀释法用0.9%的无菌NaCl稀释至小于100cfu/ml(用营养琼脂平板计数)备用。
2.2.2取生孢梭菌的新鲜培养物至硫乙醇酸盐流体培养基中于35℃培养18-24h,采用培养物直接稀释法用0.9%无菌NaCl稀释至小于100cfu/ml(在缺氧的条件下用营养琼脂平板计数)备用。
2.2.3取白色念珠菌的新鲜培养物接种至改良马丁培养基中于25℃培养18-24h,用0.9%无菌NaCl稀释至小于100cfu/ml,一般稀释至1:106的菌悬液(用玫瑰红钠琼脂培养基平板计数)备用。
2.2.4将黑曲霉的新鲜培养物接种至改良马丁琼脂斜面培养基上,于25℃培养5d。
加5 ml0.9%的无菌NaCl溶液用玻棒将孢子洗下,然后用管口带有纱布的无菌吸管吸至无菌的试管中,最后用0.9%的无菌NaCl稀释至小于100cfu/ml,一般稀释至1:104的菌悬液(用改良马丁琼脂培养基双碟法计数)备用。
2.3菌液计数
将6菌株的菌液用0.9%无菌NaCl溶液稀释至适宜的倍数,并各吸1ml注入平皿中,每菌株各注两皿,然后倒入相应的培养基。
待凝固后放入相应的培养箱中培养适宜的时间。
(需气、厌气菌30-35℃培养24h,真菌23-28℃培养48h)必要时可延长时间。
结果如下:
表1 菌液平板计数结果
菌液计数结果均符合规定
2.4培养基的无菌检查及灵敏度检查
2.4.1培养基的无菌检查
每批培养基随机取6瓶,培养14天,结果全部无菌生长。
2.4.2培养基的灵敏度检查
取装量为12ml的硫乙醇酸盐流体培养基试管9支。
分别接种上述制备的金黄色葡萄球菌、大肠埃希菌、枯草芽孢杆菌、生孢梭菌各两支,剩余一管做空白对照,35℃培养3天。
取每管装量为9ml的改良马丁培养基5支,分别接种上述制备的白色念珠菌、黑曲霉各两支,剩余一支做空白对照,25℃培养5天,逐日观察结果。
结果空白对照管无菌生长,且其它管菌都生长良好。
结果如下表2:
表2培养基的灵敏度检查结果
注:-为澄清,+表示菌生长良好
2.5方法验证实验
2.5.1试验组(菌+样品+培养基)
取本品30瓶,用20ml注射器吸适宜的稀释液(冲洗液:0.1%蛋白胨缓冲液)注入每瓶中,待溶解后吸干移至具塞的瓶子中为供试品溶液。
取一次性全封闭集菌培养器(三联)一套,放在集菌仪的不锈钢插座上,将培养器的软管放入集菌仪的泵头上。
开动电控集菌仪,先用冲洗液润湿滤膜,再将溶解好的本品泵入培养器中过滤,滤完后用冲洗液冲洗,每一个培养器每次冲洗100ml,冲洗5次。
夹住其中一软管,在另两管中分别泵入改良马丁培养基(100ml),随后取下夹子将已泵入改良马丁培养基两管的软管夹紧,再泵入硫乙醇酸盐流体培养基(100ml)。
关闭集菌仪,用剪刀将软管剪断,将软管的开口端套在空气过滤器的开口端上。
另取一次性全封闭集菌培养器(三联)一套和本品30瓶按以上方法过滤冲洗并每管分别泵入硫乙醇酸盐流体培养基(100ml),夹紧管口。
将上述两套一次性全封闭集菌培养器移入接种室用注射器将上述稀释的菌液吸1ml注入相应的培养基中,得到试验组。
2.5.2对照组(菌+培养基)
取一次性全封闭集菌培养器(三联)一套,操作同前,向两管分别泵入改良马丁培养基(100ml),向四管分别泵入硫乙醇酸盐流体培养基(100ml)。
移入接种室用注射器将上述稀释的菌液吸1ml注入相应的培养基中,即得对照组。
2.5.3阴性对照组(培养基)
取一次性全封闭集菌培养器(二联)一套,用0.1%蛋白胨缓冲液冲洗培养器,冲洗量与试验组一致。
分别泵入改良马丁培养基(100ml)和硫乙醇酸盐流体培养基(100ml),得阴性对照组。
将上述装培养基的容器按规定温度(需气、厌气菌35℃,真菌25℃)培养5天。
结果如下:
表2 a试验组与对照组检验结果
表2 b阴性对照组检验结果
(注:-为澄清,+表示菌生长良好,对照组无需冲洗)
4讨论。
