南京大学生物化学大纲
课 程 表 - 南京大学教务处
5
化学文献
6
仙2-401
7
8
9
普
通
10
物 理
实
11
验
三
四
化工制图
仙2-407 化工制图 (上机) 实验甲203
仪器分析
(二) 仙1-201
生物化学
逸B-212
大学体育 (四)
五
(单)
有 机 化 学 实 验
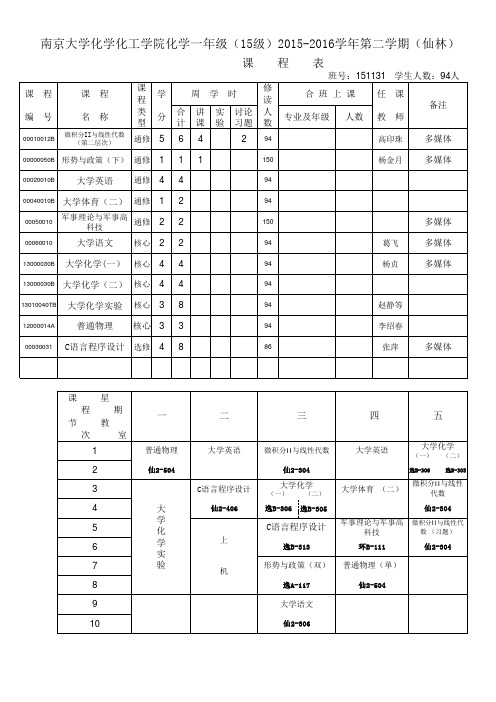
南京大学化学化工学院化学系化学三年级(13级)2015-2016学年第二学期(仙林)
课程表
班号:131131、131133 学生人数:124+24
二
三
四
五
大学英语
C语言程序设计 仙2-406 上
微积分II与线性代数
仙2-304 大学化学 (一) (二) 逸B-306 逸B-305
C语言程序设计
逸B-313
大学英语
大学化学
(一) (二)
逸B-306
逸B-305
大学体育 (二)
微积分II与线性 代数
仙2-304
军事理论与军事高 微积分II与线性代
多媒体
13030510
催化化学
选修 2 2 2
12 化学、化学基地
范以宁
多媒体
13030440 有机单元反应及过程 选修 3 3 3
12
胡兴邦
多媒体
13030530
先进高分子材料
选修 2 2 2
80 化学基地
多媒体
13030520
介观尺度材料
选修 2 2 2
12 化学、化学基地
金钟
多媒体
13030540
分子识别与分析 选修 2 2 2
生物化学复习

--羟丁酸
NAD+ NADH+H+
乙酰乙酸
呼吸链和 氧化磷酸化 O2
TCA
β-酮酯酰CoA转移 酶 (琥珀酰CoA转硫酶)
琥珀酰CoA
琥珀酸
硫解酶
2
乙酰CoA
CoASH
乙酰乙酰CoA
β - 羟丁酸 NAD+
β - 羟丁酸脱氢酶 + NADH+H
HSCoA + ATP
乙酰乙酸
琥珀酰 CoA
植烷酸的α -氧化作用
植烷酸 羟化
脱氢
氧化脱羧
降植烷酸
CO2
4.
脂肪酸的ω- 氧化途径(肝、植物及细菌)
CH3(CH2)n COO呼吸链和 氧化磷酸化
混合功能氧化酶
O2
NADPH+H+
NADP +
HOCH2(CH2)n COO醇酸脱氢酶
NAD(P) +
TCA
NAD(P)H+H+
OHC(CH2)n COO醛酸脱氢酶
CH2OH CHOH CH2OH
ATP ADP
甘油激酶
CH2O P H H CHOH CH2OH
H H NAD+ NADH+H+
磷酸甘油脱氢酶
CH2O P C=O
α-磷酸甘油
磷酸二羟丙酮
糖异生途径
CH2OH
EMP
丙酮酸
其它脂类
糖原或淀粉
氨基酸
乙酰CoA
存在于肝、肾、肠中,脂 肪及骨骼肌细胞缺乏
TCA 呼吸链
呼吸链 ATP+H2O
(一)饱和偶数C脂肪酸的彻底氧化分解
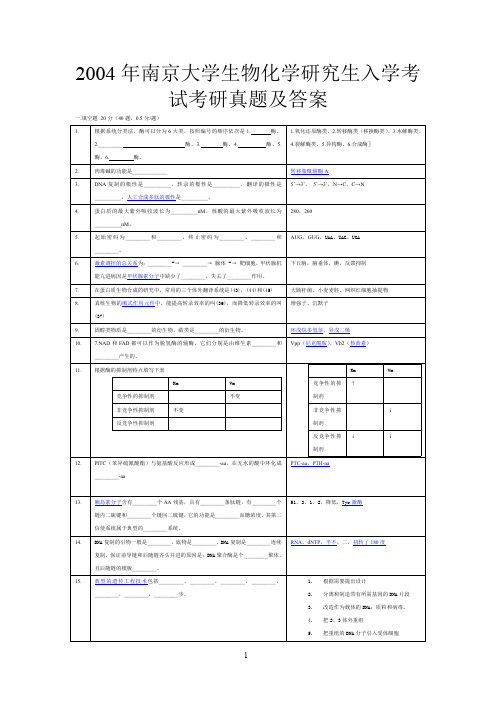
2004年南京工业大学生物化学研究生入学考试考研真题及答案
酶、6.
酶。
2.
肉毒碱的功能是_____________
转移脂酰辅酶 A
3.
DNA 复 制的 极性 是__________ , 转录 的极 性是 __________ , 翻译 的极 性是 5’→3’, 5’→3’,N→C,C→N
__________,人工合成多肽的极性是__________。
4.
蛋白质的最大紫外吸收波长为__________nM ,核酸的最大紫外吸收波长为 280,260
B.2,3,4 来源于丙二酰 CoA,而 1 和 5 来源于乙酰 CoA。
C.只有 5 来源于乙酰 CoA 并首先进入碳链。。
D.只有 1 来源于乙酰 CoA 并首先进入碳链。
9.
坂口反应可以用来鉴别
C
A.Glu B.Lys C.Arg D.Cys
10. 免疫球蛋白 g(IGg)的二级结构主要是
B
A.α-螺旋 B.β-折叠 C.U-回折 D.310 螺旋
B.β-亚基上一个酸性 AA 被疏水 AA 所取代
C.α-亚基上一个酸性 AA 被碱性 AA 所取代
D.α-亚基上一个碱性 AA 被疏水 AA 所取代
6.
增色效应指的是 DNA 溶液的
C
A.颜色变深 B.颜色变浅 C.紫外吸收变大 D.紫外吸收变小
7.
Asp 氨甲酰磷酸氨甲酰转移酶的正协同异促效应物和负协同异促效应物分别是
Km
Vm
竞争性的抑 ↑
竞争性的抑制剂
不变
制剂
非竞争性抑制剂
不变
非竞争性抑
↓
反竞争性抑制剂
制剂
反竞争性抑 ↓
↓
制剂
12. PITC(苯异硫氰酸酯)与氨基酸反应形成_________-aa,在无水的酸中环化成 PTC-aa,PTH-aa _________-aa
南京大学669药学基础综合考研专业课真题复习笔记学习建议

南京大学669药学基础综合(生物化学、有机化学各占1/2)考研专业课真题复习笔记学习建议学院坚持“重视基础研究,加强应用开发,推动成果转化,规范产业管理”为指导原则,在全院师生共同努力之下,科研工作日新月异,取得了丰硕的科研成果。
医药生物技术国家重点实验室(State Key Laboratory of Pharmaceutical Biotechnology)实验室定位于基础和应用基础研究,主要用分子生物学、生物化学和化学方法进行多肽药物的基因工程、蛋白质工程及相关重要技术以及天然产物的研究,建立了一支稳定、高素质、思想活跃的年轻的学术队伍。
在科学研究与人才培养等诸多方面取得了可喜的成绩,获得国内外同行专家的高度评价。
功能分子研究所侧重于小分子活性化合物的研究,自2000年创建以来已经在国际影响较大的学术刊物上发表论文500余篇;生物技术研究所则致力于海滨湿地生态系统的保护与修复研究。
诺登学习网作为一家专业的研究生考试学习网站,给出一些专业的学习建议,以帮助考生顺利上岸。
该专业适用于南京大学以下学院:生命科学学院2023年南京大学生命科学学院《669药学基础综合(生物化学、有机化学各占1/2)》考研全套(会员免费)1.考研真题南京大学《669药学基础综合》(生物化学、生理学、有机化学)历年考研真题汇总全国名校有机化学考研真题汇总(含部分答案)全国名校生物化学考研真题汇总(含部分答案)2.教材教辅邢其毅《基础有机化学》(第4版)(上册)课后习题和考研真题详解邢其毅《基础有机化学》(第4版)(下册)课后习题和考研真题详解邢其毅《基础有机化学》(第4版)(上册)配套题库【考研真题精选+章节题库】邢其毅《基础有机化学》(第4版)(下册)配套题库【考研真题精选+章节题库】陈钧辉《普通生物化学》(第5版)配套题库【考研真题精选+章节题库】3.考研题库2023年有机化学考研题库【考研真题精选+章节题库】2023年生物化学考研题库【名校考研真题+章节题库+模拟试题】2023年生物化学考研全真模拟试卷及详解注意要点:先整理笔记,笔记整理完了,对专业课的整体框架也有了一定的了解,复习的时候思路也会更加清晰。
南京大学生物化学期末考试

期末考试试卷1学号姓名成绩一、是非题(对的在括号内画“+”号,错的画“-”号,每题1分,共10分)1.酶被固定化后,一般稳定性增加。
. ()2.所有的磷脂分子中都含有甘油基。
()3.胆固醇分子中无双建,属于饱和固醇。
()4.光复活作用是一种比较原始的光修复,几乎所有生物包括哺乳动物都有这种修复系统。
()5.维生素B1和维生素B7都是含硫的维生素。
()6.拓扑异构酶Ⅰ和Ⅱ都使超螺旋松弛。
()7.在循环光合磷酸化中有NADPH的生成。
()8.E·coli DNA聚合酶Ⅰ和E·coli RNA聚合酶两者延长多核苷酸链所需的能量都来自焦磷酸的水解。
()9.在三羧酸循环中,琥珀酸脱氢酶催化琥珀酸氧化成延胡索酸时,电子受体为FAD。
()10.如动物长期饥饿,就要动用体内的脂肪,这时分解酮体的速度大于生成酮体的速度。
()二、选择题(以下各题中均有一个正确答案,请写出正确答案的序号。
每题1分,共16分)1.下列哪种糖是非还原糖?(1)果糖(2)葡萄糖(3)核糖(4)蔗糖2.下列关于Km的陈述,哪个是正确的?(1)Km是酶的特征性常数(2)Km是底物和酶反应的平衡常数(3)Km是与酶浓度有关3.DNA经紫外线照射后会产生嘧啶二聚体,其中主要的是(1)CC (2)CT (3)TT4.假尿嘧啶核苷分子中核糖与尿嘧啶连接为(1)C’1—N1(2)C’1—N3(3)C’1—C4(4)C’1—C55.用Edman降解法测某肽的N端残基时,未发现有游离的PTH—氨基酸产生,问下述四种推测中,哪一种是不正确的?(1)其N端氨基酸被乙酰化(2)其N端氨基酸是Pro(3)此肽是环肽(4)其N端氨基酸是Gln6.酶的非竞争性抑制剂使(1)Km增加(2)Km减少(3)V max增加(4)V max减小7.Lys—Ala—Gly在pH7.0 时所带的净电荷为(1)+2 (2)+1 (3)0 (4)-18.可用下列哪种方法打开蛋白质分子中的二硫键(1)用 —巯基乙醇(2)用8mol/L尿素(3)用水解的方法9.在厌氧条件下,下列哪一种化合物会在哺乳动物肌肉组织中积累?(1)葡萄糖(2)丙酮酸(3)乙醇(4)乳酸10.植物光合作用中二氧化碳受体是(1)甘油醛-3-磷酸(2)核酮糖-1,5-二磷酸(3)核糖-5-磷酸(4)烯醇式丙酮酸磷酸11.人尿中嘌呤代谢产物主要是(1)尿素(2)尿酸(3)尿囊酸(4)尿囊素12.联合脱氨作用所需的酶有(1)转氨酶和D-氨基酸氧化酶(2)转氨酶和腺苷酸脱氢酶(3)转氨酶和L-Glu脱氢酶(4)L—Glu脱氢酶和腺苷酸脱氢酶13.不能产生乙酰CoA的是(1)酮体(2)脂酸(3)胆固醇(4)Glc14.下列哪个反应是尿嘧啶核苷酸合成的起始反应?(1)由核糖-5-磷酸形成PRPP (2)FH4的衍生物提供的一碳单位(3)合成氨甲酰磷酸(4)由Gln提供氮原子15.在什么情况下,乳糖操纵子的转录活性最高?(1)高乳糖,低Glc (2)高乳糖,高Glc(3)低乳糖,低Glc (4)低乳糖,高Glc16.利用磷酸来修饰酶的活性,其修饰位点通常在下列哪个氨基酸残基上?(1)Cys (2)His (3)Lys (4)Ser三、填充题(每个空格1分,共34分)1.实验室常用的测蛋白质分子量的方法有和等。
南京大学2000年硕士研究生入学生物化学—2,考试试题

南京大学2000年硕士研究生入学生物化学—2,考试试题一、是非题(对的在括号内画“+”号,错的画“—”号,,每题1分,答错倒扣0.5分,不答者不倒扣):1.溶液的pH可以影响氨基酸的等电点。
( )2.疏水蛋白质在细胞内的自发折叠伴随着该多肽链的熵增。
( )3.单链DNA在CsCL密度梯度离心中的密度比双链DNA大。
( )4.长期素食很可能引起维生素B12缺乏。
( )5.脂肪和胆固醇都属于脂类化合物,它们的分子中都含有脂酸。
( )6.Phe-Leu-V al-Arg四肽的等电点在pH8.0以上。
( )7.双链DNA中若G-C含量多,则Tm值高。
( )8.自然界存在的超螺旋DNA分子,多数是由于缠绕不足,因而形成负超螺旋。
( )9.RNA容易被碱水解,DNA对碱稳定,这是由于它们所含的碱基不同。
( )10.可用8mol/L尿素拆开蛋白质分子中的二硫键。
( )11.cAmP作为一种第二信使,只存在于真核生物细胞。
( )12.脂溶性激素的受体实际上是一种反式作用因子。
( )13.02’作为一种第二信使,需要通过钙调蛋白才能发挥作用。
( )14.在消耗A TP的条件下,呼吸链上的电子可以从复合物Ⅳ流动到复合物I。
( )15.大肠杆菌DNA聚合酶I并不是参与其染色体DNA复制的主要酶,因此它的缺失不会影响到大肠杆菌的繁殖。
( )16.癌细胞和胚性细胞内的端聚酶活性较高,而正常的已经分化的细胞内的端聚酶活性则很低。
( )17.四膜虫pre-rRNA的剪接反应需要鸟苷酸提供能量。
( )18.由于遗传密码的通用性,所以真核生物的mRNA可以在原核生物细胞内得到正常的翻译。
( )19.信号肽总是处在多肽前体的N端。
( )20.与核糖体蛋白相比,rRNA仅仅作为一种结构骨架,在多肽合成中没有什么直接作用。
( )二、选择题(从4个备选答案中选出1个惟一的正确的答案,将答案代码填人题末的括号内。
每小题1分,共20分) ’1.在丁醇—乙酸—水溶剂系统中进行纸层析时,发现氨基酸的m值太小,为了使Rf 值加大,应在( )(1)层析缸中多加一些展层剂(2)溶剂系统中加大丁醇的比例(3)溶剂系统中加大乙酸的比例(4)溶剂系统中加大水的比例2.下列化合物中哪一组所标的名称是正确的? ( )(1)磷酸吡哆醛——维生素B2衍生物(2)抗坏血酸——维生素E的衍生物(3)硫胺素——维生素B1衍生物(4)核黄素——维生素B5衍生物3.酶分子中一个活性出现上重要的但在催化过程中不大可能直接与底物相互作用的氨基酸为( )(1)Glu (2)Cys (3)His (4)Set4.从某组织提取液中提纯一种酶,最理想的是酶制品的( )(1)蛋白质含量高(2)活力单位数最高(3)比活力最高(4)Km值最小5.CTP对A TCase的别构效应被称为( )(1)同促激活(2)同促抑制(3)异促激活(4)异促抑制6.当有180个氨基酸残基的蛋白质多肽链形成完整的螺旋时,其总长度为( )(1)54nm(2)27nm(3)25nm(4)12nm7.酶之所以能加速反应速度,并不是因为( )(1)是反应物集中于酶分子(2)是反应物的键适当定向(3)利用肽键的能量使反应活化能下降(4)提供酸碱侧链作为质子供体和受体8.能保护巯基酶不被氧化的物质是( ,)(1)GSH (2)尿素(3)SDS (4)FDNB9.K—A—G三肽在pH7.0时所带静电荷为( :)(1)十2 (2)+1 (3)0 (4)一110.用RNaseTl处理下面寡聚核苷酸时,将在何处发生断裂? ( 勺OH-G-p-A-p-C-p-U-p-G ;↑↑↑↑:(1)(2) (3)(4) ”;11.下列哪项中的蛋白质不是结合蛋白? ( ):(1)牛胰核糖核酸酶(2)血红蛋白(3)细胞色素c (4)黄素蛋白:12.下列有关葡萄糖的陈述,那个是错的( ):(1)自然界存在的葡萄糖为D型:(2)葡萄糖和甘露糖为差向异构体’(3)在水溶液中的葡萄糖大部分以1,4氧桥的形式存在(4)显示还原性13.要测定血红蛋白的一级结构,首先要进行的工作是( )(1)用6mol/L盐酸胍处理血红蛋白(2)用巯基乙醇处理血红蛋白(3)用过甲酸处理血红蛋白(4)用DTT处理血红蛋白14.ppGpp在下列哪种情况下被合成( )(1)细菌缺乏氮源时(2)细菌缺乏碳源时(3)细菌在环境温度太高时(4)细菌在环境温度太低时15.顺反子的概念和下面哪个名词最接近( )(1)操纵子(2)调节子(3)基因(4)多聚核苷酸16.蛋白激酶C(PkC)的活性需要下列哪个激活( )(1)cAmP (2)cGMP (3)钙调蛋白(4)Ca2’,DG和Ps17.霍乱毒素通过哪个提高cAMP的水平( )(1)抑制cAmP磷酸二酯酶(2)修饰Gs蛋白(3)修饰Gi蛋白(4)修饰Gs蛋白18.疯牛病的致病因子是一种( )(1)细菌(2)DNA病毒(3)RNA病毒(4)朊病毒19.大肠杆菌谷氨酰胺合成酶需要经历什么样的共价修饰而失活? ( )(1)磷酸化(2)甲基化(3)腺苷酸化(4)脂酰基化20.在一个复制叉中,以下哪一种蛋白质的数量最多( )(1)DNA聚合酶(2)引发酶(3)SSB (4)DNA解链酶三、填空题(每空1分,共30分)1.在Tyr,Trp,Asn和Ala四种氨基酸中侧链基性最强的氨基酸是()。
分子生物学常用参考书目
二十一世纪是分子生物学发展的世纪,生命科学将进 入一个新的时代——后基因组时代postgenomics
二十一世纪分子生物学发展的趋势:
1.功能基因组学 functional genomics 依附于对DNA序列的了解,应用基因组学的知识和工具
去了解影响发育和整个生物体的特征序列表达 谱。 酿酒酵母16条染色体的全部序列于1996年完成 。
…
1997
Wilmut成功获得克隆羊—Dolly诞生;
1998
Renard 克隆牛诞生(体细胞→个体);
…
2000 ,6.26 中、美、日、德、法、英6国,宣布人类基 因组草图发表。
2000 ,10月 科学家宣布将于2001年3月完 成河豚鱼的基 因组测序。
2000,12月14日英美等国科学家宣布绘出拟南芥基因组 的完整图谱。
2003年4月14日六国科学家完成了人类基因组序列图的 绘制,实现了人类基因组计划的所有目标。
二十世纪是以核酸为研究核心,带动分子生 物学向纵深发展:
•
50年代双螺旋结构
•
60年代操纵子学说
•
70年代DNA重组
•
80年代PCR技术
•
90年代DNA测序
生命科学从宏观→微观→宏观;由分析→综 合的时代。
分子生物学常用参考书 目
2024/2/1
第一章 绪 论
一、什么是分子生物学?
Instant Notes in Molecular Biology
---Turner et al.
Molecular biology seeks to explain the relationships between the structure and function of biological molecules and how these relationships contribute to the operation and control of biochemical processes.
2015年南京大学考博考研生物化学重点试题及答案
2015年南京大学考博考研生物化学重点试题及答案第一章糖类化学一、填空题1.纤维素是由_ D-葡萄糖_组成,它们之间通过_____β-1,4____糖苷键相连。
2.常用定量测定还原糖的试剂为___Fehling___试剂和__Benedict__试剂。
3.人血液中含量最丰富的糖是__葡萄糖_,肝脏中含量最丰富的糖是__糖原_,肌肉中含量最丰富的糖是__糖原_。
4.乳糖是由一分子_D-半乳糖_和一分子_D-葡萄糖_ 组成,它们之间通过_β-1,4__糖苷键相连。
5.鉴别糖的普通方法为___Molisch__试验。
6.蛋白聚糖是由__糖胺聚糖和___蛋白质_共价结合形成的复合物。
7.糖苷是指糖的____半缩醛(半缩酮)羟基___和醇、酚等化合物失水而形成的缩醛(或缩酮)等形式的化合物。
8.判断一个糖的D-型和L-型是以_离羰基最远的一个不对称__碳原子上羟基的位置作依据。
9.多糖的构象大致可分为_螺旋、带状__、皱折_和_无规卷曲_四种类型,决定其构象的主要因素是_糖链的一级结构_。
二、是非题1.[✗]果糖是左旋的,因此它属于L-构型。
2.[ ✗]从热力学上讲,葡萄糖的船式构象比椅式构象更稳定。
3.[ ✗]糖原、淀粉和纤维素分子中都有一个还原端,所以它们都有还原性。
4.[ ✗]同一种单糖的α-型和β-型是对映体。
5.[ ✗]糖的变旋现象是指糖溶液放置后,旋光方向从右旋变成左旋或从左旋变成右旋。
6.[ ✗]D-葡萄糖的对映体为L-葡萄糖,后者存在于自然界。
7.[√]D-葡萄糖,D-甘露糖和D-果糖生成同一种糖脎。
8.[√]糖链的合成无模板,糖基的顺序由基因编码的转移酶决定。
9.[√]醛式葡萄糖变成环状后无还原性。
10.[√]肽聚糖分子中不仅有L-型氨基酸,而且还有D-型氨基酸。
三、选择题1.[ ]下列哪种糖无还原性?A.麦芽糖B.蔗糖C.阿拉伯糖D.木糖E.果糖2.[ ]环状结构的己醛糖其立体异构体的数目为A.4B.3C.18D.32E.643.[ ]下列物质中哪种不是糖胺聚糖?A.果胶B.硫酸软骨素C.透明质酸D.肝素E.硫酸粘液素4.[ ]下图的结构式代表哪种糖?A.α-D-葡萄糖B.β-D-葡萄糖C.α-D-半乳糖D.β-D-半乳糖E.α-D-果糖5.[ ]下列有关葡萄糖的叙述,哪个是错的?A.显示还原性B.在强酸中脱水形成5-羟甲基糠醛C.莫利希(Molisch)试验阴性D.与苯肼反应生成脎E.新配制的葡萄糖水溶液其比旋光度随时间而改变6.[ ]糖胺聚糖中不含硫的是A.透明质酸B.硫酸软骨素C.硫酸皮肤素D.硫酸角质素E.肝素7.[ ]下列哪种糖不能生成糖脎?A.葡萄糖B.果糖C.蔗糖D.乳糖E.麦芽糖8.[ ]下列四种情况中,哪些尿能和班乃德(Benedict)试剂呈阳性反应?(1).血中过高浓度的半乳糖溢入尿中(半乳糖血症)(2).正常膳食的人由于饮过量的含戊醛糖的混合酒造成尿中出现戊糖(戊糖尿)(3).尿中有过量的果糖(果糖尿)(4).实验室的技术员错把蔗糖加到尿的样液中A.1,2,3B.1,3C.2,4D.4E.1,2,3,49.[ ]α-淀粉酶水解支链淀粉的结果是(1).完全水解成葡萄糖和麦芽糖(2).主要产物为糊精(3).使α-1,6糖苷键水解(4).在淀粉-1,6-葡萄糖苷酶存在时,完全水解成葡萄糖和麦芽糖A.1,2,3B.1,3C.2,4D.4E.1,2,3,410.[ ]有关糖原结构的下列叙述哪些是正确的?(1).有α-1,4糖苷键(2).有α-1,6糖苷键(3).糖原由α-D-葡萄糖组成(4).糖原是没有分支的分子A.1,2,3B.1,3C.2,4D.4E.1,2,3,4四、问答与计算1.大肠杆菌糖原的样品25mg,用2ml 1mol/L H2SO4水解。
生物化学与分子生物学代码071010
生物学一级学科细胞生物学(071009)博士培养方案培养单位:生命科学学院一、培养目标培养德、智、体全面发展的细胞生物学专业高级专门人才。
在硕士研究生学习的基础上,通过博士研究生阶段的培养和训练,能够全面地掌握本学科基础理论与熟练的实验技能,深入了解学科前沿进展,具有创新意识和创新能力,能够独立开展高水平科研工作。
具体要求:1.掌握马克思主义基本原理,坚持党的基本路线,热爱祖国,遵纪守法,品德良好,学风严谨,具有较强的事业心和献身精神,积极为社会主义现代化建设服务。
2.掌握本学科坚实宽广的基础理论和系统深入的专门知识;熟练掌握一门外国语;具有独立从事科学研究和教学工作的能力,在本学科研究领域做出创新性成果。
3.具有健康的体魄、良好的心理素质和一定的社会活动能力。
不仅具有独立从事本专业教学及科研工作能力,,也可以从事高科技企业的开发与管理工作。
二、研究方向及简介根据国家及我省经济、科技和社会发展对高级专门人才的需求,以及本学科的发展趋势,结合本单位导师专业特长等情况,本专业攻读博士学位设以下三个研究方向:1.动物细胞生物学应用先进的生物化学、细胞生物学和分子生物学研究思路与方法,从细胞和分子水平研究生物的结构和功能,主要研究内容为:动物毒理学、动物免疫学、高级电镜技术、生化与分子毒理学;动物功能基因的分子功能;环境细胞生物学等。
2.植物细胞生物学从细胞和分子水平研究植物个体发育机制、规律以及基因调控等。
应用先进的生物化学、细胞生物学和分子生物学研究思路与方法,从细胞和分子水平研究生物的结构和功能,研究内容为:植物病理学、植物功能基因的分子功能、植物资源利用、生化与分子毒理学;环境细胞生物学等。
3.肿瘤细胞生物学采用现代细胞生物学、高级生物化学与分子生物学的理论和技术手段,研究肿瘤的预防、发生与治疗的策略和方法;研究糖尿病、中心体与肿瘤发生的关系;研究小分子化合物的免疫与治疗功能的生物机制,旨在为肿瘤的精准治疗提供科学依据。
生物工程分析与检测教学大纲
生物工程分析与检测教学大纲课程名称:生物工程分析与检测课程性质:专业选修课程代码:学分:5总学时:81适用专业:生物工程先修课程:有机化学、无机化学、生物化学一、课程性质、目的与任务《生物工程分析与检测》为生物工程专业发酵工程方向必修的一门专业技术基础课。
课程主要以发酵工业生产中的分析测定技术为主,课程内容包括常规化学分析、物理分析和仪器分析技术。
《生物工程分析与检测》实验课教学尽力使学生涉及较新和较多的仪器分析方法、尽量有效地利用每个实验单元的时间和尽量做一些设计性实验。
教学过程中不仅要巩固和提高学生仪器分析方法的理论知识水平和实验操作技能,而且要着重培养学生分析问题和解决问题的能力。
通过本课程的教学,使学生掌握生物工程行业的基本分析方法原理,毕业后能够开展有关生产、品质管理、质量控制等分析技术,基本掌握一些科研技能。
二、教学内容与教学要求第一章绪论2学时1.教学内容第一节生物工程行业分析检测技术的现状与发展趋势第二节分析检测的重要性第三节分析检测方法分类及一般程序2.教学要求了解生物工程行业分析检测技术的现状与发展趋势理解分析检测的重要性了解分析检测方法的分类掌握分析检测的一般程序第二章样品的采集与处理2学时1.教学内容第一节样品的采集 1学时第二节样品的处理 1学时2.教学要求了解样品采集的原则和要求熟悉样品采集的程序与方法理解样品处理的原理熟悉样品处理的方法第三章实验数据处理与分析结果的可靠性评价 2学时1.教学内容第一节分析方法的选择第二节分析结果的可靠性评价1学时第三节实验数据的处理1学时2.教学要求了解选择分析方法应考虑的因素;理解误差产生的原因及降低方法;熟悉分析结果的可靠性评价方法,实验数据处理方法;掌握有效数字的修约规则及运算法则。
第四章化学分析法 10学时1. 教学内容第一节重量分析法4学时第二节酸碱滴定分析法2学时第三节氧化还原分析法2学时第四节配位滴定分析法2学时2. 教学要求理解重量分析法和滴定分析法的基本原理;理解不同原料水分的测定方法;理解不同原料糖类的测定方法;掌握含氮量的测定方法;理解不同原料中酸度的测定方法;理解白酒中总酯的测定方法;掌握不同原料粗脂肪的测定方法;了解不同原料粗纤维素的测定方法;了解啤酒花中单宁的测定方法;理解酒石酸的测定方法;理解原料中磷的测定方法;掌握酿造用水的硬度测定方法;了解废糖蜜中总胶体的测定方法;掌握废糖蜜中灰分的测定方法。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第一章绪论( 1 学时)1.1 生物化学的涵义1.2 生物化学的起源与发展1.3 生物化学的重要性1.4 生物化学的学习方法学习要求:了解生物化学的学习内容和学习方法,了解生物化学产生与发展的几个重要阶段及其代表性成果,了解生物化学在人类生产、生活中的重要性及其与其它学科的密切关系。
学习重点:生物化学的涵义;生物化学发展的重要阶段。
第二章糖类化学( 5学时)2.1 糖类的概念2.1.1 糖类的概念2.1.2 糖的分类2.1.3 糖类的主要生理作用2.2 单糖2.2.1 单糖的分类命名常见单糖2.2.2 单糖的结构2.2.2.1 糖的链状结构2.2.2.2 单糖的环状结构2.2.2.3 单糖的构象2.2.3 单糖的性质2.2.3.1 物理性质2.2.3.2 化学性质2.3 寡糖2.3.1 寡糖的命名2.3.2 主要的二糖(麦芽糖蔗糖乳糖)的结构性质2.4 多糖2.4.1 均一多糖2.4.1.1 淀粉糖原2.4.1.2 纤维素几丁质2.4.2 不均一多糖2.4.2.1 细菌细胞壁2.4.2.2 细胞间质学习要求:掌握糖的概念和分类;掌握单糖的结构和性质,区分单糖的构型和构象,链状结构和环状结构,醛糖和酮糖,α型与β型等重要概念,熟悉单糖的氧化性与还原性等重要化学性质及其意义;了解三种主要的二糖的结构和性质;掌握重要的多糖:淀粉与糖原的结构与性质比较,了解其它多糖的种类与生理意义。
学习重点:单糖的结构和性质;淀粉与糖原的结构与性质。
第三章脂类化学(4学时)3.1 脂类的概念3.1.1 脂类的概念3.1.2 脂类的分类3.1.3 脂类的生理作用3.2 脂肪酸3.2.1 脂肪酸的概念3.2.2 脂肪酸的结构3.2.3 脂肪酸的物理性质性质与结构的关系3.2.4 必需脂肪酸3.3 单脂3.3.1 甘油三酯3.3.1.1 甘油三酯的结构命名3.3.1.2 甘油三酯的物理性质3.3.1.3 甘油三酯的化学性质3.3.1.4 甘油三酯的生理作用3.3.2 蜡3.3.2.1 结构性质生理作用3.3.2.2 常见的蜡3.4 磷脂3.4.1 甘油醇磷脂3.4.1.1 结构命名3.4.1.2 极性3.4.1.3 主要的甘油醇磷脂卵磷脂脑磷脂肌醇磷脂心肌磷脂缩醛磷脂3.4.2 鞘胺醇磷脂3.4.2.1 鞘脂类的概念3.4.2.2 鞘脂类的结构3.4.2.3 鞘磷脂的分布功能3.5 糖脂3.5.1 糖基甘油酯3.5.1.1 结构3.5.1.2 命名3.5.1.3 分布3.5.2 糖鞘脂3.5.2.1 中性糖脂3.5.2.2 酸性糖脂(神经节苷脂)3.6 类脂3.6.1 萜类3.6.1.1 结构3.6.1.2 重要的萜类化合物3.6.2 固醇3.6.2.1 结构3.6.2.2 分类动物固醇植物固醇真菌固醇学习要求:掌握脂的概念和分类;掌握脂肪酸的结构与性质;掌握脂肪的结构与性质;掌握磷脂与糖脂的结构组分与区别;了解重要的甘油醇磷脂的种类与生理意义;了解鞘脂类的生理意义;了解类脂的概念与种类。
学习重点:脂肪酸与脂肪的结构和理化性质;复脂的概念与分类;鞘脂类的特殊生理意义;胆固醇的生理意义。
第四章蛋白质化学(14 学时)4.1 蛋白质的重要性和化学组成4.2 蛋白质的基本结构单位----氨基酸4.2.1 氨基酸的结构通式4.2.2 氨基酸的分类4.2.3 氨基酸的构型和旋光性4.2.4 氨基酸的酸碱性质和等电点4.2.5 氨基酸的化学性质4.2.6 氨基酸的分离与鉴定4.3 肽4.3.1 肽的结构和命名4.3.2 肽的理化性质4.3.3 天然存在的某些重要多肽4.4 蛋白质的结构4.4.2 蛋白质的一级结构4.4.2.1 蛋白质一级结构的测定4.4.2.2 蛋白质一级结构举例胰岛素RNase4.4.2.3 多肽和蛋白质的人工合成4.4.3 蛋白质的空间结构4.4.3.1 酰胺平面和二面角4.4.3.2 蛋白质的二级结构4.4.3.3 蛋白质的超二级结构4.4.3.4 蛋白质的结构域4.4.3.5 蛋白质的三级结构4.4.3.6 蛋白质的四级结构4.4.3.7 纤维状蛋白质的空间结构4.5 蛋白质的结构与功能的关系4.5.1 蛋白质的一级结构与功能的关系4.5.1.1 镰刀状红细胞贫血病4.5.1.2 激素及其前体分子4.5.1.3 酶原激活4.5.1.3 同源蛋白质4.5.2 蛋白质的空间结构与功能的关系4.5.2.1血红蛋白的结构与功能4.6.2.2 免疫球蛋白的结构与功能4.6 蛋白质的性质4.6.1 胶体性质4.6.2 酸碱性质和等电点4.6.3 别构作用4.6.4 变性作用4.6.5 凝固作用4.6.6 沉降作用4.6.7 沉淀作用4.7 蛋白质的分离、纯化与鉴定4.7.1 细胞破碎4.7.2 提取4.7.3 分离盐析有机溶剂沉淀等电点沉淀4.7.4 纯化离子交换层析凝胶过滤4.7.5 蛋白质分子量的测定与纯度鉴定学习要求:掌握蛋白质的概念和化学组成;掌握蛋白质的组成单位——氨基酸的结构和理化性质;掌握肽的概念和性质;掌握蛋白质的结构(包括初级结构和空间结构)和理化性质;了解蛋白质分析、分离和纯化的一般方法。
学习重点:氨基酸的结构和性质;蛋白质的结构;蛋白质的分离纯化。
第五章核酸化学(10学时)5.1核酸的概念和重要性5.1.1 核酸的概念5.1.2 核酸的重要性5.2 核苷酸5.2.1 核苷酸的结构5.2.2 核苷酸的性质5.3 DNA的结构5.3.1 DNA的碱基组成5.3.2 DNA的一级结构5.3.3 DNA的二级结构5.3.4 DNA的三级结构5.4 RNA的结构5.4.1 RNA的分布、类型和组成5.4.2 RNA的一级结构5.4.3 RNA的空间结构5.5核酸的理化性质5.5.1 核酸的粘度5.5.2 核酸的沉降特性5.5.3 核酸的紫外吸收5.5.4 核酸的酸碱性质5.5.5 核酸的变性、复性及杂交5.6核酸酶类5.6.1 核酸酶的分类5.6.2 核糖核酸酶类5.6.3 脱氧核糖核酸酶类5.6.4 非专一性核酸酶类5.6.5 其它核酸酶类5.7核酸的分离纯化和常用研究方法5.7.1 核酸的分离纯化5.7.2 核酸含量的测定5.7.3 层析5.7.4 凝胶电泳5.7.5 限制酶图谱5.8核酸的生物功能5.8.1 DNA的生物功能5.8.2 RNA的生物功能学习要求:掌握核酸的概念和化学组成;区分两类核酸:DNA和RNA的组成、分布、结构和功能上的差异;掌握核酸的组分:碱基、核苷和核苷酸的结构和理化性质;掌握核酸的结构(包括一级结构和空间结构)特征,核酸在生命过程中的重要作用;了解核酸分析、分离和纯化的一般方法。
学习重点:DNA和RNA在碱基组成、结构和功能上的差异;核酸的重要理化性质和分析方法。
第六章酶化学(10 学时)6.1酶的一般概念6.1.1 酶的一般概念6.1.2 酶是生物催化剂6.1.3 酶的专一性6.1.4 酶的化学本质6.1.5 辅酶6.1.6 抗体酶和核酶6.2酶的命名和分类6.2.1 习惯命名法6.2.2 系统命名法6.2.3 酶的分类及编号6.3酶的分离纯化6.3.1酶的分离纯化6.3.2酶活力的测定6.4酶的结构和功能6.4.1 丝氨酸蛋白酶6.4.2 溶菌酶6.4.3 乙醇脱氢酶和乳酸脱氢酶6.5酶反应的动力学6.5.1化学动力学6.5.2酶反应的动力学6.5.3 影响酶反应速度的三种因素--pH、温度和酶浓度6.5.4 激活剂和抑制剂对酶反应的作用6.5.5 双底物反应6.6酶的催化机理6.6.1 酶的活性中心6.6.2 酸碱催化6.6.3 共价催化6.6.4 金属离子催化6.6.5 静电(electrostatic)催化6.6.6 接近和轨道效应6.6.7 催化通过过渡态结合起作用6.6.8 酶原激活6.7别构酶和其他调节酶6.7.1 别构酶的动力学6.7.2 别构酶的机制6.7.3磷酸果糖激酶6.7.4天冬氨酸羧基转移酶6.7.5共价调节酶6.8同工酶、寡聚酶、诱导酶、多酶体系和复合体6.8.1同工酶6.8.2寡聚酶6.8.3诱导酶6.8.4多酶体系和复合体学习要求:掌握酶的概念和化学本质;掌握酶活力的概念和影响酶活力的因素;熟悉酶促反应动力学;了解别构酶、调节酶、同工酶、寡聚酶、诱导酶、多酶体系等酶学概念。
学习重点:酶活力的概念和影响酶活力的因素;酶促反应动力学。
第七章维生素与辅酶(4 学时)7.1 维生素的概念7.1.1 维生素的发现7.1.2 维生素的概念7.1.3 维生素的分类7.1.4 维生素的生理作用7.2 脂溶性维生素7.2.1 维生素A7.2.2 维生素D7.2.3 维生素E7.2.4 维生素K7.3 水溶性维生素7.3.1 维生素B族7.3.1.1 维生素B1与TPP7.3.1.2 维生素B2与FMN,FAD7.3.1.3 维生素B3与CoA7.3.1.3 维生素B5与NAD,NADP7.3.1.4 维生素B6与PLP,PMP7.3.1.5 维生素B7与生物素7.3.1.6 维生素B11与叶酸7.3.1.7 维生素B12与辅酶B127.3.2 维生素C7.4 其它7.4.1 CoQ7.4.2 硫辛酸学习要求:掌握维生素的概念、分类和重要意义;了解每种维生素的化学本质、在代谢和生理上的作用。
学习重点:维生素的概念与分类;维生素与代谢的关系。
第八章激素与受体介导的信息传导(4 学时)8.1 激素的定义8.1.1 激素的狭义定义8.1.2 激素的广义定义8.1.2.1 内分泌激素8.1.2.2 旁分泌激素8.1.2.3 自分泌激素8.2 激素的作用机制8.2.1 激素作用的一般特征8.2.1.1 特异性8.2.1.2 微量就能发挥作用8.2.1.3第二信使8.2.1.4脱敏性质8.2.1.5 慢反应与快反应8.2.2 脂溶性激素的作用机制8.2.2.1 受体位于细胞质的脂溶性激素的作用机制8.2.2.2 受体位于细胞核的脂溶性激素的作用机制8.2.3 水溶性激素的作用机制8.2.3.1 cAMP-PKA系统8.2.3.2 IP3,Ca2+, DG-PKC系统8.2.3.3 cGMP-PKG系统8.2.3.4 NO系统8.2.3.5 TPK系统8.2.3.6 钙调蛋白8.2.3.7 几种系统之间的CROSS-TALK8.3 激素的分泌与调节8.4 常见激素的结构与功能8.4.1 下丘脑激素8.4.2 垂体激素8.4.3 其它内分泌激素8.4.4 脑肽学习要求:掌握激素的概念、分类和重要意义;了解激素的作用机制。
学习重点:激素的概念和生理意义,激素的主要作用机制。
复习考试:2学时第九章代谢总论(1 学时)9.1代谢的定义9.2 代谢的一般特性9.2.1 代谢反应的条件温和9.2.2 代谢反应是有序、分步进行的9.2.3 代谢是受到高度调节的9.2.4 不同种类的生物具有相似的代谢途径9.2.5 代谢的高度分室化9.3 研究代谢的方法9.3.1 示踪9.3.2 代谢突变型的利用9.3.3 代谢反应的抑制剂学习要求:掌握代谢的概念和特点;了解代谢的研究方法。
