2019年高考化学浙江专用大二轮专题复习课件反应热与盖斯定律
2019届高考化学二轮复习反应热与盖斯定律的应用专题卷

专题限时集训(七) 反应热与盖斯定律的应用(限时:45分钟)1.(2018·河南十所名校高三联考)已知:①破坏1 mol A —A 键、1 mol B —B 键、1 mol A —B 键时分别需要吸收436 kJ 、498 kJ 、463 kJ 的能量;②反应2A 2(g)+B 2(g)===2A 2B(g)的能量变化如图所示。
下列说法中错误的是( )A .体系中A 2、B 2最活泼B .E 1=1 370 kJ·mol -1C .ΔH =-482 kJ·mol -1D .该反应是放热反应A [由题图可以看出,反应物的总能量高于生成物的总能量,所以该反应是放热反应,D 正确;E 1表示断开反应物中化学键所吸收的能量(即反应的活化能),则E 1=2×436 kJ·mol -1+498 kJ·mol -1=1 370 kJ·mol -1,B 正确;E 2表示形成生成物中化学键所放出的能量,则E 2=2×2×463 kJ·mol -1=1 852 kJ·mol -1,ΔH =E 1-E 2=1 370 kJ·mol -1-1 852 kJ·mol -1=-482 kJ·mol -1,C 正确;图中A 和B 具有的能量最高,因此A 和B 最活泼,故A 错误。
]2.用H 2可将工业废气中的NO 催化还原为N 2,其能量转化关系如图(图中计量单位为mol),则:NO(g)+H 2(g)===12N 2(g)+H 2O(g)的ΔH 为( )A.12(a +b -c -d ) kJ·mol -1B.12(c+a-d-b) kJ·mol-1C.12(c+d-a+b) kJ·mol-1D.12(c+d-a-b) kJ·mol-1A[由图中转化可知,断裂化学键吸收能量,形成化学键释放能量,发生2NO(g)+2H2(g)===N2(g)+2H2O(g)ΔH=(a+b-c-d) kJ·mol-1,又因为化学计量数与反应中的能量变化成正比,则NO(g)+H2(g)===12N2(g)+H2O(g)ΔH=12(a+b-c-d) kJ·mol-1。
浙江省学选考化学2019届高三二轮复习27题对题复习课件(15张)

2、特征反应现象 【讲义4】为探究无机盐X(仅含三种短周期元素) 的组成和性质,设计并完成如下实验:请回答:
n(SiO2)=0.03mol
n(Mg(OH)2)=0.06mol (3)高温条件下白色粉末与焦炭发生置换反应, 写出该反应的化学方程式______
高温
SiO2+2C==Si+2CO
注意几个特殊的置换反应: 1.金属 盐 金属 盐
【例3】(2018年4月)某同学用含结晶水的正盐X(四种短 周期元素组成的纯净物)进行了如下实验:
n(H2O)=0.05mol
n(HCl)=0.02mol n(MgO)=0.01mol
实验中观测到:混合气甲呈无色并被蒸馏水全部吸收; 固体乙为纯净物;在步骤③中,取1/10溶液丙,恰好中 和需消耗0.00200 mol NaOH;另取一定量的溶液丙,
n(SO3)=0.1mol
第2题和讲义第五题
n(Cu2O)=0.2mo
取一定量的浅绿色盐X进行上述实验,充分反应后得到 23.3 g白色沉淀E、28.8 g红色固体G和12.8 g红色固体H。
①浅绿色盐X在570 ℃、隔绝空气条件下受热分解为 非氧化还原反应;
②常温下B呈液态且1个B分子含有10个电子。
4KI+O2+2H2O
2I2+4KOH
。
(2)在通气良好的土壤中,土壤中NH4+的氧化途径
之一是在硝酸细菌作用下完成,写出反应的离子方程
式
NH4++2O2
硝酸细菌
NO3-+H2O+2H+。
(3)工业上一般采用电解(惰性电极)K2MnO4溶
液制KMnO4,写出电解总反应方程式
2019高考化学二轮复习 第1部分 专题2 第3讲 化学反应的方向、限度和速率课件.ppt

三、化学平衡常数的应用 1.影响因素 化学平衡常数只与温度有关,升高或降低温度对平衡常数的影 响取决于相应化学反应的热效应情况;反应物和生成物的浓度对 平衡常数没有影响。 2.应用 (1)判断反应进行的程度 对于同类型的反应,K值越大,表示反应进行的程度越大;K 值越小,表示反应进行的程度越小。
15
[解析] 本题是一道新型的实验探究题,根据题给信息能很容易 解决。(1)由题中“控制p-CP的初始浓度相同,恒定实验温度在 298 K或313 K(其余实验条件见下表)”这句话中的信息能解决表格 的第二列“探究温度对降解反应速率的影响”,故表格这一行应 该填写“313、3、6.0、0.30”;①③对比可以发现温度、浓度均 没发生变化,只有pH由3变成10,所以第三行空中应该填写的是 “探究溶液的pH对降解反应速率的影响”。(2)根据化学反应速 率的定义,结合图象即可计算出结果,v(p-CP)=(1.2-0.4)×10 -3 mol/L÷(150-50) s=8×10-6 mol/(L·s)。(3)提示“请从 Fenton法所用试剂H2O2的角度解释”,通过平时的学习知, H2O2温度高时不稳定,故虽然高温能加快化学反应速率,但温度 过高就导致H2O2分解,消耗了反应物,速率自然会减小。(4)由图 象观察得到图象中随时间变化的曲线③表示在pH=10时,浓度不 变,说明反应速率为0,化学反应停止。(5)可以根据上一小题回 答,使反应迅速停止,可以向溶液中加碱,调节pH=10即可。
4
[易错警示] 1.易忽视影响化学反应速率的根本因素是反应物本身的性质 。 2.比较同一反应在不同条件下反应速率的大小时,易忽视单 位换算,只有单位一致时才能比较数值大小。 3.误认为升高温度,吸热反应速率增大,而放热反应速率减 小。正确应为:升高温度,反应速率都增大,只是增大程度不 同。
高考化学二轮复习 专题13 化学反应中的热效应(含解析)
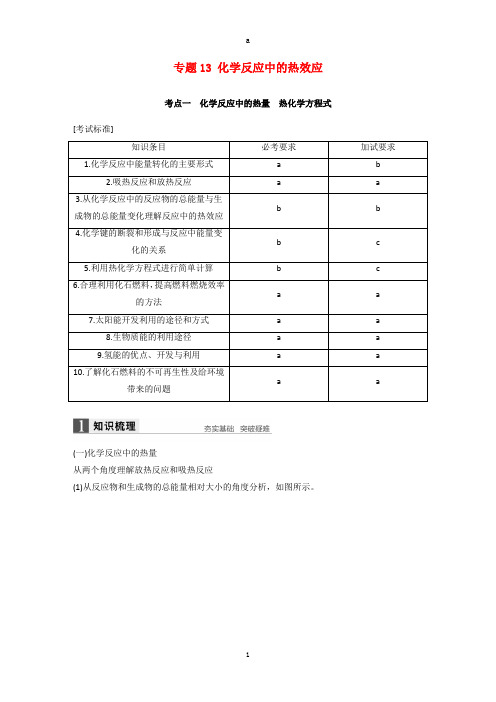
专题13 化学反应中的热效应考点一化学反应中的热量热化学方程式[考试标准]知识条目必考要求加试要求1.化学反应中能量转化的主要形式a b2.吸热反应和放热反应a a3.从化学反应中的反应物的总能量与生b b成物的总能量变化理解反应中的热效应4.化学键的断裂和形成与反应中能量变b c化的关系5.利用热化学方程式进行简单计算b c6.合理利用化石燃料,提高燃料燃烧效率a a的方法7.太阳能开发利用的途径和方式a a8.生物质能的利用途径a a9.氢能的优点、开发与利用a a10.了解化石燃料的不可再生性及给环境a a带来的问题(一)化学反应中的热量从两个角度理解放热反应和吸热反应(1)从反应物和生成物的总能量相对大小的角度分析,如图所示。
(2)从反应热的量化参数——键能的角度分析(3)记忆常见的放热反应和吸热反应放热反应:①可燃物的燃烧;②酸碱中和反应;③大多数化合反应;④金属跟酸的置换反应;⑤物质的缓慢氧化等。
吸热反应:①大多数分解反应;②盐类的水解和弱电解质的电离;③Ba(OH)2·8H2O与NH4Cl 反应;④碳和水蒸气、C和CO2的反应等。
(二)热化学方程式的书写1.注明反应条件反应热与测定条件(温度、压强等)有关。
绝大多数反应是在25 ℃、101 kPa下进行的,可不注明。
2.注明物质状态常用s、l、g、aq分别表示固体、液体、气体、溶液。
3.注意符号单位ΔH应包括“+”或“-”(“+”可省略)、数字和单位(kJ·mol-1)。
4.注意守恒关系(1)原子守恒和得失电子守恒;(2)能量守恒。
5.区别于普通方程式一般不标注“↑”、“↓”以及“点燃”、“加热”等。
6.注意热化学方程式的化学计量数热化学方程式中各物质化学式前面的化学计量数仅表示该物质的物质的量,可以是整数,也可以是分数。
且化学计量数必须与ΔH 相对应,如果化学计量数加倍,则ΔH 也要加倍。
正误辨析正误判断,正确的打“√”,错误的打“×” (1)物质发生化学变化都伴有能量的变化(√) (2)放热反应不需要加热就能发生,吸热反应不加热不能发生 (×) (3)伴有能量变化的物质变化都是化学变化 (×) (4)化学反应中的能量变化不是单一的(√) (5)化学键断裂要吸收热量,也必定发生化学变化(×) (6)书写热化学方程式时,任何情况下都没必要注明反应条件 (×) (7)C(石墨,s)===C(金刚石,s) ΔH >0说明石墨比金刚石稳定(√)(8)已知:500 ℃、30 MPa 下,N 2(g)+3H 2(g)高温高压催化剂2NH 3(g) ΔH =-92.4 kJ·mol -1,将1.5 mol H 2和过量的N 2在此条件下充分反应,放出热量46.2 kJ(×)题组一 全面认识化学反应中的能量变化1.(2016·浙江乐清市芙蓉中学高一5月月考)下列反应属于吸热反应的是( ) A .稀硫酸与氢氧化钾溶液反应 B .碳与二氧化碳的反应 C .锌与稀硫酸的反应 D .生石灰变成熟石灰的反应 答案 B2.(2016·宁波市北仑中学高一期中)图为反应2H 2(g)+O 2(g)===2H 2O(g)的能量变化示意图。
2019年高考化学二轮复习专题12化学反应与能量教案

1 专题12 化学反应与能量 该题型为高考中必考题型,通常以选择题或填空题的形式出现,考查反应热、燃烧热、中和热的概念,反应热的计算及盖斯定律的应用,热化学方程式的书写及判断,中和热的测定等。盖斯定律的应用和热化学方程式的书写时考查的重点。预测在考中,考查反应热内容将不断拓宽,对热化学方程式的应用及盖斯定律的计算要求会有所提高,另外试题可能更加关注能问题,引导考生“形成合理利用自然资、与环境和谐共处的观念” 主要考查方面: 一、焓变 反应热 1.化学反应中的能量变化 (1)化学反应中的两大变化:物质变化和能量变化。 (2)化学反应中的两大守恒:质量守恒和能量守恒。 (3)化学反应中的能量转化形式:热能、光能、电能等,通常主要表现为热量的变化。 2.反应热、焓变 (1)反应热 在化学反应过程中所释放或吸收的热量,通常叫做反应热。 (2)焓变 生成物与反应物的焓值差。 恒压条件下,化学反应的反应热等于焓变。 (3)符号:ΔH。 (4)单位:kJ·mol-1或kJ/mol。 3.吸热反应和放热反应 (1)反应特点 ①从能量高低角度理解
ΔH<0,放热反应 ΔH>0,吸热反应 ②从化学键角度理解 2
(2)常见的吸热反应和放热反应 ①放热反应:大多数化合反应、中和反应、金属与酸的反应、所有的燃烧反应。 ②吸热反应:大多数分解反应、盐的水解反应、Ba(OH)2·8H2O和NH4Cl反应、C与H2O(g)反应、C与CO2反应。 4.燃烧热
5.中和反应反应热 (1)中和反应反应热的概念及表示方法
(2)中和反应反应热的测定 ①装置(请在横线上填写仪器名称) 3
②计算公式 ΔH=-m碱+m酸ct2-t1n kJ·mol-1 t1——起始温度,t2——终止温度,n——生成水的物质的量。
(3)注意事项 ①泡沫塑料板和碎泡沫塑料(或纸条)的作用是保温隔热,减少实验过程中的热量损失。 ②为保证酸完全中和,采取的措施是使碱稍过量。 1、能量变化的图示分析 例1.最新报道:科学家首次用射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如下:
(浙江专用)2019年高考化学大二轮复习 综合训练(四)化学反应原理

综合训练(四) 化学反应原理1.(2018·镇海中学模拟)下列过程吸收热量的是( )A.钢铁生锈B.钠与水反应C.碳酸钙分解D.黑火药爆炸2.(2018·淳安中学模拟)红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。
反应过程和能量关系如图所示(图中的ΔH表示生成1 mol产物时的数据)。
根据能量变化示意图,下列热化学方程式正确的是( )A.Cl2(g)+P(s)PCl3(g)ΔH=+306 kJ·mol-1B.3Cl2(g)+2P(s)2PCl3(g)ΔH=-306 kJ·mol-1C.PCl5(g)PCl3(g)+Cl2(g)ΔH=+93 kJ·mol-1D.PCl5(g)PCl3(g)+Cl2(g)ΔH=-93 kJ·mol-13.(2018·余姚中学模拟)下列各组热化学方程式的ΔH前者大于后者的是( )①C(s)+O2(g)CO2(g) ΔH1C(s)+O2(g)CO(g) ΔH2②S(s)+O2(g)SO2(g) ΔH3S(g)+O2(g)SO2(g) ΔH4③H2(g)+O2(g)H2O(l) ΔH52H2(g)+O2(g)2H2O(l) ΔH6④CaCO3(s)CaO(s)+CO2(g) ΔH7CaO(s)+H2O(l)Ca(OH)2(aq) ΔH8A.①B.④C.②③④D.①②③4.(2018·杭州模拟)根据热化学方程式:S(g)+O2(g)SO2(g) ΔH=-Q kJ·mol-1,下列分析正确的是( )A.1 mol S(g)与1 mol O2(g)的总能量比1 mol SO2(g)的总能量低Q kJB.1 mol S(g)与1 mol O2(g)反应生成1 mol SO2(g)放出Q kJ的热量C.S(s)+O2(g)SO2(g) ΔH<-Q kJ·mol-1D.1个S(g)与1个O2(g)完全反应可以放出Q kJ的热量5.(2018·学军中学模拟)用压强传感器探究生铁在pH=2和pH=4的醋酸溶液中发生腐蚀的装置及得到的图像如下。
高考化学 二轮复习 专题六 化学反应中的能量变化
概念辨析 反应热概念判断和比较类试题
[母题 1] 已知反应:①101 kPa 时,2C(s)+O2(g)===2CO(g) ΔH=-221 kJ/mol;②稀溶液中,H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ/mol。
下列结论正确的是( ) A.碳的燃烧热大于 110.5 kJ/mol B.①的反应热为 221 kJ/mol C.稀硫酸与稀氢氧化钠溶液反应生成 1 mol 水的中和热 为-57.3 kJ/mol D.稀醋酸与稀氢氧化钠溶液反应生成 1 mol 水,放出 57.3 kJ 热量
6.不论化学反应是否可逆,热化学方程式中的反应热 ΔH 表示反应进行到底(完全转化)时的能量变化。如:2SO2(g)+ O2(g)===2SO3(g) ΔH=-197 kJ/mol 是指 2 mol SO2(g)和 1 mol O2(g)完全转化为 2 mol SO3(g)时放出的能量。 若在相同 的温度和压强时,向某容器中加入 2 mol SO2(g)和 1 mol O2(g) 反应达到平衡时,放出的热量为 Q,因反应不能完全转化生成 2 mol SO3(g),故 Q<197 kJ。
答案:D
解析:本题将燃烧热与反应热的计算和热化学方程式的书
写融合在一起,解答时要紧扣燃烧热的相关概念,注意热化学
方程式的书写原则。乙醇与汽油的物质的量之比为 1∶9,即 1 mol 该混合物中含有 0.1 mol 乙醇和 0.9 mol CxHy。0.1 mol 乙 醇燃烧放出的热量为 1 366.8 kJ/mol×0.1 mol=136.68 kJ,又 知 1 mol 混合物完全燃烧共放出 Q kJ 热量,则普通汽油的燃 烧热为(Q-136.68)/0.9 kJ/mol,据此再根据热化学方程式的书 写原则可判断选项 D 正确。
化学【专题二】化学能与热能、盖斯定律的综合应用
【专题二】化学能与热能、盖斯定律的综合应用【考情分析】最新《考试大纲》要求考生能正确理解化学反应中物质变化和能量变化的关系。
根据考纲的这一要求将化学反应中的物质变化和能量变化综合起来考查将成为一种热门的题型,同时注意到由于能源日益匮乏,因此有关燃烧热、中和热、盖斯定律等问题必将成为今后命题的重点。
二轮复习中要进一步深化热化学方程式的正确书写和盖斯定律的应用,以适应这一类新题型的要求。
【知识交汇】1.燃烧热和中和热燃烧热中和热定义要点在1大气压时1 mol物质完全燃烧生成稳定的化合物时所放出的热量在稀溶液中,酸碱发生中和反应生成1mol水,所放出的热量标准1mol可燃物1mol水单位kJ·mol-1kJ·mol-1热化学方程式的书写以燃烧1 mol可燃物为标准配平其余物质的化学计量数(常用分数表示)以生成1 mol水为标准来配平其余物质的化学计量数(常用分数表示)备注必须生成稳定的化合,如C燃烧应生成CO2而不是CO,H2燃烧应生成液态水而非气态水①强酸和强碱在稀溶液中发生中和,中和热是ΔH(强)=-57.3 kJ·mol-1②弱酸代替强酸(或弱碱代替强碱),因电离吸热,反应热增大。
2.书写热反应方程式应注意的问题⑴△H只能写在标有反应物和生成物状态的化学方程式的右边,并用“空格”隔开。
若为放热反应△H为“-”;若为吸热反应△H为“+”。
△H的单位一般为 kJ·mol-1。
⑵注意反应热△H与测定条件(温度、压强等)有关。
因此书写热化学方程式时应注明△H的测定条件。
绝大多数△H是在25℃、101325Pa下测定的,可不注明温度和压强。
⑶注意热化学方程式中各物质化学式前面的化学计量数仅表示该物质的物质的量,并不表示物质的分子或原子数,因此化学计量数可以是整数,也可以是分数。
⑷注意反应物和产物的聚集状态不同,反应热数值以及符号都可能不同。
因此,必须注明物质的聚集状态(s、l、g)才能完整地体现出热化学方程式的意义。
浙江省学选考化学2019届高三二轮复习27题对题复习课件(15张)
n(SO3)=0.1mol
n(Cu2O)=0.2mo 第2题和讲义第五题
取一定量的浅绿色盐X进行上述实验,充分反应后得到 23.3 g白色沉淀E、28.8 g红色固体G和12.8 g红色固体H。 ①浅绿色盐X在570 ℃、隔绝空气条件下受热分解为 非氧化还原反应; ②常温下B呈液态且1个B分子含有10个电子。
黑色粉末
红褐色沉淀 白色沉淀
MnO2、Fe3O4、 血红色溶液 CuO、C Fe(OH)3 红棕色气体 BaSO4、BaCO3、 黄绿色气体 CaCO3、AgCl、
NO2 Cl2
7
某化合物甲是制备负载型催化剂的主要原料。经 组成分析化合物甲中含有四种元素。
m(气)=3.00g n(CO)=0.06mol n(CO2)=0.03mol n(Fe2O3)=0.01mol m(K2CO3)=4.14g n(K2CO3)=0.03mol 气体混合物乙仅含两种元素,由丁和戊组成,其中丁占 总体积的2/3,密度为1.25g· L-1。戊能使澄清石灰水变 浑浊。 K3[Fe(C2O4)3]或K3FeC6O12 (1)化合物甲的化学式________ (2)加热化合物甲使其完全分解的化学方程式为 2K __________________________________________ 。 2; 3[Fe(C2O4)3]=3K2CO3+Fe2O3+6CO+3CO
【例2】(2017年11月)已知固体Na2SO3受热易 分解,实验流程和结果如下:
气体Y是一种纯净物,在标准状况下的密度为1.518g· L-1 (1)气体Y分子的电子式_______, (2)该流程中的Na2SO3受热分解的化学方程式 ____________________________________。 (3)另取固体X试样和Na2SO3混合,加水溶解后与稀盐 2-+SO 2-+6H+=3S↓+3H O 2S 3 2 酸反应,有淡黄色沉淀产生,写出产生淡黄色沉淀的 离子方程式___________________________________。
化学【专题二】化学能与热能、盖斯定律的综合应用
【专题二】化学能与热能、盖斯定律的综合应用【考情分析】最新《考试大纲》要求考生能正确理解化学反应中物质变化和能量变化的关系。
根据考纲的这一要求将化学反应中的物质变化和能量变化综合起来考查将成为一种热门的题型,同时注意到由于能源日益匮乏,因此有关燃烧热、中和热、盖斯定律等问题必将成为今后命题的重点。
二轮复习中要进一步深化热化学方程式的正确书写和盖斯定律的应用,以适应这一类新题型的要求。
【知识交汇】1燃烧热中和热定义要点在1大气压时1 mol物质完全燃烧生成稳定的化合物时所放出的热量在稀溶液中,酸碱发生中和反应生成1 mol水,所放出的热量标准1mol可燃物1mol水单位kJ·mol-1kJ·mol-1热化学方程式的书写以燃烧1 mol可燃物为标准配平其余物质的化学计量数(常用分数表示)以生成1 mol水为标准来配平其余物质的化学计量数(常用分数表示)备注必须生成稳定的化合,如C燃烧应生成CO2而不是CO,H2燃烧应生成液态水而非气态水①强酸和强碱在稀溶液中发生中和,中和热是H(强)=-57.3 kJ·mol-1②弱酸代替强酸(或弱碱代替强碱),因电离吸热,反应热增大。
2.书写热反应方程式应注意的问题⑴△H只能写在标有反应物和生成物状态的化学方程式的右边,并用“空格”隔开。
若为放热反应△H 为“-”;若为吸热反应△H为“+”。
△H的单位一般为kJ·mol-1。
⑵注意反应热△H与测定条件(温度、压强等)有关。
因此书写热化学方程式时应注明△H的测定条件。
绝大多数△H是在25℃、101325Pa下测定的,可不注明温度和压强。
⑶注意热化学方程式中各物质化学式前面的化学计量数仅表示该物质的物质的量,并不表示物质的分子或原子数,因此化学计量数可以是整数,也可以是分数。
⑷注意反应物和产物的聚集状态不同,反应热数值以及符号都可能不同。
因此,必须注明物质的聚集状态(s、l、g)才能完整地体现出热化学方程式的意义。
