第13章 杂环化合物
浙江大学--有机化学作业全并答案

浙江大学远程教育学院《有机化学》课程作业答案姓名:学号:年级:学习中心:第一章结构与性能概论一、解释下列术语1、键能:由原子形成共价键所放出的能量,或共价键断裂成两个原子所吸收的能量称为键能。
2、σ键:原子轨道沿着轨道的对称轴的方向互相交叠时产生σ分子轨道, 所形成的键叫σ键。
3、亲电试剂:在反应过程中,如果试剂从有机化合物中与它反应的那个原子获得电子对并与之共有形成化学键,这种试剂叫亲电试剂。
4、溶剂化作用:在溶液中,溶质被溶剂分子所包围的现象称为溶剂化作用。
5、诱导效应:由极性键的诱导作用而产生的沿其价键链传递的电子对偏移(非极性键变成极性键)效应称为诱导效应。
它可分为静态诱导效应和动态诱导效应。
二、将下列化合物按酸性强弱排序1、D>B>A>C2、D>B>A>C3、B>C>A>D三、下列哪些是亲电试剂?哪些是亲核试剂?Cl-Ag+H2O CH3OH CH2=CH2-CH3H+AlCl3Br+ ZnCl2 +NO2+CH3BF3Fe3+亲电试剂:H+,AlCl3,Br+,Fe3+,+NO2,+CH3,ZnCl2,Ag+,BF3;亲核试剂:Cl-,H2O,CH3OH,CH2=CH2,-CH3.第二章分类及命名一、命名下列化合物1、2、2、4-三甲基戊烷2、2、2-二甲基-3-己炔3、环丙基乙烯4、对羟基苯甲酸5、4-二甲氨基苯甲酸甲酯6、2-溴环己酮7、3-(3、4-二甲氧基苯基)丙烯酸8、8、8-二甲基-二环[3,2,2]-2-壬烯二、写出下列化合物的结构式1、3-甲基环己烯2、二环[]庚烷3、螺[3.4]辛烷4、2、4-二硝基氟苯5、六溴代苯6、叔氯丁烷7、对甲基苯甲酰氯8、对羟基苯乙醇第三章同分异构现象一、命名下列化合物1、(R)-2-甲基-2-羟基丁酸甲酯2、(S)-2-氯丙酸3、(2S,3R)-2-溴-3-戊醇4、(2S,3S)-2-氯-3-溴-戊酸乙酯二、请用*标记出下列化合物中的手性碳原子三、标明下列分子中手性碳原子的构型四、写出下列化合物的稳定构象1、1,2-二乙基环己烷2、1,3-二甲基环己烷第五章饱和烃一、比较下列化合物沸点的高低,并说明原因1、CH3(CH2)4CH32、(CH3)2CH(CH2)2CH33、CH3CH2C(CH3)34、CH3CH2CH(CH3)CH2CH3 (1)>(4)>(2)>(3)同碳数的烷烃异构体,含支链越多,分子间作用力越弱,沸点越低。
第十一章,第十二章,第十三章,第十四章有机化学名词解释

名词解释第十一章1.振动光谱——分子振动能级间的能量差比同一振动能级中转动能级之间能量差大100倍左右,他们大多在近红外区域内,因此称为红外光谱。
2.转动光谱——分子转动能级之间的能量差很小,转动光谱位于电磁波谱中的远红外及微波区域内。
3.红外吸收峰的位置——分子振动的频率决定分子所吸收的红外光频率。
4.红外吸收光谱——分子吸收红外光引起的振动和转动能级跃迁产生的信号。
5.红外光谱产生的条件——当一定频率的红外光照射物质时,如果分子中某一基团的振动频率正好与其相同,物质就能吸收这一频率的红外光从低能级跃迁到较高的能级,产生红外吸收光谱。
6.叁键和累积双键区——2500~2000 cm-1各种叁键基团和累积双键的伸缩振动区域7.氢键区——4000~2500cm-1含氢基团的伸缩振动区。
8.双键区——2000~1500 cm-1各种双键基团包括共轭双键以及苯基伸缩振动区域。
9.特征吸收峰——用于鉴定官能团存在的吸收峰。
10.特征谱带区——氢键,双键,叁键区的特征性强,所以4000~1500 cm-1的区域称为官能团特征频率区。
11.核磁共振谱——记录原子核对射频区电磁波的吸收,简称NMR。
12.质子磁共振谱——氢原子核共振谱,简称PMR。
13.化学位移——由于化学环境所引起的核磁共振信号位置的变化。
14.自旋偶合——相邻碳上氢核的相互影响。
15.硝基化合物的还原——硝基苯在强酸介质中,用金属还原时,总是得到苯胺,用催化加氢也可得到同样的结果。
16.胺的碱性——胺与氨相似,氮原子上的未共用电子对能与质子结合,形成带正电的铵离子。
17.胺——可看作氨的衍生物,即氨分子中的氢原子被烃基取代的产物。
18.胺的烃基化——与卤代烃(通常为伯卤代烃和具有活泼卤原子的芳卤化物),醇等烃基化试剂作用,胺基上的氢原子被烃基取代。
19.胺的酰基化——伯胺和仲胺作为亲核试剂可与酰卤,酸酐等酰基化试剂反应,生成N-取代酰胺和N,N-二取代酰胺。
《医用有机化学》课后习题答案(总)
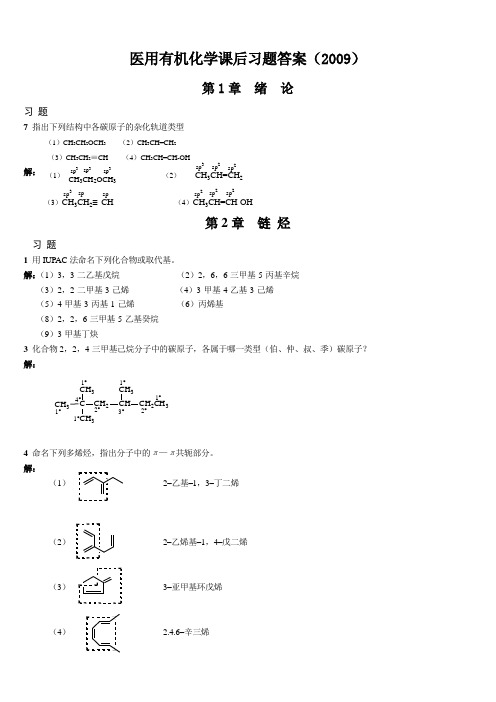
医用有机化学课后习题答案(2009)第1章 绪 论习 题7 指出下列结构中各碳原子的杂化轨道类型(1)CH 3CH 2OCH 3 (2)CH 3CH=CH 2 (3)CH 3CH 2≡CH (4)CH 3CH=CH-OH解:第2章 链 烃习 题1 用IUPAC 法命名下列化合物或取代基。
解:(1)3,3-二乙基戊烷 (2)2,6,6-三甲基-5-丙基辛烷 (3)2,2-二甲基-3-己烯 (4)3-甲基-4-乙基-3-己烯 (5)4-甲基-3-丙基-1-己烯 (6)丙烯基 (8)2,2,6-三甲基-5-乙基癸烷 (9)3-甲基丁炔3 化合物2,2,4-三甲基己烷分子中的碳原子,各属于哪一类型(伯、仲、叔、季)碳原子? 解:CH 3CCH 3CH 3CH 2CHCH 3CH 2CH 31°4°1°2°1°3°2°1°1°4 命名下列多烯烃,指出分子中的π—π共轭部分。
解:(1) 2–乙基–1,3–丁二烯(2) 2–乙烯基–1,4–戊二烯(3) 3–亚甲基环戊烯(4) 2.4.6–辛三烯spsp2sp 3sp 2sp 2spsp 2CH 3CH=CH 2sp 2(1) (2)(3)CH 3CH 2≡CH (4)CH 3CH=CH-OH CH 3CH 2OCH 3sp 3sp3sp 3sp 3(5)5–甲基–1.3–环己二烯(6)4–甲基–2.4–辛二烯9 将下列自由基按稳定性从大到小的次序排列: 解:(3)>(2)>(1)>(4)10 按稳定性增加的顺序排列下列物质,指出最稳定者分子中所含的共轭体系。
解:(1)d >b >c >a (2)d >c >b >a12下列化合物有无顺反异构现象?若有,写出它们的顺反异构体。
解:(1)无 (2)有C=CCH 3HH 2H 5C =CCH 3HHC 2H 5(3)有C =CHC =CH BrCl C 4H 9Br ClC 4H 9(4)有3C =CBrCl HCH 3C =CBr ClH(6)有C =CC 2H 5CH 3C 2H 5CHCH 3CH 3C =CC 2H 5CH 32H 5CHCH 3CH 314 经高锰酸钾氧化后得到下列产物,试写出原烯烃的结构式。
杂环化合物的命名

杂环化合物(hetero cyclic compounds)属于环状有机化合物的一种,是指由碳原子和非碳原子共同介入组成环的环状化合物。
这种介入成环的非碳原子称为杂原子。
杂原子大都属于周期表中Ⅳ、Ⅴ、Ⅵ三族的主族元素,最罕见的是氮、氧、硫,其中以氮原子最为多见。
依照这个定义,在前面一些章节中曾讨论过的内酯、交酯、环状酸酐和内酰胺等,也应属于杂环化合物。
但这些化合物通常容易开环成原来的链状化合物,其性质又与相应的链状化合物相同,因此一般不把它们列入杂环化合物的范围。
有机化学中所要讨论的杂环化合物,一般都比较稳定,不容易开环,有些杂环化合物的性质与苯、萘等相似,具有分歧程度的芳香性。
杂环化合物的种类繁多,数目庞大。
据统计,在已发现的几百万种有机化合物中,杂环化合物约占总数65%以上。
这说明杂环化合物在有机化学的各个研究领域中都占有相当重要的地位。
杂环化合物广泛地存在于自然界中,动植物体内所含的生物碱、苷类、色素等往往都含有杂环结构。
许多药物,包含天然药物和人工合成药物,例如头孢菌素(抗生素)、羟基树碱(抗肿瘤药)、小檗碱(抗菌药)等也都含有杂环。
与人类生命活动及各种代谢关系非常密切的物质──核酸,其碱基部分也含有杂环。
近几十年来,在杂环化合物的理论和应用方面的研究不竭取得重大进展,许多天然杂环化合物,包含维生素B那样结构极其复杂的杂环分子,已经能够用人工方法进行全合成;同时,人类也合成了许多自然界不存在的杂环化合物。
这些化合物作为药物,作为超导资料,作为工程资料,也都具有很重要的意义。
杂环化合物的分类杂环化合物的种类繁多,其罕见的分类方法按所依据的原则分歧,可分为按分子所含环系的多少及其连接方式分类和按分子中所含π电子的状态和数量多少分类两种。
按分子所含环系的多少及其连接方式分类根据这种方法可将杂环化合物分为以下几类:按分子中所含π电子的状态和数量多少分类依照这种方法可将杂环化合物大致分为四类,即:(1)多π-(π-excessive)杂环。
有机化学 杂环化合物

2)五员芳杂环的加成反应
(1)催化加氢
H2 / Ni O O
THF(常用的有 机溶剂) 吡咯烷:一个仲胺
使用特殊催化剂(噻
H2 / Ni N H N H
N i/H 2 脱S
S
H2 / MoS2 S
吩能使常用氢化催 化剂中毒)
(2)Dields-Alder反应
O O + O O O O O O
3) 吡咯的弱酸性
H
N
N
H
A
§15.3 含一个杂原子六员芳杂环(吡啶)
H C H C C H C H C
孤对电子
H
N
I) 符合Hückel规则 II) 吡啶环电子云分布不如苯均匀,吡啶环上的碳原子电 子云密度较苯低,氮原子附近电子云密度较大诱导效应和共轭 效应一致 III)可以质子化,具有碱性,易溶于水
一、吡啶的碱性和亲核性
2
86%
N SO3
H+
+
O r. t. O S O 3H H O 3S O S O 3H
41%
15%
•噻吩活性大,较稳定:可直接用硫酸磺化
H 2S O 4 S r. t. S SO 3H
应用:从煤焦油中得到的苯含噻吩,利用 该反应将其除去
+
H 2S O 4 S (少量) 反应快 S S O 3H r. t.
N
吲哚 indole
5
N
7
N
3
4
N
8 9
H 嘌呤 purine
四、杂环命名的标氢
饱和原子为最低编号H 作字首
O
O
4H-吡 喃
2H-吡 喃
6 1N 2
5
第十三章有机物常识烃

第十三章 有机物常识 烃【竞赛要求】有机化合物基本类型及系统命名。
烷、烯、炔、环烃、芳香烃的基本性质及相互转化。
异构现象。
C=C 加成。
马可尼科夫规则。
取代反应。
芳香烃取代反应及定位规则。
芳香烃侧链的取代反应和氧化反应。
【知识梳理】一、有机化合物的分类和命名(一)有机化合物的分类1、按基本骨架分类(1)脂肪族化合物:分子中碳原子相互结合成碳链或碳环。
(2)芳香族化合物:碳原子连接成特殊的芳香环。
(3)杂环化合物:这类化合物具有环状结构,但是组成环的原子除碳外,还有氧、硫、氮等其他元素的原子。
2、按官能团分类官能团是决定某类化合物的主要性质的原子、原子团或特殊结构。
显然,含有相同官能团的有机化合物具有相似的化学性质。
表13-1 常见的官能团及相应化合物的类别碳碳双键 烯烃碳碳叁键 炔烃卤素原子 —X 卤代烃羟基 —OH 醇、酚醚基 醚醛基 醛羰基 酮等羧基 羧酸 酰基 酰基化合物 氨基 —NH 2 胺硝基 —NO 2 硝基化合物磺酸基 —SO 3H 磺酸巯基 —SH 硫醇、硫酚氰基 —CN 腈C C C C C O C C H O C O C OH O C R O(二)有机化合物的命名1、烷烃的命名烷烃通常用系统命名法,其要点如下:(1)直链烷烃根据碳原子数称“某烷”,碳原子数由1到10用甲、乙、丙、丁、戊、己、庚、辛、壬、癸表示,如CH3CH2CH2CH3叫丁烷,自十一起用汉数字表示,如C11H24,叫十一烷。
(2)带有支链烷烃的命名原则:A.选取主链。
从烷烃构造式中,选取含碳原子数最多的碳链为主链,写出相当于这一碳链的直链烷烃的名称。
B.从最靠近取代基的一端开始,用1、2、3、4……对主链进行编号,使取代基编号“依次最小”。
C.如果有几种取代基时,应依“次序规则”排列。
D.当具有相同长度的碳链可选做主链时,应选定具有支链数目最多的碳链为主。
例如:2、脂环烃的命名脂环烃分为饱和的脂环烃和不饱和的脂环烃。
杂环化合物
S
N H
有机含氮化合物
O
18
1、酸碱性
•呋喃和噻吩是中性 化合物
•吡咯是弱碱性化合物
碱性 N H
+ KOH N H
N H
NK+ + H2O
有机含氮化合物
19
2、亲电取代反应
•吡咯、呋喃和噻吩环上碳原子电子云密度较苯增大, 导致芳香性亲电取代活性较苯增大,取代基一般进入 -位。 反应活性顺序:吡咯、呋喃、噻吩>苯
8
N1 H
2
N
3
吲哚
N N N H N
嘌呤
N N N N H
9H-嘌呤
7H-嘌呤
有机含氮化合物
15
第二节 五元杂环化合物
一、单杂原子五元杂环化合物 (一)结构 吡咯
激发 杂化
1 1 1 2S2 2Px 2Py 2Pz
N H
有机含氮化合物
16
呋喃和噻吩的结构
激发 杂化
2 2s2 2px 2py1 2pz1
O
有机含氮化合物
六元环:
4 5
3
CH - 3
6 N
1
2
N
4 -甲基吡啶 γ-甲基吡啶
CH3
Br N N
SO3H N
N
3-溴吡啶
3-吡啶磺酸
有机含氮化合物
12
(2)如有不止一个杂原子,编号尽可能小;
N 1 N
H3C OH
CH3
N
N 4-甲基咪唑
1-甲基-2-羟基咪唑 N-甲基-2-羟基咪唑
但比吡咯低。
有机含氮化合物
49
吲哚的性质
1、酸碱性
酸性强度与吡咯相似
13-杂环
N9 H 嘌呤 purine
N3
N 10
4
蒽
吖啶 acridine
二、命名
杂环化合物的命名,包括基本环和环上取代基 两部分,取代基的命名与一般化合物大体一致。
1.杂环基本环的命名
简单的杂环(看作杂环的基本环)都有一特 定的名称,按英文音译名选择相应的汉字,旁 边加“口”,表示环状化合物:
+ 2 HCl O H2 己 二胺 H2O 己 二酸 Cl(CH2)4Cl NaCN NC(CH2)4CN
二、α-呋喃甲醛(糠醛)
1. 制备
C5 H8O4 + n H2O n 稀HCl n C5 H10O5
戊聚糖
HO CH CH OH H
戊醛糖
HC HC O CH C CHO + H2O
H CH HO C OH
氧化硫的加合化合物。
+ SO3 N
CH2Cl2 室温
N SO3
(固体,含量90 %)
噻吩比较稳定,既可以直接磺化(产率稍低), 也可以用温和的磺化试剂磺化。
O
ClCH2CH2Cl
SO3-
N H
O
+
N SO3
r. t. 3 days N H
-
O3 S
O
SO3-
N H
ClCH2CH2Cl
Ba(OH)2
CH2 CH2 CH3 CH3 + 4S 600~650 oC + 3 H2S S
2 HC CH + S
2 HC CH + H2S
300 oC S
Al2O3 400 oC S +
H2
3.鉴别:
杂环化合物和生物碱-有机化学
溶解1份吡咯、呋喃及噻吩,分别需要17、 35、700份的水。 当五元杂环上连有羟基时,溶解度增大。
如: O
H3C O OH
S
S
OH
(1:35)
(1:20)
(1:700)
(1:16)
3. 杂环化合物的化学性质 (1)、亲电取代反 应
N H O S
HNO3
I2 NaOH
吡咯、呋喃、噻吩 α位取代
I
第四节 稠杂环化合物
稠杂环化合物是指苯环与杂环稠合或杂环与杂环稠合在一起的化 合物。常见的有喹啉、吲哚和嘌呤。
泳衣品牌
3 2 d ★ c
N
a b
N
1
N
★ b 2 a 3
N1
S
N
吡啶并[2,3-d]嘧啶
咪唑并[2,1-b] 噻唑
第二节
五元杂环化合物
五元杂环化合物包括含有1个杂原子的五元杂 环和含2个杂原子的五元杂环。 一、含1个杂原子的五元杂环化合物 1.结构
4 5 1N 3 2
4 5 3 2 4 5 3 2
OH
2.亲电取代反应
Cl2, AlCl 3 100 ℃ Br2, 浮石催化 300 ℃ 气相
Cl
3 氯吡啶
N
Br
3 溴吡啶
N
NO2
N
浓 H2SO4 HgSO4 催化, ℃ 220 混酸 300 ℃
3 硝基吡啶
N
SO3H
吡啶 3 磺酸
N
3.氧化还原反应
(1)氧化反应
COOH N β 吡啶甲酸(烟酸) HNO 3 N COOH N α 吡啶甲酸
由于吡啶环的N上在环外有一孤对电子,故吡啶环上的电荷分布不均。
有机化学杂环
H
• 胞嘧啶
O HN ON
H
尿嘧啶
O HN CH3 ON
H
胸腺嘧啶
NH2 NN
NN H
•
腺嘌呤
O HN N H2N N N
H
鸟嘌呤
• 杂环化合物是指成环的原子除碳以外还有 其它元素的原子(即杂原子)的化合物, 常见的杂原子有O、S、N等。但下述化合 物容易开环,性质与脂肪族的化合物相似, 不属于杂环化合物范畴。
N NO2
(β—硝基吡啶 20 %)
N
N
发烟 H2SO4 / HgSO4
230 ℃
SO3H
(吡啶—β —磺酸 71%)
Br2 300℃
N +
Br
β—溴代吡啶
N
Br
Br
3,5 二溴吡啶
• 3.氧化还原反应:由于吡啶环上的电子云 密度降低(缺π电子的体系),氧化反应难 以发生,若有侧链,侧链可以被氧化。故 吡啶更适合作氧化反应的溶剂,特别是需 要碱作催化剂时。
N
N
O
S
N
H
H
O
N
第一节 杂环化合物分类和命名
• 一、分类: • 五元杂环 • 六员杂环 • 单杂环 • 稠杂环 • 见表12-1
• 二、命名(母核)
• 杂环化合物的命很复杂。主要讨论最 常用的译音法,即将杂环母核根据国 际通用英文译音,选同音汉字再加 “口”字旁命名。例如:
N
O 恶唑
oxazole
一、呋喃、噻吩、吡咯的结构
3.氧化还原反应:由于吡啶环上的电子云密度降低(缺π电子的体系),氧化反应难以发生,若有侧链,侧链可以被氧化。
第二节 含氮六元杂环
胞嘧啶
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第13章 13.1 基本要求 ● ●
13.2 基本知识点 13.2.1 由碳原子和非碳原子所构成的环状有机化合物称为杂环化合物,环中的非碳原子称为杂原子,最常见的杂原子有氧、硫、氮等。通常将环系比较稳定,具有一定程度的芳香性,且符合Hückel规则的杂环化合物称为芳杂环。杂环化合物按环的数目不同,可分为单杂环和稠杂环两大类。单杂环按环的大小不同又可分为五元杂环和六元杂环。稠杂环通常由苯与单杂环或单杂
13.2.2 杂环化合物的命名比较复杂,目前我国常使用“音译法”,即按英文的读音,用同音汉字
(1) 五元杂环:
(2) 六元杂环 (3) 稠杂环 环上有取代基的杂环化合物的名称是以杂环为母体,并注明取代基的位置、数目和名称,杂环编号,除个别稠杂环外,一般从杂原子开始,顺环编号,环上有不同杂原子时,按O,S,
O52
34S5234N523411H1S5234
1NN52
34
H1NN
52
34
H1 噻吩thiaphene 吡咯
pyrrole 噻吩
thiazole 吡咯
pyrrole 咪唑
imidazole呋喃
furan
N1
2
3456NN234561NN234561NN234561O123456
吡啶pyridine 哒嗪
pyridazine 嘧啶
pyrimidine 吡嗪
pyrazine吡喃
pyran
N12345678 喹啉quinolineN12345678 异喹啉isoquinoline(编号特殊)1234567吲哚indoleNHN123105678 吖啶 acridine(编号特殊)NN1234
567
嘌呤 purine(编号特殊)
NNH89
9
4 2
NH,N的顺序编号;某些杂环可能有互变异构现象,为区别各异构体,需用大写斜体“H”及其位置编号标明一个或多个氢原子所在的位置。例如:
13.2.3. 1. 吡咯、呋喃、噻吩的结构和性质
吡咯、呋喃和噻吩均为五原子六电子的富电子闭合共轭体系,符合Hǖckel的4n+2规则,具有芳香性(芳香性的强弱次序为:苯>噻吩>吡咯>呋喃)。由于环上五个原子共用六个电子,环上的电子云密度比苯环大,所以它们易发生亲电取代反应,反应比苯容易进行,取代基多进入α-位,亲电取代的活性顺序为:吡咯>呋喃>噻吩>苯。
此外,吡咯和呋喃还能发生一些特殊的反应。如: 2. 咪唑的结构和性质 咪唑可视为吡咯环上3-位的CH被氮原子替换,为五原子六电子的闭合共轭体系。它具有一定程度的芳香性,分子间能形成氢键,产生缔合现象,3-位上氮原子具有弱碱性,1-位氮原子上的氢具有弱酸性,存在互变异构现象,亲电取代反应活性比苯低,取代基主要进入4(5)-2-位:
N1
2
3CH3β456 3-甲基吡啶(β-甲基吡啶)NN1234562,4二羟基嘧啶OHOHNN9
2
34
5672-氨基-6-氧嘌呤NNHO8H1H2NO43265
14H-吡喃O4326512H-吡喃
NHHHNHOHHOSHH
S
HH
H
NHN+SOHClNHSO3HSSBrBr,AcOHOONO2CH3COONO2SSCOCH3Ac2O,H3PO4①-3,100℃②室温
-5~30℃
NH
PhN2NHIIIINHNHNNPhCHOOOOOOOOOI2/NaOH碘代CHCl3/KOHReimer-Tiemann+Cl-偶联反应室温Diels-Alder反应
NNHHHN
N
H 3
13.2.4. 六元杂环的结构和性质 1. 吡啶的结构和性质
吡啶为六原子六电子的闭合共轭体系,符合Hückel的4n+2规则,具有芳香性。吡啶为一弱碱,既可以发生亲电取代反应,又可发生亲核取代反应。由于氮的电负性比碳大,故吡啶环上电子云密度比苯低,其亲电取代反应比苯困难,反应活性与硝基苯相似,吡啶环比苯环难氧化:
2. 嘧啶的结构和性质 嘧啶为六原子六电子的闭合共轭体系,显弱碱性,但其碱性比吡啶弱;由于两个氮原子的强吸电子作用,使嘧啶难以发生亲电取代反应,难氧化,而易发生亲核取代反应;嘧啶环比苯环难氧化,但它很容易被氢化。
NNHHO3SNNHHO3SH2SO4
160℃
NNHNH2
NN
H
N
NH
NNCH3
NNCH3NNHNNH磺化亲核取代偶联n烷基化缔合酰化磺CO
PhN2+Cl-N=NPh
NHHHHH
N
NBrBr2
300℃
NNO2
NSO3HN
NNH2
NPh
浓HNO3/浓H2SO4
370℃
H2SO4/HgSO4
NaNH2/PhNMe2
PhLi
HClSO3
CH3Br
H2/PtH2O2/HOAc
N+HCl-N+ CH3Br-N+SOOO-NNHO-+NNKMnO4COOHCOOH碱性亲核性还原反应
氧化反应
亲电取代反应亲电取代反应亲电取代反应亲核取代反应亲核取代反应100℃
230℃
碱性
NNNH
H
HH 4
13.2.5 1. 喹啉的结构和性质
喹啉可看成是吡啶环与苯环稠合而成的化合物,为平面型分子,含有10个电子的芳香大π键,结构类似于萘和吡啶。它的化学性质类似于吡啶和萘。由于喹啉环上有一个电
负性强的氮原子,环上的电子云密度比萘环低,亲电取代反应比萘难,但比吡啶容易,且易发生在苯环上,取代基多进入5-位和8-位;它也能发生亲核取代反应,反应发生在吡啶环上,比吡啶容易;喹啉中苯环较易氧化,而吡啶环较易被还原。 2. 合而成,它的环氮原子和环碳原子上的p电子也有相当大的离域性,是具有芳香性的稠杂环。嘌呤环中的咪唑部分可发生三原子体系的互变异构现象,有两种互变异构体,它们的结构式如下:
嘌呤主要以9H-嘌呤的形式存在。由于嘌呤环中含有四个电负性大的氮原子,使环碳原子很难与亲电试剂发生反应;同时,由于氮原子的吸电子诱导作用,使咪唑环上9-位N上的H
13.3 典型例题分析
亲电取代反应NNBrBr2,PhNO2亲核取代反应N-Na+NHNH2NNNaNH2/NH3(1)NNHPhLiPhKMnO4,Me2COPhLi/Et2O室温室温NNHClMeI/MeOHEt2O+BF4H2O2/HOAcCH2ClCH2ClN+HCl-N
碱性
MeI-NN
EtI-N+N++Et2BF4
烷基化反应(亲核性)
氧化反应O-N
N+
300℃-
NNNNH2
NBu-n
NCOOHCOOHNHNHNaNH2,二甲苯100℃n-BuLi,甲苯KMnO4,H2O100℃Sn/HCl或H2/Pt/H2OH2,Pt/HOAc40℃N
NNO2(50%)+NNO
2
(48%)
NSO3H
NBr
+N
Br
(1:1)NBr(82%)
浓HNO3,浓H2SO4
浓H2SO4,浓HNO3,浓H2SO4
Ag2SO4,△
Br,CCl4,C5H5N△
220℃0℃
NNNNHNNNNH 5
13.3.1 (1)异烟肼 (2)烟酸 (3)糠醛 (4)磺胺嘧啶 (5)尼克刹米 (6)腺嘌呤 (7)鸟嘌呤 (8)胞嘧啶 (9)尿嘧啶 (10)胸腺嘧啶 (11)吡哆醇 (12)喹碘仿 解:
13.3.2 排列组织胺中三个氮原子的碱性次序(由强到弱),并说明理由。 解: 组织胺的结构式为:
因为③氮为sp3杂化,s成分最少,碱性最强;①氮和②氮均为sp2杂化,碱性小于③氮;①氮上的未共用电子对参与环的共轭,不显碱性。所以,三个氮原子的碱性顺序为③>②>①。 注释 解此题必须知道组织胺的结构,否则无从下手。判断含氮杂环化合物的碱性强弱可从以下几个方面考虑:N的杂化状态;N上的未共用电子对是否参与形成共轭体系;环上是否
13.3.3 指出下列化合物中哪些具有芳香性,并说明理由。
解: 因为(1)和(2)中具有六个π电子,(3)中具有十个π电子,且能形成环状共轭体系,符合Hückel的4n+2规则,因此,(1),(2)和(3)均具有芳香性;而(4)中虽然也具有
N(1)CONHNH2
(2)N
COOH(3)
OCHO
4-吡啶甲酰肼3-吡啶甲酸2-呋喃甲醛
(4)H2NSO2NHNN(5)NCON(C2H5)2(6)NNNN
H
NH2
2-(对-氨基苯磺酰胺基)嘧啶N,N-二乙基-3-吡啶酰胺
6-氨基嘌呤
NNNNH2-氨基-6-氧嘌呤(7)HH2NO(8)NNNH2OH2-氧-4-氨基嘧啶(9)NNOHOH
2,4-二氧嘧啶NNHH2N
O(10)
HCH3
5-甲基-2,4-二氧嘧啶NH3C
CH2OH(11)
2-甲基-3-羟基-4,5-二羟甲基吡啶¤
HOCH2OH(12)
N
SO3H
OHI8-羟基-7-碘喹啉-5-磺酸
NNCH2CH2NH2
①②
③
H
(1)N(2)NNN(3)O(4)
