溶液PH的计算方法
pH的计算方法

1.强酸、强碱溶液的pH强酸:C——→[H+]——→pH强碱:C——→[OHˉ]——→[H+]——→pH2.弱酸、弱碱溶液pH弱酸:[H+]——→pH3.强酸与强酸混合液的pH4.强碱与强碱混合液的pH注意:不能这样计算.如果已知两种强酸或两种强碱的pH,同样用上述方法来计算,而且有如下近似规律:①两强酸等体积混合,混合液PH= pH小+0.3②两强碱等体积混合,混合液pH=pH大-0.35.强酸与强碱混合液的pH:①强酸与强碱正好完全反应,溶液呈中性,pH=7再求pH= -lg[H+]余最后求pH= -lg[H+]6.酸碱溶液用水稀释后的pH①强酸、强碱的稀释:在稀释时,当它们的浓度大于10-5mol·L-1时,不考虑水的电离;当它们的浓度小于10-5mol·L-1时,应考虑水的电离.例如:pH=6的HCl溶液稀释100倍,混合pH≈7(不能大于7);pH=8的NaOH溶液稀释100倍,混合pH≈7(不能小于7);pH=3的HCl溶液稀释100倍,混合液pH=5;pH=10的NaOH溶液稀释100倍,混合液pH=8.②弱酸、弱碱的稀释:在稀释过程中有浓度的变化,又有电离平衡的移动,不能求得具体数值,只能确定其pH范围.例如:pH=3的CH3COOH溶液,稀释100倍,稀释后3<pH<5;pH=10的NH3·H2O溶液,稀释100倍,稀释后8<pH<10;pH=3的酸溶液,稀释100倍,稀释后3<pH<5;pH=10的碱溶液,稀释100倍,稀释后8≤pH<10;该文章转自[榆林教学资源网]:/tbfd/hxfd/g3hx/200903/5955.shtml。
PH值的计算

[H+] = c HCl + [OH- ] = c HCl + Kw/[H+]
解二次方程, 解二次方程,得 [H+] = 1.6×10-7 × pH = 6.80
2、强碱 (1) (2) c NaOH≥ 10-6
, ,
[OH- ] = c NaOH [OH- ] = c NaOH + [H+]
c NaOH <
+
= 2.1×10-5 mol L-1 × pH = 4.69 2、弱酸弱碱盐 、 为例, 以NH4Ac为例,NH4+ :Ka、Ac : Ka’ 为例 PBE: [HAc] + [H+] = [NH3] + [OH ]
’ Ka[NH4 ] Kw [H+][HA] +[H+] = + + + Ka [H ] [H ] -
二、 pH值的计算 值的计算 强酸(碱 溶液 ㈠ 强酸 碱)溶液 pH的计算 的计算
1、强酸 (1) c HCl≥ 10-6
, ,
[H+] = c HCl [H+] = c HCl + [OH- ]
(2) c HCl <
溶液稀释时pH的计算
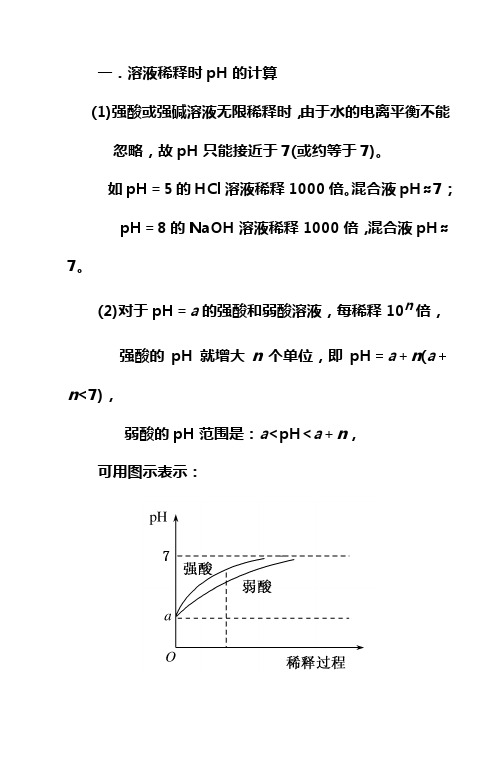
一.溶液稀释时pH的计算
(1)强酸或强碱溶液无限稀释时,由于水的电离平衡不
能忽略,故pH只能接近于7(或约等于7)。
如pH=5的HCl溶液稀释1000倍。
混合液pH≈7;
pH=8的NaOH溶液稀释1000倍,混合液pH≈7。
(2)对于pH=a的强酸和弱酸溶液,每稀释10n倍,
强酸的pH就增大n个单位,即pH=a+n(a+n<7),弱酸的pH范围是:a<pH<a+n,
可用图示表示:
从图像可以看出:
①强酸比弱酸pH改变快;
②当稀释同样倍数时,强酸pH变化大于弱酸;
③当稀释至pH相同时,弱酸稀释的倍数大。
3)对于pH =b 的强碱和弱碱溶液, 每稀释10n
倍, 强碱的pH 减小n 个单位,即pH =b -n (b -n >7), 弱碱的pH 的范围是:b -n <pH<b ,
可用图示表示。
从图像可以看出:
①强碱比弱碱pH 改变快;
②当稀释同样倍数时,强碱pH 变化大于弱碱; ③当稀释至pH 相同时,弱碱稀释的倍数大。
pH 计算记忆方法:
碱按碱,酸按酸,同强混合在中间, 异强混合看过量,无限稀释7
为限。
高中化学ph值计算公式

高中化学ph值计算公式
高中化学中计算pH值的公式为:pH=-lgc(H+),其中c(H+)为氢离子浓度。
另外,还有pOH=-lgc(OH-)和c(H+)=10-pH等公式,可以用于计算溶液
的pH值。
在计算过程中,需要注意温度和溶液体积的影响。
对于同一种电解质溶液,在室温条件下,pH+pOH=-lgKW=14。
当强酸和强碱溶液等体积混合时,若强酸和强碱溶液的pH之和等于14,则混合后的溶液呈现中性;若强酸
和强碱溶液的pH之和大于14,则混合后的溶液呈现碱性;若强酸和强碱
溶液的pH之和小于14,则混合后的溶液呈现酸性。
以上内容仅供参考,建议查阅高中化学教材或咨询化学老师获取更准确的信息。
溶液pH计算方法

溶液pH计算方法溶液的pH值是衡量溶液酸碱性强弱的重要指标,pH值的计算方法能够帮助我们了解溶液的性质。
在化学实验和工业生产中,我们经常需要对溶液的pH值进行准确测量,以便了解和控制溶液的性质,保证实验或生产的顺利进行。
本文将介绍几种常见的溶液pH计算方法,以帮助读者更好地理解和应用pH值的计算。
一、pH的概念和意义pH是指溶液中氢离子浓度的负对数,通常用来表示溶液的酸碱性程度。
在自然界和生活中,我们常常遇到酸性溶液、中性溶液和碱性溶液,它们的pH值分别在0-7、7和7-14范围内。
pH值的计算能够帮助我们了解溶液的化学性质,包括其对其他物质的溶解性、化学反应的方向和速率等。
在生活中,我们经常使用pH计来测试饮用水、游泳池水等溶液的pH 值,以保证其安全和卫生。
二、pH值的计算方法1. pH值的计算公式溶液的pH值一般通过测定其氢离子浓度来计算。
其计算公式为:pH = -log[H+]其中[H+]表示溶液中的氢离子浓度,单位通常为摩尔/升(M)。
通过测定溶液的氢离子浓度,我们可以利用上述公式计算出溶液的pH值。
2. pH计的使用pH计是一种用来测定溶液pH值的仪器,能够通过测定溶液中的氢离子浓度来计算出pH值。
pH计的工作原理是利用玻璃电极和参比电极来测定溶液中的氢离子浓度,然后通过计算得出pH值。
在使用pH计时,我们需要注意以下几点:(1)保持电极干净:使用前要用纯水清洁电极,并在使用过程中保持电极的清洁,以免影响测定结果。
(2)校正电极:定期对pH计进行校正,以确保其测定结果准确可靠。
(3)选取适当的电极:根据测定溶液的性质选择不同类型的电极,以获得更加准确的测定结果。
下面我们通过一个简单的实例来演示如何计算溶液的pH值:某溶液的氢离子浓度为1.0 x 10-4 M,求其pH值。
根据上述计算公式,我们可以得出:pH = -log(1.0 x 10-4) = 4.0该溶液的pH值为4.0。
三、pH值的应用pH值的计算方法可以帮助我们更好地了解和应用溶液的化学性质,具有以下几个方面的应用:1. 实验研究在化学实验中,我们经常需要测定溶液的pH值,以便了解溶液的酸碱性质,选择适当的试剂和条件进行实验研究。
PH值计算换算方法

PH值计算换算方法PH值是指物质溶液中氢离子(H+)的浓度,是一个反映溶液酸碱性强弱的指标。
PH值的计算换算方法主要有两种,一种是根据溶液中氢离子浓度的公式计算,另一种是通过使用PH试纸或PH计来测量溶液的酸碱性。
第一种计算换算方法是根据溶液中氢离子浓度的公式计算PH值。
一般来说,PH值的范围是0-14,溶液的PH值越低,酸性越强;PH值越高,碱性越强;PH值为7时,溶液为中性。
计算PH值的公式为:PH = -log[H+]其中,[H+]表示溶液中氢离子的浓度。
例如,如果一个溶液中氢离子浓度为10^-3 mol/L,那么根据上述公式,可以计算PH值为:PH = -log(10^-3) = -(-3) = 3根据这个公式,可以计算得到不同浓度的溶液的PH值。
需要注意的是,这个公式是以10为底的对数计算,所以计算结果是负数。
当[H+]浓度为1 mol/L时,PH值为0;当[H+]浓度为10^-7 mol/L时,PH值为7,为中性。
另一种计算换算方法是使用PH试纸或PH计测量溶液的酸碱性。
PH试纸是一种可以测量PH值的试纸,根据试纸上的颜色变化可以确定溶液的酸碱性。
PH范围通常为1-14,每一个单位表示一个数量级的变化。
PH试纸的使用方法很简单,只需将试纸浸入溶液中,然后根据试纸的显示颜色与颜色对照表相比较,即可得到溶液的PH值。
PH计是一种精确测量PH值的仪器,它使用电极测量溶液中的氢离子浓度,并将其转化为PH值。
PH计具有高精度和灵敏度,可以测量宽范围的PH值。
它是一种广泛应用于实验室和工业生产中的测量仪器。
无论是使用计算公式还是使用PH试纸或PH计测量溶液的酸碱性,都需要注意以下几点:1.PH值的测量应该在室温下进行,因为温度对PH值的测量有一定的影响。
2.在进行PH值的测量之前,应该先将电极或试纸清洗干净,以防止被污染影响测量结果。
3.当使用PH试纸时,应注意将其完全浸入溶液中,使其充分吸收溶液,从而获得准确的PH值。
溶液PH值的计算总结

溶液pH值的计算与规律的探讨溶液pH值问题涉及面广,与生活实际关系密切,内容多而繁杂,是高中阶段学习的重点和难点,尤其是pH值计算更是考试的热点。
因此,探讨pH值的计算方法和技巧,寻找解决问题的关键与规律,对于解决溶液pH问题具有重要意义。
一、单一溶液的pH的计算若是酸性溶液,应先确定c(H+),再进行pH的计算。
若是碱性溶液,应先确定c(OH-),再根据c(H+)·c(OH-)=Kw换算成c(H+), 求pH二、溶液稀释后的pH的计算1、强酸或强碱的稀释在稀释强酸或强碱时,当浓度大于10-5mol/L时,不考虑水的电离如pH=6的盐酸,稀释100倍后,p H≈7(不能大于7);pH=8的NaOH溶液,稀释100倍后,p H≈7(不能小于7);pH=3的盐酸,稀释100倍后,pH=5;pH=10的NaOH溶液,稀释100后,pH=82、弱酸或弱碱的稀释(1) 强酸或强碱的稀释在稀释强酸或强碱时,当它们的浓度大于10-5mol/L时,不考虑水的电离;当它们的浓度小于10-5mol/L时,应考虑水的电离。
如pH=6的盐酸,稀释100倍,稀释后pH≈7(不能大于7);pH=8的氢氧化钠溶液,稀释100倍,稀释后pH≈7(不能小于7);pH=3的盐酸,稀释100倍,稀释后pH=5;pH=10的氢氧化钠溶液,稀释100倍,稀释后pH=8。
(2) 弱酸或弱碱的稀释在稀释弱酸或弱碱过程中既有浓度的变化,又有电离平衡的移动,不能求得具体数值,只能确定其PH范围。
如pH=3的醋酸溶液,稀释100倍,稀释后3<pH<5;pH=10的氨水,稀释100倍,稀释后8<pH<10;pH=3的酸溶液,稀释100倍,稀释后3<pH≤5;pH=10的碱溶液,稀释100倍,稀释后8≤pH<10。
(3) 总结pH=a的强酸与弱酸和pH=b的强碱与弱碱溶液,稀释10-n倍(相同倍数),溶液的PH及其变化情况如何如下表物质pH 稀释后溶液的pH强酸 a pH=a+n弱酸 a a<pH<a+n强碱 b pH=b-n弱碱 b b-n<pH<b如:PH=3的醋酸溶液,稀释100倍,稀释后3<pH<5;PH=10的氨水,稀释100倍,稀释后8<pH<10;(4)溶液稀释后pH变化曲线pH分别相同的强酸与弱酸或强碱与弱碱溶液稀释相同的倍数(10n),对应溶液pH变化曲线如下图所示。
溶液PH值的计算

c(H+) · c(OH-) 在 ℃时其值是_________ Kw=___________在25℃时其值是 1×10-14 × 溶液的pH值计算 溶液的 值计算 例2、25℃时,4mol/L的硫酸溶液的pH= 1 、求5×10,mol/L的硫酸溶液的 100 mL稀 分 25℃时 - 有 pH =412 的 NaOH 溶液 的硫酸溶液的pH= mol/ ,稀 1×10- 12的 NaOH溶液 ,, 25℃ pH= mol/L的氢氧化钠溶液 溶液100 mL, 例 3 25℃ 时 倍后, ,稀释 2倍后,pH= ,稀释 倍后, 稀释10 (溶液混合时忽略体积变化) ,稀释 稀释10 释102倍后,pH= 10; 溶液混合时忽略体积变化) 的pH= ,稀释104倍 别采取下列三种措施( 别采取下列三种措施 后,pH= 。 pH=11,则应加入水的体积是 若稀释10 倍后, pH=11,则应加入水的体积是 。 若稀释105倍后,pH= ,c(H+)/c(SO42-)= 若加水VmL VmL后 (1)若加水VmL后 _____mL; _____mL; 若加入pH 10的NaOH溶液100mL, pH= 溶液100mL (2)若加入pH=10的NaOH溶液100mL,则混合 后溶液的pH值为______ pH值为______; 后溶液的pH值为______; 若加入pH pH= HCl溶液100mL 溶液100mL 100mL, (3)若加入pH=2的HCl溶液200 ,则混合后 溶液pH值为______ pH值为______; 溶液pH值为______; NaCl溶液100mL, (4)若加入NaCl溶液100mL,则混合后溶液pH )若加入NaCl溶液100mL 则混合后溶液pH 值为______ ______; 值为______;
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
溶 液 PH 的 计 算 方 法内蒙古赤峰市松山区当铺地中学024045白广福众所周知,溶液的酸碱度可用c (H +)或c(OH -)表示,但当我们遇到较稀的溶液时,这时再用C (H +)或C(OH —)表示是很不方便的,为此丹麦化学家索伦森提出了PH.它的定义为氢离子浓度的负常用对数.PH=-lgc (H +)。
在高中阶段,以水的电离和溶液PH 计算为考查内容的试题能有效的测试考生的判断、推理、运算等思维能力;在近几年的高考试题中也是屡见不鲜。
下面介绍几种关于溶液PH 的计算方法。
1、单一溶液PH 的计算(1)强酸溶液:如H n A,设物质的量浓度为cmoL/L,则c (H +)=ncmoL/L, PH=-lgc(H +)= -lgnc例1、求0。
1 mo1/L 盐酸溶液的pH ?解析:盐酸是强酸,所以 0.1moL/L 盐酸的c (H +)为0.1moL/L ,带入PH=-lgc (H +)即得PH=1(2)强碱溶液,如B(OH)n,设溶液物质的量浓度为cmoL/L,则c (H +)=1410nc -moL/L,PH=-lgc(H +)=14+lgnc2、两两混合溶液的PH 计算(1)强酸与强酸混合由C (H +)混=112212()()c H V c H V V V ++++先求出混合后的C(H +)混,再根据公式求出PH 。
技巧一:若两强酸等体积混合,可用速算法:混合后的PH 等于混合前溶液PH 小的加0.3如:(2)强碱与强碱混合由c (OH —)混=112212()()c OH V c OH V V V --++先求出混合后C(OH -),再通过K w 求出(H +). 技巧二:若两强碱溶液等体积混合,可采用速算法:混合扣溶液的PH 等于混合前溶液PH 大的减去0。
3。
例2、(93年高考题)25mLPH=10的氢氧化钾溶液跟50mLPH=10的氢氧化钡溶液混合,混合液的PH 是( )A、9。
7 B 、10 C 、10.3 D 、10.7解析:根据技巧二、可得出答案为B(3)强酸与强碱混合强酸与强碱混合实质为中和反应,可以有以下三种情况:①若恰好中和,PH=7。
例3、(04年全国新老课程11题)1体积pH=2。
5的盐酸与10体积某一元强碱溶液恰好完全反应,则该碱溶液的pH 等于( )A 。
9.0B 。
9.5C 。
10。
5D 。
11。
0解析:因为是恰好中和,则中和后溶液的PH=7,设碱的PH=X,则有2.5141101010X --⨯=⨯,解得X=10。
5,答案为C。
②若酸剩余,先求出中和后剩余的c(H +),再求出PH③若碱剩余,先求出中和后剩余的c (OH —), 再通过K w 求出c(H +),最后求PH。
3、溶液稀释后的PH求法(1)一般来说,强酸(强碱)溶液,每稀释为10倍体积,PH增大(减小)1个单位;对于弱酸(弱碱)溶液,每稀释为10倍体积,PH增大(减小)不足1个单位。
无论稀释多少倍,酸(碱)溶液的PH不能等于或大于(减小)7,只能趋近于7(考虑水的电离).(2)对于PH相同的强酸和弱酸(或强碱和弱碱)溶液稀释相同的倍数,强酸(或强碱)溶液的PH变化幅度大。
这是因为强酸(或强碱)已完全电离,随着加水稀释,溶液中H+(或OH-)数(除水电离的以外)不会增多,而弱酸(或弱碱)随加水稀释。
H+(或OH-)数还会增多.(3)对于相同物质的量浓度的强酸和弱酸(强碱或弱碱),稀释相同的倍数,PH的变化幅度不同,强酸(强碱)的PH变化大。
技巧三、已知酸和碱的PH之和,判断等体积混合后溶液的PH(25℃):(1)若强酸与强碱溶液的PH之和等于14,则混合后溶液显中性,PH=7.(2)若强酸与强碱溶液的PH之和大于14,则混合后溶液显碱性,PH>7。
(3)若强酸与强碱溶液的PH之的小于14,则混合后溶液显酸性,PH<7。
(4)若酸碱溶液的PH之和为14,酸碱中有一强、一弱,则酸、碱溶液混合后,谁弱显谁的性质。
例4、(06上海20)室温下,下列溶液等体积混合后,所得溶液的pH一定大于7的是A.0.1mol/L的盐酸和0。
1mol/L的氢氧化钠溶液B.0。
1mol/L的盐酸和0.1mol/L的氢氧化钡溶液C。
pH=4的醋酸溶液和pH=10的氢氧化钠溶液D。
pH=4的盐酸和pH=l0的氨水解析:A中盐酸的PH=1,氢氧化钠的PH=13,PH之和为14,等体积混合后,溶液的PH=7,A错误;B中盐酸的PH=1,氢氧化钡的PH=13。
3,PH之和为14.3,等体积混合后,溶液的PH>7,B正确;C项中醋酸是弱酸,氢氧化钠是强碱,所以醋酸是过量的,最终溶液显酸性,PH<7,C项错误;D中为氨水是弱碱,盐酸是强酸,最终溶液显碱性,PH>7;所以答案为BD。
以上介绍了关于几种关于溶液中PH的求法,希望对你会有所帮助.6.相同温度下等物质的量浓度的下列溶液中,pH值最小的是 ( C )A。
NH4Cl B。
NH4HCO3 C. NH4HSO4 D。
(NH4)2SO4(03上海化学)13.用0.01mol / L NaOH溶液完全中和pH=3的下列溶液各100 mL。
需NaOH溶液体积最大的是(03MCE 理综) ( D )A 盐酸B 硫酸C 高氯酸D 醋酸14.室温时,若0.1 mo1·L—1的一元弱碱的电离度为l%,则下列说法正确的是( A )A. 该溶液的pH=11B.该溶液的pH=3C.加入等体积0.1 mo1·L-1 HCI后所得溶液的pH=7(00广东)D. 加入等体积0。
1 mo1·L-1 HCI后所得溶液的pH>77.pH=5的盐酸和pH=9的氢氧化钠溶液以体积比11∶9混合,混合液的pH ( C )A。
为7.2 B。
为8 C. 为6 D. 无法计算(00广东) 18.pH=13的强碱溶液与pH=2的强酸溶液混合,所得混合液的pH=11,则强碱与强酸的体积比是( D )A. 11∶1 B。
9∶1 C. 1∶11 D. 1∶9(98MCE)20.某强酸溶液pH=a,强碱溶液pH=b,已知a+b=12,酸碱溶液混合后pH=7,则酸溶液体积V(酸)和碱溶液体积V(碱)的正确关系为 ( B )A. V(酸)= 102V(碱) B。
V(碱)= 102V(酸) (98上海)C。
V(酸) = 2V(碱) D. V(碱)= 2V(酸)解析:根据酸碱溶液混合后pH=7,有10—a V(酸)=10b-14V(碱),代入a+b=12,则有V(碱)=102V(酸).29.某一元强酸稀溶液和某一弱碱稀溶液等体积混合后,其pH等于7.0,则以下叙述正确的是( BC )A。
酸溶液的物质的量浓度大于碱溶液B. 酸溶液中H+的浓度大于碱溶液中OH—的浓度(94上海)C。
酸溶液的物质的量浓度小于碱溶液的物质的量浓度D。
酸溶液中H+的浓度小于碱溶液中OH-的浓度E. 两种溶液的物质的量浓度相等解析:一元强酸稀溶液和某一弱碱稀溶液等体积混合后生成强酸弱碱盐,水解呈酸性。
若使溶液中的pH 等于7.0,必须是酸溶液中的H+ 浓度大于碱溶液中OH- 浓度,或酸溶液的物质的量浓度小于碱溶液的物质的量浓度。
28.把80 mL NaOH溶液加入到120 mL盐酸中,所得溶液的pH值为2.如果混合前NaOH溶液和盐酸的物质的量浓度相同,它们的浓度是 (90MCE ) ( C )A 。
0.5 mol / LB 。
0。
1 mol / L C. 0.05 mol / L D 。
1 mol / L18.某雨水样品刚采集时测得pH 为4。
82,放在烧杯中经2小时后,再次测得pH 为4.68,以下叙述正确的是 ( D )A. 雨水样品酸度逐渐减小(01上海综)B. 雨水样品酸度没有变化C. 雨水样品继续吸收空气中的CO 2D. 雨水样品中的H 2SO 3逐渐被空气中的氧气氧化成H 2SO 417.99 mL 0。
5 mol / L 硫酸跟101 mL 1 mol / L 氢氧化钠溶液混合后,溶液的pH 值为( C )A 。
0.4 B. 2 C 。
12 D 。
13.6 (89MCE)16.等体积混合0.10 mol / L 盐酸和0。
06 mol / L Ba (OH )2溶液后,溶液的pH 值等于( D )A. 2.0 B 。
12。
3 C. 1.7 D 。
12。
0(92MCE )22.60 mL 0.5 mol / L 氢氧化钠溶液和40 mL 0。
4 mol / L 硫酸相混合后,溶液的pH 约为 ( B )A 。
0。
5B 。
1。
7 C. 2 D. 13。
2(00春京)18.用0。
1 mol·L -1 NaOH 溶液滴定0.1 mol·L -1盐酸,如达到滴定的终点时不慎多加了1滴NaOH 溶液(1滴溶液的体积约为0。
05 mL),继续加水至50 mL,所得溶液的pH 是( C )A 。
4B 。
7。
2C 。
10 D. 11。
3(99MCE )21.c 1、c 2、a 1、a 2、pH 1、pH 2分别表示两种一元弱酸的物质的量浓度、电离度和溶液的pH.如果已知pH 1>pH 2,a 1>a 2,则c 1和c 2的关系 ( C )A 。
为c 1>c 2 B. 为c 1=c 2 C. 为c 1<c 2 D. 无法确定(00春京)20.为更好地表示溶液的酸碱性,科学家提出了酸度(AG )的概念,AG =)OH ()H (lg -c c +,则下列叙述正确的是 ( AD )A. 中性溶液的AG =0(01上海)B. 酸性溶液的AG <0C. 常温下0。
l mol / L 氢氧化钠溶液的AG =12D 。
常温下0。
l mol / L 盐酸溶液的AG =129.有人曾建议用AG 表示溶液的酸度(acidity grade),AG 的定义为AG =lg )OH ()H (--c c +。
下列表述正确的是( D )A. 在25℃时,若溶液呈中性,则pH =7,AG =1(02MCE 理综)(03天津)B. 在25℃时,若溶液呈酸性,则pH <7,AG <0C. 在25℃时,若溶液呈碱性,则pH >7,AG >0D 。
在25℃时,溶液的pH 与AG 的换算公式为AG =2(7-pH )14.将硫酸钾、硫酸铝、硫酸钾铝三种盐混合溶于硫酸酸化的水中,测得c (SO 42-)=0.105mol / L,c (Al 3+)=0。
055 mol / L ,溶液的pH =2.0(假设溶液中H 2SO 4完全电离为H +和SO 42-),则c (K +)为 (98上海) ( B )A. 0。
045 mol / L B 。
0。
035 mol / L C. 0。
