IV型胶原测定试剂盒(化学发光免疫分析法)产品技术要求huadajibiai
人绒毛膜促性腺激素(HCG)测定试剂盒(化学发光免疫分析法)产品技术要求yuande

人绒毛膜促性腺激素(HCG)测定试剂盒(化学发光免疫分析法)产品技术要求yuande人绒毛膜促性腺激素(HCG)测定试剂盒(化学发光免疫分析法)适用范围:本产品用于体外定量测定人血清或血浆中的HCG的含量。
1.1 产品规格试剂盒规格为48人份/盒、96人份/盒。
1.2 主要组成成分表1 人绒毛膜促性腺激素(HCG)测定试剂盒(化学发光免疫分析法)主要组成成分不同批号试剂盒中的相同组分不能互换a) 酶结合物以含牛血清白蛋白的缓冲液配制的联接HRP的HCG单克隆抗体,其中含ProClin300做为防腐剂。
b) 校准品校准品主要以小牛血清为稀释液,其中含ProClin300做为防腐剂,校准品A~F 中含HCG的目标浓度分别约为0、5.0 IU/L、20 IU/L、80 IU/L、400IU/L、2000 IU/L。
校准品具体浓度详见标签及试剂盒参数IC卡。
c) 发光液发光液A主要成份为鲁米诺,发光液B主要成份为过氧化脲,两者均以pH8.6的Tris-HCl缓冲液配制。
d) 包被微孔板包被有HCG单克隆抗体的白色聚苯乙烯微孔板,用铝箔袋真空包装。
e) 质控品(备选)以正常人血清为基质制备的冻干品,其中含ProClin300做为防腐剂,其靶值浓度范围QCⅠ(8.00 IU/L~15.00 IU/L)QCⅡ(100.00 IU/L~150.00 IU/L)。
质控品具体浓度详见质控品参数表。
2.1 外观a)液体组分应澄清,无沉淀或絮状物,实际装量应不小于标示装量;b)冻干组分呈白色或淡黄色疏松体,加水后应在3分钟内完全溶解;c)所有组分均无包装破损,标示清楚。
2.2 准确度试剂盒内校准品与相应浓度的国家标准品(编号:150555)同时进行分析测定,用双对数模型拟合,要求两条剂量-反应曲线不显著偏离平行(t检验);以国家标准品为对照品,试剂盒校准品的实测效价与标定效价的比应在0.900~1.100之间。
2.3剂量—反应曲线的线性用双对数数学模型拟合,在[5.0,500 ]IU/L范围内,剂量-反应曲线相关系数(r)的绝对值应不低于0.9900。
总I型胶原氨基端延长肽(Total-P1NP)测定试剂盒(电化学发光免疫分析法)产品技术要求北京联众泰克

总I型胶原氨基端延长肽(Total-P1NP)测定试剂盒(电化学发光免疫分析法)组成:试剂盒由磁分离试剂(M)、试剂a(Ra)、试剂b(Rb)和定标品(Total-P1NP-Cal)(选配)组成。
组成及含量见下表:预期用途:本试剂盒用于体外定量测定人体血清样本中总I型胶原氨基端延长肽(Total-P1NP)的含量。
2.1 外观2.1.1 试剂盒各组分应齐全、完整、液体无渗漏;2.1.2 磁分离试剂摇匀后应为棕色含固体微粒的均匀悬浊液,无明显凝集、无絮状物;2.1.3 其它液体组分应澄清,无异物,沉淀物或絮状物;2.1.4 包装标签应清晰、无磨损、易识别。
2.2 空白限应不大于5.00μg/L。
2.3 准确度将已知浓度的Total-P1NP标准溶液加入到血清中,其回收率应在(85%~115%)范围内。
2.4 线性在[20.0,1200.0]μg/L范围内,线性相关系数(r)应不小于0.9900。
2.5 精密度2.5.1重复性在试剂盒的线性范围内,检测高低两个水平的样品,检测结果的变异系数(CV)应不大于8%。
2.5.2 批间差在试剂盒的线性范围内,用3个批号试剂盒分别检测高低两个水平的样品,检测结果的变异系数(CV)应不大于15%。
2.6 效期末稳定性本产品效期为15个月,试剂盒在2~8℃下保存至有效期末进行检测,检测结果应符合2.1、2.2、2.3、2.4、2.5.1的要求。
2.7 溯源性依据GB/T21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》的要求提供总I型胶原氨基端延长肽(Total-P1NP)定标品的来源、赋值过程以及测量不确定度等内容,定标品溯源至企业工作校准品。
心脏型脂肪酸结合蛋白(H-FABP)测定试剂盒(化学发光免疫分析法)产品技术要求tongxin
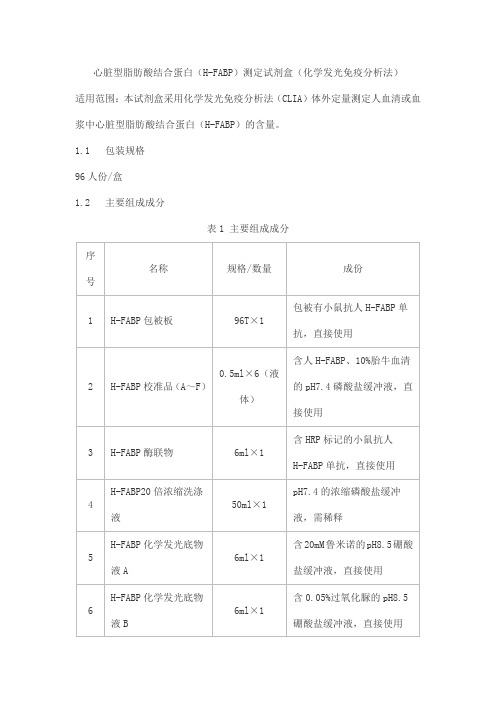
心脏型脂肪酸结合蛋白(H-FABP)测定试剂盒(化学发光免疫分析法)适用范围:本试剂盒采用化学发光免疫分析法(CLIA)体外定量测定人血清或血浆中心脏型脂肪酸结合蛋白(H-FABP)的含量。
1.1 包装规格96人份/盒1.2 主要组成成分表1 主要组成成分注:校准品溯源至同位素稀释质谱法,校准品(A~F)目标浓度为0、3、10、30、80、160ng/ml。
2.1 外观组分齐全、完整,液体无渗漏,微孔板包装袋无破损、漏气现象;标签应清晰,易识别。
2.2 装量液体装量应不少于标示值。
2.3 准确度在剂量反应曲线检测范围内,用已知浓度的纯品做回收试验,其回收率应在85~115%范围内。
2.4 线性在线性范围 [2.5,160]ng/ml内,剂量反应曲线相关系数(r)的绝对值应不低于0.9900。
2.5 空白限应不大于2.5ng/ml。
2.6 重复性变异系数(CV)应不大于10.0%。
2.7 批间差批间变异系数(CV)应不大于15.0%。
2.8 分析特异性测定浓度为300ng/ml人肝脏型脂肪酸结合蛋白(L-FABP),交叉反应率小于2.5%。
2.9 稳定性产品在2~8℃条件下保存有效期为12个月,取到效期产品在1个月内进行检测,检测结果应满足2.3~2.6,2.8项要求。
术语4.1 CLIA:Chemiluminescent immunoassay化学发光免疫分析4.2 H-FABP:Heart-type Fatty Acid-Binding Protein心脏型脂肪酸结合蛋白4.3 RLU:Relative Light Unit相对光单位。
游离甲状腺素(FT4)测定试剂盒(化学发光免疫分析法)产品技术要求爱康试剂

游离甲状腺素(FT4)测定试剂盒(化学发光免疫分析法)性能指标2.性能指标2.1试剂盒性能指标2.1.1外观试剂盒各组分应齐全、完整,液体无渗漏,标签应清晰、易识别;试剂条中第7孔内组分应为棕色含固体微粒的液体或含棕色固体沉淀的透明液体;第12孔内化学发光底物应为无色或淡绿色液体;其余皆应为无色透明液体,无悬浮物、无沉淀、无絮状物。
2.1.2检出限应小于或等于3.0pmol/L。
2.1.3准确度使用准确度参考品进行测试,实测值与标示值的相对偏差应在±10.0%以内。
2.1.4线性范围试剂盒在3.0pmol/L~77.2pmol/L区间内,其线性相关系数(r)应不小于0.9900。
2.1.5重复性变异系数(CV)应不大于10.0%。
2.1.6批间差变异系数(CV)应不大于15.0%。
2.17 特异性对浓度不低于200ng/mL的3.5.3’-三碘甲腺原氨酸、100ng/mL的3.3.5’-三碘甲腺原氨酸以及200ng/mL的3.3’-二碘甲腺原氨酸样本进行测定,其测定结果应不高于3.0pmol/L。
2.2校准品性能指标2.2.1外观校准品CAL1、CAL2应为淡黄色或无色透明液体,无悬浮物、无沉淀、无絮状物。
2.2.2装量校准品CAL1、CAL2装量偏差应在±10.0%之内。
2.2.3准确度游离甲状腺素(FT4)校准品,测试结果偏差应在±10.0%之内。
2.2.4均一性对同一瓶校准品1、校准品2分别重复10次检测,对同一批次10瓶校准品1、校准品2进行检测,检测校准品1、校准品2瓶内差CV应≤10.0%,批内瓶间差CV应≤10.0%。
2.3质控品性能指标2.3.1外观质控品应为淡黄色或无色透明液体,无悬浮物、无沉淀、无絮状物。
2.3.2装量质控品装量偏差应在±10.0%之内。
2.3.3准确度游离甲状腺素(FT4)质控品,测试结果应在靶值范围内。
2.3.4均一性对同一瓶质控品重复10次检测,对同一批次10瓶质控品进行检测,检测瓶内差CV应≤10.0%,批内瓶间差CV应≤10.0%。
透明质酸(HA)测定试剂盒(电化学发光免疫分析法)产品技术要求北京联众泰克
透明质酸(HA)测定试剂盒(电化学发光免疫分析法)适用范围:本试剂盒用于体外定量测定人体血清样本中透明质酸(HA)的含量。
1.1包装规格: 50人份/盒、100人份/盒。
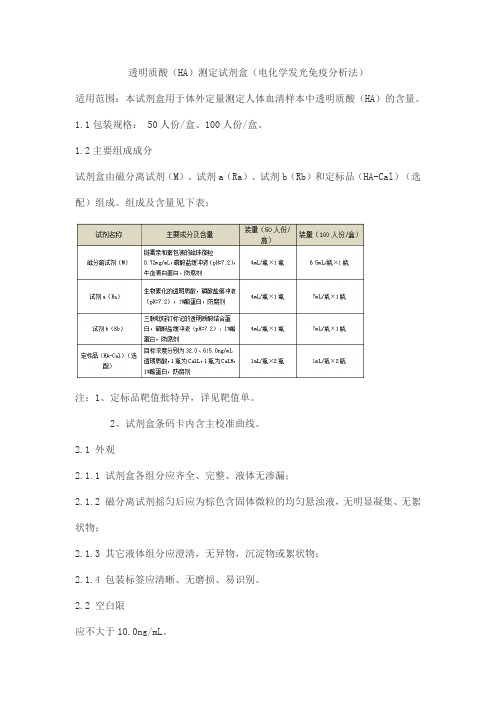
1.2主要组成成分试剂盒由磁分离试剂(M)、试剂a(Ra)、试剂b(Rb)和定标品(HA-Cal)(选配)组成。
组成及含量见下表:注:1、定标品靶值批特异,详见靶值单。
2、试剂盒条码卡内含主校准曲线。
2.1 外观2.1.1 试剂盒各组分应齐全、完整、液体无渗漏;2.1.2 磁分离试剂摇匀后应为棕色含固体微粒的均匀悬浊液,无明显凝集、无絮状物;2.1.3 其它液体组分应澄清,无异物,沉淀物或絮状物;2.1.4 包装标签应清晰、无磨损、易识别。
2.2 空白限应不大于10.0ng/mL。
2.3 准确度将已知浓度的HA标准溶液加入到血清中,其回收率应在(85%~115%)范围内。
2.4 线性在[20.0,1000.0] ng/mL范围内,线性相关系数(r)应不小于0.9900。
2.5 精密度2.5.1 分析内精密度在试剂盒的线性范围内,浓度为(100.0±20.0ng/mL)和(300.0±60.0ng/mL)的样品检测结果的变异系数(CV)应不大于8%。
2.5.2 批间精密度在试剂盒的线性范围内,用3个批号试剂盒分别检测浓度为(100.0±20.0ng/mL)和(300.0±60.0ng/mL)的样品,检测结果的变异系数(CV)应不大于15%。
2.6 效期末稳定性本产品效期为15个月,试剂盒在2~8℃下保存至有效期末进行检测,检测结果应符合2.1、2.2、2.3、2.4、2.5.1的要求。
2.7 特异性试剂盒与表1中有关潜在交叉反应物应无显著的交叉反应表1 交叉反应2.8 溯源性依据GB/T 21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》的要求提供透明质酸(HA)定标品的来源、赋值过程以及测量不确定度等内容,定标品溯源到企业工作校准品。
总甲状腺素(T4)测定试剂盒(化学发光免疫分析法)产品技术要求深圳华迈兴微医疗

总甲状腺素(T4)测定试剂盒(化学发光免疫分析法)2.性能指标2.1外观试剂盒上标签标识内容应清晰,无磨损;试剂盒内各组份齐全、完整,液体无渗漏;试剂盒无破损,试剂盒中液体澄清、无沉淀物和絮状物。
试剂盒各组分外观和性状为:Rm 应为含棕色固体微粒的液体,无板结、无絮状物;Rb、Rd、Ra/c、清洗液和发光液均应为清澈透明的液体,无沉淀、无絮状物。
校准品和质控品冻干组分呈疏松体,加入纯化水后应在10min 内完全溶解,溶液无沉淀或絮状物。
2.2装量试剂盒内各组分装量不少于标示量。
2.3线性在5.0ng/mL~248.6ng/mL 范围内,用lg-logit 数学模型拟合或其它适当的数学模型拟合,剂量-反应曲线线性相关系数的绝对值(|r|)≥ 0.9900。
2.4最低检出限本试剂盒的最低检出限:≤5.0ng/mL。
2.5准确度在试剂盒规定的测量范围内检测两个不同浓度的国家标准品或正确度控制品,其实测值与理论值之比应在0.850~1.150 之间。
2.6重复性试剂盒质控品测定结果的变异系数(CV)应不大于8.0%。
2.7批间差在3 个不同批次产品之间,质控品测定结果的变异系数(CV)应不大于15%。
2.8特异性浓度不低于500ng/mL 的三碘甲状腺原氨酸(TT3),在本试剂盒上的测定结果应不高于15.0ng/mL。
浓度不低于50ng/mL 的反三碘甲状腺原氨酸(rT3),在本试剂盒上的测定结果应不高于15.0ng/mL。
2.9校准品均一性校准品A 和B 瓶间变异系数(CV)应不大于10%,校准品C 瓶间变异系数(CV)应不大于20%。
2.10校准品准确度校准品A 和B 测量结果的相对偏差应在±10%范围内,校准品C 浓度应不大于5.0ng/ml。
2.11质控品均一性质控品瓶间变异系数(CV)应不大于10%。
2.12质控品测定值以质控品作为样本进行检测,其检测结果应在试剂盒规定的范围内。
血栓调节蛋白测定试剂盒(化学发光免疫分析法)产品技术要求万孚
2性能指标
2.1外观
外观应符合如下要求:
a)磁珠包被物R1 摇匀后应为棕褐色悬浊液;静止久后,棕褐色磁珠沉降于底部,上清液应为无色液体;酶标记物R2 应为无色液体,无沉淀或絮状物;校准品应为外观均匀,成形完整,呈乳白色的冻干品,复溶后较清亮,无浑浊及沉淀;
b)试剂盒各组分应齐全、完整,液体无渗漏;
c)中文包装标签清晰,无磨损。
2.2准确度
将两个正确度控制品进行检测,测定结果的相对偏差在±10%范围内。
2.3空白限
空白限不大于 1.0 TU/mL;
2.4线性
试剂盒在 1.0~200 TU/mL 区间内,其相关系数(r)的绝对值不低于0.9900。
2.5重复性
变异系数CV≤8.0%。
2.6批间差
变异系数CV≤10.0%。
2.7校准品
2.7.1校准品准确度
测定校准品,测定结果的相对偏差在±10%范围内。
2.7.2校准品瓶内均一性
校准品瓶内均一性≤8.0%。
2.7.3校准品瓶间均一性
校准品瓶间均一性≤5.0%。
组织纤溶酶原激活物—纤溶酶原激活物抑制剂—1复合物测定试剂盒(化学发光免疫分析法)产品技术要求
医疗器械产品技术要求编号:
组织纤溶酶原激活物-纤溶酶原激活物抑制剂-1复合物测定试剂盒(化学发光免疫分析法)
2 性能指标
2.1 外观
外观应符合如下要求:
a)磁珠包被物R1摇匀后应为棕褐色悬浊液;静止久后,棕褐色磁珠沉降于底部,上清液应为无色液体;酶标记物R2应为无色液体,无沉淀或絮状物;校准品应为外观均匀,成形完整,呈乳白色的冻干品,复溶后较清亮,无浑浊及沉淀;
b)试剂盒各组分应齐全、完整,液体无渗漏;
c)中文包装标签清晰,无磨损。
2.2准确度
将两个正确度控制品进行检测,测定结果的相对偏差在±10%范围内。
2.3空白限
空白限不大于1.0 ng/mL;
2.4线性
试剂盒在1.0 ng/mL~100 ng/mL区间内,其相关系数(r)的绝对值不低于0.9900。
2.5重复性
变异系数CV≤8.0%。
2.6批间差
变异系数CV≤10.0%。
2.7校准品
2.7.1校准品准确度
测定校准品,测定结果的相对偏差在±10%范围内。
2.7.2 校准品瓶内均一性
校准品瓶内均一性≤8.0%。
2.7.3 校准品瓶间均一性
校准品瓶间均一性≤5.0%。
III型前胶原N端肽测定试剂盒(化学发光免疫分析法)产品技术要求lianzhongtaike
III型前胶原N端肽测定试剂盒(化学发光免疫分析法)适用范围:用于体外测定人血清中III型前胶原N端肽的含量。
1.1产品型号划分说明
规格:96人份/盒
2.1 外观
2.1.1 试剂盒各组分应齐全、完整、液体无渗漏;
2.1.2 液体组分应澄清,无沉淀或絮状物;
2.1.3 包装标签应清晰,易识别;
2.1.4 各组分装量不得低于标示体积。
2.2 准确度
回收率应在 85%-115%范围内。
2.3 空白限
应不大于 1.0ng/mL。
2.4 线性
在[2.5, 100] ng/mL 的测量范围内,相关系数 r 应≥0.9900。
2.5 重复性
变异系数(CV)应不大于 10%。
2.6 批间差
变异系数(CV)应不大于 15.0%。
2.7试剂盒与表2中有关潜在交叉反应物应无显著的交叉反应
2.8稳定性
该试剂盒在2~8℃贮存,有效期为12个月,取到效期后的试剂盒样品进行检测,检测结果应符合2.2、2.3、2.4、2.5的要求。
2.9溯源性:
依据GB/T21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》的要求,校准品溯源到安图的校准品,详见附录A。
总甲状腺素(T4)测定试剂盒(化学发光免疫分析法)产品技术要求lianzhongtaike
总甲状腺素(T4)测定试剂盒(化学发光免疫分析法)适用范围:用于体外定量测定人血清中总甲状腺素(T4)的含量。
1.1规格:96人份/盒。
1.2主要组成成分2.1外观试剂盒应组分齐全,内外包装均应完整,标签清晰,液体试剂无渗漏。
2.2 线性在[20,320]ng/mL范围内,用lg-logit数学模型拟合或其他适当的数学模型拟合,剂量-反应曲线相关系数(|r|)应不低于0.9900。
2.3 最低检测限最低检测限应不大于5.0ng/mL。
2.4准确度试剂盒校准品与相应浓度的国家标准品同时进行分析测定,用lg-logit或其他适当的数学模型拟合,要求两条剂量-反应曲线不显著偏离平行;以总甲状腺素国家标准品为对照品,试剂盒内校准品的实测值与标示值的效价比应在0.900-1.100之间。
2.5 精密度2.5.1 分析内精密度在试剂盒的线性范围内,检测高、低值样品,各重复检测10次,其变异系数(CV)应不大于8%。
2.5.2 批间精密度用3个批号试剂盒检测高、低值样品,则3个批号试剂盒之间的变异系数(CV)应不大于15%。
2.6 特异性2.6.1 与总三碘甲状腺原氨酸(T3)浓度不低于500ng/mL的T3在本试剂盒上的测定结果应不高于15ng/mL。
2.6.2 与反三碘甲状腺原氨酸(rT3)浓度不低于50ng/mL的rT3在本试剂盒上的测定结果应不高于15ng/mL。
2.7溯源性依据GB/T21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》的要求,校准品溯源到国家标准品(编号150551)。
2.8稳定性效期末稳定性:本产品效期为12个月,试剂盒在2~8℃下保存至有效期末进行检测,检测结果应符合2.1、2.2、2.3、2.4、2.5.1的要求;。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
IV型胶原测定试剂盒(化学发光免疫分析法)
适用范围:本试剂盒用于体外定量测定人血清中IV型胶原(C-IV)的含量。
1.1包装规格:96人份/盒
1.2主要组成成分
表1 主要组成成分
组成 成分 数量 规格
化学发
光包被板 含鼠抗人C-Ⅳ单克隆抗体的包被板 1块 96孔/块
校准品 含不同浓度C-Ⅳ的小牛血清,0.05%的防腐剂Proclin300(目标浓度为:0、46、106、227、584、1075 μg/L) 6瓶 (6水
平)
0.5 mL/
瓶
质控品
含C-IV的血清(低值质
控品:34-59 μg/L、高值质控品:438-742 μg/L) 2瓶(2水平) 0.5 mL/
瓶
标记物 含辣根过氧化物酶标记的鼠抗C-IV单克隆抗体,0.05%的防腐剂Proclin300 1瓶 6 mL/瓶
化学发光底物A 含有0.5 mmol/L过氧化
氢的溶液,pH 4.9-5.1
1瓶 6 mL/瓶
化学发光底物B 含有1 mmol/L鲁米诺的
溶液,pH 9.5
1瓶 6 mL/瓶
浓缩洗涤液 含有5%Tween20的PBS溶
液
1瓶 30 mL/瓶
注:校准品和质控品具有批特异性,具体浓度见瓶签。
2.1 外观
2.1.1试剂(盒)各组份应齐全、完整,液体应为透明溶液,无渗漏,无混浊,
无未溶解物;
2.1.2包装标签应清晰,无磨损。
2.2. 准确度
回收率应在85%-115%范围内。
2.3 空白限
试剂盒的空白限应不大于23.0 μg/L。
2.4 线性
在[46,1075] μg/L线性范围内,试剂盒的相关系数r应不低于0.990。
2.5 重复性
批内变异系数(CV)应不大于15.0%。
2.6 批间差
批间变异系数(CV)应不大于20.0%。
2.7 稳定性
2℃-8℃保存,有效期12个月,取失效期的试剂盒检测其准确度、空白限、线
性和重复性,应符合2.2-2.5的要求。
2.8 校准品溯源性
应根据GB/T 21415—2008《体外诊断医疗器械生物样品中量的测量校准品和控
制物质赋值的计量学溯源性》及有关规定,提供所用企业产品校准品来源、赋值
过程以及测量不确定度等内容,校准品溯源至企业工作校准品,工作校准品与已
上市产品比对赋值。
