中国水华蓝藻的新记录属——拟浮丝藻属(Planktothricoides)
分类

各个门或纲的拉丁文名字,常见藻类的拉丁文名字(如:微囊藻、直链藻、小球藻……)蓝藻门Cyanophyta蓝藻纲Cyanophyceae色球藻目(Chroococcales):聚球藻Synechococcus sp、蓝球藻Chroococcus、Gloeocapsa粘球藻、Aphanocapsa隐球藻、Aphanothece 隐杆藻、粘杆藻Gloeothece、Microcystis微囊藻、Coelosphaerium腔球藻、Gomphosphaeria束球藻、Woronichinia乌龙藻(欧氏藻)、Snowella雪藻(小雪藻)宽球藻目(Pleurocapsales)颤藻目(Oscillatoriales):颤藻Oscillatoria、席藻Phormidium(胶鞘藻)、浮丝藻Planktothrix、Phormidium胶鞘藻、鞘丝藻Lyngbya、Planktolyngbya浮鞘丝藻、Pseudanabaena假鱼腥藻、Limnothrix湖丝藻(泽丝藻)、螺旋藻Spirulina、束毛藻Trichodesmium念珠藻目(Nostocales):鱼腥藻Anabaena、拟鱼腥藻Anabaenopsis、念珠藻Nostoc、Cylindrospermum柱孢藻、尖头藻Raphidiopsis、束丝藻Aphanizomenon(蓝针藻)、Scytonema伪枝藻、胶刺藻Gloeotrichia(顶孢藻)真枝藻目(Stigonematales):Stigonema真枝藻绿藻门绿藻纲团藻目:Chlamydomonas衣藻、Chloromonas拟衣藻、四鞭藻Carteria、长绿梭藻Chlorogonium、Volvox团藻、Eudorina空球藻、Pandorina 实球藻、Pleodorina杂球藻、Gonium盘藻、四孢藻目:四孢藻Tetraspora、四集藻Palmella、葡萄藻Botryococcus绿球藻目:卵囊藻Oocystis、小球藻Chlorella、栅藻Scenedesmus、十字藻Crucigenia、Tetrastrum四星藻、四角藻Tetraedron、蹄形藻属Kirchneriella、月牙藻属Selenastrum、小椿藻Characium、弓形藻Schroederia、纤维藻Ankistrodesmus、单针藻Monoraphidium、微芒藻Micractinium、多芒藻属Golenkinia、胶网藻Dictyosphaerium、四球藻Westella、盘星藻Pediastrum、水网藻Hydrodictyon、集星藻Actinastrum、空星藻Coelastrum、丝藻目:游丝藻Planctonema、微孢藻Planctonema、双胞藻属Geminella、鞘藻目:鞘藻Oedogonium、刚毛藻目:刚毛藻Cladophora、接合藻纲:Mougeotia转板藻、Spirogyra水绵属、Zygnema双星藻、Cylindrocystis柱孢鼓藻、Netrium梭形鼓藻、Spirotaenia螺带鼓藻、Closterium新月鼓藻、Pleurotaenium宽带鼓藻、Penium柱形鼓藻、Staurastrum角星鼓藻、Xanthidium多棘鼓藻、Cosmariumdepressum 扁鼓藻、Micrasterias微星鼓藻、Spondylosium顶接鼓藻、Hyalotheca圆丝鼓藻、Onychonema棘接鼓藻、Sphaerozosma瘤接鼓藻硅藻门DiatomCentricae中心纲圆筛藻目:Cyclotella小环藻、Coscinodiscus圆筛藻、Stephanodiscus冠盘藻、Melosira直链藻、Skeletonema骨条藻、Thalassiosira 海链藻、冠盖藻Stephanopyxis、细柱藻Leptocylindrus根管藻目:Rhizosolenia根管藻、盒形藻目:Attheya四棘藻、Biddulphia盒形藻、Chaetoceros角毛藻、双尾藻属Ditylum、漂流藻Planktoniella、三角褐指藻、Pennatae羽纹纲无壳缝目:Diatoma等片藻、Tabellaria平板藻、Asterionella星杆藻、Synedra针杆藻、Fragilaria脆杆藻、Achnanthes曲壳藻、Cocconeis卵形藻短壳藻目:Eunotia短缝藻单壳藻目:Achnanthes曲壳藻、Cocconeis卵形藻双壳藻目:Gomphonema异极藻、Didymosphenia双楔藻、Amphora双眉藻、Cymbella桥弯藻、Navicula舟形藻、Pinnuralia羽纹藻、Stauronei s辐节藻、Diploneis双壁藻、Gyrosigma双缝藻/布纹藻管壳藻目:Bacillaria硅杆藻、Epithemia窗纹藻/网眼藻、Nitzschia菱形藻、Hantzschia菱板藻/汉兹藻、Surirella双菱藻、Cymatopleura波纹藻甲藻门dinoflagellates薄甲藻Glenodinium、Peridinium多甲藻、Ceratium角甲藻、Gymnodinium裸甲藻XANTHOPHYTA黄藻门:Tribonema黄丝藻Chrysophyta金藻门:Dinobryon锥囊藻、Mallomonas鱼鳞藻隐藻门:隐藻Cryptomonas、蓝隐藻Chroomonas裸藻门:Euglena裸藻、Phacus扁裸藻、Trachelomonas囊裸藻、Strombomonas陀螺藻。
蓝藻水华爆发的关键内因

蓝藻水华爆发的关键内因作者:章立心来源:《中国科技教育》2018年第06期研究动机与思路我国巢湖、太湖、滇池、汉江和钱塘江都曾连年爆发大规模的蓝藻水华。
蓝藻水华爆发不仅破坏水体生态系统,危害水产养殖业和旅游业,还影响供水水质,对人类健康产生极大威胁。
对于蓝藻水华的产生,研究者们认为除了水体富营养化、高温和高光强等环境因素外,藻细胞上浮是蓝藻水华爆发的关键。
事实也表明,阻止藻细胞上浮能预防水华发生,而促使藻细胞沉降可以导致水华快速消退。
因此,对藻细胞上浮机制开展研究有助于预防和治理蓝藻水华的爆发。
铜绿微囊藻(Microcystis aeru-ginosa)是中国湖泊、水库等淡水系统中形成蓝藻水华的主要优势藻类,其分泌的微囊藻毒素对水生动物和人类具有极大毒性,极少量就能导致严重的肝损伤,甚至死亡。
在2015年7月,我在无锡旅游期间经历了铜绿微囊藻水华的爆发,亲眼目睹了在短短的时间内,藻细胞大规模从水体中浮出水面,形成色如绿色油漆的蓝藻水华(图1)。
为了弄清楚大量藻细胞如何能在短时间内聚集上浮的问题,我取了水华现场的水样带回研究。
着手研究前,通过查阅文献得知,铜绿微囊藻具有气囊,能利用气囊垂直迁移至有利于吸收光能的位置。
那么水华爆发时,藻细胞从水体中大量上浮至水面是否就是像鱼儿一样由这些类似鱼鳔的气囊调节的?除了气囊外,是否还有类似鱼鳍和鸟儿翅膀这样的装置帮助它们浮浮沉沉?带着这些疑问,我踏上了探秘之旅,在教师的帮助下,开展了一系列实验。
我的思路是首先观察气囊和细胞上浮的关系,其次利用扫描电镜观察细胞表面是否具有类似鱼鳍或鸟类翅膀的隐形结构帮助它们上浮。
如果有这种结构,就用生物化学的方法探明这种结构的物质本质。
实验方法上浮细胞和沉降细胞的气囊观察。
通过不同离心力分别从悬浮藻液和沉降藻液中分离获得处于不同水层的藻细胞,在显微镜下观察气囊的情况。
判定气囊和细胞浮沉的关系。
细胞表面结构的扫描电镜观察。
通过扫描电镜分别观察上浮和沉降藻细胞表面是否存在帮助细胞浮沉的结构。
藻

我国学者一般将藻类分为11门:蓝藻、红藻、隐藻、甲藻、金藻、黄藻、硅藻、褐藻、裸藻、绿藻、轮藻。
1.盘星藻属Pediastrum绿藻门水网藻科的一属。
植物体多数是由8、16、32个细胞构成的定形群体,细胞排列在一个平面上,大体呈星盘状;每个细胞内常有一个周位的盘状的色素体和一个蛋白核,有一个细胞核;细胞壁光滑,或具各种突出物,有的还具各种花纹。
中国已报道约10余种和10余变种。
是世界性的淡水藻类,浮游或附着于底栖生物上;湖泊、池塘、沟渠、稻田中常见,也有些生于潮湿土壤之上。
2.小球藻属(Chlorella)是绿藻门、绿藻纲、绿球藻目、小球藻科的一属。
该属分布于全世界,多生活于较小的浅水,各种容器、潮湿土壤、岩石和树皮上,也有一些海产种类。
易于人工大量培养。
小球藻能生活于其他动、植物体内,是构成地衣的几种绿藻之一,又能生活在草履虫、水螅和一些海绵动物的体内。
细胞内的蛋白质、脂肪和碳水化合物的含量都很高,又有多种维生素,因而可以作为饲料的一部分;近年来,又被考虑作为宇宙食物和气体交换的发生器,用于航天事业中;还设想从人工培养来扩大能源。
由於该属增殖迅速,富於蛋白质和维生素B族(一茶匙小球藻乾粉的营养价值和一盎斯牛排相当),因而有人研究它考虑作为地球上和外太空的食物,其味如利马豆。
「小球藻农场」(Chlorella farm, 提供食物、水和氧气的封闭系统)已在美国、日本、荷兰、德国和以色列建立成功。
小球藻能合成一种可抑制细菌生长的物质(小球藻素〔chlorellin〕),故能净化污水。
该属藉助於静止的生殖细胞(似亲孢子〔autospores〕)行无性生殖。
某些种(动物内生小球藻〔Zoochlorella〕)与低等动物共生。
常用於研究光合作用及净化污水脆杆藻属(Fragilaria)3.羽纹纲、等片藻目、等片藻科的1属。
壳面棱形至长椭圆形。
花纹左右对称,与纵轴垂直。
纵轴上拟壳缝不明显,无壳缝。
壳环面长方形。
浮游植物—黄藻的分类

绿胞藻纲
植物体为单细胞的鞭毛藻类。 无真正的细胞壁,外层只有 柔嫩的周质,因此能变形。
细胞常为背腹侧扁,背侧隆 起,腹侧平直,具1条纵沟。
鞭毛2条,游泳鞭毛向前, 拖曳鞭毛向后。
无眼点。
细胞前端具1个大的储蓄泡, 储蓄泡前端与胞咽相连,胞 咽开口于细胞顶端凹入处。
伸缩泡1~2个,位于储蓄泡 侧边。
中。
扁形膝口藻在我国较常见,常在温暖季节出现于肥水鱼池中。 大量繁殖时,形成云彩状水华,水色呈黄绿色,为鲢鳙的良
好饵料。
赤潮异弯藻
• 藻体单细胞 藻体单细胞,细胞裸露,易 变形,略呈椭圆形,长 8~25μm,宽6~15μm。 细胞腹部略凹,从此处伸出 2条不等长鞭毛,长者约为 细胞长的1.3倍,短者为细 胞长的0.7~0.8倍。
三、常见黄藻门植物
1.拟气球藻属
• 单细胞、球形、细胞壁薄,无“∪”形节片构造。
• 个体大小相差很大,大的细胞中央具1大而明显的液 泡。
• 幼细胞具1~2色素体,成熟后色素体为多数,椭圆 形、多角形或盘状,周生。
• 拟气球藻:浮游生活或潮湿土壤表面,动孢子具2条 不等长鞭毛。
2.海球藻属
• 细胞球形、个体大,直径大于500µm • 细胞壁由相等的两瓣组成,以边缘相连 • 色素体多个,侧生。 • 细胞的叶绿体常由原生质线连成网状 • 本种为暖水种,有时可大量分布于我国近海
我国南海、黄海、渤 海等有分布。
01 认识浮游植物
一、藻类的概述 二、认识蓝藻 三、认识硅藻 四、认识金藻 五、认识甲藻 六、认识裸藻 七、认识绿藻 八、认识黄藻 九、认识隐藻
02 认识浮游动物 03 认识底栖动物 04 认识大型水生植物
黄藻门的分类
一、分类Байду номын сангаас
滇池水华束丝藻(Aphanizomenon flos-aquae)对低氮的生理响应

滇池水华束丝藻(Aphanizomenon flos-aquae)对低氮的生理响应吴艳龙;郑凌凌;李林;殷大聪;代龚圆;宋立荣【摘要】通过对分离的滇池北部海埂湾春季蓝藻水华时期的两株水华束丝藻(Aphanizomenon flos-aquae)进行研究,探讨了滇池水华束丝藻在低浓度硝酸盐下的生长特征,以及无氮条件下藻丝异形胞的诱导分化过程与同氮能力.实验结果表明:两株水华束丝藻在各浓度硝酸盐中均能够生长,并且生物量能够增加到较高水平.硝态氮浓度高时水华束丝藻的生物量也较高,但是硝酸盐浓度超过0.5 mg/L时,各组生物量无显著性差异.无氮BG-11培养基培养条件下,水华束丝藻可以快速分化形成异形胞,含有异形胞的藻丝比例在3d以后即可达50%左右,最高可以达72%,之后开始下降,但是仍能维持较高比例.水华束丝藻在无氮条件下通过异形胞固定的氮元素从第7d开始逐渐增加,在生长43 d后,培养基中增加的氮浓度接近30 mg/L.【期刊名称】《湖泊科学》【年(卷),期】2014(026)001【总页数】6页(P131-136)【关键词】滇池;水华束丝藻;硝态氮;异形胞;固氮【作者】吴艳龙;郑凌凌;李林;殷大聪;代龚圆;宋立荣【作者单位】中国科学院水生生物研究所淡水生态与生物技术国家重点实验室,武汉430072;中国科学院大学,北京100049;中国科学院水生生物研究所淡水生态与生物技术国家重点实验室,武汉430072;中国科学院水生生物研究所淡水生态与生物技术国家重点实验室,武汉430072;长江水利委员会长江科学院,武汉430010;中国科学院水生生物研究所淡水生态与生物技术国家重点实验室,武汉430072;中国科学院水生生物研究所淡水生态与生物技术国家重点实验室,武汉430072【正文语种】中文蓝藻水华是世界范围内的热点研究问题,已报道的有几十个属的上百种蓝藻可以形成水华[1].出现最广泛、最常见的水华蓝藻为微囊藻属(Microcystis),因此微囊藻水华已经被广泛关注和深入研究[2].水华束丝藻(Aphanizomenon flos-aquae)也是一种水体中较常见的水华蓝藻种类,在世界各种类型的湖泊、水库、池塘等水域均有发生[3-6].水华束丝藻属于蓝藻门念珠藻科束丝藻属,是我国最早发现的束丝藻属种类,束丝藻水华在我国各地均有报道,并逐渐引起人们的广泛关注.1982年12月至1983年1月以及4月,东湖浮游植物水华经鉴定为水华束丝藻水华[7].杭州西湖1981年发生水华束丝藻水华,生物量高达67.73×107 cells/L,占浮游植物总量的98%,出现西湖历史上罕见的“黑水”[8].贵阳地区最大的人工湖泊红枫湖水库1998年3月-4月上旬出现罕见的大面积水华束丝藻水华最为典型,其间南湖水域表层0.5m左右形成藻浆[9].2002年起,湖北省通山县县城附近的一座小型水库——四斗朱水库连续几年在早春即开始发生严重束丝藻水华,富藻层厚度达4m,水华的唯一优势种为水华束丝藻[10].云南高原湖泊滇池2001-2009年调查研究发现,水华束丝藻与微囊藻属随季节演替,成为滇池蓝藻水华的两大优势种群[11-12].影响水华束丝藻发生水华的因素很多,如外部营养物质的输入、周边的生态环境、浮游动物种群、具漂浮能力的气囊、固氮异形胞、能够形成孢子、广泛的水温适应性等[4,6,13-15].浮游植物异形胞固氮对固氮蓝藻水华有重要影响,水体中磷营养充足、氮成为限制因子将导致固氮蓝藻水华的发生[16-20].湖泊、水库、池塘等生态系统中,可利用的氮浓度一般处于较低浓度水平,低氮甚至缺氮对水华束丝藻的生长及对氮的利用能力较少报道.了解水华束丝藻在低浓度氮以及无氮条件下的生长特征、异形胞发生格局以及固氮特征,对蓝藻水华的发生机制以及控制可以提供理论和技术指导.本实验以滇池水华束丝藻为研究对象,旨在通过研究滇池水华束丝藻在低浓度硝态氮条件下的生长特征,无氮条件下异形胞的形成过程及固氮能力,以期初步揭示在野外较低的氮浓度条件下,滇池水体中水华束丝藻生长过程中氮的生物学和生态学作用,了解氮在富营养化湖泊滇池水华束丝藻-微囊藻演替过程中的影响,为了解类似水体中固氮和非固氮蓝藻的演替提供新的认识.1 材料与方法1.1 藻种分离样品采自滇池北部海埂湾,其中水华束丝藻Aph1于2010年4月分离,Aph9于2011年3月分离.采样时,用1L有机玻璃采水器采集约30ml表层水,放于50ml样品瓶中,立即带回实验室进行纯种分离.藻种分离时,取少量新鲜湖水,置于灭菌载玻片上,在Olympus CX31型光学显微镜下用灭菌的巴斯德毛细管吸取单根藻丝,用无菌水清洗5次,再用无菌CT培养基[21]清洗3次后置于添加CT 培养基的12孔真空包装细胞培养板内.培养条件为:温度20±1℃、光暗比12h∶12h、光强20μE/(m2·s).分离的培养物在1个月左右生长成簇后,取少量培养物镜检是否为水华束丝藻,水华束丝藻藻株转接到含150ml CT培养基的三角瓶扩大培养,培养条件同上.两株藻种经中国科学院淡水藻种库进一步鉴定为水华束丝藻.藻种采集地(24°56′43″N,102°38′55″E)周围的理化参数为:水温15.1±0.36℃、pH 8.92±0.42、溶解氧7.65±0.14mg/L、透明度28.5±2.0cm、叶绿素a浓度121.2±39.6μg/L、溶解性反应磷浓度0.027±0.009mg/L、总溶解磷浓度0.037±0.010mg/L、总磷浓度0.332±0.056mg/L、总溶解氮浓度2.933±0.178mg/L、总氮浓度4.360±1.594mg/L.1.2 藻细胞培养与计数分离的水华束丝藻培养到一定生物量后转接至CT培养基,以对数生长期的水华束丝藻作为实验材料.水华束丝藻藻丝接种前用无氮培养基清洗3次,不进行氮饥饿处理直接作为材料接种于不同浓度的硝态氮培养基中,实验培养条件为:BG-11培养基[22]、温度20±1℃、光暗比为12h∶12h、光强30μE/(m2·s).每天手动摇动藻种两次并更换藻种在培养箱的位置.接种后,每隔两天取样一次,取样时间为9:00-11:00,在岛津1800分光光度计上于680nm处测定吸光度.藻丝以及异形胞数目在Olympus CX31型光学显微镜下直接用浮游植物计数框计数.整个实验过程中,分离和培养的水华束丝藻一直处于漂浮状态.1.3 理化参数的测定水体pH、溶解氧及水温的数据均在取样时使用YSI 550A(YSI, USA)现场测定,透明度通过塞氏盘测定,营养盐的测定采用文献[23]的方法.无氮培养基中水华束丝藻固定的氮以测定的总氮表示,其方法同上,所有玻璃器皿使用前于盐酸(1+9)中浸泡48h,然后用无氨水洗净.1.4 统计学方法数据绘图在Origin 8.0软件中完成,用SPSS 18.0进行One-way ANOVA 分析,P<0.05为显著相关.2 结果2.1 不同硝态氮浓度下水华束丝藻的生长特征两株水华束丝藻Aph1和Aph9分别接种于添加不同浓度(0、0.5、2、5、10、20mg/L,对照组BG-11含硝态氮约274mg/L)硝态氮的BG-110(不含硝态氮)培养基中. 结果表明(图1):随着培养时间的增加,水华束丝藻在各浓度硝态氮培养基中的生物量均逐渐增加. 两株水华束丝藻对不同浓度硝态氮的响应比较一致,即随着硝态氮浓度的升高,水华束丝藻的生长速率逐渐增加. 水华束丝藻在硝态氮浓度越高的培养基中,其达到稳定期的时间也越短. 水华束丝藻Aph1在生长约40d 后达到稳定,680nm处的吸光度为1.354,但是其在硝态氮浓度为20、10、5和2mg/L培养基中的生物量在45 d已经接近BG-11培养基中的生物量水平(P>0.05),0.5mg/L硝态氮中水华束丝藻生物量虽然与对照组差异比较显著(P<0.05),但其生物量也较高,并保持上升的趋势.无氮培养基中,水华束丝藻生长受到一定的抑制,生长相对比较缓慢,但是实验后期生物量也比较高,吸光度接近0.9.相比Aph1,Aph9生长潜力更大,即使培养45d其生物量仍然处于增长的趋势,在不同浓度的硝态氮培养基中,生物量均很高,仅无氮培养基中处理组的生物量与对照组存在显著差异(P<0.05).图1 不同硝态氮浓度对滇池水华束丝藻生长的影响Fig.1 The effects of different nitrate-nitrogen concentrations on the growth of A.flos-aquae isolated from Lake Dianchi图2 无氮诱导藻丝异形胞分化特征Fig.2 Heterocyst characteristics of A. flos-aquae induced in N-free status2.2 无氮诱导异形胞的分化图3 Aph9不同时期异形胞以及异形胞荧光特征Fig.3 Lightmicroscope ofheterocyst formation at different stages and autofluorescence of A. flos-aquae strain Aph9图4 两株水华束丝藻固氮特征Fig.4 Nitrogen fixation characteristics of the two strains of A. flos-aquae固氮蓝藻能够在缺氮环境下形成异形胞,固定大气中的氮气以适应氮胁迫.对分离的两株水华束丝藻进行无氮培养,诱导其异形胞的分化,发现水华束丝藻能够迅速分化形成异形胞,Aph9经过诱导后,第3d含有异形胞的藻丝即达到50%以上,第7d高达72%,之后维持较高的比例持续波动.Aph1诱导形成异形胞的总体趋势与Aph9非常相似,其形成异形胞的比例也很高,达50%以上.对照组BG-11培养基中初始时期含少量异形胞,可能是初期阶段收集藻丝过程中经历短暂的缺氮过程诱导所致,培养10d以后对照组完全没有异形胞形成(图2).由图3可见,水华束丝藻细胞能感受氮胁迫状态,缺氮能快速诱导形成异形胞.Aph9接种初期即观察到有部分藻丝形成异形胞,随着培养时间延长,异形胞的比例开始增加,培养后期也有大量的藻丝含有异形胞(图3A~D),但是,对照组BG-11培养的水华束丝藻几乎完全不含异形胞(图3E).Aph9藻丝上形成的异形胞具有明显不同的自发荧光特征,异形胞红色荧光比营养细胞弱,并且在与营养细胞结合的部分无荧光(图3F).2.3 水华束丝藻的固氮作用Aph1、Aph9接种于无氮培养基,测得不同培养时间培养基中的总氮,后期测得的总氮去除初始条件接种时期的氮即为水华束丝藻因固氮作用增加的氮.实验结果显示(图4):两株水华束丝藻培养基中氮含量增加趋势比较一致.在开始的1周内培养基中氮含量未见增加,从第7d开始稳步增加.随着培养时间的增加,培养基中因水华束丝藻固氮作用增强,总氮逐步增加.到实验后期,培养基中增加的总氮含量超过25mg/L.3 讨论氮是浮游植物生长所需的大量必需元素之一,它存在于所有组成蛋白质的氨基酸中,同时也是合成藻蓝蛋白、叶绿素a以及DNA等核酸的基本元素.藻类在氮饥饿胁迫条件下,藻蓝蛋白做为氮库降解,叶绿素a含量下降,光合作用降低,细胞代谢速率减缓[24],藻类最后可能死亡或者以类似休眠体或孢子的形式长期生存[25-26].蓝藻中具有明显固氮能力的种类,已作过研究或测定过固氮能力的约有160余种和变种,其中绝大多数属于念珠藻目中的种类,如念珠藻、鱼腥藻、束丝藻、单岐藻、眉藻等.固氮蓝藻在有氮的情况下不形成异形胞,只有当培养环境中缺乏可利用的氮源时,才开始分化异形胞.当细胞中缺乏可用的NH3时,导致α-酮戊二酸的大量积累,细胞内自由Ca2+浓度的升高,它们是氮饥饿程度的重要信号,诱导异形胞的分化.异形胞利用N2合成NH3,NH3通过谷氨酰胺合成酶-谷氨酸合成酶循环形成谷氨酰胺和谷氨酸,被转运到营养细胞中[27-29],供细胞生长和分化的需要.滇池分离的水华束丝藻不经氮饥饿处理直接接种于无氮BG-11培养基,能够诱导藻丝体异形胞的分化,含有异形胞的藻丝比例在第3d即可达到50%以上,表明水华束丝藻能快速应对缺氮胁迫.水华束丝藻在无氮培养基中生长的初期会受到一定程度的抑制,生长速率相比BG-11对照组低,但在后期生长差异减小,当添加的氮浓度达到0.5mg/L以上时,其生物量与BG-11对照组无显著差异.以上结果表明:在富营养化水体中可供利用的氮浓度高于0.5mg/L时,水华束丝藻等固氮蓝藻的生长可能不受氮营养的限制.氮在春季通常被认为是浮游植物生长的限制因子[30],滇池束丝藻水华在春季发生,除了水华束丝藻对低温有较强的适应性外,固氮作用可能在滇池水华束丝藻水华的发生过程中起到很重要的作用.Schindler等基于实验湖沼学研究提出了富营养化治理控磷是关键的观点[31-34],但是单一的控磷措施在很多湖泊中很可能失败,这些水体中磷在底泥和水体之间循环的速度很快,氮元素对蓝藻水华起着重要作用,如:阿波普卡湖、奥基乔比湖、太湖、东湖以及霞浦湖[30].营养盐添加实验表明,太湖冬、春季出现磷限制,夏、秋季出现氮限制,微囊藻水华维持需要的氮来源于新增加的氮以及先前的氮源[35].水华束丝藻即便在无氮培养基中生长,通过固氮作用增加的氮可达30mg/L,在水华束丝藻水华消退的过程中,释放的大量的氮可能成为其它非固氮蓝藻水华的诱发因子.滇池存在水华束丝藻-微囊藻的演替,结合野外条件下氮浓度的数据分析和水华束丝藻异形胞的形成特征,将可望揭示氮在滇池水华束丝藻-微囊藻演替过程中的作用,这将有助于阐明两种蓝藻演替中营养盐的驱动机制.国内诸多水体经常出现固氮蓝藻与非固氮蓝藻演替或者共同存在的现象,如洱海存在微囊藻、束丝藻和鱼腥藻;巢湖存在微囊藻与鱼腥藻之间的演替;太湖以微囊藻为主,但是同时也有束丝藻、鱼腥藻等固氮蓝藻存在.水体中的氮处于频繁动态变化中,进一步认识固氮蓝藻对氮的利用方式和机制将有助于揭示其水华的发生机制,并对固氮蓝藻与非固氮蓝藻的竞争及演替提供新认识.4 参考文献【相关文献】[1] 余博识,吴忠兴,朱梦灵等.水果湖湾蓝藻水华的形成及其对东湖影响的评价.水生生物学报,2008,32(2):286-289.[2] 吴忠兴,虞功亮,施军琼等.我国淡水水华蓝藻——束丝藻属新记录种.水生生物学报,2009,33(6):1140-1144.[3] Carmichael WW, Drapeau C, Anderson DM. Harvesting of Aphanizomenon flos-aquae Ralfs ex Born.& Flah.var.flos-aquae (Cyanobacteria) from Klamath Lake forhuman dietary use. Journal of Applied Phycology, 2000, 12: 585-595.[4] Tsujimura S, Ishikawa K, Tsukada H. Effect of temperature on growth of the cyanobacterium Aphanizomenon flos-aquae in Lake Biwa and Lake Yogo. Phycological Research, 2001, 49(4): 275-280.[5] Rücker J,Stükenb A, Nixdorfa B et al. Concentrations of particulate and dissolved cylindrospermopsin in 21 Aphanizomenon-dominated temperate lakes. Toxicon, 2007,50:800-809.[6] Üveges V, Tapolczai K, Krienitz L et al. Photosynthetic characteristics and physiological plasticity of an Aphanizomenon flos-aquae (Cyanobacteria,Nostocaceae) winter bloom in a deep oligo-mesotrophic lake (Lake Stechlin, Germany). Hydrobiologia,2012, 698(1): 263-272.[7] 林婉莲,刘鑫洲.武汉东湖浮游植物各种成份分析与沉淀物中浮游植物活体碳、氮、磷的测定.水生生物学报,1985,9(4):359-364.[8] 吴洁,虞左明.西湖浮游植物的演替及富营养化治理措施的生态效应.中国环境科学,2001,21(6):540-544.[9] 陈作州,陈椽,晏妮等.红枫湖水库浮游植物演变(1980-2006年)和富营养化趋势研究.贵州师范大学学报,2007,25(3):5-10.[10] 李敦海,刘景元,邢伟等.四斗朱水库蓝藻水华爆发成因分析及治理对策研究.环境科学与管理,2010,35(2):43-46.[11] Liu YM, Chen W, Li DH et al. First report of aphantoxins in China-water blooms of toxigenic Aphanizomenon flos-aquae in Lake Dianchi. Ecotoxicology and Environmental Safety, 2006, 65:84-92.[12] 张梅,李原,王若南.滇池浮游植物的生物多样性调查研究.云南大学学报,2005,27(2):172-176.[13] Yamamoto Y, Nakahara H. The formation and degradation of cyanobacterium Aphanizomenon flos-aquae blooms: the importance of pH, water temperature, and day length. Limnology,2005, 6:1-6.[14] Suikkanen S, Kaartokallio H,Hällf ors S et al. Life cycle strategies of bloom-forming filamentous cyanobacteria in the Baltic Sea. Deep Sea Research Part Ⅱ: Topical Studies in Oceanography, 2010, 57(3/4):199-209.[15] Yamamoto Y, Nakahara H. Life cycle of cyanobacterium Aphanizomenon flos-aquae. Taiwania, 2009, 54(2): 113-117.[16] Vahtera E, Conley DJ, Gustafsson BG et al. Internal ecosystem feedbacks enhance nitrogen-fixing cyanobacteria blooms and complicatemanagement in the Baltic Sea. AMBIO, 2007, 36(2): 186-194.[17] Conley DJ, Paerl HW, Howarth RW et al. Controlling eutrophication: nitrogenand phosphorus. Science, 2009, 323:1014-1015.[18] Oliver RL, Ganf GG. Freshwater blooms-The ecology of cyanobacteria. Netherlands:Kluwer Academic Publishers, 2000:149-194.[19] Wood SA, Prentice MJ, Smith K et al. Low dissolved inorganic nitrogen and increasedheterocyte frequency: precursors to Anabaena planktonica blooms in a temperate, eutrophic reservoir. Journal of Plankton Research, 2010, 32: 1315-1325. [20] Carey CC, Ibelings BW, Hoffmann EP et al. Eco-physiological adaptations that favour freshwater cyanobacteria in a changing climate. Water Research, 2012, 36(5):1394-1407.[21] Watanabe MM, Ichimura T. Fresh-and salt-water forms of Spirulina platensis in axenic cultures. Bull Jpn Soc Phycol, 1977, 25: 371-377.[22] Stanier RY, Kunisawa R, Mandel M et al. Purification and properties of unicellular blue-green algae (order Chroococcales). Bacteriological Reviews, 1971, 35(2): 171. [23] 国家环境保护局《水和废水监测分析方法》编委会.水和废水监测分析方法:第4版.北京:中国环境科学出版社,2002.[24] Sauer J, Schreiber U, Schmid R et al. Nitrogen starvation-induced chlorosis in Synechococcus PCC 7942. Low-level photosynthesis as amechanism of long-term survival. Plant Physiol, 2001, 126(1): 233-243.[25] Brussaard CPD, Noordeloos AAM, Riegman R. Autolysis kinetics of themarine diatom Ditylum brightwellii (Bacillariophyceae) under nitrogen and phosphorus limitation and starvation. Journal of Phycology, 1997, 33(6): 980-987.[26] Peters E, Thomas DN. Prolonged nitrate exhaustion and diatommortality: a comparison of polar and temperate Thalassiosira species. Journal of Plankton Research,1996, 18(6): 953-968.[27] Li RH, Watanabe M, Watanabe MM. Akinete formation in planktonic Anabaena spp.(Cyanobacteria) by treatment with low temperature. Journal of Phycology, 1997,33(4): 576-584.[28] Muro-Pastor MI, Reyes JC, Florencio FJ. Ammonium assimilation in cyanobacteria. Photosynthesis Research, 2005, 83: 135-150.[29] Adams DG. Heterocyst formation in cyanobacteria. Current Opinion in Microbiology,2000, 3: 618-624.[30] Conley DJ, Paerl HW, Howarth RW et al. Controlling eutrophication: nitrogen and phosphorus. Science, 2009, 323(5917): 1014-1015.[31] Wang HJ, Wang HZ. Mitigation of lake eutrophication: Loosen nitrogen control and focus on phosphorus abatement.Progress in Natural Science, 2009, 19: 1445-1451.[32] Carpenter SR. Phosphorus control is critical tomitigating eutrophication. PNAS,2008, 105(32): 11039-11040.[33] Schindler DW, Hecky RE, Findlay DL et al. Eutrophication of lakes cannot be controlled by reducing nitrogen input: results of a 37-year whole-ecosystem experiment. PNAS, 2008, 105(32): 11254-11258.[34] Havens KE, Fukushima T, Xie P et al. Nutrient dynamics and the eutrophication of shallow lakes Kasumigaura (Japan), Donghu (PR China), and Okeechobee (USA). Environmental Pollution, 2001, 111(2): 263-272.[35] Paerl HW, Xu H, McCarthy MJ et al. Controllingharmful cyanobacterial blooms in ahyper-eutrophic lake (Lake Taihu, China): The need for a dual nutrient (N &P)management strategy. Water Research, 2011, 45(5): 1973-1983.。
【国家自然科学基金】_中国新记录属_基金支持热词逐年推荐_【万方软件创新助手】_20140802
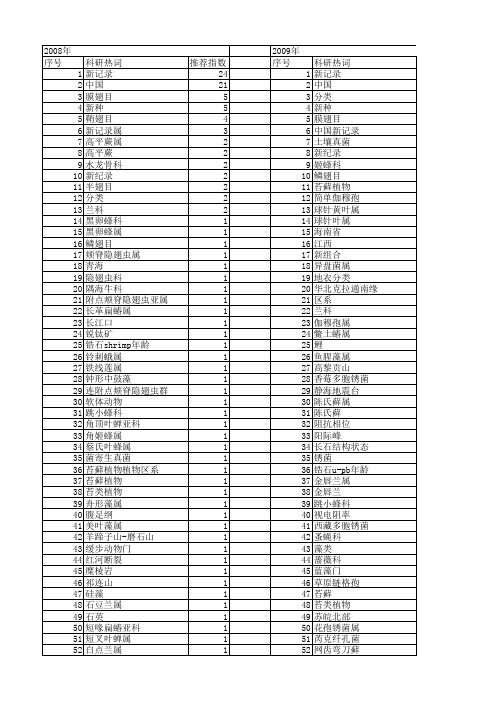
科研热词 新记录 中国 分类 新种 膜翅目 中国新记录 土壤真菌 新纪录 姬蜂科 鳞翅目 苔藓植物 简单伽穆孢 球针黄叶属 球针叶属 海南省 江西 新组合 异盘菌属 地衣分类 华北克拉通南缘 区系 兰科 伽穆孢属 鳖土蝽属 鲤 鱼腥藻属 高黎贡山 香莓多胞锈菌 静海地震台 陈氏藓属 陈氏藓 阻抗相位 阳际峰 长石结构状态 锈菌 锆石u-pb年龄 金唇兰属 金唇兰 跳小蜂科 视电阻率 西藏多胞锈菌 蚤蝇科 藻类 蔷薇科 蓝藻门 草原链格孢 苔藓 苔类植物 苏皖北部 花孢锈菌属 芮克纤孔菌 网齿弯刀藓
甘肃 瓶口衣目 物种多样性 牙甲科 淡水甲藻 海链藻属thalassiosira 海链藻 海南 浮游植物 浙江 毛腿牙甲属 步甲科 楷膜藻科 植物资源 桥弯藻科 桥弯藻属 柳叶蕨属 查特附点颊脊隐翅虫群 木生真菌 显微结构 方头泥蜂科 新记录种 新纪录. 新疆岩蜥阿尔泰亚种 掘步甲属 掌状美叶藻 拟步甲科 扁蝽科 快足小唇泥蜂属 微壳藻属 微型硅藻 弯肋藻属 应变速率 广东 富矿层和花岗岩 宽额甲属 姬蜂科 天牛科 多甲藻属 壶步甲族 地衣 地球化学 后鳃亚纲 吉林省 叶蝉科 叶蜂总科 双眉藻属 动态重结晶 刺蛾科 分形维数 分布 内蒙古 内丝藻属 克什米尔附点颊脊隐翅虫群
绦虫 细颈许氏绦虫 细柄锈菌属 粗壮多胞锈菌 粉蚧科 簇树花 石豆兰属 眉刺蛾属 相似性系数 盘菌 盔蛛科 白色伪壶担菌 电磁场 甘肃省 珊瑚虫纲 珊瑚 溶孔腔菌属 温度 海洋生物学 浙江省 浅色葡萄穗霉 洼唇姬蜂属 泰国卷瓣兰 沈阳 污翅姬蜂属 江西省 水螅水母纲 樟科 梭形纽带属 杨生纤孔菌 木生真菌 晚太古代 显生宙改造事件 新记录种 新记录属 新种新记录 新异名 新变种 新元古代裂解事件 新元古代 斑腹叶蜂属 拟细角跳小蜂属 拟环唇石豆兰 微小分枝管菌 形态 弯刀藓属 异蚤蝇属 异盘菌 广东省徐闻县海岸 年代学 平树花 带小卷蛾属 巴蛛亚科 山榄科
裸藻水华的调控---勿把裸藻当蓝(绿)藻
裸藻水华的调控---勿把裸藻当蓝(绿)藻(裸藻水体)水华是水体藻类大量生长或聚集并达到一定浓度的现象,是水体富营养化和特定条件综合作用的结果。
很多水藻水华(比如蓝、绿藻)的危害和防治多为大家熟知,而对裸藻水华认识较少,其对水产养殖生物的危害以及防治措施报道也较少,现在裸藻水华的暴发也时有发生,但因认识不足大多将裸藻误认为是蓝绿藻而失误造成的危害及损失也不小,因此,对裸藻水体的认知我们必须加以充分重视。
一、裸藻的起源(裸藻--眼虫显微镜图)裸藻是古代原生生物,能够进行光合作用,自己制造营养,五亿年前就已经在地球上繁衍的生物,是地球上动物与植物共同的祖先。
裸藻是古代原生动物眼虫的植物学名称,因为眼虫同时具有动物与植物两种特性,它是一种“原生动物”,但同时眼虫细胞又有含叶绿素的叶绿体,能够进行光合作用,自己制造营养,所以植物学家认为它是一种“原生植物”。
由于眼虫细胞没有细胞壁,植物学家给它起了另外一个名字——裸藻。
二、裸藻水华生长的条件裸藻水华多发生在静水、有机质丰富的小水体,水库、河沟、江河等较少见。
裸藻适宜生存的温度范围很广,水华形成的适宜温度为20℃-35℃,生长时间横跨春、夏、秋三个季节,尤以6、7、8、9月份生长最旺盛。
裸藻对温度突变很敏感,当遇到恶劣天气或环境变化较大时,裸藻比蓝藻、绿藻等更容易突然集体死亡而发生死藻现象。
裸藻大量死亡后,尸体分解会释放毒素,不仅败坏水质,还会造成鱼虾泛塘、死亡。
三、裸藻水华与蓝(绿)藻的区别1、裸藻水华是裸藻因具有趋光性而聚集在水面表层,形成浮膜,颜色大多呈绿色、蓝绿色,这点跟蓝藻引起的水华很像,较难鉴别。
(较适宜鱼类消化的蓝藻水华)2、可通过测量pH进行鉴定,裸藻绝大多数生长于pH6.5-8.5之间的水体中,而蓝藻大量繁殖时,pH多在8.5以上。
(蓝藻)3、裸藻水华大多表现为在水体表层形成因裸藻种类不同而呈现出各种不同颜色的'浮(油)膜',这是裸藻水华最大的特征,这一点也易区别于其它水华。
水华与赤潮
筒胞藻毒素 Cylindrospermopsin
肝脏
Cylindrospermopsis
( Sivonen and Jones, 1999)
水华与赤潮– 微囊藻毒素
(6)
D-Glu
COOH
(7) Mdha
CH3 N O
(5) Adda
OCH3
NH
H3C O O CH2
NH
(1) D-Ala
O
NH CH3 CH3 O NH O
2.物理化学措施 这类方法包括用化学药剂杀藻和凝聚沉 降等。使用杀藻剂可杀死藻类。藻类被杀 死后,死藻应及时捞出,或者再投加适当 的化学药品,将藻类腐烂分解释放出的磷 酸盐沉降。对那些溶解性营养物质如正磷 酸盐等,采用往水体中投加化学物质使其 生成沉淀而沉降。脱氮的物理化学方法有 氨汽提法、沸石法和折点加氯法等。
藻类学 Phycology
专题1: 水华与赤潮
主讲人: 陈辉蓉
计划中的专题
• 水华与赤潮 • 藻类与污水处理 • 藻类固沙技术 • 藻类与生物能源 • 藻类中的生物活性物质 • 藻类基因工程
水华与赤潮
• • • • •
什么是水华与赤潮? 水华赤潮有关的藻类 危害性主要在哪些方面? 产生的原因? 现有的治理手段
微囊藻毒素的慢性危害
上世纪70年代,中国进行了第一次死因回顾调查。复旦大学公共卫 生学院前院长俞顺章教授及其同事注意到,某些饮用沟塘水的地区肝 癌死亡率比其他饮用深井水或自来水的地区高出10倍以上。之后,他 与中国科学院水生生物所何家苑研究员等人合作,从沟塘水中分离出 微囊藻毒素,并怀疑微囊藻毒素是肝癌的诱因之一。
中国淡水水华爆发状况
(陈能汪等 2010)
深圳的水华
藻类_高等教育-生物学
一、隐藻属隐藻属(Cryptomonas)细胞有背腹之分,背部隆起,腹部平直或略凹。
腹侧有明显口沟。
鞭毛2条,自口沟伸出,略不等长。
色素体2个,叶状,黄绿色或黄褐色。
该属在淡水、海水中皆有分布,且在淡水湖泊、堰塘、鱼池中极为常见。
在高产鱼池可形成云彩状水华,水色呈红褐色。
二、甲藻门 -- 薄甲藻属 | 多甲藻属 | 角甲藻属 | 裸甲藻属 |薄甲藻属薄甲藻属(Glenodinium)植物体为单细胞,球形、卵形、圆锥形,上壳和下壳等大或不等大,横沟环状或略呈螺旋状环绕,纵沟明显,位于腹面。
胞壁厚,整块或由大小不等的多角形板片组成,板片平滑,具点纹、线纹或乳头状突起。
鞭毛2条,从横沟和纵沟相交处的鞭毛孔分别伸出,色素体多数,圆盘状、卵形,呈金色、黄绿色、褐色,少数种类无色素体。
多甲藻属(Peridinium)植物体为单细胞,细胞形状多样,球形、椭圆形、卵形等。
细胞壁厚,甲片缝常很清楚,甲片上有小刺和窿起的网纹。
鞭毛2条,从横沟和纵沟相交处的鞭毛孔伸出。
色素体多数,周生,颗粒状、圆盘状,呈黄色、褐色。
裸甲藻属(Gymnodinium)藻体单细胞,卵圆形,无细胞壁,横沟位于细胞中部,环状或稍向左旋。
营浮游生活,运动时呈左右摇摆状。
下椎部的底部中央有明显的凹陷,右侧底端略长于左侧。
鞭毛2条,从横沟和纵沟相交处的鞭毛孔伸出。
色素体多数,盘状、狭椭圆状或棒状,周生或辐射状排列,呈黄色、褐色、绿色或蓝色,有些种类无色素体。
世界广布种,常见于温带和热带浅海水域,温暖季节易大量繁殖,形成赤潮。
角甲藻属(Ceratium)植物体为单细胞,明显不对称。
藻体长,前后延伸,上体部长,略呈等腰三角形,细胞前、后端都延伸成为长的角。
顶角一个,后角2~3个。
顶角与上体部无明显分界线。
横沟部位最宽,呈环状,平直,细胞腹面中央为斜方形。
鞭毛2条,从横沟和纵沟相交处的鞭毛孔伸出。
色素体多数,周生,呈圆盘状,黄色、黄绿色、褐色。
世界性分布,典型的沿岸表层性种,广泛分布于热带和寒带海洋,是渤海、东海和南海长见种,在养鱼池有时形成红色水华。
拟柱胞藻检测技术改进
拟柱胞藻检测技术改进拟柱胞藻检测技术改进莆田市环境监测站傅昶宁[摘要]近年来,在我国各地陆续发现拟柱胞藻水华,由于其具有一定的毒性,而且发生水华时肉眼不易发现,同时爆发时,藻密度通常能达到每升上亿个细胞。
该文根据与其它藻类不同的特性,提出了拟柱胞藻检测方法,通过对传统检测方法的改进,证明了其实用性、准确性和简洁性。
[关键词]拟柱胞藻检测鉴定改进1概述拟柱胞藻(Cylindrospermopsis raciborskii),又名拉氏拟柱胞藻,为蓝藻类原核生物念珠藻目念珠藻科柱胞藻属。
由于其在不同的环境下,形态变化较大,因此,在我国有中华尖头藻和拉氏拟鱼腥藻等多个名称[1]。
拟柱胞藻能够产生Cylindrospermopsin(CYN)、麻痹性贝毒、类毒素-A等。
其中CYN能导致肝肾损害,也有可能致癌,麻痹性贝毒和类毒素-A均为神经毒素。
据报道,在澳大利亚棕榈岛,有149人出现了肝肠炎症状,这与被拟柱孢藻所产生毒素污染的饮用水有较大相关性。
拟柱孢藻在温带和热带地区的浅水水域(如湖泊、水库等)生长良好,一旦形成水华,数目巨大,如美国印第安纳州发现拟柱胞藻的19个湖泊中,藻密度均达到每升上亿个细胞[2]。
近年来,在我国山东、湖北、广东和云南等地陆续发现了拟柱胞藻及其水华。
由于拟柱胞藻通常不在水体表面形成明显的浮膜,根据近几年对莆田市东圳水库拉氏拟柱胞藻的上百次日常检定发现,若待到发现水体颜色变为较为明显的黄绿色,则藻密度至少在2×108个细胞/升以上。
一旦水华爆发,其藻类数量将占藻类总数的98%以上。
因此,拟柱胞藻的检测方法,在对水库、湖泊水质的预警和水质评价中具有十分重要的意义。
2拟柱胞藻检测现状由于拟柱胞藻是发现能产生毒素的最新蓝藻种类,在国内各项标准中均未见对拟柱胞藻的毒素或藻密度做出相关规定。
在我国,福建、山东、湖北和云南等地发现了拟柱胞藻及其水华。
本文在深入理解《水和废水监测分析方法》(第四版增补版)中关于藻类检测方法的基础上进行了技术试验,总结出鉴定拟柱胞藻并改进的快速检测方法[3]。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Ab ta t sr c :Du n u e e t n e tg to s fr wae lo fr n l e ge n a g e, a kohrc i e i r g o r r c n iv si ain o t r b o m o mi g b u — r e la Pl n t t io d s
武 汉 植 物 学研 究 20 ,6 5 : 6 — 6 0 82 ( ) 4 1 4 5
J un lo h n B tnc lR sac o ra f Wu a oa i eerh a
中国水 华 蓝 藻 的 新记 录属 —— 拟 浮 丝 藻属 ( ln ttr od s Pa koh i ie ) c
界范 围 内的湖泊 、 流 、 河 水库 、 区等各 水 域 “ 海 水华 ”
( ae bom ) 发 。水 华 带来 的不 仅 仅 是 由于 大 w t lo s 频 r 量藻 体死亡 后形成 水体 缺氧而 导致其 它水 生生物 的 死 亡 , 为严 重 的是 , 更 其所 产生 的藻毒 素能 通过饮 用
随着全 球气候 变 暖 和水 体 富 营 养化 的发 展 , 世
属微 囊藻 , 而其 它形成 水华 的丝状 蓝藻 , 别是无 异 特
形 胞分化 的颤 藻 类 ( siao aen 研 究 得 相 对 较 O cl t il ) l r a 少 。这种 状况 出现 的理 由可能是人 们对这 类丝状 蓝
藻认 识 的缺乏 , 即分类 学上研 究 的不足 。 A ans ds K m rk 18 ng ot i 和 o Oe ¨ 于 9 8年 对 颤藻 属 i O cltr a c e e o o t 新 进 行 了 划 分 , siaoi V uh r x G m n 重 l a 浮
( .ntu yrb l y h hns cdm Si cs 1 Istt o doi o ,TeC i eAa e yo c ne,Wu a 40 7 ,C ia i e fH og eue e ucs o tws F r t n esy u mi 6 0 2 .col N tr R s r 。Suh et oe r U i rt,K n n f o e sy v i g 5 24,C ia hn)
水 以及水生 生物食 物 链 进 入人 体 , 接 威胁 到 人 类 直 的健 康 。此 外 , 华藻 类 所 产 生 的异 味 物质 也 影 响 水
到饮 用 水 质 量 以及 观 赏 娱 乐 性 水 体 的 商 业 价 值 ,
( l zfk )S d t t a e2 0 , e cr eu f ynp y r hn a e ti . h Wo sy sa u ae Wa n b 0 2 an w r odgn so ao ht f i w s d nie T e o i a e c ao C a i fd
( ts fk )S d t t ae20 。文 中对该属及该属一个新记录种 的主要 形态学特征进行 了描述 , 对其相 Woozi a u ae Waa b 0 2 ys n 并 近属浮丝 藻属 Pa k t i l t h x进行 了形态学 比较研究。 n or
关 键 词 : 丝 藻 属 ; 浮 丝 藻 属 ; 氏拟 浮 丝 藻 ; 华 ;中 国 浮 拟 拉 水 中 图 分类 号 :Q 4 .2 5 9 92 文献标识码 : A 文 章 编 号 : 00 40 20 ) 5 06 —5 10 — 7 X(0 8 0 —4 10
Pl k oh io d s, Ne y Re o de e uso a e an tt rc i e A wl c r d G n fW t r Bl o r i a o h t n Chi o m Fo m ng Cy n p y a i na
WU Z ogXn U B —h ,,P N i ,Y o gLa g ,Q N J .i,L e . i hn . i ,Y oS i E G Xn g U G n .i I i L n a IR nHu
p e e tsu y d s rb d d srb t n nd t x n mi fa u e ft i g n s, n h o a io b t e r s n t d e c i e iti u i a a o o c e t r s o h s e u a d t e c mp rs n ewe n o Plnkoh iod s a d isr lt d g n sPlnkoh i sa s ic s e a tt rc ie n t eae e u a t trx wa lo d s u s d. Ke r s:Pl n tt rx;Pl k oh io d s y wo d a ko h i an tt rc i e ;Pl n tt rc ie a io s i;W ae l o ;Ch n a k oh iod s r cb rk i trb o m ia
吴忠兴 , 余博识 ,彭 欣 ,虞功亮 ,覃家理 ,李仁辉
( . 国科 学 院水 生 生 物 研 究 所 ,武 汉 1中 4 07 30 2;2 西 南 林 学 院 资 源学 院 ,昆 明 . 602) 5 24
摘
要:在近 年 来 对 水 华 蓝 藻 的 调 查 中, 定 了 我 国 一 水 华 蓝 藻 新 记 录 属—— 拟 浮 丝 藻 属 Pak tr o e 确 lnt hi i s o cd
